扩展功能
文章信息
- 梁玉林, 刘秀, 周振森, 周鹏飞, 尹建军
- LIANG Yu-Lin, LIU Xiu, ZHOU Zhen-Sen, ZHOU Peng-Fei, YIN Jian-Jun
- 基于反转录-环介导等温扩增技术检测沙门氏菌
- Detection of Salmonella by reverse transcriptase loop-mediated isothermal amplification
- 微生物学通报, 2018, 45(10): 2293-2300
- Microbiology China, 2018, 45(10): 2293-2300
- DOI: 10.13344/j.microbiol.china.170858
-
文章历史
- 收稿日期: 2017-10-23
- 接受日期: 2018-06-15
- 网络首发日期(www.cnki.net): 2018-06-21
沙门氏菌是一种重要的革兰氏阴性致病菌,有些专对人致病,有些专对动物致病,有些对人和动物同时致病[1]。按其抗原成分可以分为甲、乙、丙、丁、戊等基本菌组,其中与人体疾病有关的主要为丁组的伤寒沙门氏菌和肠炎沙门氏菌。在发展中国家每年大约有2 200万人感染伤寒沙门氏菌,导致2.16万人死亡[2],在发达国家肠炎沙门氏菌是最主要的人类肠道传染病[3]。易感染沙门氏菌的食品有肉类、蛋类、乳品和蔬菜类,人们食用了该类食品后会导致肠道疾病,伴随呕吐、发烧和腹泻等症状[4-6]。
目前我国规定的沙门氏菌检测方法为国标法[7],它主要分为前增菌、增菌、分离、生化试验和血清学鉴定等步骤,其检验程序费时费力、繁琐复杂,需要4-7 d才能得到检验结果。作为免疫学检测方法,酶联免疫技术具有高灵敏度、反应时间短等优势,因此在食品微生物研究与检测中应用广泛。Krysinski等最早阐述了鼠伤寒沙门氏菌的酶联免疫检测法,但实验可能出现假阳性现象[8]。近些年来分子生物学检测方法层出不穷,以聚合酶链式反应(PCR)为代表的变温核酸扩增技术虽然具有高特异性、高灵敏度等优势,但是往往需要专业操作人员和昂贵的实验设备,不利于现场快速检测[9]。因此,有必要开发一种高效检测方法,为沙门氏菌现场快速检测提供有力手段。
环介导等温扩增(Loop-mediated isothermal amplification,LAMP)技术是一种新型核酸扩增技术,该技术在60–65 ℃恒温条件1 h内把特异性靶序列扩增到109水平,并且具有高特异性、高敏感性、简单、便捷及成本低的特点[10-11]。LAMP技术和PCR扩增技术相比,其灵敏度、检测范围、特异性均能达到检测要求,甚至LAMP技术优于PCR技术[12];并且,这种新的扩增方法不需要任何实验室专用仪器,只要设计适合的引物,就可以在现场实现高通量快速检测。由于DNA在死菌中不易降解,传统的以DNA为模板的LAMP反应无法区分死活菌,容易导致假阳性的后果。以半衰期短的RNA为模板进行RT-LAMP反应,可以达到鉴别死活菌的目的[13]。RT-LAMP技术在国内已经广泛应用于病毒检测中[14-15],在细菌检测方面应用较少。本研究以沙门氏菌特异性保守片段设计LAMP引物,构建基于RNA为检测模板的RT-LAMP技术体系。
1 材料与方法 1.1 菌种各种标准菌株:大肠杆菌O157 (E. coli O157) CMCC44828,大肠杆菌O157 (E. coli O157) CICC21530,肠侵袭性大肠杆菌(Enterinvasive E. coli,EIEC) CICC24188,肠致病性大肠杆菌(Enteropathogenic E. coli,EPEC) CICC24189,伤寒沙门氏菌(S. typhi) ATCC14028,甲型副伤寒沙门氏菌(S. paratyphoid A) CMCC50001,霍乱沙门氏菌(S. cholera) CMCC50019,肠炎沙门氏菌(S. enteritidis) CMCC50041,伤寒沙门氏菌(S. typhi) CMCC50115,宋内志贺氏菌(S. sonnei) CMCC51592,痢疾志贺氏菌(S. dysenteriae) CMCC51252,福氏志贺氏菌(S. flexneri) CMCC51572,福氏志贺氏菌(S. flexneri) ATCC12022,金黄色葡萄球菌(S. aureus) ATCC13565,金黄色葡萄球菌(S. aureus) ATCC29213,金黄色葡萄球菌(S. aureus) ATCC2592,金黄色葡萄球菌(S. aureus) ATCC14458,金黄色葡萄球菌(S. aureus) CMCC26002,副溶血弧菌(V. parahaemolyticus) ATCC27519,副溶血弧菌(V. parahaemolyticus) CMCC60101,单增李斯特菌(L. monocytogenes) ATCC19111,单增李斯特菌(L. monocytogenes) CMCC54001,小肠结肠炎耶尔森菌(Y. enterocolitica) CICC21669,铜绿假单胞菌(P. aeruginosa) ATCC27853,阪崎肠杆菌(E. sakazakii) ATCC51007,酿脓链球菌(S. pyogenes) CICC10373。
1.2 主要试剂和仪器RNeasy Mini Kit,凯杰企业管理(上海)有限公司;PrimeScriptTM RT-PCR Kit、Marker DL2000,宝生物工程(大连)有限公司;Isothermal Master Mix (IMM)、Genie Ⅲ,OptiGene Limited公司;Trans DNA Marker Ⅱ、北京全式金生物技术有限公司。微量移液器、离心机,Eppendorf公司;高压灭菌锅,Tomy Digital Biology公司;超微量核酸蛋白分析仪,柏点公司;PCR仪,Biometra公司;电泳仪,北京君意仪器公司;凝胶成像仪,Vilber Lourmat公司。
1.3 方法 1.3.1 引物设计根据GenBank中invA基因(GenBank Accession EU348365)的序列,利用LAMP Primer Explorer 4在线软件(http://primerexplorer.jp/elamp4.0.0/index.html)设计6组引物,每组引物分别包括外引物F3、B3,内引物FIP、BIP和环引物LoopF、LoopR,设计完成后委托北京六合华大基因科技有限公司合成。
1.3.2 纯培养细菌RNA提取与质量测定在平板上取肠炎沙门氏菌(CMCC50041)单菌落接入LB液体培养基中,37 ℃、200 r/min培养12 h到对数期。取1 mL OD600为0.15的菌悬液,5 000×g离心10 min,轻轻倒掉液体。向沉淀加入10 μL蛋白酶K,100 μL TE (含终浓度15 mg/mL溶菌酶),充分混匀沉淀,在室温下反应30 min,严格按照RNeasy Mini Kit操作步骤提取RNA。
RNA的质量浓度和纯度检测:取RNA溶液1 μL,用超微量核酸蛋白分析仪测定提取的RNA在波长260 nm和280 nm处的紫外吸收值,通过OD260/OD280和浓度值判断RNA的纯度和浓度,重复测定3次。
RNA的完整性检测:分别取RNA样品6 μL,在1%的琼脂糖凝胶上进行电泳检测其完整性,150 V恒定电压电泳20 min。紫外灯下观察RNA条带,并照相记录结果。
1.3.3 RT-PCR和RT-LAMP反应体系RT-PCR扩增引物序列如表 1所示,扩增产物为116 bp。按照PrimeScriptTM RT-PCR Kit操作步骤进行反转录和PCR扩增反应。
经优化后在12.5 μL RT-LAMP体系中,包括7.5 μL IMM、3.5 μL混合引物(外引物、内引物和环引物含量分别为2.5、10.0和5.0 pmol)、1.5 μL模板。RT-LAMP反应温度65 ℃,反应时间30-60 min。
| 靶基因 Target gene |
检测方法 Detection method |
引物 Primer |
引物序列 Primers sequence (5′→3′) |
长度 Size (bp) |
| invA | RT-LAMP | F3 | GCGAAGCGTACTGGAAAGG | 19 |
| B3 | TCAACAATGCGGGGATCTG | 19 | ||
| FIP | ATGATGCCGGCAATAGCGTCACAAAGCCAGCTTTACGGTTCC | 42 | ||
| BIP | GTGGGGAATACTCGCCATGGACCATCACCAATGGTCAGC | 39 | ||
| LooF | AAACTTCATCGCACCGTCAAA | 21 | ||
| LooB | CCTCCGCCCTGTCTACTTATACCA | 24 | ||
| RT-PCR | F | CAACGTTCTCTGCGGTACTGT | 21 | |
| R | CCCGAACGTGGCGATAATT | 19 |
提取5株沙门氏菌和21株非沙门氏菌RNA,以此为模板进行RT-LAMP反应验证方法的特异性。
将提取的肠炎沙门氏菌(CMCC50041)原菌液总RNA测定浓度后,对总RNA进行10倍梯度稀释后选取1.7 fg、17 fg、170 fg、1.7 pg、17 pg、170 pg、1.7 ng/μL共7个浓度梯度,从各浓度梯度各取1.5 μL作为模板进行RT-LAMP反应检测纯培养沙门氏菌灵敏度。
1.3.5 RT-PCR和RT-LAMP反应在人工污染脱脂乳中的灵敏度检测为保证检测结果的准确性,经国标GB/T4789.4-2016方法验证试验所用脱脂乳中不含沙门氏菌,取25 g脱脂乳置于225 mL灭菌生理盐水中作为对照样品。取新鲜培养的12 h的肠炎沙门氏菌(CMCC50041),用生理盐水充分洗涤培养基,10倍梯度系列稀释,取各稀释度菌液1 mL加入人工脱脂乳样品中,使人工污染脱脂乳中菌液浓度达到10-1-105 CFU/mL,充分混合,作为人工污染脱脂乳样品。
取各菌液浓度的人工污染脱脂乳样品1 mL,提取人工污染脱脂乳样品中的RNA,同时取不加沙门氏菌的脱脂乳样品1 mL作为阴性对照平行进行RNA提取。分别进行RT-PCR和RT-LAMP反应,比较两种方法的检测灵敏度。
1.3.6 活菌状态和死菌状态下RT-LAMP检测探究死菌中RNA降解情况,避免死菌中DNA对RT-LAMP检测结果的干扰。选取105、104、103、102、101、100 CFU/mL六个菌液浓度。0.1 MPa灭菌30 min,放置一段时间,模拟死菌状态,对死菌进行平板培养,验证是否灭菌完全。分别对灭菌前后各浓度梯度的沙门氏菌菌液进行RNA提取,并进行RT-LAMP反应。
2 结果与分析 2.1 纯培养沙门氏菌RNA提取质量测定当RNA OD260/OD280大于2时表明提取的RNA纯度较高,经Qiagen试剂盒提取的沙门氏菌RNA浓度为78.30±0.10 µg/mL,纯度为2.29±0.24。由图 1可知,经Qiagen试剂盒提取的沙门氏菌RNA只有16S和23S两个条带,无严重的拖尾状况,表明提取的RNA完整性较高。

|
| 图 1 沙门氏菌RNA电泳 Figure 1 Salmonella RNA electrophoresis 注:M:Marker DL2000;1、2和3:肠炎沙门氏菌. Note: M: Marker DL2000; 1, 2 and 3: S. enteritidis. |
|
|
图 2和图 3分别是在不含检测模板和含检测模板前提下进行RT-LAMP引物的阴性和阳性扩增反应。在不含检测模板的情况下,1号和6号引物仍然出现扩增曲线,在排除气溶胶污染等因素后,该反应可能为引物间碱基互补配对引起的非特异性扩增。在含检测模板的情况下,3号引物具有较短的扩增时间和较高的扩增荧光值。综合图 2和图 3,3号引物在扩增稳定性、扩增时间和荧光值等方面均优于其他组引物,可作为RT-LAMP下一步试验的反应引物。3号引物序列见表 1。
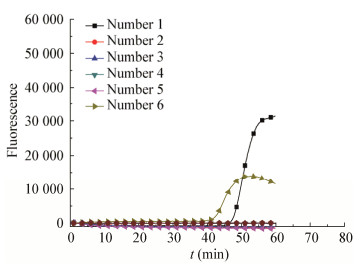
|
| 图 2 引物阴性扩增 Figure 2 Primer negative amplification |
|
|
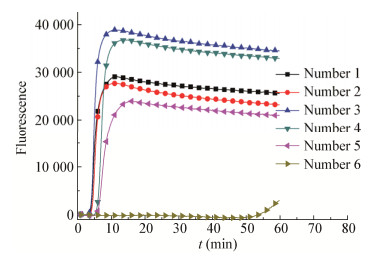
|
| 图 3 引物阳性扩增 Figure 3 Primer positive amplification |
|
|
试验对包括5株沙门氏菌在内的26株常见细菌进行RT-LAMP特异性检测。结果如表 2所示,只有2株鼠伤寒沙门氏菌、1株甲型副伤寒沙门氏菌、1株霍乱沙门氏菌和1株肠炎沙门氏菌产生荧光扩增曲线,其他菌株均未产生荧光扩增曲线。结果表明建立的RT-LAMP方法具有较高的菌株特异性。
| 菌株名称 Strain name |
菌株编号 Strain No. |
检测结果 Detection result |
| E. coli O157 | CMCC44828 | – |
| E. coli O157 | CICC21530 | – |
| EIEC | CICC24188 | – |
| EPEC | CICC24189 | – |
| S. typhi | ATCC14028 | + |
| S. paratyphoid A | CMCC50001 | + |
| S. cholera | CMCC50019 | + |
| S. enteritidis | CMCC50041 | + |
| S. typhi | CMCC50115 | + |
| S. sonnei | CMCC51592 | – |
| S. dysenteriae | CMCC51252 | – |
| S. flexneri | CMCC51572 | – |
| S. flexneri | ATCC12022 | – |
| S. aureus | ATCC13565 | – |
| S. aureus | ATCC29213 | – |
| S. aureus | ATCC25923 | – |
| S. aureus | ATCC14458 | – |
| S. aureus | CMCC26002 | – |
| V. parahaemolyticus | ATCC27519 | – |
| V. parahaemolyticus | CMCC60101 | – |
| L. monocytogenes | ATCC19111 | – |
| L. monocytogenes | CMCC54001 | – |
| Y. enterocolitica | CICC21669 | – |
| P. aeruginosa | ATCC27853 | – |
| E. sakazakii | ATCC51007 | – |
| S. pyogenes | CICC10373 | – |
| 注:+:有荧光扩增曲线,阳性;–:无荧光扩增曲线,阴性. Note: +: Fluorescence amplification curve; –: No fluorescence amplification curve. |
||
提取纯培养沙门氏菌总RNA作为阳性模板,对模板进行10倍梯度稀释,检测RT-LAMP反应的灵敏度。由图 4可知,RT-LAMP检测invA靶基因的灵敏度为17 fg/μL,并且在30 min内完成扩增反应。
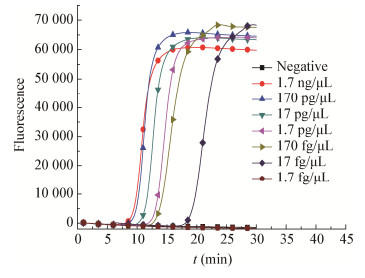
|
| 图 4 RT-LAMP反应灵敏度 Figure 4 RT-LAMP reaction sensitivity |
|
|
把脱脂乳与不同浓度的沙门氏菌混匀,室温放置30 min后进行病原微生物RNA的提取,然后进行RT-PCR和RT-LAMP灵敏度检测(图 5和图 6)。由图 5可知RT-PCR反应灵敏度达到6×102 CFU/mL,换算成固体脱脂乳样品检测灵敏度为6×103 CFU/g。由图 6可知RT-LAMP反应灵敏度达到6 CFU/mL,换算成固体脱脂乳样品检测灵敏度为60 CFU/g。建立的RT-LAMP方法灵敏度较高,是RT-PCR反应灵敏度的100倍以上。

|
| 图 5 人工污染脱脂乳RT-PCR产物电泳 Figure 5 Artificial contamination skim milk RT-PCR product electrophoresis 注:M:Trans DNA markerⅡ;NC:阴性对照;1:6×105 CFU/mL;2:6×104 CFU/mL;3:6×103 CFU/mL;4:6×102 CFU/mL;5:6×101 CFU/mL;6:6 CFU/mL;7:0 CFU/mL. Note: M: Trans DNA markerⅡ; NC: Negative control; 1: 6×105 CFU/mL; 2: 6×104 CFU/mL; 3: 6×103 CFU/mL; 4: 6×102 CFU/mL; 5: 6×101 CFU/mL; 6: 6 CFU/mL; 7: 0 CFU/mL. |
|
|
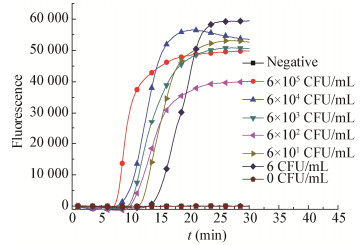
|
| 图 6 人工污染脱脂乳RT-LAMP反应灵敏度 Figure 6 Artificial contamination skim milk RT-LAMP reaction sensitivity |
|
|
灭菌前后各浓度梯度的沙门氏菌菌液进行RNA提取并进行RT-LAMP反应。图 7为灭菌前沙门氏菌RT-LAMP反应,100-105 CFU/mL菌液浓度均有荧光扩增反应,表明各反应体系中均含有沙门氏菌RNA。图 8为灭菌后沙门氏菌RT-LAMP反应,即使最高浓度的菌液也没有出现荧光扩增反应。灭菌处理的沙门氏菌,经平板培养观察未发现形成菌落,表明灭菌后的沙门氏菌均为死菌状态。综合图 7和图 8结果,沙门氏菌死菌RNA降解完全,所建立的RT-LAMP方法不能检出沙门氏菌死菌,可对活的沙门氏菌有效检出。

|
| 图 7 活菌RNA检测 Figure 7 RNA detection of viable bacteria |
|
|

|
| 图 8 死菌RNA检测 Figure 8 RNA detection of dead bacteria |
|
|
针对沙门氏菌特异性保守基因片段共设计了6组LAMP引物,对设计的引物进行初步筛选,避免出现引物二聚体等非特异性扩增。相比凝胶电泳和浊度法检测,本实验扩增产物能够在仪器上显示荧光曲线,整个检测过程无需开盖检测,因此大大降低了污染率和人为观测误差。
由于DNA稳定,在死菌中不易降解,可以长时间存在。传统以DNA为检测模板进行的LAMP反应可能会由于DNA的存在而导致假阳性的后果,而RNA具有的单链结构不稳定,导致RNA在死菌细胞内会很快被降解。基于此,以RNA为模板进行RT-LAMP反应能够有效区分细菌的死活,避免假阳性结果的发生;扩增结果能表明检测的沙门氏菌是否处于活的增殖状态,更能体现样品的潜在感染性,有助于食品安全风险监测。
常作为检测沙门氏菌的靶基因有invA、fimY、phoP和HisJ等[16-21],其中invA基因编码的蛋白在沙门氏菌致病过程中起着重要的作用,是沙门氏菌的主要毒力因子,已发表的文献大多是以沙门氏菌侵袭蛋白invA基因作为检测的靶基因[22]。本实验根据沙门氏菌特异性invA基因设计LAMP引物,建立了实时荧光RT-LAMP检测方法。RT-LAMP检测方法灵敏度高,对固体人工污染脱脂乳检测灵敏度达到60 CFU/g,高于RT-PCR检测方法。同时该方法反应迅速,依靠OptiGene仪器平台使得核酸扩增和反转录过程可以同时进行,从核酸提取到扩增反应结束仅需2 h左右,与其他检测方法相比较大大缩短了反应时间,有望实现对沙门氏菌的现场实时监控。
建立的实时荧光RT-LAMP方法只能检测到沙门氏菌属,不能区分伤寒沙门氏菌和肠炎沙门氏菌等。樊粉霞等[23]和Chen等[24]分别以伤寒沙门氏菌的STY3671和STM4496基因为靶基因,能够把伤寒沙门氏菌与沙门氏菌属中其他常见的沙门菌血清型分开。Yang等[25]和袁发浒等[26]则以lygD基因作为检测肠炎沙门氏菌的靶基因,仅能特异性检出肠炎沙门氏菌。后期可根据不同血清型的沙门氏菌特异性靶基因设计引物,将不同种的沙门氏菌分别检出。
因食品种类繁多,不同的食物基质可能会对核酸提取效果产生干扰。因此需要扩大沙门氏菌污染样品的种类,探究复杂条件下对沙门氏菌RNA提取与RT-LAMP方法检测的情况。综上所述,建立了简便快捷、灵敏度高、特异性强的适用于脱脂乳检测的实时荧光RT-LAMP方法,将通过对实际样品检测以进一步完善该方法。
| [1] |
Chen J, Park B. Recent advancements in nanobioassays and nanobiosensors for foodborne pathogenic bacteria detection[J]. Journal of Food Protection, 2016, 79(6): 1055-1069. DOI:10.4315/0362-028X.JFP-15-516 |
| [2] |
Yang HZ, Mou Y, Luo W. Research progress of food-borne Salmonella[J]. Heilongjiang Animal Science and Veterinary Medicine, 2016(4): 69-71, 75. (in Chinese) 杨怀珍, 牟亚, 罗薇. 食源性沙门氏菌的研究进展[J]. 黑龙江畜牧兽医, 2016(4): 69-71, 75. |
| [3] |
Ravan H, Yazdanparast R. Development and evaluation of a loop-mediated isothermal amplification method in conjunction with an enzyme-linked immunosorbent assay for specific detection of Salmonella serogroup D[J]. Analytica Chimica Acta, 2012, 733: 64-70. DOI:10.1016/j.aca.2012.04.034 |
| [4] |
Kennedy J, Bolton DJ, Cowan C. Food safety and bacterial pathogens: why you should eat in restaurants[A]//Proceedings of an International Conference Hosted by the 32nd Annual Food science and Technology Research Conference[C]. Ireland Cork: National University of Ireland Cork, 2002
|
| [5] |
Ding B. Investigation and analysis of pathogenic microorganisms in cold dishes of Shandong Province[D]. Jinan: Master's Thesis of Shandong University, 2013 (in Chinese) 丁勃.山东省凉菜类餐饮食品中致病微生物的调查分析[D].济南: 山东大学硕士学位论文, 2013 |
| [6] |
Ravan H, Amandadi M, Sanadgol N. A highly specific and sensitive loop-mediated isothermal amplification method for the detection of Escherichia coli O157:H7[J]. Microbial Pathogenesis, 2016, 91: 161-165. DOI:10.1016/j.micpath.2015.12.011 |
| [7] |
Gao H, He J, Yan L. Capability verification of three detection methods of Salmonella[J]. Journal of Food Safety and Quality, 2017, 8(2): 510-515. (in Chinese) 高晗, 何娟, 严礼. 3种沙门氏菌检测方法能力验证[J]. 食品安全质量检测学报, 2017, 8(2): 510-515. |
| [8] |
Krysinski EP, Heimsch RC. Use of enzyme-labled antibodies to detect salmonella in foods[J]. Applied and Environmental Microbiology, 1977, 33(4): 947-954. |
| [9] |
Hara-Kudo Y, Yoshino M, Kojima T, et al. Loop-mediated isothermal amplification for the rapid detection of Salmonella[J]. FEMS Microbiology Letters, 2005, 253(1): 155-161. DOI:10.1016/j.femsle.2005.09.032 |
| [10] |
Wang Y, Wang ZQ, Zhang W. Loop-mediated isothermal amplification assay for the detection of Salmonella in meat and meat products[J]. Food Science, 2010, 31(16): 270-273. (in Chinese) 王羽, 王贞强, 张伟. 环介导等温扩增技术检测肉及肉制品中的沙门氏菌[J]. 食品科学, 2010, 31(16): 270-273. |
| [11] |
Notomi T, Okayamah H, Masubuchi H, et al. Loop-mediated isothermal amplification of DNA[J]. Nucleic Acids Research, 2000, 28(12): E63. DOI:10.1093/nar/28.12.e63 |
| [12] |
Tomita N, Mori Y, Kanda H, et al. Loop-mediated isothermal amplification(LAMP) of gene sequences and simple visual detection of products[J]. Nature Protocols, 2008, 3(5): 877-882. DOI:10.1038/nprot.2008.57 |
| [13] |
Techathuvanan C, D'Souza DH. Reverse-transcriptase loop-mediated isothermal amplification as a rapid screening/monitoring tool for Salmonella enterica detection in liquid whole eggs[J]. Journal of Food Science, 2012, 77(4): M200-M205. DOI:10.1111/j.1750-3841.2011.02601.x |
| [14] |
Fan FX, Wang SJ, Lou J, et al. Establishment of RT-LAMP assay to detect Salmonella Typhi in blood[J]. Disease Surveillance, 2012, 27(4): 325-329. (in Chinese) 樊粉霞, 王淑京, 娄静, 等. 全血中伤寒沙门菌RT-LAMP检测方法的建立[J]. 疾病监测, 2012, 27(4): 325-329. DOI:10.3784/j.issn.1003-9961.2012.4.022 |
| [15] |
Yu Y, Ma XY, Zhang W. Detection of Staphylococcus aureus in milk using real-time fluorescence loop-mediated isothermal amplification[J]. Advance Journal of Food Science and Technology, 2015, 8(9): 678-684. DOI:10.19026/ajfst.8.1588 |
| [16] |
Lu YX, Yang WQ, Shi L, et al. Specific detection of viable Salmonella cells by an ethidium monoazide-loop mediated isothermal amplification (EMA-LAMP) method[J]. Journal of Health Science, 2009, 55(5): 820-824. DOI:10.1248/jhs.55.820 |
| [17] |
Chen SY, Wang F, Beaulieu JC, et al. Rapid detection of viable Salmonellae in produce by coupling propidium monoazide with loop-mediated isothermal amplification[J]. Applied and Environmental Microbiology, 2011, 77(12): 4008-4016. DOI:10.1128/AEM.00354-11 |
| [18] |
Ye YX, Wang B, Huang F, et al. Application of in situ loop-mediated isothermal amplification method for detection of Salmonella in foods[J]. Food Control, 2011, 22(3/4): 438-444. |
| [19] |
Zhang YQ, Shan XX, Shi L, et al. Development of a fimY-based loop-mediated isothermal amplification assay for detection of Salmonella in food[J]. Food Research International, 2012, 45(2): 1011-1015. DOI:10.1016/j.foodres.2011.02.015 |
| [20] |
Li XF, Zhang S, Zhang HW, et al. A loop-mediated isothermal amplification method targets the phoP gene for the detection of Salmonella in food samples[J]. International Journal of Food Microbiology, 2009, 133(3): 252-258. DOI:10.1016/j.ijfoodmicro.2009.05.027 |
| [21] |
Zhang L, Pan ZM, Geng SZ, et al. A loop-mediated isothermal amplification method targets the HisJ gene for the detection of food borne Salmonella[J]. European Food Research and Technology, 2012, 234(6): 1055-1062. DOI:10.1007/s00217-012-1725-8 |
| [22] |
Mashooq M, Kumar D, Niranjan AK, et al. Development and evaluation of probe based real time loop mediated isothermal amplification for Salmonella: A new tool for DNA quantification[J]. Journal of Microbiological Methods, 2016, 126: 24-29. DOI:10.1016/j.mimet.2016.04.014 |
| [23] |
Fan FX, Kan B, Yan MY. Detection of Salmonella typhi by RT-LAMP[J]. Chinese Journal of Biochemistry and Molecular Biology, 2013, 29(7): 682-689. (in Chinese) 樊粉霞, 阚飙, 闫梅英. 利用RT-LAMP技术鉴别伤寒沙门菌[J]. 中国生物化学与分子生物学报, 2013, 29(7): 682-689. |
| [24] |
Chen ZQ, Zhang K, Yin H, et al. Detection of Salmonella and several common Salmonella serotypes in food by loop-mediated isothermal amplification method[J]. Food Science and Human Wellness, 2015, 4(2): 75-79. DOI:10.1016/j.fshw.2015.05.001 |
| [25] |
Yang JL, Ma GP, Yang R, et al. Simple and rapid detection of Salmonella serovar enteritidis under field conditions by loop-mediated isothermal amplification[J]. Journal of Applied Microbiology, 2010, 109(5): 1715-1723. |
| [26] |
Yuan FH, Yin H, Li Q, et al. Detection of Salmonella enteritidis by loop-mediated isothermal amplification[J]. China Brewing, 2013, 32(4): 146-149. (in Chinese) 袁发浒, 尹欢, 李琦, 等. 肠炎沙门氏菌的LAMP检测方法的建立[J]. 中国酿造, 2013, 32(4): 146-149. DOI:10.3969/j.issn.0254-5071.2013.04.034 |
 2018, Vol. 45
2018, Vol. 45




