扩展功能
文章信息
- 刘宝宝, 汪洋, 易力, 王慧芳, 王瑜欣, 宫胜龙, 涂春田
- LIU Bao-Bao, WANG Yang, YI Li, WANG Hui-Fang, WANG Yu-Xin, GONG Sheng-Long, TU Chun-Tian
- 细菌生物被膜检测与分析方法
- Detection and analysis methods of bacterial biofilm
- 微生物学通报, 2018, 45(10): 2263-2270
- Microbiology China, 2018, 45(10): 2263-2270
- DOI: 10.13344/j.microbiol.china.170948
-
文章历史
- 收稿日期: 2017-11-13
- 接受日期: 2018-02-01
- 网络首发日期(www.cnki.net): 2018-02-13
2. 洛阳师范学院生命科学学院 河南 洛阳 471022
2. College of Life Science, Luoyang Normal University, Luoyang, Henan 471022, China
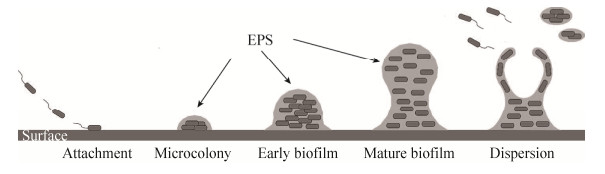
细菌生物被膜(Biofilm,BF)由物体表面集聚生长的微生物群落和细胞外以及自身分泌的基质构成[1]。在自然界中,任何细菌在成熟条件下都能以BF形式存在,并且可出现于包括自然的、人工的及宿主体内环境的任何生态系统中[2]。BF的形成是一个复杂的过程,主要包括黏附、增殖、聚集、成熟和分离几个主要阶段[3-4](图 1)。细菌BF状态被认为是细菌适应恶劣环境而形成的一种保护模式。BF对抗生素及宿主的免疫反应不敏感,导致感染性疾病迁延不愈,浪费大量的人力及物力,形成了公共卫生问题[5]。因此,可靠、简单和快速的检测方法有助于预防和治疗BF引起的相关疾病。基于不同原理的检测方法已广泛用于BF的研究[6],其优点和局限性见表 1。本文重点阐述显微镜技术在BF检测中的应用,并介绍近年来发展检测BF的新技术如:拉曼光谱、质谱成像和MALDI-TOF-MS等,以便研究者找到最合适和最新的研究方法。BF的检测方法主要有生物学方法、物理或化学方法、显微镜技术以及近年来发展的检测细菌BF新技术。
|
| 图 1 细菌生物被膜的形成过程 Figure 1 The formation of bacterial biofilm 注:EPS:胞外聚合物. Note: EPS: Extracellular polymeric substances. |
|
|
| 类型 Types |
方法 Method |
应用 Application |
优点 Advantages |
局限性 Limitations |
| 生物学方法 Microbiological methods |
96孔微量板定量检测法 | 定性细菌形成BF,结合染色法定量BF的形成能力 | 定量检测,适用所有实验室,同时处理大批样品 | 由于边缘液体易挥发导致测定值过高 |
| qPCR | 基于靶向DNA片段的扩增,间接评估细胞总数 | 快速,量化不同物种的BF | 昂贵,高估细胞数量 | |
| PMA-qPCR | 使用PMA预处理样品,PCR评估活细胞数 | 快速,只能量化活细胞,eDNA不会干扰 | 只基于BF细胞的完整性进行评估 | |
| 物理方法 Physical methods |
重量 | 通过干重或湿重间接测量BF生物量 | 易执行,不需昂贵的设备 | 耗时,灵敏度低,准确度低 |
| 电化学阻抗谱 | 基于电化学反应BF的间接测量 | 非破坏性方法,实时和原位观察 | 由于BF异质性导致数据难以解读 | |
| 超声时域反射计 | 通过声阻抗间接测量BF生物量和厚度 | 非破坏性方法,实时和原位观察 | 特殊异质BF难测量,薄的BF灵敏度低 | |
| 化学方法 Chemical methods |
CV染色法 | 通过CV染色间接测定BF生物质 | 用于不同细菌种类,高通量,不需去除BF | 重复性差,敏感性差,无固定标准 |
| 试卤灵试验 | 通过化学还原染料间接测量BF代谢活性 | 耗时少,便宜,无毒,可以通过分光荧光测定 | 检测限低,难以用于多菌种BF(代谢率不同) | |
| EPS提取 | 分析EPS组合物 | 解密EPS的糖和蛋白质组成 | 有细胞内含物污染 | |
| 基于ESP磷脂测量BF | 通过定量ESP磷脂间接测量活细胞 | 适用于广泛范围的微生物,可估计其活力 | 耗时,灵敏度低,对脂质污染敏感 | |
| CLSM+FLBA | 检测和分析EPS多糖组成 | 解密糖的空间分布和EPS的组成 | 荧光探针成本高 | |
| 抗EPS抗体 | 检测并定位EPS结构 | 特异性高,需定位EPS特定成分 | 成本高 |
微量板定量检测法用于定量检测BF的形成能力,用稀释倍数来量化细胞适用于每个微生物实验室研究[7]。此方法常与光学显微镜结合来定量和定性评估BF的形成能力和耐药性[8]。Chavant用一种固定化的磁珠放入培养基中形成BF,收集磁珠后用特定的公式来定量计算生物被膜,这种方法已经被用于研究BF形成的动态规律和基质成分[9]。
1.2 定量聚合酶链式反应(qPCR)定量聚合酶链式反应(Quantitative PCR,qPCR)是细菌BF的定量分析方法。这种方法由于存在游离细胞外DNA (eDNA)和死细胞DNA的影响,其测定值可能大于实际值[10]。为了不计算活细胞之外DNA,样品可以在DNA提取前用叠氮溴化丙锭(Propidium monoazide, PMA)处理[11]。PMA只进入膜受损的细胞并与eDNA相互作用[12],提取过程中修饰过的DNA在qPCR期间不会扩增[13]。因此PMA-qPCR可用于精确计算BF中活细胞的数量和定性分析单个细菌群落的BF[14]。
2 物理方法通过干重或湿重可以间接测量BF生物量。Trulear用干燥载玻片与BF之间的重量差计算BF生物量和体积密度[15]。还可以将细胞的表面进行涡旋,用过滤后释放的组分来计算BF生物量[16]。因为没有从表面去除整个BF,并且小分子可以通过过滤器,所以可能低估BF生物量。
2.1 电化学阻抗谱(Electrochemical impedance spectroscopy,ECIS)电化学阻抗谱用于研究细菌BF电化学系统,间接评估细菌BF生物量[17]。ECIS通过检测氧化还原溶质扩散系数的变化,记录在电极上测量的电化学反应。电极上氧化还原溶质(示踪剂)的反应取决于局部传质系数,随着BF厚度增加,示踪剂电流逐渐降低,利用数码相机可以直接观察BF。
2.2 超声时域反射计超声时域反射计是用于测量BF厚度的物理方法[18]。从BF一侧界面测量的声阻抗差值得到BF厚度。Schultz等测量了边界层流动中平均湍流速度的分布,并报道了BF厚度与表面摩擦系数之间的相关性[19]。另一种方法是用直接和间接测量生物污染的组合监测器,在热交换器单元中监测流体输送特性,通过摩擦阻力和传热阻力的数学计算来实现BF检测[20]。
3 化学方法化学方法是一种检测细菌特定BF组分的间接方法,利用能够吸附结合到BF组分上的荧光染料测量特定组分。用于研究BF的化学方法有很多,除了下面介绍的方法之外还有Syto9/PI染色法、荧光二乙酸试验、1, 9-二亚甲基蓝试验和色氨酸定量试验[21]。
3.1 结晶紫(Crystal violet,CV)染色法结晶紫染色是最常用的定量检测细菌BF的化学方法[22]。这个方法可染色活细胞、死细胞以及存在于BF基质中的一些成分,从而非常适合量化总BF生物量,用于各种BF形成的测定。本课题组通过该方法鉴定了猪链球菌BF并筛选出BF形成能力强弱菌株[23-26]。
3.2 比色法 3.2.1 XTT/TTC试验比色法用于测量细菌BF组分含量,原理是将特定底物的细胞代谢物转化成可用分光光度计测定的有色产物。Koban研究试剂3, 3'-[1-(苯氨酰基)-3, 4-四氮唑]-二(4-甲氧基-6-硝基)苯磺酸钠(XTT),被活菌代谢为甲躜[27]。最近使用优化了的另一种四唑盐TTC (2, 3, 5–氯化三苯基四氮唑)来量化BF中细菌的代谢活性[21]。
3.2.2 试卤灵(Resoruffn)试验刃天青又称阿尔玛蓝,是一种稳定的氧化还原指示剂,通过代谢活细胞被还原成试卤灵,用于量化BF的代谢活性[28]。刃天青和CFU计数得到的结果之间具有良好的相关性[29]。应用BF (非浮游)细胞获得的数据建立标准曲线。同时可以用新鲜培养基与刃天青钠盐一起添加到BF上,更准确地量化BF活性。不同细菌代谢刃天青的速率不同,因此难以应用多微生物菌落。
4 显微镜技术BF生物量和细胞活力可以通过显微镜来观察。在表 2展现了几种显微镜方法的优点和缺点。光学显微镜技术是形成视觉观察BF的基本技术。de Carvalho使用光学显微镜对BF结构和生物量进行了研究[30]。
| 显微镜技术 Microscopy technique |
应用 Application |
优点 Advantages |
局限性 Limitations |
| 光学显微镜 Light microscopy |
形成视觉识别,定量评估,与透射电子显微镜或SEM组合使用 | 样品制备简单,便宜,容易操作,样品成像范围大 | 放大倍数和分辨率有限,部分样品需要染色,缺乏细节 |
| CLSM | 观察BF空间结构,分布,抗生素对细胞活力的影响 | 观察BF的空间结构,样品的3-D图像,无需计算机处理 | 需要荧光团,观察的分子数量有限,荧光探针,天然荧光的干扰 |
| SEM | BF空间结构研究,评估抗生素药物的作用,形成BF动力学评估 | 分辨率高,能够成像复杂的形状,放大倍数大 | 样品制备繁琐,会破坏样品结构,缺乏垂直分辨率 |
| Cryo-SEM | 表面结构,内部的结构细节(冻结断裂),液体,半液体和光束敏感样品 | 分辨率高,需在完全水合状态下观察,样品制备简单快速,破坏少 | 分辨率低,样品可能溶化,设备昂贵 |
| E-SEM | 自然状态下成像,原位和实时动态研究 | BF完整,无需预处理,在水合和非导电中观察 | 湿样品分辨率低,样品可能损伤 |
| FIB-SEM | BF内部结构,3D结构,研究环境BF | 不容易产生假象,研究BF内部结构 | 需要真空,离子束损坏会降低分辨率 |
| AFM | 确认其他技术获得的结果,确定BF粘附力,强度,原位成像 | 无破坏性,预处理少,原位成像,提供表面3D图像 | 观察范围小,测量会带来样品损伤 |
激光共聚焦扫描显微镜(Confocal laser scanning microscopy,CLSM)用于观察BF的空间结构[31]和形态差异。本课题组通过此方法观察到猪链球菌在体外能够形成BF并观察到BF的形态[32]。此方法还可以用特异性的荧光探针(常用核酸染料SYTO-9和SYBR-Green标记[33])进行BF的CLSM成像。CLSM可以用于分析胞外聚合物(Extracellular polymeric substances,EPS)的分布和原位表征,结合荧光凝集素来检测分析EPS碳水化合物,多糖化合物及其在BF内的分布[34]。CLSM可以与特异性细胞荧光探针结合,获得EPS分布的3-D图像[35],结合特异性抗体可以检测BF中一些特定的胞外多糖纤维束。荧光原位杂交(Fluorescence in situ hybridization,FISH)或衍生的方法可以在多物种BF的条件下分析种间的竞争和干扰,确定BF形成的关键分子决定簇[36]。可以利用CLSM分析BF中死亡的细胞,观察BF中局部细胞死亡及其调控机制[37],并评估多种抗微生物制剂对BF活力的影响[38]。Davison[39]提出了观察杀菌剂对革兰阳性菌BF作用方式的间接标记程序,Bridier将此方法扩展到革兰阴性菌[40]。
扫描电子显微镜(Scanning electron microscope,SEM)提供了关于空间结构的信息并且能够检测EPS的存在[41]。SEM方法已经用于细菌和真菌BF的定量测定[42],同时还可以评估BF的表型特征[43]。我们采用HE染色和扫描电镜观察,发现猪链球菌在斑马鱼体内呈细菌聚集趋势,发现了类似于“BF”样的细菌集簇[32]。利用此方法分析野生株和luxS缺失株BF的图像,为进一步分析链球菌中luxS的功能和BF形成和毒力的关键作用奠定了基础[44]。冷冻扫描电镜(Cryo-scanning electron microscope,Cryo-SEM)允许在冷冻水合状态下保存BF,观察BF的内部结构,揭示细菌如何相互连接。环境扫描电镜(Environmental scanning electron microscope,ESEM)可以在高放大倍数下进行观察含水和非导电的活菌BF,不受人为操作对样品形态破坏和假象产生的影响[45]。聚焦离子束扫描电子显微镜(Focused ion beam scanning electron microscope,FIB-SEM)是一种用于探索BF内部结构的工具。通过称为“切片和视图”的过程获得3-D重建,并通过软件连续获得图像切片以重建3-D模型。原子力显微镜(Atomic force microscope,AFM)用于在非破坏性条件下纳米至微米尺度上对生物样品的成像。用于确认通过定量(活细胞计数,CV染色)或其他成像(光学显微镜,SEM)技术获得的结果。在检查的样品表面特征中,来自AFM图像可以定量BF生物量[46]。
5 近年来发展的检测细菌BF方法 5.1 基于拉曼光谱技术分析BF胞外物质拉曼光谱技术用于检测BF基质的化学成分和组成[47],探索细菌细胞壁的精细结构[48],研究BF的空间结构[49],具有快速、准确、无损鉴定和检测的优势。Venkata等[50]首次运用拉曼光谱检测到了大肠杆菌BF状态下高水平的亮氨酸,研究表明亮氨酸促进了大肠杆菌生物被膜的形成。拉曼光谱技术和扫描电子显微镜(SEM)结合可以用于分析细菌浮游状态和生物被膜状态下核酸、碳水化合物和蛋白质的差异,区分同物种细胞之间的生理特性[51]。
5.2 基于质谱成像(Imaging mass spectrometry,IMS)技术分析BF化学成分的空间分布质谱成像技术是一种基于质谱分析,用于检测待测样品空间分布的分子成像技术[52],具有多分子水平、多分子种类、高灵敏度同时检测的优点。在此技术上发展的飞行时间二次离子质谱技术(Time-of-flight secondary ion mass spectrometry,TOF-SIMS)用于观察BF基质组分如蛋白质、多糖和脂质的特征片段和空间分布[53],具有高灵敏度和分辨率的优势。
5.3 基于基质辅助激光解吸电离飞行时间质谱鉴定BF生物大分子基质辅助激光解吸电离飞行时间质谱(Matrix- assisted laser desorption/ionization time of flight mass spectrometry,MALDI-TOF-MS)是一种新型软电离方法,用于测定BF生物大分子和有机小分子化合物的分子量,鉴定BF表面的蛋白质。具有快速、操作简单、谱图直观的特点[54]。Pereira等使用MALDI- TOF-MS方法首次在聚丙烯表面上监测铜绿假单胞菌BF的形成过程,结果表明此方法不仅能够区分BF形成的不同阶段,而且适用于指示BF分散释放的时间,指出MALDI分析可能会成为BF形成和控制的临床诊断和预后处理的有前景工具[55]。
6 小结与展望在自然界中,任何细菌在成熟条件下都可以形成BF,90%以上的微生物是以BF形式生存生长的[2]。美国疾病控制预防中心专家估计大于65%的人类细菌感染与BF有关[56],这提示如果能有效预防控制BF感染,在临床感染治疗中有重要意义,同时也使BF研究成为一个热门的领域。随着科研水平的提高,传统的鉴定方法已经不能满足BF的研究,迫使我们需要用更全面、更先进、更快速的技术和方法研究BF。而我们常规的BF研究方法操作复杂、敏感性和特异性差,远远不能满足早期快速鉴定的需要[57]。只有利用各种先进的技术和方法进行BF深入而全面的研究,我们才能得到客观、准确的鉴定结果,加快抗菌药物的研发,减少BF带来的感染和工业、食品污染,为临床治疗生物膜引起的感染提供帮助。
上述各种技术和方法可以从不同方面研究BF的复杂结构,建议采用综合方法来获得更具体和精确的BF生物量和活力。部分化学方法与显微镜技术结合,可以共同解析BF的组分及结构。可以通过细菌ESP测量来定量检测BF生物量[58]。使用水解多糖的多种分析技术获得BF EPS的碳水化合物组成,同时可以使用蛋白质组学方法探索BF蛋白质多样性[59],还可以通过ESP磷脂进行细菌BF检测分析。此外,动物体内BF模型的建立和鉴定也越来越受到重视,细菌以BF形式存在于动物体内可能是其致病的重要原因[60-61]。通过SEM和AFM可以直接量化生物量,虽然理论上的优势偏向于间接方法,但是分析的成本和耗时限制了其在大规模上的应用。另外,大部分BF的研究方法停留在静态的观察中,期望能有新的技术实现BF形成过程中的动态观察。同时,研究BF的成分是通过物理分离,这会破坏细胞和BF之间的空间结构。截至目前,在活细胞中观察BF的相关功能区域和其相互作用还很困难,期待有新的方法和技术解决这个难题,以便更好地研究BF。
| [1] |
Dufour D, Leung V, Lévesque CM. Bacterial biofilm: structure, function, and antimicrobial resistance[J]. Endodontic Topics, 2010, 22(1): 2-16. DOI:10.1111/etp.2012.22.issue-1 |
| [2] |
Costerton JW, Stewart PS, Greenberg EP. Bacterial biofilms: a common cause of persistent infections[J]. Science, 1999, 284(5418): 1318-1322. DOI:10.1126/science.284.5418.1318 |
| [3] |
Abdullahi UF, Igwenagu E, Muázu A, et al. Intrigues of biofilm: A perspective in veterinary medicine[J]. Veterinary World, 2016, 9(1): 12-18. DOI:10.14202/vetworld. |
| [4] |
Wang Y, Yi L, Fan HJ, et al. Progress in several important animal pathogens biofilm formation[J]. Chinese Journal of Veterinary Science, 2014, 34(10): 1693-1698. (in Chinese) 汪洋, 易力, 范红杰, 等. 几件重要动物病原菌生物被膜形成的研究进展[J]. 中国兽医学报, 2014, 34(10): 1693-1698. |
| [5] |
Wang Y, Wang YX, Sun LY, et al. Streptococcus suis biofilm: regulation, drug-resistance mechanisms and disinfection strategies[J]. Applied Microbiology and Biotechnology. DOI:10.1007/s00253-018-9356-z |
| [6] |
Zhang X, Zhang XG, Dang YS, et al. Bacterial biofilm preparation and detection methods[J]. Chinese Journal of Postgraduates of Medicine, 2014, 37(25): 67-71. (in Chinese) 张秀, 张晓刚, 党永生, 等. 细菌生物膜制备及其检测方法的研究进展[J]. 中国医师进修杂志, 2014, 37(25): 67-71. DOI:10.3760/cma.j.issn.1673-4904.2014.25.024 |
| [7] |
Ceri H, Olson ME, Stremick C, et al. The Calgary Biofilm Device: new technology for rapid determination of antibiotic susceptibilities of bacterial biofilms[J]. Journal of Clinical Microbiology, 1999, 37(6): 1771-1776. |
| [8] |
Müsken M, Fiore SD, Römling U, et al. A 96-well-plate-based optical method for the quantitative and qualitative evaluation of Pseudomonas aeruginosa biofilm formation and its application to susceptibility testing[J]. Nature Protocols, 2010, 5(8): 1460-1469. DOI:10.1038/nprot.2010.110 |
| [9] |
Chavant P, Gaillard-Martinie B, Talon R, et al. A new device for rapid evaluation of biofilm formation potential by bacteria[J]. Journal of Microbiological Methods, 2007, 68(3): 605-612. DOI:10.1016/j.mimet.2006.11.010 |
| [10] |
Klein MI, Scott-Anne KM, Gregoire S, et al. Molecular approaches for viable bacterial population and transcriptional analyses in a rodent model of dental caries[J]. Molecular Oral Microbiology, 2012, 27(5): 350-361. DOI:10.1111/omi.2012.27.issue-5 |
| [11] |
Yasunaga A, Yoshida A, Morikawa K, et al. Monitoring the prevalence of viable and dead cariogenic bacteria in oral specimens and in vitro biofilms by qPCR combined with propidium monoazide[J]. BMC Microbiology, 2013, 13: 157. DOI:10.1186/1471-2180-13-157 |
| [12] |
Nocker A, Sossa KE, Camper AK. Molecular monitoring of disinfection efficacy using propidium monoazide in combination with quantitative PCR[J]. Journal of Microbiological Methods, 2007, 70(2): 252-260. DOI:10.1016/j.mimet.2007.04.014 |
| [13] |
Nocker A, Mazza A, Masson L, et al. Selective detection of live bacteria combining propidium monoazide sample treatment with microarray technology[J]. Journal of Microbiological Methods, 2009, 76(3): 253-261. DOI:10.1016/j.mimet.2008.11.004 |
| [14] |
Chen NT, Chang CW. Rapid quantification of viable legionellae in water and biofilm using ethidium monoazide coupled with real-time quantitative PCR[J]. Journal of Applied Microbiology, 2010, 109(2): 623-634. |
| [15] |
Trulear MG, Characklis WG. Dynamics of biofilm processes[J]. Journal (Water Pollution Control Federation), 1982, 54(9): 1288-1301. |
| [16] |
Jackson S, Coulthwaite L, Loewy Z, et al. Biofilm development by blastospores and hyphae of Candida albicans on abraded denture acrylic resin surfaces[J]. The Journal of Prosthetic Dentistry, 2014, 112(4): 988-993. DOI:10.1016/j.prosdent.2014.02.003 |
| [17] |
Dominguez-Benetton X, Sevda S, Vanbroekhoven K, et al. The accurate use of impedance analysis for the study of microbial electrochemical systems[J]. Chemical Society Reviews, 2012, 41: 7228-7246. DOI:10.1039/c2cs35026b |
| [18] |
Sim STV, Suwarno SR, Chong TH, et al. Monitoring membrane biofouling via ultrasonic time-domain reflectometry enhanced by silica dosing[J]. Journal of Membrane Science, 2013, 428: 24-37. DOI:10.1016/j.memsci.2012.10.032 |
| [19] |
Schultz MP, Swain GW. The effect of biofilms on turbulent boundary layers[J]. Journal of Fluids Engineering, 1999, 121(1): 44-51. DOI:10.1115/1.2822009 |
| [20] |
Trueba A, Eguía E, Río-Calonge B, et al. Combined monitor for direct and indirect measurement of biofouling[J]. Biofouling, 2008, 24(2): 75-86. DOI:10.1080/08927010701817241 |
| [21] |
Chen CX. Qualitative and quantitative research methods of bacterial biofilm[J]. Hubei Agricultural Sciences, 2016(9): 2177-2180. (in Chinese) 陈朝喜. 细菌生物被膜定性和定量研究方法[J]. 湖北农业科学, 2016(9): 2177-2180. |
| [22] |
Hui LY, Li J, Zhu MX, et al. Inhibition of Staphylococcus aureus biofilm by antimicrobial peptide 17BIPHE2[J]. Microbiology China, 2017, 44(4): 872-880. (in Chinese) 回丽媛, 李军, 朱明星, 等. 抗菌肽17BIPHE2对金黄色葡萄球菌生物被膜的抑制作用[J]. 微生物学通报, 2017, 44(4): 872-880. |
| [23] |
Wang Y, Yi L, Zhang ZC, et al. Biofilm formation, host-cell adherence, and virulence genes regulation of Streptococcus suis in response to autoinducer-2 signaling[J]. Current Microbiology, 2014, 68(5): 575-580. DOI:10.1007/s00284-013-0509-0 |
| [24] |
Wang Y, Yi L, Wang SH, et al. Crystal structure and identification of two key amino acids involved in AI-2 production and biofilm formation in Streptococcus suis LuxS[J]. PLoS One, 2015, 10(10). |
| [25] |
Wang Y, Yi L, Zhang FQ, et al. Identification of genes involved in Mycoplasma gallisepticum biofilm formation using mini-Tn4001-SGM transposon mutagenesis[J]. Veterinary Microbiology, 2017, 198: 17-22. DOI:10.1016/j.vetmic.2016.11.021 |
| [26] |
Wang Y, Yi L, Zhang ZC, et al. Overexpression of luxS cannot increase autoinducer-2 production, only affect the growth and biofilm formation in Streptococcus suis[J]. Scientific World Journal, 2013, 2013: Article ID 924276
|
| [27] |
Ramage G. Comparing apples and oranges: considerations for quantifying candidal biofilms with XTT[2, 3-bis (2-methoxy-4-nitro-5-sulfo-phenyl)-2H-tetrazolium-5-carboxanilide] and the need for standardized testing[J]. Journal of Medical Microbiology, 2016, 65(4): 259-260. DOI:10.1099/jmm.0.000237 |
| [28] |
O'Brien J, Wilson I, Orton T, et al. Investigation of the Alamar Blue (resazurin) fluorescent dye for the assessment of mammalian cell cytotoxicity[J]. European Journal of Biochemistry, 2000, 267(17): 5421-5426. DOI:10.1046/j.1432-1327.2000.01606.x |
| [29] |
van den Driessche F, Rigole P, Brackman G, et al. Optimization of resazurin-based viability staining for quantification of microbial biofilms[J]. Journal of Microbiological Methods, 2014, 98: 31-34. DOI:10.1016/j.mimet.2013.12.011 |
| [30] |
de Carvalho CCCR, Da Fonseca MMR. Assessment of three-dimensional biofilm structure using an optical microscope[J]. BioTechniques, 2007, 42(5): 616-620. DOI:10.2144/000112403 |
| [31] |
Bridier A, Briandet R. Contribution of confocal laser scanning microscopy in deciphering biofilm tridimensional structure and reactivity[J]. Methods in Molecular Biology, 2014, 1147(1147): 255-266. |
| [32] |
Wang Y. Study on the mechanism of biofilm formation and molecular pathogenesis of Streptococcus suis[D]. Nanjing: Doctoral Dissertation of Nanjing Agricultural University, 2011 (in Chinese) 汪洋.猪链球菌生物被膜形成及致病机理研究[D].南京: 南京农业大学博士学位论文, 2011 |
| [33] |
Neu TR, Lawrence JR. Advanced techniques for in situ analysis of the biofilm matrix (structure, composition, dynamics) by means of laser scanning microscopy[A]//Donelli G. Microbial Biofilms. Methods in Molecular Biology (Methods and Protocols), Vol. 1147[M]. New York, NY: Humana Press, 2014: 43-64
|
| [34] |
Turonova H, Neu TR, Ulbrich P, et al. The biofilm matrix of Campylobacter jejuni determined by fluorescence lectin-binding analysis[J]. Biofouling, 2016, 32(5): 597-608. DOI:10.1080/08927014.2016.1169402 |
| [35] |
Zhang RY, Neu TR, Zhang YT, et al. Visualization and analysis of EPS glycoconjugates of the thermoacidophilic archaeon Sulfolobus metallicus[J]. Applied Microbiology & Biotechnology, 2015, 99(17): 7343-7356. |
| [36] |
Bridier A, Briandet R, Bouchez T, et al. A model-based approach to detect interspecific interactions during biofilm development[J]. Biofouling, 2014, 30(7): 761-771. DOI:10.1080/08927014.2014.923409 |
| [37] |
Guilbaud M, Piveteau P, Desvaux M, et al. Exploring the diversity of Listeria monocytogenes biofilm architecture by high-throughput confocal laser scanning microscopy and the predominance of the honeycomb-like morphotype[J]. Applied and Environmental Microbiology, 2015, 81(5): 1813-1819. DOI:10.1128/AEM.03173-14 |
| [38] |
Doroshenko N, Tseng BS, Howlin RP, et al. Extracellular DNA impedes the transport of vancomycin in Staphylococcus epidermidis biofilms preexposed to subinhibitory concentrations of vancomycin[J]. Antimicrobial Agents and Chemotherapy, 2014, 58(12): 7273-7282. DOI:10.1128/AAC.03132-14 |
| [39] |
Davison WM, Pitts B, Stewart PS. Spatial and temporal patterns of biocide action against Staphylococcus epidermidis biofilms[J]. Antimicrobial Agents and Chemotherapy, 2010, 54(7): 2920-2927. DOI:10.1128/AAC.01734-09 |
| [40] |
Bridier A, Briandet R, Thomas V, et al. Resistance of bacterial biofilms to disinfectants: a review[J]. Biofouling, 2011, 27(9): 1017-1032. DOI:10.1080/08927014.2011.626899 |
| [41] |
Hung C, Zhou YZ, Pinkner JS, et al. Escherichia coli biofilms have an organized and complex extracellular matrix structure[J]. mBio, 2013, 4(5): e00645-13. |
| [42] |
Kumar D, Banerjee T, Chakravarty J, et al. Identification, antifungal resistance profile, in vitro biofilm formation and ultrastructural characteristics of Candida species isolated from diabetic foot patients in Northern India[J]. Indian Journal of Medical Microbiology, 2016, 34(3): 308-314. DOI:10.4103/0255-0857.188320 |
| [43] |
Ceresa C, Tessarolo F, Caola I, et al. Inhibition of Candida albicans adhesion on medical-grade silicone by a Lactobacillus-derived biosurfactant[J]. Journal of Applied Microbiology, 2015, 118(5): 1116-1125. DOI:10.1111/jam.2015.118.issue-5 |
| [44] |
Wang Y, Zhang W, Wu ZF, et al. Functional analysis of luxS in Streptococcus suis reveals a key role in biofilm formation and virulence[J]. Veterinary Microbiology, 2011, 152(1/2): 151-160. |
| [45] |
Pompilio A, De Nicola S, Crocetta V, et al. New insights in Staphylococcus pseudintermedius pathogenicity: antibiotic-resistant biofilm formation by a human wound-associated strain[J]. BMC Microbiology, 2015, 15: 109. DOI:10.1186/s12866-015-0449-x |
| [46] |
Danin PE, Girou E, Legrand P, et al. Description and microbiology of endotracheal tube biofilm in mechanically ventilated subjects[J]. Respiratory Care, 2015, 60(1): 21-29. DOI:10.4187/respcare.02722 |
| [47] |
Chao YQ, Zhang T. Surface-enhanced Raman scattering (SERS) revealing chemical variation during biofilm formation: from initial attachment to mature biofilm[J]. Analytical & Bioanalytical Chemistry, 2012, 404(5): 1465-1475. |
| [48] |
Samek O, Al-Marashi JFM, Telle HH. The potential of Raman spectroscopy for the identification of biofilm formation by Staphylococcus epidermidis[J]. Laser Physics Letters, 2010, 7(5): 378-383. DOI:10.1002/lapl.v7:5 |
| [49] |
Marcotte L, Barbeau J, Lafleur M. Characterization of the diffusion of polyethylene glycol in Streptococcus mutans biofilms by Raman microspectroscopy[J]. Applied Spectroscopy, 2004, 58(11): 1295-1301. DOI:10.1366/0003702042475484 |
| [50] |
Venkata HNN, Nomura N, Shigeto S. Leucine pools in Escherichia coli biofilm discovered by Raman imaging[J]. Journal of Raman Spectroscopy, 2011, 42(11): 1913-1915. DOI:10.1002/jrs.v42.11 |
| [51] |
Henry VA, Jessop JL, Peeples TL. Differentiating Pseudomonas sp. strain ADP cells in suspensions and biofilms using Raman spectroscopy and scanning electron microscopy[J]. Analytical & Bioanalytical Chemistry, 2017, 409(5): 1441-1449. |
| [52] |
Bleich R, Watrous JD, Dorrestein PC, et al. Thiopeptide antibiotics stimulate biofilm formation in Bacillus subtilis[J]. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(10): 3086-3091. DOI:10.1073/pnas.1414272112 |
| [53] |
Ding YZ, Zhou YF, Yao J, et al. In situ molecular imaging of the biofilm and its matrix[J]. Analytical Chemistry, 2016, 88(22): 11244-11252. DOI:10.1021/acs.analchem.6b03909 |
| [54] |
Stîngu CS, Rodloff AC, Jentsch H, et al. Rapid identification of oral anaerobic bacteria cultivated from subgingival biofilm by MALDI-TOF-MS[J]. Journal of Oral Microbiology, 2008, 23(5): 372-376. DOI:10.1111/omi.2008.23.issue-5 |
| [55] |
Pereira FDES, Bonatto CC, Lopes CAP, et al. Use of MALDI-TOF mass spectrometry to analyze the molecular profile of Pseudomonas aeruginosa biofilms grown on glass and plastic surfaces[J]. Microbial Pathogenesis, 2015, 86: 32-37. DOI:10.1016/j.micpath.2015.07.005 |
| [56] |
Potera C. Forging a link between biofilms and disease[J]. Science, 1999, 283(5409): 1837-1839. DOI:10.1126/science.283.5409.1837 |
| [57] |
Hu JS, Chen HT, Zhang J, et al. Advances in the common identification methods of bacterial biofilm[J]. Chinese Veterinary Science, 2010, 40(11): 1194-1199. (in Chinese) 胡锦松, 陈豪泰, 张杰, 等. 细菌生物被膜鉴定方法的研究进展[J]. 中国兽医科学, 2010, 40(11): 1194-1199. |
| [58] |
Dall L, Herndon B. Quantitative assay of glycocalyx produced by viridans group streptococci that cause endocarditis[J]. Journal of Clinical Microbiology, 1989, 27(9): 2039-2041. |
| [59] |
Lilledahl MB, Stokke BT. Novel imaging technologies for characterization of microbial extracellular polysaccharides[J]. Frontiers in Microbiology, 2015, 6: 525. |
| [60] |
Wang Y, Yi L, Shi MY, et al. Establishment and application of animal bacterial biofilm model in vivo: CN, CN102669017A[P]. 2012 (in Chinese) 汪洋, 易力, 史明艳, 等.一种体内细菌生物被膜感染动物模型的构建方法: 中国CN102669017A[P]. 2012-09-19 |
| [61] |
Wang Y, Yi L, Cheng XC, et al. Establishment and application of bacterial biofilm model in animals[J]. Chinese Journal of Preventive Veterinary Medicine, 2013, 35(11): 946-949. (in Chinese) 汪洋, 易力, 程相朝, 等. 动物体内细菌生物被膜模型的建立及应用[J]. 中国预防兽医学报, 2013, 35(11): 946-949. DOI:10.3969/j.issn.1008-0589.2013.11.21 |
 2018, Vol. 45
2018, Vol. 45




