扩展功能
文章信息
- 彭丽萍, 张冰, 喻其林, 李建荣, 梁超, 任彤彤, 李明春
- PENG Li-Ping, ZHANG Bing, YU Qi-Lin, LI Jian-Rong, LIANG Chao, REN Tong-Tong, LI Ming-Chun
- 白假丝酵母CFL1基因通过转录调控参与氧化压力应答
- CFL1 regulates oxidative stress response genes in transcriptional levels in Candida albicans
- 微生物学通报, 2018, 45(10): 2209-2216
- Microbiology China, 2018, 45(10): 2209-2216
- DOI: 10.13344/j.microbiol.china.180396
-
文章历史
- 收稿日期: 2018-05-22
- 接受日期: 2018-06-20
- 网络首发日期(www.cnki.net): 2018-06-27
白假丝酵母是临床常见的条件致病性真菌,菌落特征为白色、光滑、圆形或卵圆形[1]。通常情况下白假丝酵母与健康人体共生,不会危害人体健康。但是当人体免疫力降低造成菌群失衡后,会导致白假丝酵母的迅速生长,轻则引起浅层感染,导致鹅口疮、阴道炎等疾病,重则造成致病性的深度感染,导致菌血症、败血症的发生[2]。目前,随着全球免疫缺陷患者的增多,由白假丝酵母感染导致的念珠菌病成为人们广泛关注的健康问题[3]。此外,由于抗真菌药物的广泛使用,白假丝酵母进化出一定的耐药性,给治疗带来了更大的困难。因此,寻找白假丝酵母的药物治疗靶点,从而为白假丝酵母的治疗提供理论支撑,是科研工作关注的重点。
白假丝酵母入侵宿主时会受到宿主免疫系统的攻击,巨噬细胞、嗜中性粒细胞等免疫细胞在杀伤白假丝酵母时会释放大量活性氧(Reactive oxygen species,ROS),造成白假丝酵母的氧化压力显著升高,产生很强的毒害作用[4]。因此,为了在宿主体内存活,白假丝酵母进化出了较为完备的氧化压力应答机制。Cap1途径是目前研究得较为透彻的转录调控途径。在正常条件下,Cap1穿梭于胞质和细胞核之间,维持白假丝酵母胞内氧化水平的稳定。当受到氧化压力刺激时,Cap1能够进入细胞核,并发生磷酸化,失去与Crm1核输出序列(Nuclear export sequence,NES)的结合能力,进而结合在包括TRR1、GLR1和CAT1等氧化压力应答(Oxidative stress response,OSR)基因的启动子上,起始靶基因的表达,应对氧化压力[5-6]。
铁离子是生物体生长必需的元素,人体中的铁主要以转铁蛋白和乳铁蛋白的形式存在,而游离铁离子含量较低[7]。为了在宿主体内这一低铁环境下生存,白假丝酵母进化出复杂而高效的铁离子储存、转运和利用系统。其中,高铁还原酶能够将不可利用的三价铁离子(Fe3+)还原为可被细胞利用的二价铁离子(Fe2+),促进铁离子的吸收和利用[8]。在酿酒酵母中,典型的高铁还原酶有FRE1、FRP1和FRE10等。
CFL1基因(Candida ferric reductase-like gene)是首个被克隆出的白假丝酵母高铁还原酶编码基因。Cfl1属于还原性铁离子吸收系统的成员[9]。据文献报道[10-11],白假丝酵母CFL1基因与酿酒酵母的FRE1基因同源,并且在FRE1基因缺失后能够弥补其功能,其转录受到铜和铁含量的调节。
本实验室前期研究发现,白念珠菌CFL1基因的缺失会因其它替代高铁还原酶基因表达水平上调而导致细胞表面高铁还原酶活性的升高,进而造成胞内亚铁离子的聚集。在菌丝发育和小鼠毒力方面,CFL1基因的缺失也会造成缺陷[12]。此外,CFL1基因在氧化压力应答方面发挥作用,但是其调控过程并不清楚,其中发挥作用的元件也并未明确。在此基础上,本研究首次探讨CFL1基因对氧化压力应答的调控机理,探索CFL1的调控靶点,从而丰富对白假丝酵母氧化压力应答的认识,在铁稳态与氧化压力应答之间建立深层次的联系,进而为白假丝酵母的临床治疗提供理论支撑。
1 材料与方法 1.1 菌株、质粒及引物| Strains and plasmids | Genotype and description | References |
| C. albicans strains | ||
| BWP17 (WT) | ura3Δ::λimm434/ura3Δ::λimm434 his1::hisG/his1::hisG arg4::hisG/arg4::hisG | This study |
| cfl1Δ/Δ | ura3Δ::λimm434/ura3Δ::λimm434 his1::hisG/his1::hisG arg4::hisG/arg4::hisG cfl1::ARG4/cfl1::URA3-dpl200 | [12] |
| cfl1Δ/Δ+CFL1 | ura3Δ::λimm434/ura3Δ::λimm434 his1::hisG/his1::hisG arg4::hisG/arg4::hisG cfl1::ARG4/cfl1::URA3-dpl200 CFL1 | [12] |
| WT-CAT1-GFP | ura3Δ::λimm434/ura3Δ::λimm434 his1::hisG/his1::hisG arg4::hisG/arg4::hisG pACT-CAT1-GFP | This study |
| cfl1Δ/Δ-CAT1-GFP | ura3Δ::λimm434/ura3Δ::λimm434 his1::hisG/his1::hisG arg4::hisG/arg4::hisG cfl1::ARG4/cfl1::URA3-dpl200 pCAT1-GFP | This study |
| Plasmids | ||
| pRS-ARG4∆SpeI | Containing ARG4 marker, Ampr | [12] |
| pDDB57 | Containing URA3 marker, Ampr | [12] |
| pDDB78 | Containing HIS1 marker, Ampr | [12] |
| pDDB78-CFL1 | Containing HIS1 marker, Ampr, CFL1 | This study |
| pCAT1-GFP | Containing URA3 marker, Ampr | This study |
| Primers | Sequences (5′→3′) |
| TRR1-5RT | TGGAGGATCTGAATTGATGG |
| TRR1-3RT | CACCAGTAGCAATGATAACG |
| SOD1-5RT | CGAATCCGCTCCAACCACAA |
| SOD1-3RT | CCTTTAGCAACACCATTACCAT |
| GLR1-5RT | GGAGATTTCGATTGGGCTAA |
| GLR1-3RT | GACTTCAACTTCACCTTCAG |
| CAT1-5RT | TCCAGAACCATTTGCCACTCA |
| CAT1-3RT | GGAACCTTTAGCGTGGACAAC |
聚乙二醇3350 (PEG3350)、醋酸锂(LiAc)和碘化丙啶(PI)等购自Sigma公司;M-MLV反转录酶、Oligo-dT、RNA酶抑制剂等购自Promega公司;SYBR Green qPCR SuperMix购自TransGen公司。PCR仪购自Gene Company Limited公司;荧光显微镜购自Olympus公司。
1.3 培养基白假丝酵母的培养使用YPD培养基和SC培养基,使用前均需添加0.1%的无菌尿苷(浓度为0.08 g/L,SC-Ura无需添加)[13]。大肠杆菌的培养使用LB培养基,根据需要添加0.1%的氨苄青霉素(浓度为25 mg/L)[13]。巨噬细胞RAW264.7的培养使用RPMI-1640培养基,并加入10%胎牛血清(用前添加0.1%的0.08 g/L无菌尿苷)。
1.4 菌株的构建通过PCR介导的同源重组法,构建白假丝酵母的缺失株cfl1Δ/Δ。将CFL1基因克隆至pDDB78质粒上,并通过醋酸锂转化法将重组质粒转化cfl1Δ/Δ,构建回补菌株cfl1Δ/Δ+CFL1[12]。将pCAT1-GFP质粒转化WT与cfl1Δ/Δ,构建WT-CAT1-GFP和cfl1Δ/Δ-CAT1-GFP重组菌株。
1.5 生长能力的测定将WT、缺失株cfl1Δ/Δ和回补菌株cfl1Δ/Δ+CFL1的初始菌浓分别调整OD600为0.1,30 ℃、180 r/min振荡培养4 h,测定OD600。加入5 mmol/L H2O2,每隔2 h测定OD600,记录菌株的生长情况。在研究羟基自由基清除剂二甲基亚砜(Dimethyl sulfoxide,DMSO)对缓解氧化压力的作用时,向H2O2处理的菌液中加入75 mmol/L DMSO。
1.6 巨噬细胞损伤能力的测定取2 mL RAW264.7巨噬细胞加入6孔细胞板,培养至生长状况良好。收集对数生长期的WT、缺失株cfl1Δ/Δ和回补菌株cfl1Δ/Δ+CFL1,调整浓度为1×106 cells/mL。将白假丝酵母加入细胞培养板,置于37 ℃培养箱中共孵育3 h,向培养板中加入200 μL浓度为0.1 mg/mL的PI染料。收集菌体与细胞混合物,8 000 r/min离心2 min,PBS洗涤3次,显微镜观察,计算巨噬细胞死亡率。
1.7 ROS的测定处理方法:向对数生长初期的WT、缺失株cfl1Δ/Δ和回补菌cfl1Δ/Δ+CFL1中分别加入5 mmol/L H2O2,30 ℃、180 r/min振荡培养2 h,加入75 mmol/L DMSO,继续培养2 h后8 000 r/min离心2 min。ROS测定方法:向菌液中加入10 μmol/L DCFH-DA探针,避光孵育30 min,加入适量PBS洗涤2次,在激发波长488 nm和发射波长520 nm条件下测定荧光强度。
1.8 氧化压力应答基因表达的测定将WT、缺失株cfl1Δ/Δ和回补菌株cfl1Δ/Δ+CFL1培养至对数生长初期,加入5 mmol/L H2O2,振荡培养2 h,8 000 r/min离心2 min收集菌体,使用RNA提取试剂盒提取胞内总RNA[13]。将RNA反转录为cDNA,通过qRT-PCR的方法检测胞内TRR1、SOD1、GLR1、CAT1等氧化压力应答(Oxidative stress response,OSR)基因的表达量。
1.9 CAT活性的测定向对数生长初期的WT、缺失株cfl1Δ/Δ和回补菌株cfl1Δ/Δ+CFL1中加入5 mmol/L H2O2,培养2 h后8 000 r/min离心2 min收集菌体,提取胞内总蛋白。采用过氧化氢酶检测试剂盒测定CAT活性[14]。
2 结果与分析 2.1 CFL1缺失对氧化压力敏感性的影响在正常YPD培养条件下,cfl1Δ/Δ的生长与野生型和回补株cfl1Δ/Δ+CFL1没有差异(数据未显示)。经过5 mmol/L H2O2处理(图 1),8 h后cfl1Δ/Δ的生长明显弱于WT和cfl1Δ/Δ+CFL1,21 h后cfl1Δ/Δ的生长迟缓现象并未缓解。这表明cfl1Δ/Δ对氧化压力较为敏感,CFL1基因的缺失导致生长迟缓。
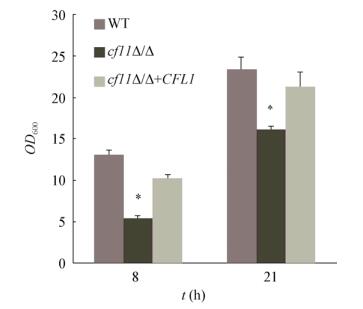
|
| 图 1 CFL1缺失对氧化压力敏感性的影响 Figure 1 Effects of CFL1 deletion on the sensitivity to oxidative stress of C. albicans |
|
|
巨噬细胞是生物体内重要的免疫细胞,在清除入侵宿主的白假丝酵母时,巨噬细胞会释放ROS,增强氧化压力,因此可以使用巨噬细胞检测氧化压力应答水平。将巨噬细胞株RAW264.7与白假丝酵母进行共培养,并对死亡的巨噬细胞进行PI染色,结果表明:野生型和回补菌均能杀死大量的巨噬细胞,而cfl1Δ/Δ对巨噬细胞的杀伤能力显著降低(图 2A)。进一步统计巨噬细胞的死亡率,发现WT或回补菌株能导致 > 90%的巨噬细胞死亡,而cfl1Δ/Δ仅造成11%的巨噬细胞死亡。可见CFL1基因的缺失会造成白假丝酵母氧化压力应答耐受能力的显著降低。
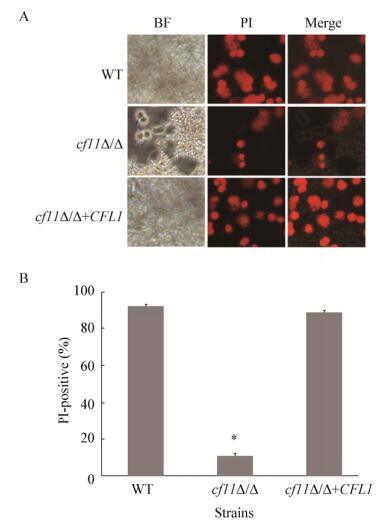
|
| 图 2 CFL1缺失对巨噬细胞损伤能力的影响 Figure 2 Effects of CFL1 deletion on the ability to kill the macrophages of C. albicans 注:A:PI染色分析;B:巨噬细胞死亡率分析. Note: A: PI dye; B: Death rate of macrophages. |
|
|
CFL1是高铁还原酶基因,能够将胞外的Fe3+还原为Fe2+,CFL1基因的缺失会造成胞内铁离子浓度的失衡。推测cfl1Δ/Δ对氧化压力敏感的机理是胞内过量的Fe2+与H2O2结合,发生芬顿反应,提高了羟自由基的含量,导致胞内大量ROS的积累[15]。为验证这一假设,加入羟自由基清除剂DMSO,测定氧化压力条件下细胞生长情况。结果表明:DMSO会促进WT野生型菌株和回补株的生长,其OD600分别增加了0.16和0.07,但是对cfl1Δ/Δ并无促进作用,OD600仅增加0.02 (图 3A)。这说明DMSO对cfl1Δ/Δ的生长并无显著作用。
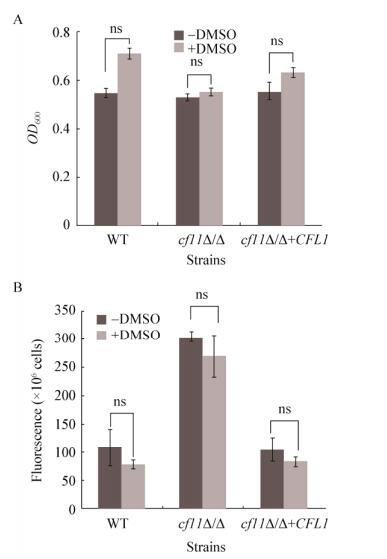
|
| 图 3 羟基自由基清除剂DMSO对cfl1Δ/Δ氧化压力敏感性的影响 Figure 3 Effects of hydroxyl radical DMSO scavenging agent on the sensitivity of oxidative stress in cfl1Δ/Δ 注:A:加入DMSO后菌液的生长情况;B:加入DMSO后胞内ROS水平. Note: A: Growth after adding DMSO; B: ROS levels after adding DMSO. |
|
|
为验证DMSO清除羟自由基是否缓解氧化压力,测定了氧化压力下DMSO处理后的ROS水平。结果显示:在野生型WT、缺失株cfl1Δ/Δ和回补株中,DMSO处理并未导致胞内ROS的含量显著下降(图 3B)。这表明cfl1Δ/Δ对氧化压力的敏感性与羟自由基的增加无关。
2.4 CFL1缺失对氧化压力应答基因表达的影响由于羟自由基的增加并非cfl1Δ/Δ对氧化压力敏感的原因,因此继续在基因表达水平上探究cfl1Δ/Δ对氧化压力敏感的机制。实时荧光定量PCR结果显示:无氧化压力时,WT、cfl1Δ/Δ和回补株中OSR基因的表达均处于较低水平(图 4A);在5 mmol/L H2O2刺激2 h后,cfl1Δ/Δ中OSR基因TRR1、SOD1、GLR1和CAT1的表达均明显下降(图 4B)。说明CFL1基因对OSR基因的正常功能发挥起着调控作用,cfl1Δ/Δ的缺失会显著降低OSR基因的应答水平。
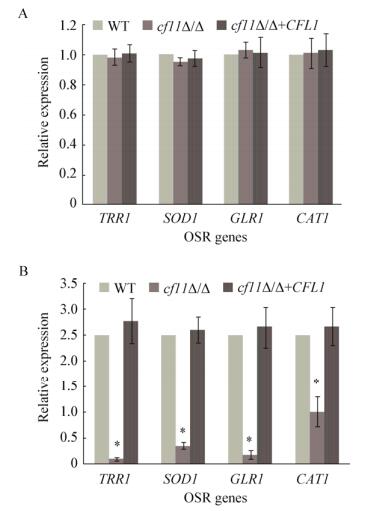
|
| 图 4 CFL1缺失对氧化压力应答基因表达的影响 Figure 4 Effects of CFL1 deletion on OSR genes expression of C. albicans under the oxidative stress 注:A:非氧化应激下OSR基因的表达;B:氧化应激下OSR基因的表达. Note: A: Expression of OSR genes under non-oxidative stress; B: Expression of OSR genes under oxidative stress. |
|
|
CAT1基因编码过氧化氢酶(Catalase,CAT),在受到氧化压力刺激时能够被大量表达,从而分解过氧化氢,清除胞内含量过高的ROS。正常条件下,CAT活性在WT、cfl1Δ/Δ和回补株中都处于较低的水平(图 5A)。为进一步验证CFL1的缺失对CAT1表达的影响,测定了氧化压力刺激下的CAT活性。结果显示:5 mmol/L H2O2处理2 h后,cfl1Δ/Δ中CAT活性显著偏低,只有0.05 U/mg protein,而野生型与回补菌株的CAT活性可达到1.53 U/mg protein和0.64 U/mg protein (图 5B)。可见,CFL1的缺失导致CAT1基因表达下调,进而引起CAT活性显著下降。
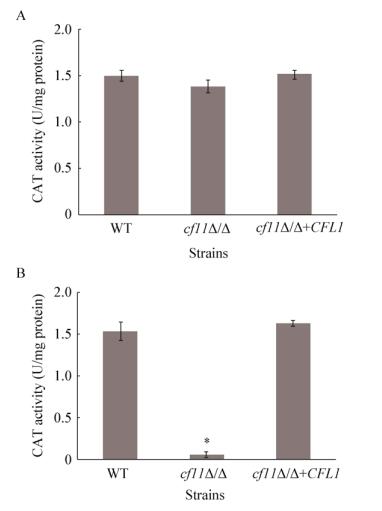
|
| 图 5 CFL1缺失对过氧化氢酶活性的影响 Figure 5 Effects of CFL1 deletion on the activity of catalase 注:A:非氧化应激下CAT的活性水平;B:氧化应激下CAT的活性水平. Note: A: Activity of catalase under non-oxidative stress; B: Activity of catalase under oxidative stress. |
|
|
鉴于CAT在白假丝酵母耐受H2O2过程中的重要作用,推测cfl1Δ/Δ氧化压力敏感性增强主要由于CAT1表达量的显著下降。为验证这一推测,探究了CAT过表达对cfl1Δ/Δ氧化压力敏感性的影响。将pCAT1-GFP过表达质粒分别转化白假丝酵母WT和缺失株cfl1Δ/Δ,使质粒中的强启动子ACT1起始CAT1的表达,并用GFP标记CAT1基因,分别测定5 mmol/L H2O2处理2 h后压力条件下各菌株的CAT活性和生长情况。结果表明:CAT1的过表达导致缺失株中CAT活性明显增加,达到了WT中CAT活性的水平(图 6A)。生长能力测定进一步表明:H2O2处理后,cfl1Δ/Δ-CAT1-GFP和WT-CAT1-GFP的生长量没有显著差异(图 6B)。上述结果进一步证明:CFL1缺失引起的CAT1基因表达下降是缺失菌株氧化压力敏感性增强的关键原因。
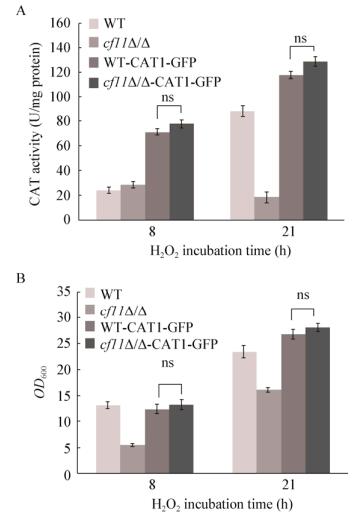
|
| 图 6 H2O2处理下过氧化氢酶过表达对cfl1Δ/Δ的CAT活性及氧化压力敏感性的影响 Figure 6 Effects of catalase over-expression on the CAT activity and the sensitivity to oxidative stress 注:A:过氧化氢酶过表达对cfl1Δ/Δ的CAT活性的影响;B:过氧化氢酶过表达对cfl1Δ/Δ氧化压力敏感性的影响. Note: A: Effect catalase over-expression on the CAT activity; B: Effect catalase over-expression on the sensitivity to oxidative stress. |
|
|
本实验室前期研究表明,CFL1基因在铁稳态维持、形态发生、细胞壁完整性等多方面发挥着重要作用。此外,CFL1基因的缺失会导致细胞表现出对氧化压力的敏感性,说明CFL1与氧化压力应答紧密相关,但是其调控氧化压力应答的具体机制有待深入探讨[12]。
本课题组前期研究结果发现,CFL1基因在白假丝酵母中编码高铁还原酶,其缺失导致胞内铁离子的大量聚集,但该聚集与细胞表现出的氧化压力敏感性并不具有直接联系[8]。本研究结果也证实,cfl1Δ/Δ对氧化压力敏感性的增强与铁离子相关的芬顿反应(该反应可产生大量羟基自由基)无关。本研究发现,CFL1缺失会导致细胞在氧化压力条件下OSR基因表达的下调,说明该基因在激活OSR基因表达方面发挥正向调控作用。过氧化氢酶编码基因CAT1的过表达能够补救CFL1缺失造成的氧化压力敏感性,该结果进一步说明,CFL1基因通过未知机制参与维持CAT1等氧化压力应答相关基因在胞内稳定的表达水平,进一步调控白假丝酵母胞内氧化压力应答过程。
白假丝酵母胞内铁稳态的维持受到严格的调控。其中转录调控的方式主要有同源Aft-型转录因子调控系统和Sef1-Sfu1-Hap43转录调控通路[14]。转录因子Sef1参与铁稳态维持,对CFL1基因的表达起激活作用[16]。Aft2也是低铁应答调控因子,作为转录激活因子,能够激活CFL1基因的表达。白假丝酵母氧化压力应答调控是一个复杂的过程,Cap1转录元件的入核和出核过程均需要多种蛋白的介导和参与,如Gpx3、Ybp1和Trx1等[17]。本研究通过对CFL1在氧化压力应答过程中作用机制的探索,进一步发现Cf11对Cap1依赖性的OSR基因转录具有调控作用,从而建立了Aft2调控的铁信号途径与Cap1介导的氧化压力应答途径的紧密联系。
因此,本研究揭示了CFL1能够在转录水平上调控OSR基因的表达,进而在氧化压力耐受过程中发挥重要作用。尽管如此,CFL1上游铁转录元件与OSR转录调控元件之间的关系仍需进一步研究,CFL1对OSR基因的具体调控机制也需要探讨。例如,CFL1在转录水平发挥调节作用的具体过程、中间介导蛋白的类型和作用、下游调节元件的应答机制等,都需要进一步深入研究。
| [1] |
Tong YQ, Tang JG. Candida albicans infection and intestinal immunity[J]. Microbiological Research, 2017, 198: 27-35. DOI:10.1016/j.micres.2017.02.002 |
| [2] |
Pan LN, Cao CJ, Wei YJ, et al. Phenotypic transitions and their regulatory mechanisms in the human fungal pathogen Candida albicans[J]. Chinese Journal of Cell Biology, 2016, 38(9): 1049-1059. (in Chinese) 潘丽娜, 曹承俊, 魏羽佳, 等. 白念珠菌形态转换及其调控机制的研究进展[J]. 中国细胞生物学学报, 2016, 38(9): 1049-1059. |
| [3] |
da Silva Dantas A, Day A, Ikeh M, et al. Oxidative stress responses in the human fungal pathogen, Candida albicans[J]. Biomolecules, 2015, 5(1): 142-165. DOI:10.3390/biom5010142 |
| [4] |
Diezmann S. Oxidative stress response and adaptation to H2O2 in the model eukaryote Saccharomyces cerevisiae and its human pathogenic relatives Candida albicans and Candida glabrata[J]. Fungal Biology Reviews, 2014, 28(4): 126-136. DOI:10.1016/j.fbr.2014.12.001 |
| [5] |
Wang Y, Cao YY, Jia XM, et al. Cap1p is involved in multiple pathways of oxidative stress response in Candida albicans[J]. Free Radical Biology & Medicine, 2006, 40(7): 1201-1209. |
| [6] |
Moye-Rowley WS. Transcription factors regulating the response to oxidative stress in yeast[J]. Antioxidants and Redox Signaling, 2002, 4(1): 123-140. DOI:10.1089/152308602753625915 |
| [7] |
Peng J, Zhang YT, Chen J, et al. Structural function and potential clinical value of transferrin[J]. China Journal of Modern Medicine, 2017, 27(26): 56-60. (in Chinese) 彭健, 张耀婷, 陈杰, 等. 转铁蛋白的结构功能和潜在临床应用价值[J]. 中国现代医学杂志, 2017, 27(26): 56-60. DOI:10.3969/j.issn.1005-8982.2017.26.011 |
| [8] |
Qian KF, Dong YJ, Xu N, et al. Research advances of cellular iron transport and storage in Candida albicans[J]. Microbiology China, 2014, 41(8): 1643-1648. (in Chinese) 钱柯帆, 董义杰, 徐宁, 等. 白念珠菌胞内铁离子存储转运系统的研究进展[J]. 微生物学通报, 2014, 41(8): 1643-1648. |
| [9] |
Yamada-Okabe T, Shimmi O, Doi R, et al. Isolation of the mRNA-capping enzyme and ferric-reductase-related genes from Candida albicans[J]. Microbiology, 1996, 142(9): 2515-2523. DOI:10.1099/00221287-142-9-2515 |
| [10] |
Hammacott JE, Williams PH, Cashmore AM. Candida albicans CFL1 encodes a functional ferric reductase activity that can rescue a Saccharomyces cerevisiae fre1 mutant[J]. Microbiology, 2000, 146(4): 869-876. DOI:10.1099/00221287-146-4-869 |
| [11] |
Georgatsou E, Alexandraki D. Regulated expression of the Saccharomyces cerevisiae Fre1p/Fre2p Fe/Cu reductase related genes[J]. Yeast, 1999, 15(7): 573-584. DOI:10.1002/(ISSN)1097-0061 |
| [12] |
Qian KF. Functional study of ferric reductase gene CFL1 in Candida albicans[D]. Tianjin: Master's Thesis of Nankai University, 2014 (in Chinese) 钱柯帆.白念珠菌高铁还原酶CFL1基因功能研究[D].天津: 南开大学硕士学位论文, 2014 http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2699729 |
| [13] |
Yu QL. Role of the calcium homeostasis system in morphogenesis and stress response in Candida albicans[D]. Tianjin: Doctoral Dissertation of Nankai University, 2013 (in Chinese) 喻其林.钙稳态系统在白念珠菌形态发生及压力应答中的功能研究[D].天津: 南开大学博士学位论文, 2013 http://cdmd.cnki.com.cn/Article/CDMD-10055-1014171673.htm |
| [14] |
Xu N, Cheng XX, Yu QL, et al. Research advances of iron homeostasis regulatory networks in Candida albicans[J]. Microbiology China, 2012, 39(3): 386-393. (in Chinese) 徐宁, 程欣欣, 喻其林, 等. 白念珠菌铁稳态调控网络研究进展[J]. 微生物学通报, 2012, 39(3): 386-393. |
| [15] |
He J, Yang XF, Men B, et al. Interfacial mechanisms of heterogeneous Fenton reactions catalyzed by iron-based materials: A review[J]. Journal of Environmental Sciences, 2016, 39: 97-109. DOI:10.1016/j.jes.2015.12.003 |
| [16] |
Chen CB, Pande K, French SD, et al. An iron homeostasis regulatory circuit with reciprocal roles in Candida albicans commensalism and pathogenesis[J]. Cell Host & Microbe, 2011, 10(2): 118-135. |
| [17] |
Kos I, Patterson MJ, Znaidi S, et al. Mechanisms underlying the delayed activation of the Cap1 transcription factor in Candida albicans following combinatorial oxidative and cationic stress important for phagocytic potency[J]. mBio, 2016, 7(2). |
 2018, Vol. 45
2018, Vol. 45




