扩展功能
文章信息
- 许苗苗, 苏前富, 李丽娜, 渠清, 贾娇, 曹志艳, 董金皋
- XU Miao-Miao, SU Qian-Fu, LI Li-Na, QU Qing, JIA Jiao, CAO Zhi-Yan, DONG Jin-Gao
- 青色荧光蛋白标记的禾谷镰孢转化子的构建
- Construction of CFP-labeled Fusarium graminearum transformants
- 微生物学通报, 2018, 45(10): 2191-2199
- Microbiology China, 2018, 45(10): 2191-2199
- DOI: 10.13344/j.microbiol.china.180290
-
文章历史
- 收稿日期: 2018-04-10
- 接受日期: 2018-06-01
- 网络首发日期(www.cnki.net): 2018-07-17
2. 吉林省农业科学研究院植物保护研究所 吉林 长春 130033
2. Institute of Plant Protection, Jilin Academy of Agricultural Sciences, Changchun, Jilin 130033, China
玉米茎腐病,又称为玉米茎基腐病,常侵染玉米茎秆基部,从而导致茎组织变软变褐和果穗倒挂,减产严重,并影响机械化收获。玉米茎腐病的致病菌十分复杂,通常是多种病原菌复合侵染。另外,其病原组成又因地区差异和气候条件变化,导致不同地区不同年份间茎腐病的病原组成也不相同[1]。目前,已知引起玉米茎腐病的主要致病菌主要包括禾谷镰孢(Fusarium graminearum)、拟轮枝镰孢(F. verticillioides)、尖孢镰孢(F. oxysporum)等。其中禾谷镰孢侵染玉米茎部会导致茎髓部腐烂,并且在被感染的玉米秸秆上产生毒素[2]。对于该病的防治目前尚无有效的方法,主要归因于病原菌组成复杂,不同镰孢菌在玉米茎部侵染、定殖规律不清楚。据文献报道,应用荧光标记菌株可观测致病菌在寄主体内的侵染定殖情况[3-4]。如Santiago等[5]采用绿色荧光标记的炭疽病菌,观察致病菌在玉米根系的侵染过程,研究发现接种1 d后菌丝定殖胚根表面;2 d时菌丝沿着表皮生长,平行于根部的纵向轴线;在3 d时可观察到部分菌丝侵入根表皮细胞的细胞间隙。Haile等[6]通过荧光观察GFP标记的灰葡萄孢(Botrytis cinerea)在葡萄开花期的侵染过程,确定了病菌的定殖部位,进而检测接种后不同时间寄主与病菌在转录和代谢水平上的变化,揭示了宿主与病菌间的互作关系。凌瑶[7]研究表明,使用CFP荧光标记技术可研究菜豆根瘤菌(Rhizobium leguminosarum)的竞争结瘤能力。
丝状真菌的荧光报告基因标记技术能够在细胞和全植物水平上监测真菌的生长和发育,这种技术对于非破坏性和原位观察致病真菌与其宿主之间复杂的相互作用特别有吸引力[8]。绿色荧光蛋白(Green fluorescent protein,GFP)已广泛应用于多种细菌、真菌、植物和哺乳动物细胞的研究中,目前已为多种植物致病真菌在植物体外和体内中的观察提供了有效工具[9-10]。Heim等早在1994年就率先阐述了GFP发光的化学机制[11],于1995年通过单点突变(S65T)技术获得了荧光强度和光稳定性大大增强的GFP突变体(GFP-S65T),并进一步获得了蓝色荧光蛋白(Blue fluorescent protein,BFP)、青色荧光蛋白(Cyan fluorescent protein,CFP)和黄色荧光蛋白(Yellow fluorescent protein,YFP)[12]。青色荧光蛋白的编码基因CFP在宿主细胞表达后,对细胞本身没有任何损伤,反应过程也无需底物,能产生更明亮的蓝-绿色或青色荧光[13]。
为了将外源荧光蛋白基因成功导入目标真菌基因组中,高效的遗传转化系统必不可缺。Bundock等[14]首次将ATMT技术应用于研究酵母菌,而后得到广泛应用,并已应用于病原真菌突变体库的构建和功能基因组学的研究中。目前,丝状真菌如日本曲霉(Asnergillus japonicus)[15]、泡盛曲霉(Aspergillus awamori)[16]、青霉菌(Penicillium)[17]、炭疽病菌(Colletotrichum gloeosporioides)[18]和轮枝菌(Verticillium dahliae)[19]等的ATMT遗传转化技术体系已成熟。
近几年,关于玉米茎腐病的防控研究备受关注,但对玉米茎腐病病原菌的侵染机制还缺乏深入了解。本课题组前期获得了带有绿色荧光蛋白(GFP)和红色荧光蛋白(RFP)标记的层出镰孢(F. proliferatum)和拟轮枝镰孢(F. verticillioides)。在此基础上,本研究拟通过ATMT技术构建青色荧光标记的禾谷镰孢,为寄主与病原菌间的互作研究以及不同镰孢菌侵染寄主过程中的竞争机制研究提供一种直观的、非破坏性的技术,为病原菌在寄主体内的定殖规律研究奠定了基础。
1 材料与方法 1.1 供试玉米品种、菌株及质粒供试玉米B73,河北省植物生理与分子病理学重点实验室保存。
供试菌株禾谷镰孢(Fusarium graminearum)由吉林省农业科学研究院植物保护研究所苏前富博士提供。农杆菌AGL-1来自河北省植物生理与分子病理学重点实验室。
供试质粒pBSK-CFP-Kan,含有青色荧光蛋白基因,用于扩增目的片段,由河北省植物生理与分子病理学重点实验室保存;质粒pCAMBIA1300,含有卡那抗性和潮霉素抗性,适用于农杆菌介导的遗传转化,由上海交通大学农业与生物学院陈捷教授惠赠。
1.2 供试培养基PDA培养基(g/L):马铃薯200.0,葡萄糖20.0,琼脂粉13.0。
CMC培养基(g/L):NH4NO3 1.0,KH2PO4 1.0,MgSO4·7H2O 0.5,酵母浸粉1.0,羧甲基硝酸纤维素钠15.0。
LB液体培养基(g/L):胰蛋白胨10.0,酵母提取物5.0,NaCl 10.0。调节pH 7.0。固体培养基加琼脂粉15.0 g/L。
YEB液体培养基(g/L):蔗糖5.0,胰蛋白胨5.0,牛肉浸膏抽浸膏5.0,酵母提取物1.0,MgSO4·7H2O 0.5,调pH 7.2-7.4。固体培养基加琼脂粉15.0 g/L。
IM诱导培养基:10.0 mL K-buffer,20.0 mL M-N,1.0 mL 1% CaCl2·2H2O (质量体积比),10.0 mL 0.01% FeSO4 (质量体积比),5.0 mL Spore Elements,2.5 mL 20% NH4NO3 (质量体积比),10.0 mL 50%甘油,40.0 mL 1 mol/L MES (pH 5.3),5.0 mL 2 mol/L葡萄糖,2.0 mL 100 mmol/L乙酰丁香酮(AS),加ddH2O 898.7 mL至1 L。
IM共培养固体培养基IM诱导培养基加15.0 g/L琼脂粉,其中2 mol/L葡萄糖改为2.5 mL/L。
K-buffer (g/L):K2HPO4 200.0,KH2PO4 145.0,调节pH 7.0;M-N (g/L):MgSO4·7H2O 30.0,NaCl 15.0;Spore Elements:100.0 mg/L ZnSO4·7H2O,100.0 mg/L CuSO4·5H2O,100.0 mg/L H3BO3,100.0 mg/L MnSO4·H2O,100.0 mg/L Na2MoO4·2H2O。
1.3 主要试剂和仪器羧甲基纤维素钠、头孢噻肟钠、卡那霉素、氨苄青霉素、乙酰丁香酮,生工生物工程(上海)股份有限公司;LATaq DNA聚合酶、dNTPs、限制性内切酶Sma I,宝生物工程(大连)有限公司;DL2000、DL10000 DNA marker,上海捷瑞生物科技有限公司;潮霉素B,Roche公司;硝酸纤维素膜,Whatman公司;葡萄糖、平衡酚、胰蛋白胨、氯仿、异丙醇、无水乙醇、琼脂粉、酵母浸粉等常用分析纯,BBI生命科学有限公司。
高压蒸汽灭菌锅,厦门致微仪器有限公司;EasyCycler PCR仪,耶拿分析仪器股份公司;全自动凝胶成像仪,北京赛创科技有限公司;智能生化培养箱,宁波江南仪器厂;光学显微镜、荧光显微镜、激光共聚焦显微镜,奥林巴斯公司;高速冷冻离心机,贺利氏控股集团公司。
1.4 带有青色荧光的ATMT转化载体的构建基于目前本实验室尚无携带青色荧光且适用于真菌ATMT转化的质粒载体,本研究首先对现有质粒pBSK-CFP-Kan和pCAMBIA1300-eGFP-Kan进行改造。应用重叠PCR的方法,以pBSK-CFP-Kan为模板扩增CFP基因,以pCAMBIA1300-eGFP-Kan为模板扩增启动子trpC和Z序列(载体序列,从CFP终止子到Sma Ⅰ酶切位点的序列),PCR扩增所用引物见表 1。PCR反应体系(25 μL):模板DNA 1 μL,引物10 μmol/L各0.5 μL,10×Taq buffer (Mg2+ Plus) 2.5 μL,dNTP Mixture (2.5 mmol/L) 2 μL,TaKaRa Taq酶(5 U/μL) 0.5 μL,ddH2O 18 μL。反应条件:95 ℃ 5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1-2 min,35个循环;72 ℃ 10 min。PCR产物经1%琼脂糖凝胶电泳后回收,纯化后测序。之后用Sma Ⅰ单酶切质粒pCAMBIA1300-eGFP-Kan,回收质粒序列与测序正确的目的片段进行连接,再转入大肠杆菌感受态中,将转化后的大肠杆菌均匀涂布于含有100 μg/mL卡那霉素抗性的LB平板上培养过夜,挑取单克隆37 ℃、220 r/min振荡培养4 h,再进行菌液检测,提取阳性菌液质粒pCAMBIA1300-CFP-Kan,同样用Sma Ⅰ进行酶切验证。
| 引物 Primers |
序列 Sequence (5′→3′) |
大小 Size (bp) |
| TrpC-F | CCCGGGACCTCAAAGGAGGAGGGGGGTCCCC | 449 |
| TrpC-R | GGTGGCGAGCTCGGTACCTAAGTTCTTCTCCTTTACTCAT | |
| CFP-F | ATGAGTAAAGGAGAAGAACTTAGGTACCGAGCTCGCCAC | 726 |
| CFP-R | GGTCAAGCATGCAGGCCTCTCTAGGATCTACCTTTGTATA | |
| Z-F | TATACAAAGGTAGATCCTAGAGAGGCCTGCATGCTTGACC | 1 431 |
| Z-R | CCCGGGCGGGTTTTCGAGTCGTTTTTGTCAC |
(1) 取200 μL农杆菌AGL-1感受态细胞,加入10 μL重组质粒pCAMBIA1300-CFP-Kan后冰浴热击转化,然后加入600 μL YEB液体培养基,28 ℃、220 r/min恒温振荡培养6 h。之后取50 μL菌液均匀涂布于含有100 μg/mL卡那霉素和100 μg/mL氨苄青霉素的YEB平板上,28 ℃培养3 d后挑取单克隆,进行菌液检测。取阳性克隆的菌液进行活化,然后多次离心收集菌体,加入IM诱导培养基调整菌液OD600为0.15-0.20左右,再加入终浓度为80 μg/mL的乙酰丁香酮(AS)对农杆菌进行预培养,待菌体OD600值为0.8-1.0时取出,以备转化用[20]。
(2) 将禾谷镰孢接种于CMC液体培养基中,25 ℃、180 r/min振荡培养7 d,制备106/mL的孢子悬浮液。
(3) 在含乙酰丁香酮(AS)浓度为40 μg/mL的共培养IM平板上铺一层硝酸纤维素膜,将100 μL禾谷镰孢孢子悬浮液与100 μL农杆菌培养物(OD600为0.8-1.0)混合均匀,涂布于IM平板上25 ℃黑暗培养5-10 d。将含有培养物的硝酸纤维素膜转移至PDA选择培养基(含0.2 mol/L头孢噻肟钠和100 μg/mL潮霉素)上,于25 ℃黑暗培养4-6 d后挑取生长的菌落,继续接种到选择培养基上培养,连续进行5轮,将得到的潮霉素抗性转化子进行纯化。
1.6 禾谷镰孢CFP转化子的鉴定 1.6.1 转化子的PCR验证将获得的潮霉素抗性转化子接种于PDA培养基上,25 ℃黑暗培养7 d,然后轻轻刮取表面菌丝,按常规十六烷基三甲基溴化铵(CTAB)方法提取野生型及转化子的基因组DNA[21],转化子CFP基因的验证参照质粒构建的引物进行扩增,1%琼脂糖凝胶电泳检测目的片段。
1.6.2 转化子的荧光显微验证取生长在PDA培养基上的菌丝,在接种点旁倾斜45°插入灭菌后的盖玻片,黑暗倒置培养3 d后,取出盖玻片,在载玻片上滴一滴无菌水,轻轻从一侧盖上盖玻片,赶走气泡制成菌丝切片,在荧光显微镜下观察其荧光信号。
1.7 禾谷镰孢在玉米茎部的定殖观察选取经分子鉴定已经转入目的基因且荧光观察有较强信号的禾谷镰孢青色荧光转化子,将其在CMC培养基中25 ℃、180 r/min振荡培养7 d,过滤洗涤得到孢子悬液后调整浓度至106/mL,在玉米茎部第二节注射2 mL孢子悬浮液,接种无菌水为空白对照。接种后在伤口部位包扎灭菌纱布后按常规方法管理。于接种后4 d取样,之后将茎秆从中心纵向劈开,用超薄切片刀切取适量茎部组织放于载玻片上,滴加无菌水,迅速盖上盖玻片,尽量除去气泡,将制作好的玻片样品置于激光共聚焦显微镜下观察禾谷镰孢在茎部组织的定殖情况。
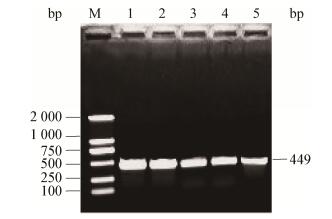
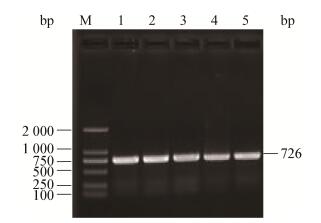
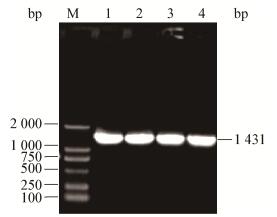
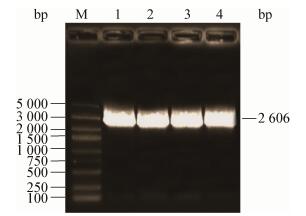
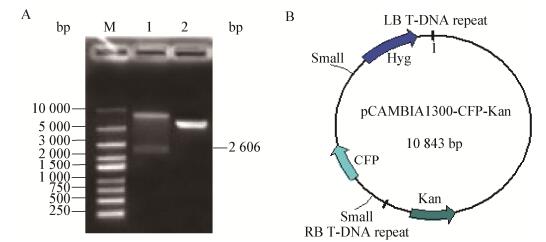
2 结果与分析 2.1 重组质粒pCAMBIA1300-CFP-Kan载体的获得利用3对引物trpC-F/R、CFP-F/R和Z-F/R,分别扩增出启动子、青色荧光蛋白和Z序列目的片段(图 1-3)。然后,利用重叠PCR方法将3个基因片段融合成1个长片段(图 4),PCR产物经1.0%的琼脂糖凝胶检测结果显示,获得的目的片段大小与预期一致,证明已获得了CFP蛋白的表达框。酶切验证结果(图 5A)显示,目的片段大小正确,表明已将目的基因连接到载体上,青色荧光标记的质粒载体构建成功(图 5B)。
|
| 图 1 启动子trpC基因的PCR结果 Figure 1 Detection of PCR amplification of promoter trpC 注:M:DL2000 DNA marker;1-5:样品. Note: M: DL2000 DNA marker; 1-5: Samples. |
|
|
|
| 图 2 荧光蛋白基因CFP的PCR结果 Figure 2 Detection of PCR amplification of CFP 注:M:DL2000 DNA marker;1-5:样品. Note: M: DL2000 DNA marker; 1-5: Samples. |
|
|
|
| 图 3 Z序列片段的PCR结果 Figure 3 Detection of PCR amplification of Z sequence 注:M:DL2000 DNA marker;1-4:样品. Note: M: DL2000 DNA marker; 1-4: Samples. |
|
|
|
| 图 4 重叠PCR结果 Figure 4 Detection of overlapping PCR 注:M:DL5000 DNA marker;1-4:样品. Note: M: DL5000 DNA marker; 1-4: Samples. |
|
|
|
| 图 5 重组质粒的酶切验证(A)和重组质粒图谱(B) Figure 5 The enzyme digestion pattern (A) and DNA map of recombinant vector (B) 注:M:DL10000 DNA marker;1:重组质粒酶切;2:质粒对照. Note: M: DL10000 DNA marker; 1: Recombinant plasmid digest product; 2: Plasmid control. |
|
|
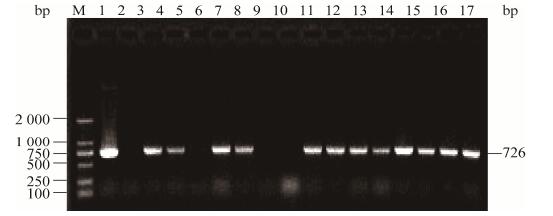
分别以重组质粒pCAMBIA1300-CFP-Kan、禾谷镰孢野生型菌株DNA和转化子DNA为模板,用引物CFP-F/CFP-R进行PCR扩增,检测是否含有青色荧光基因片段。琼脂糖凝胶电泳结果显示,阳性对照质粒有明亮的目的条带,而野生型菌株未能扩增到目的条带,大部分转化子能够扩增获得726 bp的预期条带(图 6)。由此初步确定pCAMBIA1300- CFP-Kan载体中的CFP基因通过ATMT转化,成功地整合到野生型菌株的基因组中。
|
| 图 6 CFP标记基因转化子的PCR鉴定 Figure 6 PCR identification of CFP transformants 注:M:DL2000 DNA marker;1:阳性对照;2:阴性对照;3-17:转化子. Note: M: DL2000 DNA marker; 1: Positive control; 2: Negative control; 3-17: Transformants. |
|
|
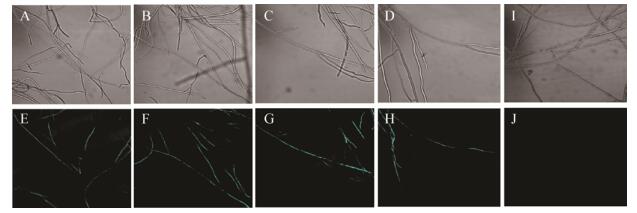
将PCR鉴定为阳性的转化子进行荧光显微观察,选取在普通PDA培养基上生长的转化子和野生型菌株的幼嫩菌丝,于荧光显微镜下观察各个转化子荧光信号的强弱,为避免成团的菌丝自发荧光,观察时选取少量菌丝或单根菌丝。结果显示,PCR鉴定为阳性的转化子菌丝有稳定的青色荧光信号(图 7),证明菌株已被成功标记。
|
| 图 7 禾谷镰孢青色荧光转化子的荧光显微检测 Figure 7 Fluorescent detection of Fusarium graminearum transformants 注:A-D:转化子的显微观察;E–H:转化子的荧光观察;I:野生型的显微观察;J:野生型的荧光观察. Note: A-D: Microscopic observation of transformants; E–H: Fluorescence observation of transformants; I: Microscopic observation of wild type; J: Fluorescence observation of wild type. |
|
|
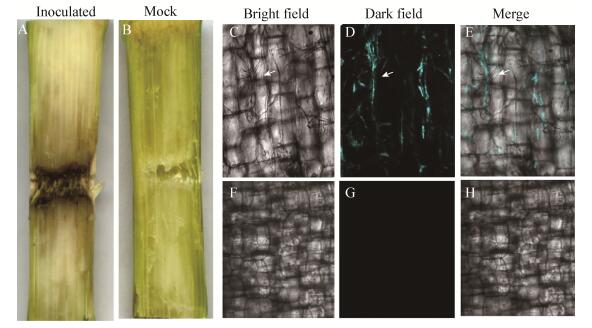
将CFP标记的镰孢菌接种到玉米茎部取样观察发现,接种镰孢菌的处理出现了明显发病症状,接种部位组织变褐坏死,而接种无菌水的处理无明显变化(图 8A、B)。选取接种部位临近的细胞组织制成切片,使用激光共聚焦显微镜观察接种的玉米茎部组织,结果发现,自然光下可见菌丝在玉米茎部细胞和细胞间隙定殖,荧光激发下清楚地显示出青色菌丝的定殖位置,接种无菌水的对照没有明显现象(图 8C、H)。上述结果证明,青色荧光标记的禾谷镰孢菌已成功在玉米茎部组织中定殖,同时也说明CFP标记的转化子致病力没有受到影响,而且很好地显示了菌丝在玉米茎部的侵染部位。
|
| 图 8 禾谷镰孢青色荧光转化子接种玉米茎部的荧光观察 Figure 8 Fluorescent observation of Fusarium graminearum transformants growing in corn stem tissues 注:A:茎部接种禾谷镰孢转化;B:茎部接种无菌水;C:茎部接种禾谷镰孢转化子的显微观察;D:茎部接种禾谷镰孢转化子的荧光观察;E:茎部接种禾谷镰孢转化子的明暗场重叠图;F:茎部接种无菌水的显微观察;G:茎部接种无菌水的荧光观察;H:茎部接种无菌水的明暗场重叠图. Note: A: Stem inoculated Fusarium graminearum transformants; B: Stem inoculated with sterile water; C: Microscopic observation of stem inoculated Fusarium graminearum transformants; D: Fluorescence observation of stem inoculated Fusarium graminearum transformants; E: Merge field of observation of stem inoculated Fusarium graminearum transformants; F: Microscopic observation of stem inoculated with sterile water; G: Fluorescence observation of stem inoculated with sterile water; H: Merge field of observation of stem inoculated with sterile water. |
|
|
由镰孢菌侵染引起的玉米茎腐病给玉米生产构成了严重威胁,一般发病年份导致减产20%,严重时可减产50%-60%[22]。植株在玉米生长后期感病时可见叶片迅速枯萎,茎基部节位变软变空,果穗倒挂,植株容易倒伏,直接影响玉米产量和品质。目前,由于缺少抗病品种和高效的防控药剂,该病尚无有效的防治方法。
通过荧光标记菌株来探讨病原菌侵染途径、定殖规律和解析侵染机制的研究越来越多,GFP和DsRed已被广泛应用于荧光标记的研究中,同时已有文献报道CFP在细菌中可以表现明亮的荧光信号[7]。例如,许有嫔等[23]将稻瘟病菌(Magnaporthe grisea)进行了绿色荧光标记,观察稻瘟病菌在高抗水稻和易感水稻中的侵染过程,发现侵染过程的差异主要表现在侵染钉的穿透和侵染菌丝的定殖上。Mrosk等[24]以含有DsRed的载体转化菌根真菌(Mycorrhizal fungi),追踪了标记菌株在植物茎叶和根中的定殖情况。Vu等[25]用农杆菌介导的遗传转化技术用GFP和DsRed标记了青霉菌(Penicillium),通过荧光观察到青霉菌在柑橘上的侵染过程,发现GFP比DsRed更适用于青霉菌的侵染过程观察。玉米镰孢茎腐病病原组成复杂,常为多种镰孢菌或其他病菌复合侵染,在侵染过程是以某个镰孢菌为主还是不同镰孢菌间存在协同作用或竞争关系,目前尚不清楚。本研究利用重叠PCR的方法成功构建了青色荧光蛋白CFP的质粒载体,该方法避免了试验过程中基于酶切位点选择而带来的不便,而且对原有质粒没有造成过多的改变,荧光信号表达稳定。试验中使用的启动子在真菌中能够稳定启动,保证了所插入目的基因的表达效果与原有基因表达效果一致。凌瑶[7]通过三亲本杂交方法将细菌供体中的CFP基因转给受体细菌,而禾谷镰孢属于真核生物,要将质粒中携带的CFP基因转入真菌基因组中必须借助媒介,ATMT技术是目前研究中采用的最常用最有效的方法。在此基础上,本研究通过实验室前期建立的层出镰孢ATMT转化体系[26],将CFP基因整合到禾谷镰孢基因组中,通过荧光检测,获得了CFP蛋白的表达。本文研究结果为进一步深入了解禾谷镰孢病菌在玉米茎部的侵染定殖规律奠定了坚实基础,同时可以为多种镰孢菌在侵染过程中的互作关系研究提供材料。
| [1] |
Ma HX, Zhang HJ, Sun H, et al. Comparison of pathogen detection methods for corn stalk rot[J]. Plant Protection, 2017, 43(3): 149-153. (in Chinese) 马红霞, 张海剑, 孙华, 等. 玉米茎腐病病原菌检测方法研究[J]. 植物保护, 2017, 43(3): 149-153. DOI:10.3969/j.issn.0529-1542.2017.03.025 |
| [2] |
Quesada-Ocampo LM, Al-Haddad J, Scruggs AC, et al. Susceptibility of maize to stalk rot caused by Fusarium graminearum deoxynivalenol and zearalenone mutants[J]. Postharvest Pathology and Mycotoxins, 2016, 106(8): 920-927. |
| [3] |
Palencia ER, Glenn AE, Hinton DM, et al. Constitutive expression of fluorescent protein by Aspergillus var. niger and Aspergillus carbonarius to monitor fungal colonization in maize plants[J]. Journal of Microbiological Methods, 2013, 94(3): 381-389. DOI:10.1016/j.mimet.2013.07.016 |
| [4] |
Islam MN, Nizam S, Verma PK. A highly efficient Agrobacterium mediated transformation system for chickpea wilt pathogen Fusarium oxysporum f. sp. ciceri using DsRed-Express to follow root colonisation[J]. Microbiological Research, 2012, 167(6): 332-338. DOI:10.1016/j.micres.2012.02.001 |
| [5] |
Santiago R, Reid LM, Arnason JT, et al. Phenolics in maize genotypes differing in susceptibility to Gibberella stalk rot (Fusarium graminearum schwabe)[J]. Journal of Agricultural and Food Chemistry, 2007, 55(13): 5186-5193. DOI:10.1021/jf070641e |
| [6] |
Haile ZM, Pilati S, Sonego P, et al. Molecular analysis of the early interaction between the grapevine flower and Botrytis cinerea reveals that prompt activation of specific host pathways leads to fungus quiescence[J]. Plant, Cell & Environment, 2017, 40(8): 1409-1428. |
| [7] |
Ling Y. The competitiveness and effectiveness of Phaseolus rhizobia studied by using CFP marker gene technique[D]. Chengdu: Master's Thesis of Sichuan Agricultural University, 2005 (in Chinese) 凌瑶.用CFP标记基因法研究菜豆根瘤菌的竞争性和有效性[D].成都: 四川农业大学硕士学位论文, 2005 http://cdmd.cnki.com.cn/article/cdmd-10626-2005141191.htm |
| [8] |
Larrainzar E, O'Gara F, Morrissey JP, et al. Applications of autofluorescent proteins for in situ studies in microbial ecology[J]. Annual Review of Microbiology, 2005, 59(1): 257-277. DOI:10.1146/annurev.micro.59.030804.121350 |
| [9] |
Lorang JM, Tuori RP, Martinez JP, et al. Green fluorescent protein is lighting up fungal biology[J]. Applied and Environmental Microbiology, 2001, 67(5): 1987-1994. DOI:10.1128/AEM.67.5.1987-1994.2001 |
| [10] |
da Silva Siqueira C, da Cruz Machado J, Corrêa CL, et al. Colonization of maize seeds by two species of Stenocarpella transformed with fluorescent proteins and assessed through scanning electron microscopy[J]. Journal of Seed Science, 2014, 36(2): 168-177. DOI:10.1590/2317-1545v32n2918 |
| [11] |
Heim R, Prasher DC, Tsien RY. Wavelength mutations and posttranslational autoxidation of green fluorescent protein[J]. Proceedings of the National Academy of Sciences of the United States of America, 1994, 91(26): 12501-12504. DOI:10.1073/pnas.91.26.12501 |
| [12] |
Heim R, Tsien RY. Engineering green fluorescent protein for improved brightness, longer wavelengths and fluorescence resonance energy transfer[J]. Current Biology, 1996, 6(2): 178-182. DOI:10.1016/S0960-9822(02)00450-5 |
| [13] |
Yang J, Zhang ZH, Luo QM. Recent progress in fluorescent proteins research[J]. Acta Biophysica Sinica, 2010, 26(11): 1025-1035. (in Chinese) 杨杰, 张智红, 骆清铭. 荧光蛋白研究进展[J]. 生物物理学报, 2010, 26(11): 1025-1035. |
| [14] |
Bundock P, Den Dulk-Ras A, Beijersbergen A, et al. Trans-kingdom T-DNA Transfer from Agrobacterium tumefaciens to Saccharomyces cerevisiae[J]. The EMBO Journal, 1995, 14(13): 3206-3214. DOI:10.1002/embj.1995.14.issue-13 |
| [15] |
Guo H, Yang Z, Xing LJ, et al. Transformation system of Aspergillus japonicus mediated by Agrobacterium tumefaciens[J]. Acta Microbiologica Sinica, 2011, 51(1): 115-121. (in Chinese) 郭慧, 杨哲, 邢来君, 等. 根癌农杆菌介导的日本曲霉转化体系的建立[J]. 微生物学报, 2011, 51(1): 115-121. |
| [16] |
Michielse CB, Hooykaas PJJ, van den Hondel CAMJJ, et al. Agrobacterium-mediated transformation as a tool for functional genomics in fungi[J]. Current Genetics, 2005, 48(1): 1-17. DOI:10.1007/s00294-005-0578-0 |
| [17] |
Wang JY, Li HY. Agrobacterium tumefaciens-mediated genetic transformation of the phytopathogenic fungus Penicillium digitatum[J]. Journal of Zhejiang University Science B, 2008, 9(10): 823-828. DOI:10.1631/jzus.B0860006 |
| [18] |
Cai ZY, Li GH, Lin CH, et al. Identifying pathogenicity genes in the rubber tree anthracnose fungus Colletotrichum gloeosporioides through random insertional mutagenesis[J]. Microbiological Research, 2013, 168(6): 340-350. DOI:10.1016/j.micres.2013.01.005 |
| [19] |
Maruthachalam K, Klosterman SJ, Kang S, et al. Identification of pathogenicity-related genes in the vascular wilt fungus Verticillium dahliae by Agrobacterium tumefaciens-mediated T-DNA insertional mutagenesis[J]. Molecular Biotechnology, 2011, 49(3): 209-221. DOI:10.1007/s12033-011-9392-8 |
| [20] |
Maruthachalam K, Nair V, Rho HS, et al. Agrobacterium tumefaciens-mediated transformation in Colletotrichum falcatum and C. acutatum[J]. Journal of Microbiology and Biotechnology, 2008, 18(2): 234-241. |
| [21] |
An XL, Dong JG, Han JM. RAPD analysis of Exserohilum turcicum Ⅰ. CTAB method of isolating DNA from Exserohilum turcicum for RAPD[J]. Journal of Agricultural University of Hebei, 2001, 24(1): 38-41. (in Chinese) 安鑫龙, 董金皋, 韩建民. 玉米大斑病菌的RAPD分析Ⅰ.应用CTAB法提取玉米大斑病菌DNA[J]. 河北农业大学学报, 2001, 24(1): 38-41. |
| [22] |
Cui XW. Study on corn stalk rot in Henan province[D]. Shaanxi: Master's Thesis of Northwest A & F University, 2013 (in Chinese) 崔小伟.河南省玉米茎腐病研究[D].陕西: 西北农林科技大学硕士学位论文, 2013 http://cdmd.cnki.com.cn/Article/CDMD-10712-1013345842.htm |
| [23] |
Xu YP, Liao HC, Chen JH, et al. Fluorescent microscopic analysis of the plant infection process of Magnaporthe oryzae using green fluorescent protein[J]. Plant Protection, 2017, 43(6): 53-61. (in Chinese) 许有嫔, 廖海澄, 陈金华, 等. 利用绿色荧光蛋白GFP研究稻瘟病菌与水稻的互作[J]. 植物保护, 2017, 43(6): 53-61. DOI:10.3969/j.issn.0529-1542.2017.06.008 |
| [24] |
Mrosk C, Forner S, Hause G, et al. Composite Medicago truncatula plants harbouring Agrobacterium rhizogenes-transformed roots reveal normal mycorrhization by Glomus intraradices[J]. Journal of Experimental Botany, 2009, 60(13): 3797-3807. DOI:10.1093/jxb/erp220 |
| [25] |
Vu TX, Ngo TT, Mai LTD, et al. A highly efficient Agrobacterium tumefaciens-mediated transformation system for the postharvest pathogen Penicillium digitatum using DsRed and GFP to visualize citrus host colonization[J]. Journal of Microbiological Methods, 2018, 144: 134-144. DOI:10.1016/j.mimet.2017.11.019 |
| [26] |
Xu P. The pathway and biochemical mechanism of Fusarium proliferatum infecting corn sheath[D]. Baoding: Master's Thesis of Agricultural University of Hebei, 2013 (in Chinese) 徐鹏.层出镰孢侵染玉米叶鞘的途径及生化机制[D].保定: 河北农业大学硕士学位论文, 2013 http://cdmd.cnki.com.cn/Article/CDMD-10086-1014106126.htm |
 2018, Vol. 45
2018, Vol. 45




