扩展功能
文章信息
- 于瑞嵩, 高位相, 李凤平, 董世娟, 李震
- YU Rui-Song, GAO Wei-Xiang, LI Feng-Ping, DONG Shi-Juan, LI Zhen
- 西藏株小反刍兽疫病毒H蛋白的原核表达及其多克隆抗体的制备
- Prokaryotic expression and polyclonal antibody preparation of peste des petits ruminants virus H protein
- 微生物学通报, 2018, 45(10): 2183-2190
- Microbiology China, 2018, 45(10): 2183-2190
- DOI: 10.13344/j.microbiol.china.171047
-
文章历史
- 收稿日期: 2017-12-12
- 接受日期: 2018-05-04
- 网络首发日期(www.cnki.net): 2018-06-13
2. 上海农业遗传育种重点实验室 上海 201106;
3. 上海海洋大学水产与生命学院 上海 201306
2. Shanghai Key Laboratory of Agricultural Genetics and Breeding, Shanghai 201106, China;
3. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306, China
小反刍兽疫(Peste des petits ruminant,PPR)是由小反刍兽疫病毒(Peste des petits ruminant virus,PPRV)引起的家养或野生小反刍动物的一种急性、烈性传染病[1]。PPR主要临床症状包括发热、坏死性口炎、结膜炎、肺炎和腹泻脱水直至死亡;在没有接触过PPRV的地区,PPR的发病率可高达100%,严重暴发时死亡率可达100%[2]。PPR严重影响小反刍动物及其相关产品的国际贸易,对包括我国在内的发展中国家的养羊业造成了巨大的经济损失[3]。自2007年我国首次在西藏阿里地区暴发了PPR疫情并迅速得到有效控制之后,2013年底到2014年,PPR再次在我国呈现暴发流行,给养羊业造成了巨大经济损失。2015年以来,虽然我国PPR疫情逐渐减少,但小反刍兽疫疫情并没有消失。2017年,我国仍有3个省报道了小反刍兽疫疫情,发病羊546只,死亡257只,扑杀910只。这些迹象表明,虽然小反刍兽疫疫情在我国得到有效控制,但其防控形式依然严峻。
PPRV是有囊膜的负链RNA病毒,其约16 kb的基因组从3′→5′依次分布着-n-p/c/v-m-f-h-l 6个基因,分别编码6个结构蛋白(N、P、M、F、H、L)和2个非结构蛋白(C、V蛋白)[4]。PPRV H蛋白构成病毒粒子表面的纤突,是病毒刺激机体产生中和抗体的主要抗原成分,也是引起宿主细胞发生病变的主要蛋白质[4]。因此,PPRV H蛋白在其致病和刺激宿主免疫中发挥重要作用,也是小反刍兽疫鉴别诊断的可靠标记[5]。本研究用E. coli表达了密码子优化的PPRV H蛋白,并制备了其多克隆抗体,为进一步研究H蛋白的功能,建立相应免疫学检测方法及PPRV H蛋白的线性B细胞表位作图奠定了基础。
1 材料与方法 1.1 材料 1.1.1 菌株和质粒大肠杆菌(Escherichia coli,E. coli) TOP 10和BL21(DE3)购自天根生化科技(北京)有限公司;克隆载体pMD18-T购自上海皓嘉科技发展有限公司;克隆载体pJET1.2/blunt购自赛默飞世尔科技(中国)有限公司;原核表达载体pET-28a (-30a,-32a)为本实验室保存。
1.1.2 主要试剂和仪器及培养基限制性内切酶、DNA聚合酶、DNA连接酶,上海皓嘉科技发展有限公司;弗式完全佐剂、弗氏不完全佐剂,上海前尘生物科技有限公司;质粒提取试剂盒,DNA胶回收试剂盒,Axygen生物技术(杭州)有限公司;常用生化试剂,生物工程(上海)股份有限公司。
恒温培养箱、恒温培养摇床,上海一恒科学仪器有限公司;超声波细胞破碎仪,宁波新芝生物科技有限公司;高速冷冻离心机,希格玛实验室离心机公司;PCR扩增仪、凝胶成像系统,伯乐公司。
E. coli的培养采用LB培养基。
1.2 方法 1.2.1 PPRV h基因的全化学合成将GenBank中PPRV西藏株H蛋白质的序列(AEH25644)提交DNAWorks网站(http://helixweb.nih.gov/dnaworks)进行密码子偏爱性优化,选择E. coli为表达宿主,设定PCR退火温度为55 ℃,并在基因的两端分别添加BamH Ⅰ和Hind Ⅲ酶切位点。将系统输出的64条DNA序列送生工生物工程(上海)股份有限公司合成。通过两步PCR的方法合成。h基因全长,将其克隆至pJET1.2/blunt克隆载体得到pJET-H。
1.2.2 PPRV H蛋白原核表达载体的构建以BamH Ⅰ和Hind Ⅲ将测序验证正确的PPRV h基因片段从pJET-H切下,将其插入至pET-32a得到pET-32a-H。
为了构建pET-28a-H和pET-30a-H,重新设计引物扩增PPRV h基因,并在上下游引物的5′端分别添加Nde Ⅰ和Xho Ⅰ识别位点(FF: 5′-CATATGATGAGCGCGCAACGGGAACGTATAAACGCCT-3′;FR: 5′-CTCGAGCACCGGGTTAC AGGTCACTTCAATGC-3′),以pJET-H为模板PCR扩增h基因。PCR反应体系:10×ExTaq buffer 5 μL,dNTP mixture 4 μL,DNA模板1 μL,引物FF和FR各1 μL,ExTaq酶1 μL,ddH2O补足50 μL;PCR反应条件:98 ℃ 2 min;98 ℃ 15 s,55 ℃ 30s,72 ℃ 2 min,30个循环;72 ℃ 5 min。将PCR产物克隆至pMD18-T。以Nde Ⅰ和Xho Ⅰ将h基因片段从pMD18-H切下,克隆至pET-28a和pET-30a得到pET-28a-H和pET-30a-H。
1.2.3 PPRV H蛋白的原核表达将pET-28a-H、pET-30a-H和pET-30a-H分别转化至E. coli BL21,挑取单克隆,转接至LB培养基(含氨苄100 μg/mL或卡纳霉素50 μg/mL)中,37 ℃、220 r/min培养过夜。次日,以1:100接种量各转接9支LB试管,37 ℃、220 r/min培养至OD550约为0.5,分别向8支试管中加入IPTG至终浓度0.5 mmol/L,37 ℃诱导PPRV H蛋白的表达,分别于诱导的0、3、4、5、6、7、8、9 h取出一管;另一支试管作为未诱导对照培养9 h。各取2 mL菌液4 ℃、12 000 r/min离心1 min收集菌体,以备SDS-PAGE分析。
1.2.4 PPRV H蛋白的纯化和Western blot检测将E. coli BL21(pET-30a-H) 37 ℃诱导培养7 h,4 ℃、12 000 r/min离心1 min收集菌体。以PBS (10 mL/g菌体)重悬,冰上超声破碎20 min,4 ℃、12 000 r/min离心30 min收集包涵体。包涵体以PBS悬浮后加入等体积的2×上样缓冲液,上样进行SDS-PAGE电泳,电泳结束后以0.25 mol/L的KCl染色10 min,使用手术刀片将目的蛋白条带切下,切成2 mm的碎片后装入透析袋,60 V电泳洗脱120 min,反向电泳15 min,回收纯化的PPRV H蛋白。
进行Western blot检测时,SDS-PAGE结束后将蛋白以12 V恒压半干转移30 min至PVDF膜上,转印膜以10%的脱脂奶粉封闭5 h,加入一抗(抗His单抗或兔抗PPRV H血清,1:4 000) 4 ℃孵育过夜,以TBST洗涤3次,加入二抗(IgG-HRP,1:20 000)室温孵育1 h,以TBST洗涤4次,ELC显色。
1.2.5 抗PPRV H蛋白血清的制备将纯化的PPRV H蛋白与等体积的弗氏完全佐剂混合,以0.5 mg /只的剂量经颈背部多点注射免疫3只新西兰大白兔,同时以PBS免疫1只大白兔作为对照。此后,每隔14 d加强免疫1次,共免疫4次。分别于第一次免疫后的第7、21、35、42、49、63天耳部静脉取血,间接ELISA检测抗体水平,第63天颈动脉采血并收集血清。
1.2.6 ELISA法检测血清的效价(1) 免疫后兔血清抗体水平检测。以纯化的PPRV H蛋白(1 μg/mL)包被酶标板,4 ℃过夜。以PBST洗板3次,加入5%的脱脂奶粉37 ℃封闭1 h;PBST洗涤3次。加入1:400倍稀释后的血清(不同时间点采集的兔血清),37 ℃孵育1 h,PBST洗涤3次;加入1:500倍稀释的辣根过氧化酶标记的山羊抗兔IgG,37 ℃孵育45 min,PBST洗涤3次;加入TMB底物显色液,暗处显色15 min,加入1 mol/L的硫酸终止液,酶标仪读取OD450值。
(2) 抗体滴度检测。除了一抗采用倍比稀释的免疫后63 d采集兔血清外,其它操作同上。
2 结果与分析 2.1 PPRV h基因的密码子优化、全化学合成及原核表达载体的构建对PPRV h基因的密码子偏爱性分析表明,h基因中存在约10%大肠杆菌稀有密码子。因此,首先对其进行密码子同义优化,优化前后PPRV h基因的核苷酸序列一致性为72.6%,氨基酸序列的一致性为100% (图 1)。然后,采用两步PCR方法全化学合成了密码子优化后全长h基因,并将其分别插入到pET-28a、pET-30a和pET-32a的多克隆位点,得到PPRV h基因的重组表达质粒。

|
| 图 1 PPRV h基因密码优化前后的序列比对 Figure 1 Sequence alignment of the wild type PPRV h gene with its codon optimized counterpart 注:差异核苷酸位点以灰色阴影标出;优化后h基因中相同的位点以“.”代替;每个氨基酸的单字母缩写位于其密码子下方. Note: Differential nucleotides were shaded with grey; The identical nucleotide in the sequence of the optimized h gene was substituted with a "."; Below the triplet code of each amino acid marked its corresponding name with one letter abbreviation. |
|
|
SDS-PAGE分析显示,携带pET-28a-H、pET-30a-H和pET-32a-H的重组E. coli BL21诱导后分别出现了70、68、86 kD的目标蛋白条带,表明3株重组E. coli都可以有效表达PPRV H蛋白(图 2A-C)。而且,在诱导的1-7 h内,随着诱导时间的增加,PPRV H蛋白表达量增加。诱导时间继续增加,目标蛋白表达量基本维持不变(图 2A-C)。
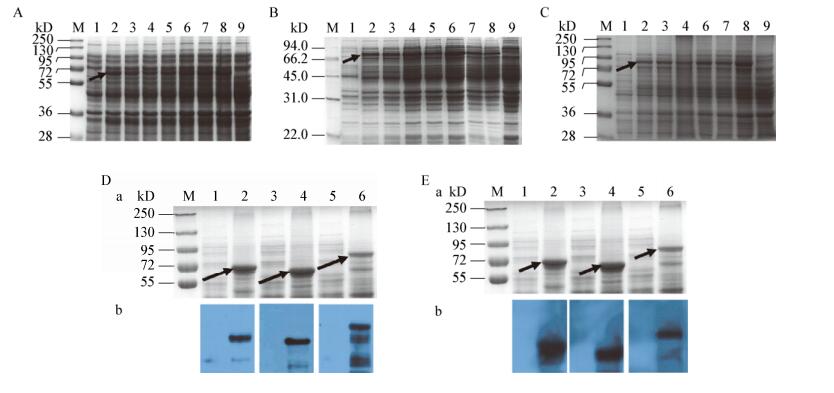
|
| 图 2 不同诱导时间对PPRV H蛋白表达的影响(A、B、C)和Western blot验证(D、E) Figure 2 The expression time courses of PPRV H protein (A, B, C) and confirmation with Western blot (D, E) 注:A、B、C:转化pET-28a-H、pET-30a-H、pET-32a-H的重组E. coli;1:重组E. coli诱导前;2-8:诱导3-9 h的菌体;9:未诱导的菌体对照. D、E:利用抗His标签抗体、PPRV阳性血清Western blot分析表达的重组PPRV H蛋白(a: SDS-PAGE分析;b: Western blot结果);1、3、5:诱导后E. coli (pET-28a-H)、E. coli (pET-30a-H)、E. coli (pET-32a-H)超声破碎离心上清;2、4、6:诱导后E. coli (pET-28a-H)、E. coli (pET-30a-H)、E. coli (pET-32a-H)超声破碎离心沉淀.箭头指向PPRV H蛋白的位置;M:蛋白质分子量标准. Note: A, B, C: Recombinant E. coli transformed with pET-28a-H, pET-30a-H, pET-32a-H, respectively; 1: Precipitate of cultured recombinant E. coli before induction; 2-8: Precipitate of recombinant E. coli induced 3-9 h, respectively; 9: Precipitate of un-induced recombinant E. coli. D, E: Western blot analysis of recombinant PPRV H protein using anti-his monoclonal antibody and goat anti-PPRV serum as primary antibody (a: SDS-PAGE analysis; b: Western blot analysis); 1, 3, 5: Centrifugal supernatant of recombinant E. coli (pET-28a-H), E. coli (pET-30a-H), E. coli (pET-32a-H), respectively, broken by ultrasonication; 2, 4, 6: Precipitate of recombinant E. coli (pET-28a-H), E. coli (pET-30a-H), E. coli (pET-32a-H), respectively, broken by ultrasonication; Arrow points to the position of PPRV H protein; M: Protein marker. |
|
|
为了分析PPRV H蛋白是可溶性表达还是形成包涵体,我们将诱导后的菌体超声波破碎后离心,分别收集上清和沉淀进行SDS-PAGE分析。如图 2D(a)、2E(a)所示,表达的PPRV H蛋白在大肠杆菌细胞内形成不可溶性包涵体,破碎上清中几乎无目标蛋白出现。以抗重组H蛋白带有His标签的单克隆抗体和PPRV免疫羊血清通过Western blot分析表达的重组PPRV H蛋白,结果表明携带3种重组质粒的重组E. coli BL21表达的H蛋白都可以与抗His标签单抗和羊抗PPRV阳性血清反应[图 2D(b)、2E(b)],这也说明表达的重组H蛋白可以被羊阳性血清识别(图 2E)。
虽然携带3个重组载体的重组E. coli的H蛋白表达量没有明显差异,但包涵体提取结果显示,由重组E. coli (pET-28a-H)和E. coli (pET-30a-H)制备的H蛋白纯度高于由重组E. coli (pET-32a-H)得到的蛋白[图 2D(a)、2E(a)];因此选择携带pET-30a-H的重组E. coli BL21诱导7 h的菌体纯化制备PPRV H重组蛋白,并免疫新西兰大白兔制备抗PPRV H蛋白多抗血清。
2.3 PPRV H包涵体蛋白的割胶纯化和Western blot检测为了得到高纯度的重组PPRV H蛋白,采用SDS-PAGE割胶纯化、电泳洗脱的方法收集包涵体蛋白,SDS-PAGE和以抗His标签单抗为一抗的Western blot分析显示得到了条带单一的重组PPRV H蛋白(图 3)。
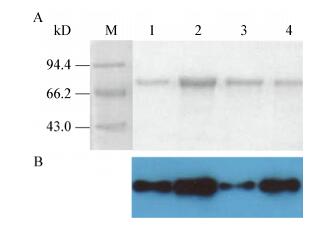
|
| 图 3 SDS-PAGE (A)和Western blot (B)分析纯化的重组PPRV H蛋白 Figure 3 SDS-PAGE (A) and Western blot (B) analysis of purified PPRV H protein 注:M:蛋白质分子量标准;1-4:4次SDS-PAGE割胶纯化的PPRV H蛋白. Note: M: Protein marker; 1-4: Four times purified PPRV H protein by cutting out the aimed protein from SDS-PAGE gel. |
|
|
以纯化的PPRV H蛋白为包被抗原,间接ELISA检测免疫后不同时间点采集的兔血清效价,结果表明抗PPRV H蛋白抗体在首次免疫7 d后即产生并迅速增加,至35 d后缓慢增加(图 4)。第4次免疫后获得的多克隆抗体的滴度,1号兔子最高,达到1:25 600;2号兔子的抗体滴度为1:12 800;3号兔子抗体滴度稍低,为1:6 400,表明获得的多抗血清具有很好的敏感性(图 5)。
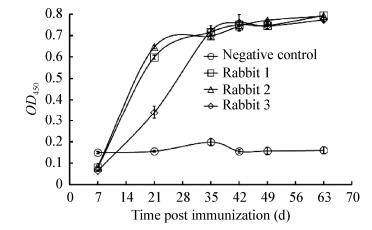
|
| 图 4 不同免疫时间的血清抗体水平 Figure 4 Time course of serum antibody level |
|
|

|
| 图 5 血清抗体滴度的检测 Figure 5 Determination of the titers of the anti-sera |
|
|
利用免疫获得的新西兰大白兔血清作为一抗,通过Western blot验证得到的抗血清与由重组E. coli (pET-28a-H)、E. coli (pET-30a-H)、E. coli (pET-32a-H)得到的PPRV H蛋白的特异性识别能力,结果表明获得兔抗血清均能与3株重组E. coli表达PPRV H蛋白的发生特异性反应(图 6),表明多克隆抗体均具有较好的特异性。

|
| 图 6 多克隆抗体的Western blot鉴定 Figure 6 Western blot confirmation of the reactivity of the anti-sera with PPRV H protein 注:A:SDS-PAGE分析;B:Western blot结果;M:蛋白质分子量标准;1、3、5:分别为诱导后E. coli (pET-28a-H)、E. coli (pET-30a-H)、E. coli (pET-32a-H)超声破碎离心上清;2、4、6:分别为诱导后E. coli (pET-28a-H)、E. coli (pET-30a-H)、E. coli (pET-32a-H)超声破碎离心沉淀. Note: A: SDS-PAGE analysis; B: Western blot result; M: Protein Marker; 1, 3, 5: Centrifugal supernatant of recombinant E. coli (pET-28a-H), E. coli (pET-30a-H), E. coli (pET-32a-H), respectively, broken by ultrasonication; 2, 4, 6: Precipitate of recombinant E. coli (pET-28a-H), E. coli (pET-30a-H), E. coli (pET-32a-H), respectively, broken by ultrasonication. |
|
|
H蛋白是PPRV的一个重要糖蛋白,构成病毒粒子表面的纤突,在PPRV感染过程中负责与宿主细胞的受体结合,能够诱导机体产生体液和细胞保护性免疫,因此PPRV H蛋白的研究具有重要的意义,受到了国内外研究者的广泛关注[6-9]。为深入研究H蛋白的抗原表位构成及相关特性,我们克隆并原核表达了密码子优化的西藏株PPRV的h基因,表达产物可以与抗His标签单克隆抗体和抗PPRV阳性羊血清反应,表明所表达的PPRV H蛋白具有良好的反应活性。以SDS-PAGE割胶纯化的PPRV H蛋白免疫新西兰大白兔得到了抗H蛋白多抗兔血清。
有报道称PPRV H蛋白全长表达量较低[10],我采用两种策略来提高PPRV H蛋白原核表达的成功率。首先,为了减少PPRV h基因中约10%的大肠杆菌稀有密码子对其原核表达的影响,对h基因的全部密码子进行了大肠杆菌偏爱性优化。其次,选用3个带有不同标签序列的pET (-28a、-30a和-32a)载体来表达PPRV H蛋白,且全部将h基因插入到载体多克隆位点而保留所有的标签序列。我们选用的3个表达载体都成功表达了PPRV H蛋白,表明h基因密码子的优化和与标签序列融合表达成功克服了其他研究者报道的PPRV H蛋白全长序列原核表达时表达量低或不能表达的问题[10]。我们近期开展猪流行腹泻病毒S蛋白的原核表达研究也表明,载体中带有的标签序列对病毒结构蛋白的原核表达成功至关重要。
免疫所用重组蛋白纯度是影响多克隆抗体质量的重要因素之一。虽然不能与真核系统一样可使所表达蛋白糖基化,原核表达系统具有其独特的优势,如表达量相对较高,通过提取包涵体重组蛋白并SDS-PAGE割胶回收可以得到高纯度的目的蛋白等。本研究中,我们提取包涵体直接进行SDS-PAGE,以氯化钾染色确定目标条带位置后切胶回收H蛋白,具有操作简单方便的优势。获得抗PPRV H多抗血清的Western blot结果显示,得到了高特异性的多抗血清。作者后续开展的线性B细胞表位作图的研究结果也表明,利用此策略获得多抗血清可以满足表位筛选和最小表位基序鉴定实验的需要[8, 11]。
本研究利用大肠杆菌表达了PPRV H蛋白并免疫新西兰大白兔制备了抗H蛋白多抗血清,得到的抗PPRV H多抗可以特异性识别H蛋白。PPRV H蛋白的表达和多克隆抗体的制备为建立针对PPRV H蛋白的ELISA抗体检测方法及研制新型亚单位疫苗奠定了基础。同时,这也将为本课题组正在开展的PPRV主要结构蛋白线性B细胞表位作图提供了血清抗体。
| [1] |
Baazizi R, Mahapatra M, Clarke BD, et al. Peste des petits ruminants (PPR): a neglected tropical disease in Maghreb region of North Africa and its threat to Europe[J]. PLoS One, 2017, 12(4): e0175461. DOI:10.1371/journal.pone.0175461 |
| [2] |
Adombi CM, Waqas A, Dundon WG, et al. Peste des petits ruminants in Benin: persistence of a single virus genotype in the country for over 42 years[J]. Transbound and Emerging Diseases, 2017, 64(4): 1037-1044. DOI:10.1111/tbed.2017.64.issue-4 |
| [3] |
Baron MD, Diop B, Njeumi F, et al. Future research to underpin successful peste des petits ruminants virus (PPRV) eradication[J]. Journal of General Virology, 2017, 98(11): 2635-2644. DOI:10.1099/jgv.0.000944 |
| [4] |
Ye XF, Ci C. Peste des petitis ruminants and its comprehensive prevention and control measures[J]. Zhong Guo Xu Mu Shou Yi Wen Zhai, 2015, 31(2): 89. (in Chinese) 叶雪芬, 次成. 小反刍动物兽疫及其综合防控措施[J]. 中国畜牧兽医文摘, 2015, 31(2): 89. |
| [5] |
Baron MD. The molecular biology of peste des petits ruminants virus[A]//Munir M. Peste des Petits Ruminants Virus[M]. Berlin, Heidelberg: Springer, 2015: 11-38
|
| [6] |
Tao H, Sun J, Li JB, et al. Prokaryotic expression and immunoreactivity identification of peste des petits ruminants virus haemagglutinin protein[J]. Progress in Veterinary Medicine, 2014(11): 6-9. (in Chinese) 陶虹, 孙洁, 李健波, 等. 小反刍兽疫病毒H蛋白的原核表达和免疫学活性鉴定[J]. 动物医学进展, 2014(11): 6-9. DOI:10.3969/j.issn.1007-5038.2014.11.002 |
| [7] |
Gao HF, Xin AG, Gao L, et al. Expression of H gene of peste des petits ruminants virus in Baculovirus[J]. Chinese Journal of Animal Infectious Diseases, 2012, 20(1): 43-46. (in Chinese) 高华峰, 信爱国, 高林, 等. 小反刍兽疫病毒H基因在杆状病毒中的表达[J]. 中国动物传染病学报, 2012, 20(1): 43-46. DOI:10.3969/j.issn.1674-6422.2012.01.008 |
| [8] |
Yu RS, Zhu R, Gao WX, et al. Fine mapping and conservation analysis of linear B-cell epitopes of peste des petits ruminants virus hemagglutinin protein[J]. Veterinary Microbiology, 2017, 208: 110-117. DOI:10.1016/j.vetmic.2017.07.008 |
| [9] |
Herbert R, Baron J, Batten C, et al. Recombinant adenovirus expressing the haemagglutinin of Peste des petits ruminants virus (PPRV) protects goats against challenge with pathogenic virus; a DIVA vaccine for PPR[J]. Veterinary Research, 2014, 45(1): 24. DOI:10.1186/1297-9716-45-24 |
| [10] |
Tian XL, Zhao YG, Song HH, et al. Prokaryotic expression of PPRV H protein antigen epitopes[J]. Chinese Journal of Animal Health Inspection, 2009, 26(3): 28-30. (in Chinese) 田晓灵, 赵永刚, 宋厚辉, 等. 小反刍兽疫H蛋白主要抗原表位的原核表达[J]. 中国动物检疫, 2009, 26(3): 28-30. DOI:10.3969/j.issn.1005-944X.2009.03.015 |
| [11] |
Yu RS, Fan XM, Xu WX, et al. Fine mapping and conservation analysis of linear B-cell epitopes of peste des petits ruminants virus nucleoprotein[J]. Veterinary Microbiology, 2015, 175(1): 132-138. DOI:10.1016/j.vetmic.2014.10.012 |
 2018, Vol. 45
2018, Vol. 45




