扩展功能
文章信息
- 栗飞红, 陈向东, 汪辉, 纪乃琪, 王雪萌, 鲍张杰, 任聪
- LI Fei-Hong, CHEN Xiang-Dong, WANG Hui, JI Nai-Qi, WANG Xue-Meng, BAO Zhang-Jie, REN Cong
- 利用Pseudonocardia sp.微生物转化制备骨化醇类化合物
- Preparation of calcified alcohols analogues by bioconversion using Pseudonocardia sp.
- 微生物学通报, 2018, 45(10): 2164-2173
- Microbiology China, 2018, 45(10): 2164-2173
- DOI: 10.13344/j.microbiol.china.170986
-
文章历史
- 收稿日期: 2017-11-22
- 接受日期: 2018-01-03
- 网络首发日期(www.cnki.net): 2018-04-04
2. 南京海融医药科技股份有限公司 江苏 南京 210009
2. Nanjing Heron Pharmaceutical Science and Technology Co. Ltd., Nanjing, Jiangsu 210009, China
骨化醇类化合物是活性维生素D及其类似物的统称,包括骨化三醇[1]、艾地骨化醇、马沙骨化醇[2]、度骨化醇[3]、帕立骨化醇[4]等,在治疗骨质疏松、甲状腺功能亢进、肾功能不全引起的并发症等疾病中疗效显著[5-7]。目前,国内外骨化醇系列化合物的生产方式主要是有机化学全合成的方法,合成步骤非常复杂且试剂昂贵,收率较低,产物特异性差,造成骨化醇类原料药价格昂贵且被少数制药公司垄断[8-9]。生物转化法为骨化醇类化合物的制备开辟了一条新的道路,与化学合成法相比,微生物转化法工艺简单、反应条件温和、成本低[10]。国内外研究者筛选到包括灰色链霉菌(Streptomyces griseolus)、反硝化红环菌(Sterolibacterium denitrificans)、自养假诺卡氏菌(Pseudonocardia autotrophica)等多种可以应用于骨化醇类化合物合成过程的微生物菌株[11-14],而自养加诺卡氏菌在众多转化菌株中对底物的转化率相对较稳定[15]。但是目前自养加诺卡氏菌在制备骨化醇类化合物的应用中仍然有很多需要解决的问题,这也限制了其在工业化中的应用,如:转化率不高、底物浓度低等。
本实验室前期工作从泥土样品中筛选到一株放线菌,经鉴定为假诺卡氏菌,本研究利用这株假诺卡氏菌作为转化菌株,从常见的化学合成骨化醇类化合物的甾体和非甾体类原料及中间体中筛选出能够被有效转化为骨化醇类化合物的底物分子,并通过转化条件的优化提高转化率。
1 材料与方法 1.1 材料 1.1.1 菌种假诺卡氏菌由中国药科大学微生物学教研室保藏。
1.1.2 培养基种子培养基(g/L):葡萄糖20.0,酵母提取物2.0,L-天冬酰胺1.0,K2HPO4 0.5。初级转化培养基(g/L):葡萄糖20.0,酵母提取物2.0,黄豆粉1.5,K2HPO4 0.4,NaCl 0.4,CaCO3 2.0。
1.1.3 主要试剂和仪器甾体和非甾体类原料及中间体(表 1),南京海融医药科技股份有限公司;高效液相色谱仪,日本岛津公司;500 MHz核磁共振仪,Bruker公司。
| 甾体类化合物 Steroids |
非甾体类化合物 Non-steroidal |
| Cholesterol | Vitamin D2 |
| 7-Dehydrocholesterol | Vitamin D3 |
| Eldecalcitol intermediate (AD-M04) |
Paricalcitol intermediate (PC-M07) |
| Eldecalcitol intermediate (AD-M07) |
1α-(OH)VD3 |
菌种经斜面活化后制备菌悬液,取2 mL接种于50 mL种子培养基中,28 ℃、200 r/min摇瓶培养,每24 h取样测菌体干重(g/L),绘制假诺卡氏菌生长曲线,选取对数生长期作为种子液。
1.3 底物筛选及产物分离与鉴定 1.3.1 底物的筛选从8种化学合成骨化醇类化合物常用甾体和非甾体类原料及中间体中筛选出能被假诺卡氏菌转化获得骨化醇类化合物的底物。转化过程如下:取2 mL种子液接种于50 mL初级转化培养基中,28 ℃、200 r/min培养72 h后菌浓度达到108 CFU/mL,加入底物终浓度为0.3 mg/mL乙醇溶液,28 ℃、200 r/min转化72 h后取发酵液与甲醇按1:1的体积比混合均匀,4 ℃、10 000 r/min离心10 min,取上清进行HPLC检测。
1.3.2 产物分离纯化与结构鉴定方法发酵液与乙酸乙酯按1:1 (体积比)混合,4 ℃、10 000 r/min离心5 min后取上层有机相,用饱和食盐水洗涤,无水硫酸钠干燥,旋转蒸发浓缩后进行硅胶柱层析(石油醚:乙酸乙酯=2:1,体积比)分离,洗脱液经薄层色谱法初步检测后旋转蒸发浓缩致干得到白色粉末,用甲醇溶解后进行HPLC检测和制备纯化,利用核磁和质谱进行结构确认。
1.4 助溶剂对转化率的影响 1.4.1 不同助溶剂对转化率的影响制备骨化醇类化合物的底物均属于脂溶性化合物,在培养基中的溶解性差,且底物分子需要进入细胞内才能被胞内酶转化[16],而助溶剂可以提高底物在转化体系中的溶解性。使用初级转化培养基,添加底物前向各摇瓶中分别加入1% (质量体积比)部分甲基化的β-环糊精(PMCD)、吐温-80、Triton X-100、乳酸链球菌素(Nisin,0.5 mg/mL),并设置空白对照组,28 ℃、200 r/min转化72 h,取样进行HPLC检测。
1.4.2 助溶剂浓度对转化率的影响设置助溶剂浓度梯度0-2% (体积比),与底物同时添加到转化体系中,28 ℃、200 r/min转化72 h,取样检测底物转化率。
1.5 转化培养基的优化 1.5.1 不同氮源对转化率的影响在初级转化培养基的基础上,分别添加20.0 g/L的蛋白胨、黄豆粉、鱼粉、NH4Cl、NH4NO3、KNO3、NH4H2PO4、玉米浆作为转化培养基氮源,28 ℃转化72 h,取样检测底物转化率。
1.5.2 不同碳源对转化率的影响在初级转化培养基的基础上,分别添加15.0 g/L的葡萄糖、蔗糖、乳糖、麦芽糖、甘油、可溶性淀粉作为转化培养基碳源,28 ℃转化72 h,取样检测底物转化率。
1.6 单因素试验优化转化条件在初始转化条件[接种量5% (体积比),接种后72 h加底物,底物浓度0.3 mg/mL,转化温度28 ℃,pH自然,200 r/min,转化72 h]的基础上,通过单因素试验分别考察接种量(4%-10%)、转化温度(20-35 ℃)、初始pH 4.0-9.0、底物浓度(0.3-2.0 mg/mL)、底物添加时间点(0-48 h)对转化率的影响。利用单因素实验优化后的底物浓度、接种量、转化温度、初始pH、底物添加时间点以及筛选到的助溶剂等条件进行底物转化,每24 h取样检测,确定各底物最佳转化时间。
1.7 正交试验在优化转化培养基成分及转化条件的单因素试验基础上,选择适当的单因素:PMCD浓度、底物浓度、转化时间、初始pH进行正交试验,确定各底物的最佳转化条件。
1.8 数据分析采用统计学软件GraphPad Prism 5.0和SPSS 19.0处理实验数据,P < 0.05有显著性差异。
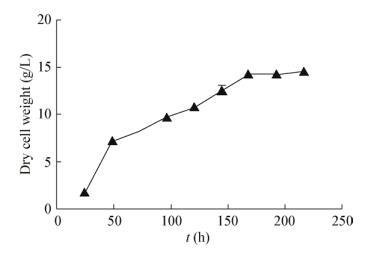
2 结果与分析2.1假诺卡氏菌种子液的制备生长曲线如图 1所示,菌株在0–48 h处于生长迟滞期,50 h后进入对数生长期,7 d后进入平稳生长期,培养9 d未见明显衰亡,选取相对较稳定的对数生长期72 h的菌株作为种子。
|
| 图 1 假诺卡氏菌生长曲线 Figure 1 The growth curves of strain Pseudonocardia sp. |
|
|
经过高效液相色谱及核磁和质谱鉴定,确定阿法骨化醇[Alfacalcidol,1α-(OH)VD3]、艾地骨化醇中间体(Eldecalcitol intermediate 07,AD-M07)、帕立骨化醇中间体(Paricalcitol intermediate 07,PC-M07)可分别被转化为骨化三醇[Calcitriol,1α, 25-(OH)2VD3]、艾地骨化醇中间体(Eldecalcitol intermediate 08,AD-M08)和帕立骨化醇(Paricalcitol,PC) 3种重要的骨化醇类化合物及中间体。经高效液相色谱条件的摸索,确定3种产物均用梯度洗脱法检测,AD-M08和1α, 25-(OH)2VD3使用YMC-Pack ODS-AQ柱,150 mm×4 mm,柱温30 ℃,流速分别为1.7、1.2 mL/min;PC使用Xtimate C18柱,250 mm×4.6 mm,柱温40 ℃,流速2 mL/min,流动相A泵为水,B泵为乙腈,HPLC梯度洗脱时间与B泵乙腈浓度(体积比)见表 2。各产物的高效液相色谱图如图 2所示,在此检测条件下AD-M08的保留时间为4.69 min,PC的保留时间为39.08 min,1α, 25-(OH)2VD3的保留时间为10.05 min。
| AD-M08 | 1α, 25(OH)2VD3 | PC | |||||
| 时间 Time (h) |
B泵 B Pump (%) |
时间 Time (h) |
B泵 B Pump (%) |
时间 Time (h) |
B泵 B Pump (%) |
||
| 0 | 75 | 0 | 60 | 0 | 60 | ||
| 15 | 77 | 10 | 60 | 10 | 60 | ||
| 20 | 90 | 15 | 100 | 30 | 53 | ||
| 30 | 90 | 25 | 100 | 40 | 53 | ||
| 32 | 75 | 26 | 60 | 45 | 100 | ||
| 40 | 75 | 35 | 60 | 50 | 100 | ||
| - | - | - | - | 60 | 0 | ||
| Note: -: The end. | |||||||

|
| 图 2 转化产物的高效液相色谱检测图谱 Figure 2 High-performance liquid chromatogram of products Note: A: AD-M08; B: 1α, 25-(OH)2VD3; C: PC. |
|
|
不同助溶剂对转化率的影响差异显著(P < 0.05),如图 3所示,Nisin和Triton X-100对转化率没有显著的促进作用,与对照组相比反而有一些抑制作用,原因可能是Nisin和Triton X-100破坏了菌体的细胞结构,进而影响了胞内酶的活性;Tween-80和PMCD对转化起到了促进作用,PMCD相对于Tween-80更有助于转化,且Tween-80的沸点较高,在后续产物分离纯化过程中去除困难,所以选PMCD作为助溶剂。

|
| 图 3 不同助溶剂对转化率的影响 Figure 3 Effect of different complex solubilizer on the conversion rate |
|
|
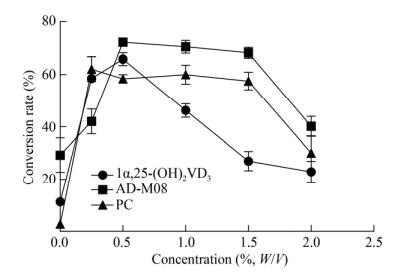
不同浓度PMCD (质量体积比)对转化率的影响有显著的差异(P < 0.05)(图 4),1α, 25-(OH)2VD3的产率在PMCD 0.25%–0.5%之间最高,而当PMCD浓度大于0.5%时1α, 25-(OH)2VD3的产率明显下降,帕立骨化醇和艾地骨化醇的产率在PMCD 0.5%–1.5%之间最高,大于1.5%后产率明显下降。
|
| 图 4 不同PMCD浓度对底物转化率的影响 Figure 4 Effect of different concentration of PMCD on the conversion rate |
|
|
含不同氮源的转化培养基对转化率的影响有显著差异(P < 0.05),且转化率均高于空白对照组,如图 5所示,无机氮源对于底物的转化率比有机氮源低,有机氮源中蛋白胨、黄豆粉、鱼粉蛋白胨的转化率较高,但是黄豆粉本身为不溶性,不利于产物的后处理,而鱼粉蛋白胨自身营养过于丰富,在转化过程中易产生气泡,在利用发酵罐放大生产中不利于转化反应的进行,所以综合考虑最终选择蛋白胨作为转化培养基的氮源。

|
| 图 5 不同氮源对转化率的影响 Figure 5 Effect of different nitrogen sources on the conversion rate |
|
|
含不同碳源的转化培养基对转化率的影响有显著差异(P < 0.05),且均高于空白对照组,从图 6可以看出3种底物的最佳碳源都是葡萄糖,其次是甘油,同为速效碳源的蔗糖对PC和1α, 25-(OH)2VD3的转化促进作用不显著,对AD-M08的转化有一定促进作用,乳糖和可溶性淀粉作为迟效碳源对PC和1α, 25-(OH)2VD3的转化促进作用不明显,对AD-M08的转化具有一定促进作用,综合考虑经济及转化率等因素选择葡萄糖作为转化培养基的碳源。

|
| 图 6 碳源对转化率的影响 Figure 6 Effect of the carbon sources on the conversion rate |
|
|
不同底物浓度对转化率的影响有显著差异(P < 0.05),如图 7A所示,PC和1α, 25-(OH)2VD3的得率在底物浓度为0.6-1.2 mg/mL时较高,高于1.2 mg/mL时转化率逐渐下降,所以选择1.2 mg/mL作为最佳转化浓度,而AD-M08的得率在底物浓度超过0.6 mg/mL即出现明显下降趋势,所以AD-M08的最佳浓度为0.6 mg/mL。不同温度下底物的转化率有显著差异(P < 0.05),如图 7B所示,3种底物的最适转化温度均在25–30 ℃之间。接种量对转化率的影响见图 7C,在5%–10%之间转化率相对稳定,选择接种量6%作为本实验的接种量。转化培养基初始pH对转化率的影响有显著差异(P < 0.05),如图 7D所示,1α, 25-(OH)2VD3、PC、AD-M08的最佳初始pH分别为8.0、6.0、8.0。底物添加时间点对转化率的影响见图 7E,底物添加时间对转化率的影响不显著(P > 0.05),综合考虑选择在接种后24 h添加底物。不同转化时间3种底物的转化率均有显著差异(P < 0.05),如图 7F所示,PC在转化96 h后产率达到最高值,而AD-M08和1α, 25-(OH)2VD3在转化72 h即达到最大转化率,所以确定1α-(OH)VD3和AD-M07的转化时间为72 h,PC-M07的最佳转化时间为96 h。

|
| 图 7 转化条件对转化率的影响 Figure 7 Effect of conversion conditions on conversion rate |
|
|
在单因素试验结果基础上进行正交设计,采用L9(34)进行四因素三水平的正交试验,因素水平表见表 3,结果分析见表 4。
| 因素 Factor |
A底物浓度 Substrate (mg/mL) |
B PMCD浓度 PMCD (%, W/V) |
C pH |
D转化时间 Time (h) |
| 1 | 0.6 | 0.2 | 4.0 | 48 |
| 2 | 0.8 | 0.5 | 6.0 | 72 |
| 3 | 1.2 | 1.0 | 8.0 | 96 |
| Test | A | B | C | D | Conversion rate (%) | |||
| 1α, 25-(OH)2VD3 | PC | AD-M08 | ||||||
| 1 | 3 | 2 | 3 | 1 | 76.65 | 43.56 | 49.09 | |
| 2 | 3 | 3 | 1 | 2 | 45.03 | 38.28 | 36.83 | |
| 3 | 2 | 1 | 3 | 2 | 55.09 | 43.46 | 78.45 | |
| 4 | 2 | 3 | 2 | 1 | 47.20 | 35.22 | 80.66 | |
| 5 | 2 | 2 | 1 | 3 | 62.09 | 46.25 | 52.03 | |
| 6 | 1 | 3 | 3 | 3 | 51.66 | 57.06 | 86.04 | |
| 7 | 1 | 1 | 1 | 1 | 43.06 | 36.06 | 50.44 | |
| 8 | 3 | 1 | 2 | 3 | 54.32 | 60.88 | 41.33 | |
| 9 | 1 | 2 | 2 | 2 | 78.06 | 62.09 | 89.03 | |
| 1α, 25-(OH)2VD3 | K1 | 57.59 | 50.82 | 50.06 | 55.63 | |||
| K2 | 54.79 | 72.27 | 59.86 | 59.39 | ||||
| K3 | 58.67 | 47.96 | 61.13 | 56.02 | ||||
| R | 3.88 | 24.31 | 11.07 | 3.76 | ||||
| PC | K1 | 51.74 | 46.80 | 40.19 | 38.28 | |||
| K2 | 41.64 | 50.63 | 52.73 | 47.94 | ||||
| K3 | 47.57 | 43.52 | 48.03 | 54.73 | ||||
| R | 10.10 | 7.11 | 12.54 | 16.45 | ||||
| AD-M08 | K1 | 75.17 | 56.74 | 46.43 | 60.06 | |||
| K2 | 70.38 | 63.38 | 70.34 | 68.10 | ||||
| K3 | 42.27 | 67.70 | 71.19 | 59.80 | ||||
| R | 32.90 | 10.96 | 24.76 | 8.30 | ||||
由表 4极差分析可知,所选的4种转化影响因素对1α, 25-(OH)2VD3转化率的影响大小为:PMCD浓度 > pH > 底物浓度 > 转化时间,比较各因素的不同水平,得到最佳组合为A3B2C3D2,即底物浓度为1.2 mg/mL,PMCD浓度为0.5% (质量体积比),pH值为8.0,转化时间为72 h;对PC转化率的影响大小为:转化时间 > pH > 底物浓度 > PMCD浓度,最佳组合为A1B2C2D3,即底物浓度0.6 mg/mL,PMCD浓度0.5% (质量体积比),pH值为6.0,转化时间为96 h;对AD转化率的影响大小为:底物浓度 > pH > PMCD浓度 > 转化时间,比较各因素不同水平,得到最佳组合为A1B3C3D2,即底物浓度为0.6 mg/mL,PMCD浓度为1% (质量体积比),pH值为8.0,转化时间为72 h。在以上条件下进行验证实验,取样检测各底物转化率,结果如图 8所示,1α, 25-(OH)2VD3、AD、PC的最高转化率分别可以达到85%、96%、75%。

|
| 图 8 最优条件下的转化结果 Figure 8 Bioconversion results in optimal conditions |
|
|
骨化醇类化合物原料药在药用领域应用十分广泛,除了传统的钙磷调节外,还包括抑制肿瘤细胞增殖、免疫调节、心血管疾病治疗以及抑制甲状旁腺激素分泌[17-18]等,20世纪80年代发现骨化三醇有诱导白血病细胞分化成单核巨噬细胞的能力。艾地骨化醇是目前治疗骨质疏松的一线药物,在骨钙动员和肠钙吸收方面的效果优于骨化三醇。帕立骨化醇在治疗慢性肾病引起的并发症中疗效显著且副作用小[19]。微生物转化法制备骨化醇类化合物始于20世纪90年代,最先由日本、美国、瑞典投入研究,但截至目前仅停留在第一代骨化醇类化合物的应用中,而且制备工艺处于保密阶段,所以研究骨化醇类化合物原料药的制备工艺对我国医药事业的发展具有重要意义。
本研究利用微生物转化法从有机合成骨化醇类化合物的原料及中间体中成功筛选出3种底物分子,首次发现1α-(OH)VD3、AD-M07、PC-M07可同时被假诺卡氏菌生物转化,分别获得1α, 25-(OH)2VD3、AD-M08、PC三种重要骨化醇类化合物及中间体,说明假诺卡氏菌具有广谱的底物羟基化作用,可以尝试更多骨化醇类相关底物或其他脂溶性化合物的微生物转化。
AD-M08是在AD-M07的25位碳原子上添加羟基,这一中间体利用化学方法很难实现,而且特异性差,容易出现异构体,利用假诺卡氏菌微生物转化法一步即可获得单一结构的AD-M08中间体,最优条件下转化率可以达到96%,为艾地骨化醇的制备提供了一条新的途径。1α, 25-(OH)2VD3是第一代骨化醇类化合物,在最优条件下的转化率为85%,达到了日本Yasutake等[20]的最高转化率,而且底物浓度提高了3倍,将极大地提高我国工业化生产1α, 25-(OH)2VD3的效率。最优条件下PC的转化率达到了75%,转化率较目前最新报道高20%,且底物浓度由0.5 mg/mL提高到了1.2 mg/mL[21]。但是目前的优化工艺仍然有不足之处,由于菌株生长缓慢,整个生产周期需要一周时间,这对于利用发酵罐进行工业化大生产非常不利。后期实验正在积极进行菌种改造,利用DNA重组技术将假诺卡氏菌胞内发挥主要功能的酶在合适的宿主中表达,缩短转化周期,达到高效制备以上3种骨化醇类化合物的目的。
| [1] |
Deluca HF, Schnoes HK. Vitamin D: recent advances[J]. Annual Review of Biochemistry, 1983, 52: 411-439. DOI:10.1146/annurev.bi.52.070183.002211 |
| [2] |
Zhao GD. Synthesis of maxacalcitol, eldecalcitol and 1α, 25-dihydroxyvitamin D3 analogues[D]. Ji'nan: Doctoral Dissertation of Shandong University, 2017 (in Chinese) 赵国栋.活性维生素D3类药物马沙骨化醇和艾尔骨化醇及其衍生物的合成研究[D].济南: 山东大学博士学位论文, 2017 http://cdmd.cnki.com.cn/Article/CDMD-10422-1017081833.htm |
| [3] |
Sun B, Xu HG, Wen P, et al. Synthesis of doxercalciferol[J]. Chinese Journal of New Drugs, 2009, 18(13): 1243-1244. (in Chinese) 孙博, 徐红贵, 文鹏, 等. 度骨化醇的合成[J]. 中国新药杂志, 2009, 18(13): 1243-1244. DOI:10.3321/j.issn:1003-3734.2009.13.018 |
| [4] |
Slatopolsky E, Cozzolino M, Lu Y, et al. Efficacy of 19-nor-1, 25-(OH)2D2 in the prevention and treatment of hyperparathyroid bone disease in experimental uremia[J]. Kidney International, 2003, 63(6): 2020-2027. DOI:10.1046/j.1523-1755.2003.00029.x |
| [5] |
Tang BMP, Eslick GD, Nowson C, et al. Use of calcium or calcium in combination with vitamin D supplementation to prevent fractures and bone loss in people aged 50 years and older: a meta-analysis[J]. The Lancet, 2007, 370(9588): 657-666. DOI:10.1016/S0140-6736(07)61342-7 |
| [6] |
Griffin MD, Lutz WH, Phan VA, et al. Potent inhibition of dendritic cell differentiation and maturation by vitamin D analogs[J]. Biochemical and Biophysical Research Communications, 2000, 270(3): 701-708. DOI:10.1006/bbrc.2000.2490 |
| [7] |
Deeb KK, Trump DL, Johnson CS. Vitamin D signalling pathways in cancer: potential for anticancer therapeutics[J]. Nature Reviews Cancer, 2007, 7(9): 684-700. DOI:10.1038/nrc2196 |
| [8] |
Deluca HF, Schnoes HK, Perlman KL. Intermediates for the synthesis of 19-nor vitamin D compounds: U.S. Patent 5086191[P]. 1992-02-04
|
| [9] |
Bouillon R, Okamura WH, Norman AW. Structure-function relationships in the vitamin D endocrine system[J]. Endocrine Reviews, 1995, 16(2): 200-257. |
| [10] |
Zhang YQ, Wang DQ. Advances in microbial transformation of phytosterol into steroid medicine intermediates[J]. Microbiology China, 2006, 33(2): 142-146. (in Chinese) 张裕卿, 王东青. 植物甾醇微生物转化制备甾体药物中间体的研究进展[J]. 微生物学通报, 2006, 33(2): 142-146. DOI:10.3969/j.issn.0253-2654.2006.02.029 |
| [11] |
Sasaki J, Mikami A, Mizoue K, et al. Transformation of 25-and 1α-hydroxyvitamin D3 to 1α, 25-dihydroxyvitamin D3 by using Streptomyces sp. strains[J]. Applied and Environmental Microbiology, 1991, 57(10): 2841-2846. |
| [12] |
Sawada N, Sakaki T, Yoneda S, et al. Conversion of vitamin D3 to 1α, 25-dihydroxyvitamin D3 by Streptomyces griseolus cytochrome P450SU-1[J]. Biochemical and Biophysical Research Communications, 2004, 320(1): 156-164. DOI:10.1016/j.bbrc.2004.05.140 |
| [13] |
Li BJ, Li YX, Bai DM, et al. Whole-cell biotransformation systems for reduction of prochiral carbonyl compounds to chiral alcohol in Escherichia coli[J]. Scientific Reports, 2014, 4: 6750. |
| [14] |
Warnke M, Jung T, Dermer J, et al. 25-Hydroxyvitamin D3 synthesis by enzymatic steroid side-chain hydroxylation with water[J]. Angewandte Chemie, 2016, 128(5): 1913-1916. DOI:10.1002/ange.201510331 |
| [15] |
Takeda K, Asou T, Matsuda A, et al. Application of cyclodextrin to microbial transformation of vitamin D3 to 25-hydroxyvitamin D3 and 1α, 25-dihydroxyvitamin D3[J]. Journal of Fermentation and Bioengineering, 1994, 78(5): 380-382. |
| [16] |
Imoto N, Nishioka T, Tamura T. Permeabilization induced by lipid Ⅱ-targeting lantibiotic nisin and its effect on the bioconversion of vitamin D3 to 25-hydroxyvitamin D3 by Rhodococcus erythropolis[J]. Biochemical and Biophysical Research Communications, 2011, 405(3): 393-398. DOI:10.1016/j.bbrc.2011.01.038 |
| [17] |
Lin ZT, Li W. The roles of vitamin D and its analogs in inflammatory diseases[J]. Current Topics in Medicinal Chemistry, 2016, 16(11): 1242-1261. DOI:10.2174/1568026615666150915111557 |
| [18] |
Cheung FSG, Lovicu FJ, Reichardt JKV. Current progress in using vitamin D and its analogs for cancer prevention and treatment[J]. Expert Review of Anticancer Therapy, 2012, 12(6): 811-837. DOI:10.1586/era.12.53 |
| [19] |
Abe E, Miyaura C, Sakagami H, et al. Differentiation of mouse myeloid leukemia cells induced by 1α, 25-dihydroxyvitamin D3[J]. Proceedings of the National Academy of Sciences of the United States of America, 1981, 78(8): 4990-4994. DOI:10.1073/pnas.78.8.4990 |
| [20] |
Yasutake Y, Tamura T. Efficient production of active form of vitamin D3 by microbial conversion[J]. Synthesiology English Edition, 2012, 4(4): 227-235. |
| [21] |
Luo JQ, Jiang F, Song WQ, et al. Synthesis of paricalcitol: a novel strategy combining chemical and microbial transformations[J]. Russian Journal of Bioorganic Chemistry, 2017, 43(3): 323-327. DOI:10.1134/S1068162017030104 |
 2018, Vol. 45
2018, Vol. 45




