扩展功能
文章信息
- 杨榕, 王敬敬, 徐松, 赵维, 刘海燕, 李晴晴, 黄志勇
- YANG Rong, WANG Jing-Jing, XU Song, ZHAO Wei, LIU Hai-Yan, LI Qing-Qing, HUANG Zhi-Yong
- 溶磷真菌的筛选及耐盐特性分析
- Screening, identification and salt-tolerant characteristics of phosphate-solubilizing fungi
- 微生物学通报, 2018, 45(10): 2142-2151
- Microbiology China, 2018, 45(10): 2142-2151
- DOI: 10.13344/j.microbiol.china.180010
-
文章历史
- 收稿日期: 2018-01-03
- 接受日期: 2018-05-25
- 网络首发日期(www.cnki.net): 2018-06-12
2. 石河子大学兵团绿洲生态农业重点实验室 新疆 石河子 832003
2. Key Laboratory of Oasis Eco-agricultures, Shihezi University, Shihezi, Xinjiang 832003, China
磷对植物生长的影响仅次于氮,与植物的生长和能量流动密切相关。尽管土壤中磷的储备量很大,但是化学固定和复杂的螯合作用使土壤中磷的移动性和可利用性较差。研究发现,土壤中可供植物利用的有效磷仅占总量的0.1%[1],因此,土壤磷较低的可利用性成为制约农业生产的重要因素。传统农业中通过施用大量化学磷肥保证作物产量,但是长期过量施用化肥不仅导致土壤板结、根系生长受到抑制、水肥利用率降低,还会导致土壤总磷累积,使土壤和水体受到二次污染。因此,如何提高土壤磷的可利用性一直受到国内外研究人员广泛关注。
为了提高磷的可利用性,土壤微生物的作用成为近几年来研究的热点。研究发现很多土壤微生物,包括细菌、真菌和放线菌均可参与土壤难溶性磷的溶解、转化和迁移过程,它们能把沉淀在土壤中的磷转化为H2PO4−和HPO42−,提高了土壤的供磷水平,从而增加作物产量[2]。微生物溶解难溶性无机磷的机制主要包括提高土壤有机酸含量、降低土壤pH[3]、螯合作用和离子交换反应等[4]。Illmer等[5]早在1995年就提出,微生物通过呼吸作用释放的质子,可以显著促进土壤中无机磷的溶解。Mohammadi等[6]研究发现,植物根际的细菌通过分泌大量有机酸溶解磷酸钙和岩石中的磷,从而有效提高植物对磷的获取。然而,目前大量研究都在讨论细菌的溶磷特性和机制,而对真菌的关注较少。事实上,与细菌相比,真菌产生有机酸的能力更强,有些种属的溶磷效率明显高于细菌[7],而且其溶磷活性在传代培养过程中的稳定性也显著优于细菌[8]。因此,作为土壤微生物的重要类群,溶磷真菌在提高土壤磷可利用性方面的作用不容忽视。然而,目前关于溶磷真菌的报道仅局限于曲霉属(Aspergillus)和青霉属(Penicillium)真菌,其它类群的报道较少[9-10]。因此,寻找更多有溶磷功能的真菌类群,可为增强土壤或肥料中磷的可利用性提供更多的菌种资源。
我国土地资源丰富,但各类盐碱化土壤总面积多达9.91×107 hm2,尤其在干旱、半干旱内陆和滨海地区,土壤盐渍化问题更为严重[11],开发和利用盐碱化土壤对我国农业生态系统的可持续发展具有重要意义。近年来,虽然有较多的溶磷微生物被筛选和鉴定,但大多是一些非耐盐菌,它们在盐渍化土壤中的应用潜力有限。因此,寻找具有耐盐能力的溶磷真菌,挖掘它们的耐盐潜力,有助于发展盐碱地农业和土壤改良。基于此,本研究从农田土壤和微生物菌肥中筛选出有一定溶磷能力的真菌,讨论这些溶磷菌株对盐胁迫的耐受程度,深入挖掘菌株在不同盐胁迫下的溶磷效果,明确不同菌株的适用范围,以期根据土壤盐渍化程度选择最适菌株进行土壤改良和田间应用。
1 材料与方法 1.1 样品采集2017年4月,土壤样品采集于黑龙江盘锦、新疆石河子和山东寿光地区根际土壤,种植作物分别是水稻、棉花和蔬菜。采用五点取样法采集土样,取距离地表 5 cm−20 cm的新鲜土壤样品,筛出石块、大型动物等残体,保存于灭菌的密封袋中,置于冰袋中冷藏迅速带回实验室,保存在−20 ℃。
1.2 培养基、主要试剂和仪器真菌分离采用孟加拉红固体培养基(g/L):蛋白胨7.0,葡萄糖10.0,磷酸二氢钾1.0,硫酸镁0.5,琼脂18.0,1%孟加拉红液3.3 mL,pH 6.8−7.2。待培养基灭菌后温度降至45 ℃左右时,每100 mL培养基中加1%链霉素液0.3 mL。真菌纯化采用马铃薯琼脂培养基(PDA,g/L):马铃薯200,蔗糖20,琼脂20,pH 6.0。
解磷菌的分离采用无机磷培养基(Pikovskaya agar,g/L):氯化钠0.30,硫酸镁0.30,氯化钾0.30,硫酸铵0.50,硫酸亚铁0.03,四水合硫酸锰0.03,磷酸钙5.00,葡萄糖10.00,琼脂20.00,pH 7.0−7.5。所用试剂均为国产分析纯。
紫外可见分光光度计,岛津公司;恒温培养箱,上海新苗医疗器械有限公司;PCR仪、变性梯度凝胶电泳仪,伯乐公司。
1.3 测定方法 1.3.1 土壤真菌的分离和纯化土样稀释采用10倍梯度稀释法,称取10 g土壤充分混匀并研磨后,倒入盛有90 mL无菌水的三角瓶中,充分振荡混匀,取上清液稀释成浓度为10−3、10−4、10−5、10−6的土壤悬液。真菌分离采用稀释涂布平板法,吸取200 µL稀释液涂布于孟加拉红固体培养基上。28 ℃培养3−5 d后在平板上选择不同形态特征的菌落,继续在PDA平板上纯化,培养温度和时间与分离相同。
1.3.2 发芽率测定选取大小一致的饱满水稻种子在2% (质量体积比)次氯酸钠溶液中浸泡15 min消毒,然后用去离子水清洗干净,进行发酵液拌种处理。将水稻种子放在发酵液中,对照采用等体积的无菌发酵液处理,28 ℃、180 r/min振荡培养4 h后将种子取出,置于9 cm培养皿中。培养皿中放2层滤纸,无菌水浸湿,最后盖一层滤纸在种子上。每个平皿20粒,每个处理3次重复,28 ℃黑暗培养72 h,期间定时补加无菌水保持水分[12],测定种子的发芽率和发芽长度。发芽率测定公式:
发芽率(%)=总发芽种子数/种子总数×100%。
1.3.3 真菌序列分析采用CTAB法提取真菌的基因组DNA。利用真菌ITS序列的PCR通用引物ITS1 (5′-TCCGTAG GTGAACCTGCGG-3′)和ITS4 (5′-TCCTCCGCTTA TTGATATGC-3′)进行PCR扩增[13]。50 µL PCR反应体系:模板DNA 2 µL,上、下游引物(0.25 µmol/L)各2 µL,PCR MasterMix 25 µL,ddH2O 19 µL。PCR反应条件:93 ℃ 3 min;93 ℃ 1 min,53 ℃ 1 min,72 ℃ 90 s,30个循环;72 ℃ 10 min。测序结果在GenBank数据库中进行BLAST比对,选择相似度最高的参考序列,将参考序列、外源序列(Outgroup)和目标序列一起利用MEGA 5.0软件生成系统发育树,并将序列提交至GenBank获得登录号。
1.3.4 溶磷能力和pH测定(1) 定性测定溶磷能力。用无菌打孔器从新鲜培养的真菌菌落边缘打取菌丝薄片,置于100 mL的PDA液体培养基中,28 ℃、180 r/min振荡培养48 h。取50 µL菌液点在无机磷培养基上,28 ℃培养24 h,观察出现溶磷圈的菌落[14]。测定溶磷圈直径(D)和菌落直径(d),用D/d定性检验真菌的溶磷能力,将有溶磷能力的菌株进行反复纯化后转至斜面培养基,4 ℃保藏。
(2) 定量测定溶磷能力。用无菌打孔器从新鲜培养的真菌菌落边缘打取菌丝薄片,放入含有Ca3(PO4)2无机磷的PDA液体培养基中。28 ℃、180 r/min振荡培养72 h。用真空抽滤泵过滤得到菌种滤液,用钼锑抗比色法测定滤液中可溶性无机磷含量,同时测定pH值,以不接菌作为空白对照[12]。溶磷率计算公式为:
溶磷率(%)=(接菌可溶性磷含量−对照可溶性磷含量)/加入无机磷源的量×100%。
1.4 正交试验设计采用正交试验的设计方法研究双因素NaCl胁迫和Ca3(PO4)2添加量对菌株生长和溶磷能力的影响。NaCl设置3个梯度,分别是0、1%和5%;Ca3(PO4)2设置4个梯度,分别是0、1、3、5 g/L。在100 mL的PDA液体培养基中分别添加不同量的NaCl和Ca3(PO4)2,配制成不同浓度的培养基。用灭菌的打孔器在长满真菌菌丝的PDA平板上打孔,夹取琼脂片放入已灭菌的培养基中,28 ℃、180 r/min振荡培养72 h。
1.5 数据分析方法所有数据为均值±标准差(n=3)。通过t检验分析各菌株对水稻发芽率和发芽长度的影响(P≤0.05),通过单因素方差分析比较不同菌的生长情况以及在不同生长环境中的溶磷能力,并用Turkey’s honestly significant difference (HSD)检验不同处理间差异的显著性(P≤0.05)。使用Pearson相关分析检验不同真菌的溶磷能力与pH的相关性。所有统计分析均使用IBM SPSS statistic (Version 21.0)进行。所有作图都使用Origin 2016完成。
2 结果与分析 2.1 溶磷菌的分离筛选经过平板初筛和复筛,共获得16株在无机磷平板上有明显溶磷圈的菌株(表 1),它们D/d的比值在1.13−2.07之间,其中山东土壤中共筛选到2株菌有明显溶磷圈,用SD表示;黑龙江土壤中共筛选到2株菌有明显溶磷圈,用HLJ表示;新疆土壤中共筛选到7株菌有明显溶磷圈,用XJ表示;从微生物肥料中共筛选到5株有明显溶磷圈的菌株,用MF表示。
| 菌株编号 Isolates name |
直径比 D/d |
标准差 SD |
| SD-1 | 1.55 | 0.02 |
| SD-2 | 1.81 | 0.10 |
| HLJ-2 | 1.52 | 0.03 |
| HLJ-3 | 1.66 | 0.08 |
| XJ-1 | 1.78 | 0.06 |
| XJ-2 | 1.16 | 0.03 |
| XJ-3 | 2.07 | 0.09 |
| XJ-4 | 1.36 | 0.04 |
| XJ-5 | 1.70 | 0.08 |
| XJ-6 | 1.94 | 0.06 |
| XJ-7 | 1.46 | 0.02 |
| MF-1 | 1.89 | 0.07 |
| MF-2 | 1.22 | 0.04 |
| MF-3 | 1.13 | 0.05 |
| MF-5 | 1.69 | 0.04 |
| MF-6 | 1.79 | 0.08 |
通过测定这16株溶磷真菌对水稻发芽率的影响后发现,经过不同菌株发酵液处理后,只有4株溶磷菌对水稻的发芽长度有显著的促进作用(P≤0.05)。其中MF-1可以显著提高47.03%,SD-2可以显著提高54.26%,HLJ-3可以显著提高77.05%,XJ-7可以显著提高42.78%。因此,选取这4株菌做进一步溶磷耐盐研究。
2.2 溶磷菌ITS rDNA序列鉴定利用ITS rDNA特异引物对4株溶磷菌株的ITS DNA序列进行PCR扩增,扩增产物由华大基因科技有限公司测序,将得到的序列提交到GenBank获得了登录号。菌株SD-2、HLJ-3、XJ-7和MF-1获得的登录号分别为MG745309、MG745311、MG745319和MG745304。构建的系统发育树(图 1)显示,菌株SD-2、和XJ-7与踝节菌属绳状青霉(Talaromyces funiculosum)的相似性较高,而HLJ-3与踝节菌属嗜松青霉(Talaromyces phiophilus)的相似性较高,初步鉴定这3株菌为踝节菌属真菌(Talaromyces);另外,MF-1菌株与长枝木霉(Trichoderma longibrachiatum)的相似性为99%,因此将其鉴定为长枝木霉(Trichoderma longibrachiatum)。

|
| 图 1 溶磷菌株的系统发育分析 Figure 1 Phylogenetic analysis of phosphate solubilizing fungi 注:括号中的序号代表序列GenBank登录号;分支点数字代表步长值;标尺代表序列间分歧度. Note: Numbers in parentheses represent the sequences' accession number in GenBank; Numbers at the nodes indicate the bootstrap values on Neighbor-Joining analysis of 1 000 resampled date sets; Bar 0.2 represents sequence divergence. |
|
|
供试菌株SD-2、XJ-7、HLJ-3和MF-1在3个NaCl浓度和4个无机磷浓度的培养基中均能生长,但培养72 h后,它们的生长情况明显不同(图 2)。通过t检验两两比较菌株生长情况,结果发现,菌株SD-2和XJ-7的生长没有显著差异(P=0.383),但菌株SD-2的耐盐能力显著高于MF-1 (P=0.008)和HLJ-3 (P=0.000);而XJ-7的耐盐能力显著好于HLJ-3 (P=0.000),但与MF-1之间没有显著差异(P=0.052)。
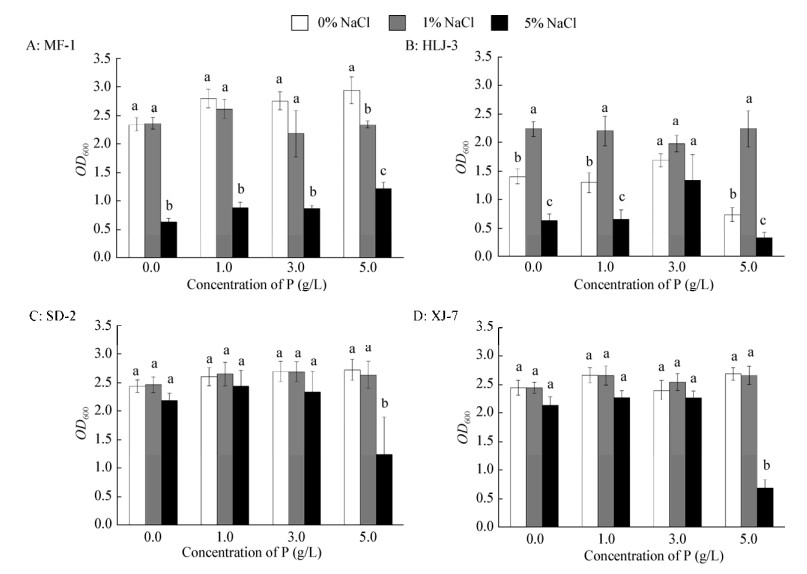
|
| 图 2 盐度和无机磷浓度对菌株生长的影响 Figure 2 Effects of different concentrations of Ca3(PO4)2 and NaCl on growth of different isolates 注:不同小写字母表示数据在不同盐度条件下存在显著差异(P≤0.05). Note: Data followed by the different lowercase letters are significantly different due to NaCl treatment at P≤0.05. |
|
|
单因素方差分析5% NaCl条件下4株菌的耐盐能力,结果显示菌株SD-2和XJ-7的生长无显著差异,但均显著好于菌株MF-1和HLJ-3 (F=18.843,P=0.000);随着NaCl浓度的增加,菌株SD-2和XJ-7的生长没有受到显著抑制,只是当外源磷添加量为5 mg/L时,菌株生长出现下降趋势,说明菌株SD-2和XJ-7生长的耐盐能力较好,在改良重度盐渍化土壤方面有一定的应用潜力;对于菌株MF-1而言,随着NaCl浓度的增加,菌株的生长情况逐渐降低。而菌株HLJ-3在1% NaCl条件下的生长情况明显好于0和5% NaCl条件,说明1% NaCl是该菌的最适生长环境(图 2)。
2.4 盐度和无机磷浓度对菌株溶磷能力的影响为了进一步研究4株菌在不同NaCl胁迫下对Ca3(PO4)2的溶解能力,分别测定培养72 h后4株菌的溶磷量,结果见图 3。4株菌的溶磷量差别很大,菌株MF-1的溶磷能力较低并且对NaCl胁迫比较敏感,在无NaCl条件下的溶磷量显著高于1%和5% NaCl条件,在无NaCl条件下的最高溶磷量为37.33 mg/L;菌株SD-2的最适溶磷环境是1% NaCl条件下,最高溶磷量可达176.13 mg/L;菌株HLJ-3的溶磷量在0和1%的NaCl条件下没有显著差异,最高溶磷量可达162.65 mg/L;菌株XJ-7的溶磷量在1%和5%的NaCl条件下没有显著差异,最高溶磷量可达158.93 mg/L。
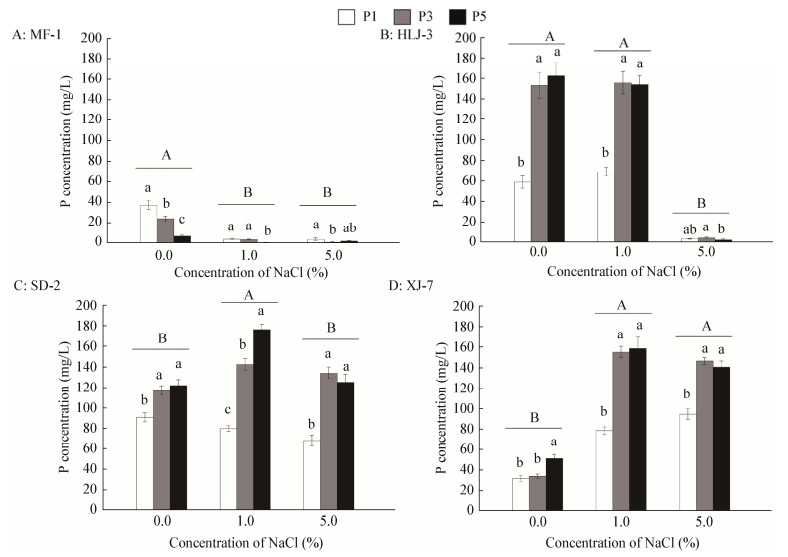
|
| 图 3 盐度和无机磷浓度对菌株溶磷量的影响 Figure 3 Effects of different concentrations of Ca3(PO4)2 and NaCl on phosphate-solubilizing concentration of different isolates 注:P1、P3和P5表示Ca3(PO4)2浓度分别为1、3和5 g/L.不同小写和大写字母分别表示数据在不同无机磷浓度和盐度条件下存在显著差异(P≤0.05). Note: P1, P3 and P5 represent 1 g/L, 3 g/L and 5 g/L of Ca3(PO4)2, respectively. Data followed by the different lowercase and uppercase letters are significantly different due to Ca3(PO4)2 and NaCl treatment respectively at P≤0.05. |
|
|
双因素分析Ca3(PO4)2和NaCl的交互作用对菌株溶磷能力的影响(表 2)。结果发现,4株菌的溶磷率均显著受到Ca3(PO4)2、NaCl以及它们之间交互作用的影响。菌株XJ-7的溶磷率对盐的耐受能力较强,在5% NaCl条件下该菌的溶磷率最高,可达9.49%;菌株HLJ-3的溶磷率对盐的耐受能力较弱,在1% NaCl条件下,该菌株的溶磷率最大,为6.93%;菌株SD-2和MF-1的溶磷率对盐的耐受能力较差,在无NaCl条件下,菌株SD-2和MF-1的最大溶磷率分别为9.07%和3.73%。
| 试验号 Numbers |
因素 Factors |
SD-2 | XJ-7 | MF-1 | HLJ-3 | |
| Ca3(PO4)2 (g/L) | NaCl (%) | |||||
| 1 | 1 | 0 | 9.07a | 3.21d | 3.73a | 5.90b |
| 2 | 3 | 0 | 3.90ef | 1.14e | 0.80b | 5.10b |
| 3 | 5 | 0 | 2.44g | 1.03e | 0.13c | 3.25c |
| 4 | 1 | 1 | 7.97b | 7.88b | 0.38c | 6.93a |
| 5 | 3 | 1 | 4.75d | 5.18c | 0.12c | 5.19b |
| 6 | 5 | 1 | 3.52f | 3.17d | 0.01c | 3.08c |
| 7 | 1 | 5 | 6.79c | 9.49a | 0.30c | 0.31d |
| 8 | 3 | 5 | 4.47de | 4.89c | 0.03c | 0.14d |
| 9 | 5 | 5 | 2.50g | 2.28d | 0.03c | 0.04d |
| Ca3(PO4)2 | ** | ** | ** | ** | ||
| NaCl | ** | ** | ** | ** | ||
| Ca3(PO4)2×NaCl | ** | ** | ** | ** | ||
| Maximum P-solubilizing rate | 9.07 | 9.49 | 3.73 | 6.93 | ||
| 注:数据来自3个数据的平均值;数据后面不同的小写字母表示不同处理之间在0.05水平下有显著差异. *:P≤0.05;**:P≤0.01. Note: Data are means (n=3); Data followed by different lowercase letters indicate significant differences among different treatment.*: P≤0.05; **: P≤0.01. |
||||||
进一步分析不同菌株的溶磷能力与pH的相关性(n=27),经Pearson相关系数计算法可得,菌株SD-2、XJ-7和HLJ-3的溶磷能力与pH的相关系数分别为−0.399 (P=0.020)、−0.692 (P=0.000)和−0.964 (P=0.000),说明菌株SD-2、XJ-7和HLJ-3的溶磷能力与pH呈显著负相关关系(图 4),而菌株MF-1则没有发现类似结果。
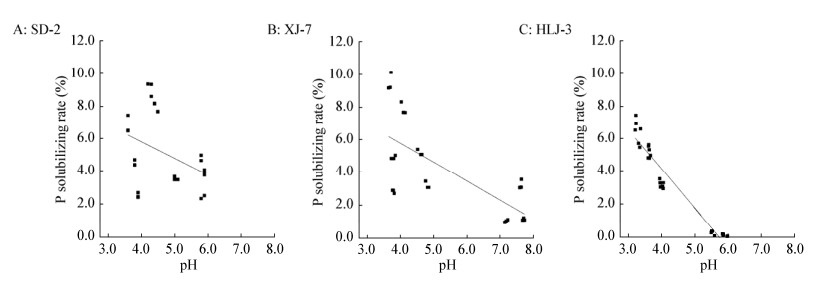
|
| 图 4 不同菌株溶磷率与pH的相关性 Figure 4 The correlation between P solubilizing rate and pH in different isolates |
|
|
通常对于耐盐菌的研究都是从高盐碱化土壤、盐湖、海洋等环境中筛选和驯化极端耐盐或者嗜盐微生物,而对于农田生态系统中溶磷菌的耐盐性关注较少。由于微生物的种类和数量会受到生长环境的强烈影响[15],导致很多有益微生物不易通过实验筛到[16]。因此,目前从高盐环境中筛选到的溶磷真菌种类非常有限,主要报道有裂褶菌属(Schizophyllum)[17]和青霉属真菌(草酸青霉[13]和绳状青霉[18]),严重限制了更多有益菌的开发和利用。另外,从极端环境中筛选的耐盐微生物在应用过程中对土著微生物的生长、作物产量以及生态系统稳定性方面的影响还有待深入讨论。因此,深入挖掘土壤中常规微生物的耐盐能力,以及不同盐胁迫条件下的溶磷效果,对于有针对性地应用土著有益微生物具有重要意义。本研究通过溶磷圈法共筛选到16株有明显溶磷效果的真菌,其中4株溶磷真菌对水稻发芽有显著的促进作用。通过构建系统发育树确定其中1株溶磷真菌属于长枝木霉属,另外3株属于踝节菌属,目前对这两类真菌溶磷和耐盐方面的报道较少。
木霉菌(Trichoderma spp.)可以产生多种对植物病原真菌、细菌以及昆虫有拮抗作用的活性物质,同时它不会侵入到植物根内,不影响植物生长发育,因而木霉作为一种生防菌剂已经在中国、印度、瑞典、美国等国家进行商品化生产。近年来,对于木霉菌的研究不仅仅局限于它的抗生防病作用,其溶磷功能也逐渐被挖掘出来,比如哈茨木霉和康宁木霉[19]。Yasser等[20]的研究中,哈茨木霉的溶磷率仅为0.3%,本试验发现,在没有盐胁迫条件下长枝木霉的溶磷率为3.73%,是哈茨木霉的10倍,说明长枝木霉不仅可以作为生防菌株,其溶磷能力在农业应用中也具有良好的的发展前景。在张曼曼等[19]的工作中虽然发现康宁木霉的溶磷量可以达到109.22 mg/L,但是该试验并没有考虑到盐胁迫环境对木霉溶磷能力的影响,尤其是木霉菌常常作为生防菌株对土壤盐环境的耐受程度会显著影响抗病效果。本研究发现,随着盐胁迫增加,长枝木霉的生长和溶磷能力均有降低趋势,说明该菌在作为生物菌肥应用的过程中需要充分考虑土壤条件,土壤盐渍化程度越高越会显著抑制该菌的抗病和溶磷功能。
踝节菌是青霉菌的一个亚属[21],主要用于工业酶的产生和应用方面。例如,有研究发现踝节菌属的柄篮状菌(Talaromyces stipitatus)在液体培养条件下可以产生大量的阿魏酸酯酶,该酶可能与细胞壁物质中多糖的降解和木质素的释放有关[22]。但是,踝节菌在农业生态系统中的研究明显少于工业领域,而且处于起步阶段。本试验发现,3株踝节菌属真菌可以显著提高水稻的芽长,这种促生机制是否与菌株生长过程中产生的某些有机酸、无机酸或者生长素(吲哚乙酸和赤霉素等)有关,或者存在类似于青霉属(Aspergillus sp.)和曲霉属(Penicillium sp.)的促生机制[23],还需要后续进行深入研究。本研究发现的这3株踝节菌属真菌的耐盐能力均好于长枝木霉,并且这3株菌在不同盐环境中的溶磷效果有显著差异,菌株XJ-7在5% NaCl条件下的溶磷率可达9.49%,菌株HLJ-3在1% NaCl条件下的溶磷率为6.93%。菌株SD-2在无NaCl条件下的溶磷率最高为9.07%。在吴海楠等[24]的工作中发现,当NaCl浓度为3%−7%时,草酸青霉的溶磷率仅在1.25%−1.63%之间。说明本试验中筛选到的踝节菌属真菌的溶磷能力好于草酸青霉。另外,在乔欢等[11]的工作中发现嗜松青霉的溶磷率较高,可达到24.1%,但是该试验对嗜松青霉的研究没有考虑盐胁迫的问题,即盐环境可能会显著影响该菌株的溶磷效果。本试验通过分析不同NaCl条件下菌株的耐盐情况以及溶磷能力,发现踝节菌属不同菌株对盐的耐受程度有显著差异。因此在实际应用过程中,应该充分考虑土壤环境,选用适合的菌株,更大程度地发挥菌株功能,降低肥料成本。
溶磷微生物的溶磷作用主要是通过产生有机酸、磷酸酶和氢质子等,而产生有机酸是其主要方式,这些有机酸在降低反应液pH值的同时,又能与钙、铝、铁等离子发生螯合作用,使难溶性磷转化为有效磷[25]。在本试验中发现,3株踝节菌属真菌的溶磷能力与pH呈显著负相关关系,这可能是菌株产生有机酸造成,即pH值越小,酸化能力越强,溶磷能力越强。然而试验中发现长枝木霉的溶磷能力与pH无显著相关性,有研究认为pH值下降并非是菌株溶磷的必要条件[26],也可能与真菌的类型和生长代谢有关[27],其溶磷机制有待深入研究。
盐碱土的改良和修复是亟待解决的问题,利用微生物改良盐碱土壤既经济又环保。本试验发现1株长枝木霉和3株踝节菌真菌在不同盐环境中有不同的溶磷能力,扩大了这两类广谱性真菌的应用范围,也为盐碱地土壤质量的改良和微生物肥料的研发提供了更多菌种资源。
| [1] |
Mclaughlin MJ, Alston AM, Martin JK. Phosphorus cycling in wheat pasture rotations. I. the source of phosphorus taken up by wheat[J]. Australian Journal of Soil Research, 1988, 26(2): 323-331. DOI:10.1071/SR9880323 |
| [2] |
Coutinho FP, Felix WP, Yano-Melo AM. Solubilization of phosphates in vitro by Aspergillus spp. and Penicillium spp[J]. Ecological Engineering, 2012, 42: 85-89. DOI:10.1016/j.ecoleng.2012.02.002 |
| [3] |
Ghosh R, Barman S, Mukherjee R, et al. Role of phosphate solubilizing Burkholderia spp. for successful colonization and growth promotion of Lycopodium cernuum L. (Lycopodiaceae) in lateritic belt of birbhum district of west bengal, India[J]. Microbiological Research, 2016, 183: 80-91. DOI:10.1016/j.micres.2015.11.011 |
| [4] |
Delvasto P, Valverde A, Ballester A, et al. Characterization of brushite as a re-crystallization product formed during bacterial solubilization of hydroxyapatite in batch cultures[J]. Soil Biology and Biochemistry, 2006, 38(9): 2645-2654. DOI:10.1016/j.soilbio.2006.03.020 |
| [5] |
Illmer P, Schinner F. Solubilization of inorganic calcium phosphates—solubilization mechanisms[J]. Soil Biology and Biochemistry, 1995, 27(3): 257-263. DOI:10.1016/0038-0717(94)00190-C |
| [6] |
Mohammadi K. Phosphorus solubilizing bacteria: occurrence, mechanisms and their role in crop production[J]. Resources and Environment, 2012, 2(1): 80-85. |
| [7] |
Whitelaw MA, Harden TJ, Bender GL. Plant growth promotion of wheat inoculated with Penicillium radicum sp. nov[J]. Australian Journal of Soil Research,, 1997, 35(2): 291-300. DOI:10.1071/S96040 |
| [8] |
Rashid M, Khalil S, Ayub N, et al. Organic acids production and phosphate solubilization by phosphate solubilizing microorganisms (PSM) under in vitro conditions[J]. Pakistan Journal of Biological Science, 2004, 7(2): 187-196. DOI:10.3923/pjbs.2004.187.196 |
| [9] |
Li Z, Bai TS, Dai LT, et al. A study of organic acid production in contrasts between two phosphate solubilizing fungi: Penicillium oxalicum and Aspergillus niger[J]. Scientific Reports, 2016, 6: 25313. DOI:10.1038/srep25313 |
| [10] |
Srividya S, Soumya S, Pooja K. Influence of environmental factors and salinity on phosphate solubilization by a newly isolated Aspergillus niger F7 from agricultural soil[J]. African Journal of Biotechnology, 2009, 8(9): 1864-1870. |
| [11] |
Qiao H, Wu XQ, Wang Z. Phosphate-solubilizing characteristic of a Penicillium pinophilum strain JP-NJ4[J]. Microbiology China, 2014, 41(9): 1741-1748. (in Chinese) 乔欢, 吴小芹, 王早. 一株嗜松青霉JP-NJ4的解磷特性[J]. 微生物学通报, 2014, 41(9): 1741-1748. |
| [12] |
Radhakrishnan R, Shim KB, Lee BW, et al. IAA-producing Penicillium sp. NICS01 triggers plant growth and suppresses Fusarium sp. induced oxidative stress in sesame (Sesamum indicum L.)[J]. Journal of Microbiology and Biotechnology, 2013, 23(6): 856-863. DOI:10.4014/jmb |
| [13] |
Fan YH, Wang J, Liu XH, et al. Isolation, identification and fermentation optimization of a halotolerant strain with phosphate-solubilizing activity[J]. Chinese Journal of Soil Science, 2015, 46(2): 362-367. (in Chinese) 范延辉, 王君, 刘雪红, 等. 一株耐盐解磷真菌的筛选、鉴定及其发酵优化[J]. 土壤通报, 2015, 46(2): 362-367. |
| [14] |
Pikovskaya RI. Mobilization of phosphorus in soil in connection with vital activity of some microbial species[J]. Mikrobiologiya, 1948, 17: 362-370. |
| [15] |
Rietz DN, Haynes RJ. Effects of irrigation-induced salinity and sodicity on soil microbial activity[J]. Soil Biology and Biochemistry, 2003, 35(6): 845-854. DOI:10.1016/S0038-0717(03)00125-1 |
| [16] |
Tripathi S, Kumari S, Chakraborty A, et al. Microbial biomass and its activities in salt-affected coastal soils[J]. Biology and Fertility of Soils, 2006, 42(3): 273-277. DOI:10.1007/s00374-005-0037-6 |
| [17] |
Liu GL, Gong N, Chen X, et al. Promotion effect of fungus DL12 fermentation liquid on salt-resistance ability of tomato and primary identification of strain[J]. Acta Agriculturae Zhejiangensis, 2017, 29(4): 605-610. (in Chinese) 刘国丽, 龚娜, 陈珣, 等. 一株真菌的发酵液对番茄抗盐的促进作用及菌株初步鉴定[J]. 浙江农业学报, 2017, 29(4): 605-610. DOI:10.3969/j.issn.1004-1524.2017.04.13 |
| [18] |
Zhang JF, Miao TY, Zhang JX, et al. Screening, identification and phosphate solubilizing properties of a fungi strain isolated from saline-alkali land[J]. Journal of Northwest A & F University (Natural Science Edition), 2017, 45(12): 121-128. (in Chinese) 张建峰, 苗天瑶, 张嘉旭, 等. 1株溶磷真菌的分离鉴定及溶磷特性分析[J]. 西北农林科技大学学报:自然科学版, 2017, 45(12): 121-128. |
| [19] |
Zhang MM, Deng CS, Ma JF, et al. Screening and identification of multi-functional Trichoderma spp[J]. Journal of Agro-Environment Science, 2012, 31(8): 1571-1575. (in Chinese) 张曼曼, 邓春生, 马金奉, 等. 多功能木霉的筛选及鉴定[J]. 农业环境科学学报, 2012, 31(8): 1571-1575. |
| [20] |
Yasser MM, Mousa ASM, Massoud ON, et al. Solubilization of inorganic phosphate by phosphate solubilizing fungi isolated from Egyptian soils[J]. Journal of Biology and Earth Sciences, 2014, 4(1): B83-B90. |
| [21] |
Samson RA, Yilmaz N, Houbraken J, et al. Phylogeny and nomenclature of the genus Talaromyces and taxa accommodated in Penicillium subgenus Biverticillium[J]. Studies in Mycology, 2011, 70: 159-183. DOI:10.3114/sim.2011.70.04 |
| [22] |
Maria-Teresa GC, Valérie FC, Andrew JG, et al. The feruloyl esterase system of Talaromyces stipitatus: production of three discrete feruloyl esterases, including a novel enzyme, TsFaeC, with a broad substrate specificity[J]. Journal of Biotechnology, 2004, 108(3): 227-241. DOI:10.1016/j.jbiotec.2003.12.003 |
| [23] |
Whitelaw MA. Growth promotion of plants inoculated with phosphate-solubilizing fungi[J]. Advances in Agronomy, 1999, 69: 99-151. DOI:10.1016/S0065-2113(08)60948-7 |
| [24] |
Wu HN, Li XP. Environmental influence factors for phosphate-solubilizing fungus strain in saline-alkali soil[J]. Modern Agricultural Science and Technology, 2015(5): 205-206. (in Chinese) 吴海楠, 李学平. 一株盐碱地耐盐解磷菌的环境影响因子研究[J]. 现代农业科技, 2015(5): 205-206. DOI:10.3969/j.issn.1007-5739.2015.05.129 |
| [25] |
Gyaneshwar P, Naresh KN, Parekh LJ. Effect of buffering on the phosphate-solubilizing ability of microorganisms[J]. World Journal of Microbiology and Biotechnology, 1998, 14(5): 669-673. DOI:10.1023/A:1008852718733 |
| [26] |
Scervino JM, Papinutti VL, Godoy MS, et al. Medium pH, carbon and nitrogen concentrations modulate the phosphate solubilization efficiency of Penicillium purpurogenum through organic acid production[J]. Journal of Applied Microbiology, 2011, 110(5): 1215-1223. DOI:10.1111/jam.2011.110.issue-5 |
| [27] |
Seshadri S, Ignacimuthu S, Lakshminarasimhan C. Effect of nitrogen and carbon sources on the inorganic phosphate solubilization by different Aspergillus niger strains[J]. Chemical Engineering Communications, 2004, 191(8): 1043-1052. DOI:10.1080/00986440490276308 |
 2018, Vol. 45
2018, Vol. 45




