扩展功能
文章信息
- 王言吉, 容丹, 王佳平, 王海立, 高建义, 韩延平, 杨瑞馥, 李勇枝
- WANG Yan-Ji, RONG Dan, WANG Jia-Ping, WANG Hai-Li, GAO Jian-Yi, HAN Yan-Ping, YANG Rui-Fu, LI Yong-Zhi
- 模拟失重环境对大肠杆菌K12表型异质性亚群菌株的影响
- Effect of simulated weightlessness on Escherichia coli K12 phenotypic heterogeneous strains
- 微生物学通报, 2018, 45(10): 2112-2120
- Microbiology China, 2018, 45(10): 2112-2120
- DOI: 10.13344/j.microbiol.china.170938
-
文章历史
- 收稿日期: 2017-11-09
- 接受日期: 2018-04-08
- 网络首发日期(www.cnki.net): 2018-04-11
2. 军事医学研究院微生物流行病研究所 病原微生物生物安全国家重点实验室 北京 100071
2. State Key Laboratory of Pathogen and Biosecurity, Beijing Institute of Microbiology and Epidemiology, Beijing 100071, China
一定条件下由细菌单克隆群体产生的表型差异,如休眠状态(芽孢)、抗原相变、感受态、生物膜等,叫做表型异质性[1-3]。表型异质性是细菌适应环境的结果,赋予细菌多种抵抗外界刺激的能力,使细菌能快速适应变换的环境,获得有效资源、生态位,有效抵抗外界环境压力等,对于细菌在新环境中的生存至关重要[4]。失重及低剪切力环境在我们的生活中较为罕见,失重主要存在于航天活动当中,而低剪切力环境则存在于人体消化道、泌尿道及呼吸道等。航天过程中有大量微生物随着人类的航天器进入太空,面对太空新环境,微生物会发生一系列的表型异质性变化以保证种群延续[5]。以前的研究发现,在模拟失重环境下,大肠杆菌生长速率增快,Tixador等[6]通过研究航天员的肠道菌群发现,大肠杆菌和金黄色葡萄球菌对于某些抗生素的耐药性增加,苯唑西林、氯霉素和红霉素对金黄色葡萄球菌的MIC (最小抑菌浓度)大约是地面模拟环境中对照值的2倍,粘菌素和卡那霉素对大肠杆菌的MIC大约比地面对照组高5倍以上,在缺乏抗生素的状态下,金黄色葡萄球菌空间搭载飞行后细胞壁大大增厚。大肠杆菌是人体肠道正常的定殖菌群,有时会发生菌群移位出现在呼吸道或者泌尿道,引起感染[7-9],低剪切力正常重力环境的培养能探究大肠杆菌在此环境下可能出现的表型变化并进行检测。
众所周知,自然环境会对生物形状进行定向选择,这也是生物进化的动力之一,表型发生变化是自然选择的第一步。对于大肠杆菌在失重条件下的变化已有较多报道[7, 10-12],但是尚未有研究从表型异质性的角度探讨失重对大肠杆菌的影响,本实验通过利用LSMMG以及LSNG对大肠杆菌进行处理,探索大肠杆菌在这两种环境中可能出现的表型差异性亚群菌株,筛选可能对人类造成危害的表型进行深入研究。
1 材料与方法 1.1 材料 1.1.1 菌株及细胞系大肠杆菌(Escherichia coli 1.2389)购自中国普通微生物菌种保藏管理中心。Lovo结肠癌上皮细胞株由广东省胃肠疾病重点实验室惠赠。
1.1.2 培养基LB液体培养基(g/L):蛋白胨10.0,酵母提取物5.0,氯化钠5.0,用于大肠杆菌的培养;LB-刚果红固体培养基(g/L):刚果红染料0.5,去离子水50 mL,琼脂粉15.0,蛋白胨10.0,酵母提取物5.0,氯化钠5.0,用于模拟失重培养后的单克隆分离;LB固体培养基(g/L):蛋白胨10.0,酵母提取物5.0,氯化钠5.0,琼脂粉15.0,用于大肠杆菌生存率实验计数;DMEM-F12培养液,用于Lovo细胞株的培养。
1.1.3 主要试剂和仪器胰蛋白酶,Gibco公司;抗生素药敏试纸,OXOID公司;其他常规试剂均为进口分析纯级产品。高速离心机,Eppendorf公司;旋转细胞培养系统,Synthecon公司;实时细胞检测系统,艾森生物有限公司;分光光度计,上海元析仪器有限公司;恒温培养箱,苏州培英实验设备有限公司;生物安全柜,Thermo公司。
1.2 大肠杆菌K12的培养利用旋转细胞培养系统(Rotary cell culture system,RCCS)模拟失重条件(图 1),本系统由控制器和旋转生物反应器(High aspect rotating vessel,HARV)构成,控制器调节旋转的速度和方向,反应器对细菌进行培养。HARV垂直旋转时受低剪切力及随机矢量的重力形成LSMMG环境,水平旋转时仅受低剪切力形成LSNG环境,分别为模拟失重组和正常重力对照组,生物反应器由半透膜进行气体交换。

|
| 图 1 旋转细胞培养系统 Figure 1 Rotary cell culture system 注:A:低剪切力模拟失重组;B:低剪切力正常重力组. Note: A: Low-shear modeled microgravity, HARV system rotate about a horizontal axis to generate LSMMG environment; B: Low-shear normal gravity, HARV system rotate about a vertical axis to generate LSNG environment. |
|
|
模拟失重培养实验利用LB液体培养基对大肠杆菌甘油种活化培养过夜(37 ℃、200 r/min,1׃100接入5 mL LB培养基),取平台期菌液以1׃250体积比接种到生物反应器中(含50 mL LB培养基),分别在水平和垂直方向以37 ℃、25 r/min进行培养,每24 h以1׃250体积比进行传代,连续培养2周。
1.3 不同表型亚群的筛选每24 h对模拟失重组及对照组大肠杆菌K12进行传代时,取菌液50 μL进行稀释,并涂片用显微镜下观察,取0.5 mL菌液以10倍比用磷酸盐缓冲液(PBS)稀释至10−6,并取200 μL稀释液在LB-刚果红固体培养基上进行均匀涂布,放入37 ℃孵育箱培养,待长出单克隆后,根据菌落形态及染色深浅,挑选出不同的单克隆制作涂片并在显微镜下观察,进一步挑选出菌体形态不同的单克隆。
1.4 生长曲线测定将原始菌株及表型异质性菌株甘油种进行活化培养过夜(37 ℃、200 r/min 1:100接入5 mL LB培养基),将活化好的菌液以1:250体积比接入含50 mL LB培养液的HARV,在37 ℃、25 r/min条件下进行模拟失重培养。从0 h开始,每2 h从加样孔取菌液300 μL,用30 μL甲醛固定,连续取36 h,最后将所取样品用分光光度计在OD600下进行测定,并作生长曲线图。
1.5 菌落表面褶皱实验根据细菌富产胞外多糖(生物膜基质的主要成分)菌落表面会呈现褶皱的原理,可以通过观察菌落表面褶皱的方法来判断生物膜形成量。由于培养时间较长,固体培养基厚度应为培养皿深度的1/2,使用前37 ℃、200 r/min平衡2 h,取5 μL的甘油菌种点加于LB平板表面,37 ℃培养3−5 d,拍正面照。
1.6 生物膜形成的测定将原始菌株及表型异质性菌株甘油种以1:100接入2 mL LB培养液,用15 mL玻璃试管在37 ℃,200 r/min条件下培养至平台期,菌液转移至离心管测定OD600值,用去离子水温和地洗涤试管2次,洗净菌液。将试管在60 ℃放置15 min固定,每孔再加入5 mL的0.1%结晶紫,染色15 min。用去离子水洗涤2−3次,充分洗去游离的结晶紫。每管加入5 mL的DMSO (需完全没过生物膜),放置30−60 min,期间间隔吹打混合,直至菌体发白。测定OD570值。计算生物膜的相对形成量= 1 000×OD570/(OD620×V1×V2),V1:初始菌液体积(2 mL),V2:DMSO体积(5 mL)。
1.7 环境压力耐受的比较根据大肠杆菌的生存条件以及常见的消毒剂范围,选择了酸性(pH 3.5)、碱性(pH 9.0)、酒精(10%)、过氧化氢(0.003%)以及高盐条件(450 mmol/L NaCl)对不同菌株进行了刺激。将不同菌株甘油种在普通LB培养基中活化并传代,取第二代对数中期菌液,1:100接入以上条件的LB培养液以及对应的空白对照组中,37 ℃孵育1 h。孵育结束后,将培养液用PBS倍比稀释,取10−4、10−5、10−6三个梯度,在LB固体培养基上涂布计数,每个浓度涂3块。计算刺激后菌株生存率=(a1+a2+a3)/ (b1+b2+b3),a1、a2、a3为刺激条件下孵育1 h后的涂布计数结果,b1、b2、b3为普通LB培养液中孵育1 h后的涂布计数结果,每个实验至少重复3次。
1.8 抗生素敏感性测定将菌株甘油种进行活化过夜并传代,取第2代对数中期的菌液,4 000 r/min离心3 min,弃上清,用PBS重悬,并调整至OD600约为1.0,将菌液均匀密集地划满LB固体培养基,每个平板分三区,分别贴上抗生素圆片试纸,37 ℃孵育箱培养,待菌落长出,测量抑菌斑大小判断抗生素敏感性。本实验选用的抗生素如下:美罗培南(MEM10),亚胺培南(IPM10),米诺环素(MH30),氯霉素(C30),头孢哌酮(CFP75),氨苄西林舒巴坦(SAM20),氨苄西林(AMP10),环丙沙星(CIP5),卡那霉素(K30),阿米卡星(AK30)。
1.9 实时细胞检测试验实时细胞检测系统(Real-time cellular analysis,RTCA)由底部带有高密度微电极阵列的八孔培养板、配套的检测器、安装有实时监测软件(xCELLigence,version 1.0.1401)的平板电脑三部分组成。培养孔底部电阻固定,当细胞黏附于底部生长时电阻增高,实时电阻检测可以直接反映细胞的贴壁生长状态,当培养孔中加入细菌后,细菌对细胞生长状态的影响也能直接通过软件观察。
每孔加入Lovo细胞培养液300 μL,含细胞约6×104个,待细胞生长状态稳定后,按照感染复数(Multiplicity of infection,MOI)为200加入细胞培养液重悬的细菌100 μL继续培养,待培养结束进行分析。
2 结果与分析 2.1 低剪切力和模拟失重环境导致大肠杆菌发生表型异质性变化在模拟失重组培养过程中分离出2株表型不同的亚群,分别是M1和Ma;在低剪切力正常重力组培养过程中分离出2株表型不同的亚群,分别是N1和Na (表 1),菌落形态及菌体形态见图 2。
| 菌株 Strain |
分离源 Separated from |
特征 Feature |
| P | 原始菌株 Original strain |
|
| M1 | 模拟失重组 Simulated microgravity group |
第5天从模拟失重组分离,菌体呈丝状,明显长于原始菌株,刚果红平板培养单克隆染色较深 On the fifth day after separation from the simulated microgravity group, the strain were filamentous and significantly longer than the original strain, which monoclonal stained darker with Congo red plates culture |
| Ma | 模拟失重组 Simulated microgravity group |
第14天从模拟失重组分离,菌落及菌体形态与原始菌株无明显区别 On the fourteenth day after isolation from simulated loss recombination, there was no significant difference from the original strain in colony and bacterial morphology |
| N1 | 正常重力组 Normal microgravity group |
第14天从正常重力组分离,菌体较原始菌株粗短,菌落边缘褶皱明显 On the fourteenth day after separation from the normal gravity group, the bacterial cells were thicker and shorter than the original strain, and the colony edge folds were distinct |
| Na | 正常重力组 Normal microgravity group |
第14天从正常重力组分离,菌落及菌体形态与原始菌株无明显区别 On the fourteenth day after separation from the normal gravity group, there was no significant difference from the original strain in colony and cell morphology |

|
| 图 2 各菌株菌落及菌体形态 Figure 2 The shape and congo red staining of different subpopulation colony and the gram staining of different subpopulation |
|
|
将模拟失重组分离出的2株表型异质性亚群菌株同原始菌株一起在模拟失重条件下培养36 h,每2 h取一次样;正常重力组同理。结果发现与原始菌株P相比,模拟失重组分离出的菌株M1和Ma在失重条件下增殖速率高于P,对数期延长,平台期浓度增高;正常重力组分离出的菌株N1和Na在正常重力条件下增殖速率高于P,其中N1对数期增殖效率高于Na和P,Na对数期相对P延长(图 3)。

|
| 图 3 在37 ℃ LSMMG环境下的生长曲线 Figure 3 Growth curve at 37 ℃ LSMMG 注:A:在37 ℃ LSMMG环境下P、M1和Ma的生长曲线;B:在37 ℃ LSNG环境下P、N1和Na的生长曲线. Note: A: Growth kinetics of P, M1 and Ma at 37 ℃ under LSMMG condition in LB medium; B: Growth kinetics of P, N1 and Na at 37 ℃ under LSNG condition in LB medium. |
|
|
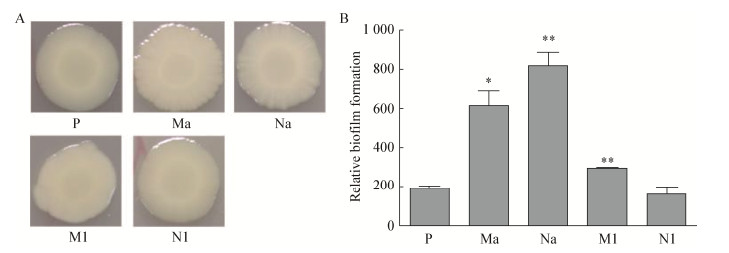
生物膜的形成能显著增强细菌对外界环境的抵抗力,增强细菌在极端环境中的生存能力[13]。在菌落表面褶皱试验中,可以发现Ma褶皱形成最明显,其次为Na,其余亚群菌株几乎不形成褶皱。在结晶紫染色实验中,与原始菌株P相比,在失重环境下分离出的2株亚群菌株M1和Ma生物膜形成能力均明显增强,在低剪切力正常重力条件下分离出的Na生物膜形成能力也明显增强,N1成膜能力无明显变化(图 4)。
|
| 图 4 细胞褶皱与生物膜生成的比较 Figure 4 Comparison of cell folds and biofilm formation 注:A:Ma褶皱形成最明显,并且褶皱形成数量的排列是Ma > Na > > M1≈P≈N1;B:此图为P,Ma,Na,M1和N1的生物相对膜形成量比较,亚群Ma,Na和M1显示出比P更强的生物膜形成能力(分别为P < 0.05,P < 0.01和P < 0.01). Note: A: Ma shows a most abundant colony drape, and the ranking of colony drape production is Ma > Na > > M1≈P≈N1; B: Relative biofilm formation of P, Ma, Na, M1 and N1. Subpopulation Ma, Na and M1 show a significant stronger (P < 0.05, P < 0.01 and P < 0.01, respectively) ability of biofilm formation than P. |
|
|
之前已有研究表明,短期暴露于模拟失重环境能增强沙门氏菌对于热休克和酸性的抵抗[14],大肠杆菌AMS6在经过短期模拟失重培养之后对于渗透压和酸性的抵抗力明显增强[14-20]。截至目前,还没有研究从表型异质性的角度对模拟失重培养过程中分离出的不同表型的亚群进行分析。本实验的结果(图 5)显示,与原始菌株P相比亚群菌株对于酸性(pH 3.5)的抵抗力均增强,其中Ma和Na有统计学差异;与原始菌株P相比,Ma和Na对于碱性(pH 9.0)的抵抗力明显减弱,M1和N1无显著差异;Ma和Na对于酒精(10%乙醇)的抵抗力明显低于原始菌株P,M1和N1则无显著差异;在高盐(450 mmol/L NaCl)条件下,亚群菌株M1的生存率显著降低,其余亚群菌株与P相比无显著差异;亚群菌株M1的抗氧化(0.003% H2O2)能力显著低于原始菌株P,其余亚群菌株与P相比无显著差异。

|
| 图 5 各亚群菌株在不同环境压力刺激下的生存率比较 Figure 5 Comparison of survival rates of strains of different subgroups under different environmental stress stimuli 注:A:不同亚群体在酸性LB培养基(pH 3.5)中的存活率,Ma和Na比P存活率更高(P < 0.05);B:暴露于碱性LB培养基(pH 9.0)后,Ma和Na显示比P存活能力更弱(P < 0.05);C:暴露于含有10%乙醇的LB培养基后,Ma和Na显示比P存活率更低(P < 0.05),N1的存活率略微但不显着;D:M1在高渗性LB培养基(450 mmol/L NaCl)中比P表现出更弱的存活率(P < 0.05),并且N1比P略高些,但不明显;E:抗氧化能力,M1明显比P更弱(P < 0.05). Note: A: Survival rate of different subpopulation after exposure to acid LB medium (pH 3.5), Ma and Na is significantly more viable (P < 0.05) than P; B: Ma and Na show a significant weaker (P < 0.05) viability than P after exposure to alkaline LB medium (pH 9.0); C: Ma and Na show a significant weaker (P < 0.05) viability than P after exposure to LB medium with 10% ethanol, survival rate of N1 is slightly but not significantly higher than P's; D: M1 demonstrate a significant weaker (P < 0.05) viability than P in hyperosmotic LB medium (450 mmol/L NaCl) and N1 is slightly but not significantly more viable than P; E: M1 demonstrate a significant weaker (P < 0.05) resistance to oxidation than P. |
|
|
用药敏试纸鉴定5株菌的抗生素敏感性,结果显示(表 2)与原始菌株相比,表型异质性菌株对于多种抗生素的敏感性均无变化。
| Strains | P | Ma | Na | M1 | N1 |
| MEM10 | + | + | + | + | + |
| IPM10 | + | + | + | + | + |
| MH30 | + | + | + | + | + |
| C30 | + | + | + | + | + |
| CFP75 | + | + | + | + | + |
| SAM20 | + | + | + | + | + |
| AMP10 | + | + | + | + | + |
| CIP5 | + | + | + | + | + |
| K30 | + | + | + | + | + |
| AK30 | + | + | + | + | + |
| 注:+:敏感;−:不敏感. Note: +: Sensitive; −: Insensitive. |
|||||
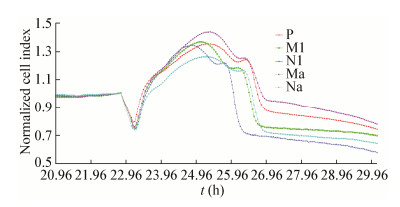
设定每3 min检测一次Lovo细胞贴壁生长状况,在第23 h之前加入细菌继续培养,将结果标准化处理后发现在第25 h之前,N1组首先出现了细胞指数(Normalized cell index,NCI)的下降,并且在1 h后出现了急剧的下降;进入第25 h之后,M1组和Na组几乎同时出现了NCI的下降,不过由于Na组加入细菌后增速减慢,所以NCI低于M1组;在25.5 h左右,P组和Ma组NCI几乎同时开始下降,不过由于前期增速减缓,P组NCI低于Ma组。实验结果显示5株菌的细胞毒性强弱结果是:N1 > Na > M1 > P > Ma (图 6)。
|
| 图 6 细菌对Lovo细胞影响的标准化细胞指数结果 Figure 6 Standard cell index results of bacteria effect on lovo cells 注:N1的细胞毒力明显比其他4株菌更强,5株菌的细胞毒性强弱结果是:N1 > Na > M1 > P > Ma. Note: N1 show a significant stronger cytotoxicity than other four subpopulation. And the result of cytotoxicity ranking is N1 > Na > M1 > P > Ma. |
|
|
受限于太空搭载资源的稀缺,本实验采用了地面模拟微重力的方法进行研究,所采用的旋转细胞培养系统又称为旋转壁式生物反应器(RWV),是20世纪90年代由美国国家航天航空局(NASA)研发并完善的,对地面环境模拟失重条件进行科学研究提供了有力的技术支持[21-22]。
本实验在培养初期对大肠杆菌进行了单克隆分纯培养,然后进行2周的LSMMG及LSNG处理后分离出4株表型异质性亚群菌株,模拟失重实验进行3次,亚群菌株能逐渐稳定出现(M1第5天从模拟失重组分离),并且将亚群菌株进行单克隆传代培养,表型能遗传,说明这4株菌的进化方向是稳定的,而且具有可遗传性。虽然新发现的亚群菌株并不能代表LSMMG及LSNG状态下细菌的实际情况,但是从发现的角度来看被筛选出来的几率比较大,也就说明经过LSMMG及LSNG处理后新的亚群菌株在数量方面占有优势。4株菌分别来自模拟失重组和正常重力组,进行组内比较可以发现,4株菌的生长速度都比原始菌株明显增快。我们推测是因为2组环境都营养相对丰富,细菌为了尽可能利用营养,其物质转运及营养代谢系统表达会增高,让其生长速率增快。生物膜有利于细菌抵抗极端环境,本实验证实Ma、Na和M1生物膜形成能力增强,这个结果结合生长曲线来看,可以得出结论:Ma、Na和M1相比原始菌株,在营养丰富的条件下能更好地利用营养物质生长,而且在极端环境下也有更强的生存能力。
在细菌环境压力耐受实验中,与原始菌株相比,4株菌对于环境压力耐受能力的变化没有明显的方向性,除了在耐酸性上4株菌都出现比原始菌株更耐酸的结果,其余的比较中都有增高或者降低。将5个实验结果进行总结,我们可以发现M1与原始菌株相比,耐受力都是持平或者降低的,没有明显增高过;而N1正好相反,都是增高或者持平,没有降低过。结合这两株菌的菌体形态可以推测,M1的长丝状菌体不利于细菌抵抗外界环境压力,而N1的粗短菌体对于细菌抵抗外界环境压力是有利的。
细菌的抗生素耐药基因一般存在于质粒上,而本实验采用的菌株K12是一株工程菌,自身并没有携带质粒,所以抗生素耐药性没有变化。
RTCA结果显示5株菌的细胞毒性为N1 > Na > M1 > P > Ma,且N1毒力明显强于其余4株,N1在显微镜下明显粗短且染色加深,细胞壁较其余4株明显增厚,推测毒力的增强可能跟N1荚膜形成有关。
本实验利用LSMMG及LSNG培养大肠杆菌,摸索出了在模拟微重力的2种条件下可能出现的大肠杆菌异质性表型并进行检测,达到了实验目的,为下一步深入研究模拟微重力条件下表型异质性变化的机制打下了坚实的基础。
| [1] |
Dhar N, Mckinney JD. Microbial phenotypic heterogeneity and antibiotic tolerance[J]. Current Opinion in Microbiology, 2007, 10(1): 30-38. DOI:10.1016/j.mib.2006.12.007 |
| [2] |
Dubnau D, Losick R. Bistability in bacteria[J]. Molecular Microbiology, 2006, 61(3): 564-572. DOI:10.1111/mmi.2006.61.issue-3 |
| [3] |
Casadesús J, Low DA. Programmed heterogeneity: Epigenetic mechanisms in bacteria[J]. Journal of Biological Chemistry, 2013, 288(20): 13929-13935. DOI:10.1074/jbc.R113.472274 |
| [4] |
Stewart PS, Franklin MJ. Physiological heterogeneity in biofilms[J]. Nature Reviews Microbiology, 2008, 6(3): 199-210. DOI:10.1038/nrmicro1838 |
| [5] |
Rong D, Wang JP, Wang HL, et al. Effect of microgravity on Escherichia coli K12 phenotype and gene expression[J]. Microbiology China, 2017, 44(5): 1038-1046. (in Chinese) 容丹, 王佳平, 王海立, 等. 模拟失重对大肠杆菌K12基因表达及表型的影响[J]. 微生物学通报, 2017, 44(5): 1038-1046. |
| [6] |
Tixador R, Gasset G, Eche B, et al. Behavior of bacteria and antibiotics under space conditions[J]. Aviation Space & Environmental Medicine, 1994, 65(6): 551-556. |
| [7] |
Zhang XL. Research about the impact of spaceflight on multi-drug resistant Escherichia coli[D]. Beijing: Doctoral Dissertation of Medical School of China PLA, 2015 (in Chinese) 张学林. 太空飞行对多药耐药大肠杆菌影响的研究[D]. 北京: 解放军医学院博士学位论文, 2015 |
| [8] |
Crump JA, Sulka AC, Langer AJ, et al. An outbreak of Escherichia coli O157:H7 infections among visitors to a dairy farm[J]. New England Journal of Medicine, 2002, 347(8): 555-560. DOI:10.1056/NEJMoa020524 |
| [9] |
King LA, Nogareda F, Weill FX, et al. Outbreak of Shiga toxin-producing Escherichia coli O104:H4 associated with organic fenugreek sprouts, France, June 2011[J]. Clinical Infectious Diseases, 2012, 54(11): 1588-1594. DOI:10.1093/cid/cis255 |
| [10] |
Dang L, Yin H, Jin MH, et al. Mutagenesis of E. coli in microgravity[J]. Microbiology China, 2010, 37(6): 852-856. (in Chinese) 党磊, 印红, 靳明慧, 等. 微重力诱变大肠杆菌快速生长突变株特性[J]. 微生物学通报, 2010, 37(6): 852-856. |
| [11] |
Yin HC, Xue XP, Yang H, et al. Study on biological effects of simulated microgravity on bacteria[J]. Space Medicine & Medical Engineering, 2009, 22(5): 341-346. (in Chinese) 尹焕才, 薛小平, 杨慧, 等. 模拟微重力环境下细菌生物学效应的初步研究[J]. 航天医学与医学工程, 2009, 22(5): 341-346. |
| [12] |
Weng ML, Li JG, Gao HY, et al. Mutation induced by space conditions in Escherichia coli strains[J]. Space Medicine & Medical Engineering, 1998, 11(4): 245-248. (in Chinese) 翁曼丽, 李金国, 高红玉, 等. 大肠杆菌菌种空间变异的研究[J]. 航天医学与医学工程, 1998, 11(4): 245-248. |
| [13] |
Beloin C, Renard S, Ghigo JM, et al. Novel approaches to combat bacterial biofilms[J]. Current Opinion in Pharmacology, 2014, 18: 61-68. DOI:10.1016/j.coph.2014.09.005 |
| [14] |
Wilson JW, Ott CM, Ramamurthy R, et al. Low-shear modeled microgravity alters the Salmonella enterica serovar typhimurium stress response in an RpoS-independent manner[J]. Applied & Environmental Microbiology, 2002, 68(11): 5408-5416. |
| [15] |
Vukanti R, Model MA, Leff LG. Effect of modeled reduced gravity conditions on bacterial morphology and physiology[J]. BMC Microbiology, 2012, 12(1): 4. DOI:10.1186/1471-2180-12-4 |
| [16] |
Kim W, Tengra FK, Young Z, et al. Spaceflight promotes biofilm formation by Pseudomonas aeruginosa[J]. PLoS One, 2013, 8(4): e62437. DOI:10.1371/journal.pone.0062437 |
| [17] |
Lawal A, Kirtley ML, van Lier CJ, et al. The effects of modeled microgravity on growth kinetics, antibiotic susceptibility, cold growth, and the virulence potential of a Yersinia pestis ymoA-deficient mutant and its isogenic parental strain[J]. Astrobiology, 2013, 13(9): 821-832. DOI:10.1089/ast.2013.0968 |
| [18] |
Kim HW, Matin A, Rhee MS. Microgravity alters the physiological characteristics of Escherichia coli O157:H7 ATCC 35150, ATCC 43889, and ATCC 43895 under different nutrient conditions[J]. Applied & Environmental Microbiology, 2014, 80(7): 2270-2278. |
| [19] |
Rosenzweig JA, Ahmed S, John Eunson J, et al. Low-shear force associated with modeled microgravity and spaceflight does not similarly impact the virulence of notable bacterial pathogens[J]. Applied Microbiology & Biotechnology, 2014, 98(21): 8797-8807. |
| [20] |
Mauclaire L, Egli M. Effect of simulated microgravity on growth and production of exopolymeric substances of Micrococcus luteus space and earth isolates[J]. FEMS Immunology & Medical Microbiology, 2010, 59(3): 350-356. |
| [21] |
Hammond TG, Hammond JM. Optimized suspension culture: the rotating-wall vessel[J]. American Journal of Physiology-Renal Physiology, 2001, 281(1): F12-F15. DOI:10.1152/ajprenal.2001.281.1.F12 |
| [22] |
Jessup JM, Pellis NR. NASA biotechnology: cell science in microgravity[J]. Vitro Cellular & Developmental Biology Animal, 2001, 37(2): 2 p preceding 63. |
 2018, Vol. 45
2018, Vol. 45




