扩展功能
文章信息
- 陈小红
- CHEN Xiao-Hong
- 一株分离自网箱养殖区沉积物的硫氧化菌B1-1的鉴定及其硫氧化特性
- Identification and characterization of a sulfur-oxidizing bacterium B1-1 isolated from the sediment of marine cage culture area
- 微生物学通报, 2018, 45(10): 2082-2090
- Microbiology China, 2018, 45(10): 2082-2090
- DOI: 10.13344/j.microbiol.china.170941
-
文章历史
- 收稿日期: 2017-11-10
- 接受日期: 2018-02-27
- 网络首发日期(www.cnki.net): 2018-03-22
海水网箱养殖是一种开放式、人工营养型、高密度和集约化的现代养鱼方式。在海水网箱养殖过程中,残饵、粪便以及鱼类排泄物等给养殖环境带来了沉重的负担[1],污染物质在底泥中的长期积累和分解作用会造成养殖海域的“二次污染”[2]。其中,沉积物中的硫化物是养殖环境最主要污染物之一,是造成渔场老化的主要原因[3]。
硫氧化菌(Sulfur oxidizing bacteria,SOB)是一类通过氧化还原性硫化物获取能源生长的特殊微生物[4],在自然界中的分布极为广泛。近年来,已有大量关于硫氧化菌在生物浸矿[5]、煤炭脱硫[6]和废水处理[7]等方面的研究,并取得了良好的应用效果。由于微生物修复的彻底性、安全性等优点,微生物修复已逐渐应用到水产养殖的污染治理中[8]。由此可见,利用土著硫氧化菌治理网箱养殖区的硫化物污染具有重要的现实意义。但是由于硫氧化菌多为自养型微生物,其生长速率普遍偏低,导致培养效果不理想,难以满足实际科研和生产需求[9]。因此,本实验针对网箱养殖区沉积物中分离得到的硫氧化菌,对其主要影响因素如pH、温度、底物浓度、外加碳氮源及金属离子进行研究,获得其氧化硫代硫酸盐的最适条件,为将硫氧化菌应用于网箱养殖环境中硫化物的治理奠定理论基础。
1 材料与方法 1.1 菌种菌株B1-1由本课题组通过富集培养从福建漳州网箱养殖区沉积物中分离得到[10],并保藏于中国典型培养物保藏中心(菌种保藏编号:CCTCC AB2016151)。
1.2 主要试剂和仪器及培养基Taq聚合酶,上海桑尼生物科技有限公司。生化培养箱,宁波赛福实验仪器有限公司;透射电子显微镜,日本电子株式会社。
基础培养基[11](g/L):MgSO4·7H2O 0.1,Na2S2O3·5H2O 5.0,K2HPO4 2.0,(NH4)2SO4 0.1,CaCl2·2H2O 0.1,FeSO4·7H2O 0.02,陈海水1 L,1×105 Pa灭菌15 min,用无菌HCl/NaOH调pH至7.6-8.2。固体培养基加15.0 g/L琼脂粉。
1.3 菌株形态学观察将分离到的菌株在固体基础培养基上于28 ℃培养36 h后,观察菌落形态。细菌革兰氏染色反应参照标准方法[12]进行。细菌的生理生化实验步骤按照北京陆桥细菌常规生化鉴定盒说明书进行。通过透射电镜观察细菌的细胞形态并测定菌体大小。
1.4 菌株分子生物学鉴定将筛选得到的菌株保存斜面送交上海派森诺生物科技股份有限公司进行16S rRNA基因序列分析鉴定。正、反向引物分别为27F (5′-AGAGTTTGA TCCTGGCTCAG-3′)和1492R (5′-CTACGGCTACC TTGTT ACGA-3′)。50.0 μL扩增体系:基因组DNA 1.0 μL,10×Buffer 5.0 μL,Taq聚合酶(5 U/μL) 1.0 μL,dNTPs (10 mmol/L) 1.0 μL,27F、1492R引物(10 μmol/L)各1.5 μL,ddH2O 39.0 μL。RCR反应条件:95 ℃ 5 min;95 ℃ 30 s,58 ℃ 30 s,72 ℃ 90 s,35个循环;72 ℃ 7 min。使用测序仪ABI3730-XL进行DNA测序。
将所测得的序列提交到GenBank,并利用NCBI的BLAST软件进行同源性比对。将筛选菌株及近缘菌株的16S rRNA基因序列用MEGA 6.0软件构建系统发育树,采用邻接法(Neighbor- Joining)、Kimura双参数模型(Kimura 2-parameter model) 1 000次自展(Bootstrap)来评估所建进化树的准确性[13]。
1.5 硫氧化特性试验菌株B1-1的生长特性试验结果表明[10],在28 ℃、初始pH 8.0、150 r/min培养条件下,细菌在12 h进入对数生长期,36 h进入稳定期并开始氧化S2O32-,至60 h培养液pH下降到4.8后S2O32-浓度不再变化,最终S2O32-氧化率达84.2%。为进一步提高菌株的氧化能力,在此基础上开展硫氧化特性试验。
1.5.1 不同初始pH对菌株B1-1氧化硫代硫酸盐的影响将5组基础培养基的初始pH分别调至5.0、6.0、7.0、8.0、9.0,每组各分装150 mL培养基至300 mL三角瓶,以2%的接种量接入种子液,再次用无菌HCl/NaOH微调至目标pH,于28 ℃、150 r/min摇床培养,每组2个平行。每隔12 h测定培养液中S2O32-的浓度。
1.5.2 不同温度对菌株B1-1氧化硫代硫酸盐的影响取5组300 mL三角瓶加入150 mL基础培养基,然后以2%的接种量接入种子液,用无菌NaOH将pH微调至8.0,分别置于20、25、30、35、40 ℃摇床培养,转速均为150 r/min,每组2个平行。每隔12 h测定培养液中S2O32-的浓度。
1.5.3 不同底物浓度对菌株B1-1氧化硫代硫酸盐的影响取4组不加硫代硫酸钠的基础培养基,添加不同浓度的硫代硫酸钠,使其终浓度分别为2.5、5.0、7.5、10.0 g/L,调节初始pH为8.0,每组各分装150 mL培养基至300 mL三角瓶,以2%的接种量接入种子液,用无菌NaOH将pH微调至8.0,于28 ℃、150 r/min摇床培养,每组2个平行。每隔12 h测定培养液中S2O32-的浓度。
1.5.4 不同碳源对菌株B1-1氧化硫代硫酸盐的影响取4组基础培养基,分别添加经0.22 μm滤膜过滤除菌后的葡萄糖、麦芽糖、蔗糖、淀粉,使其终浓度均为0.4 g/L,以基础培养基为对照,每组2个平行。按2%的接种量接入种子液,用无菌NaOH将pH微调至8.0,于28 ℃、150 r/min摇床培养。每隔12 h测定培养液中S2O32-的浓度。
1.5.5 不同氮源对菌株B1-1氧化硫代硫酸盐的影响取4组基础培养基,分别添加经0.22 μm滤膜过滤除菌后的硫酸铵、硝酸钠、草酸铵、蛋白胨,使其终浓度均为0.8 g/L,以基础培养基为对照,每组2个平行。按2%的接种量接入种子液,用无菌NaOH将pH微调至8.0,于28 ℃、150 r/min摇床培养。每隔12 h测定培养液中S2O32-的浓度。
1.5.6 不同金属离子(Mg2+、Ca2+、K+)对菌株B1-1氧化硫代硫酸盐的影响取3组以蒸馏水替换陈海水的基础培养基,并添加25.0 g/L的NaCl,灭菌前再分别添加MgCl2·7H2O、CaCl2、KCl,使其终浓度分别为10.0、10.0、7.0 g/L;以添加陈海水的基础培养基为对照,每组2个平行。按2%的接种量接入种子液,用无菌NaOH将pH调至8.0,于28 ℃、150 r/min摇床培养。每隔12 h测定培养液中S2O32-的浓度。
1.6 分析方法S2O32-浓度采用碘量滴定法[14-15]测定。步骤如下:(1)配制稀释溶液:取1 mL的培养液于碘量瓶中,用蒸馏水稀释至50 mL (稀释50倍);(2)碘量瓶中加2 mL 17.5 mol/L醋酸和1 mL 1%的淀粉溶液;(3)用0.01 mol/L的碘标准溶液滴定至出现不消失的蓝色为止,用滴定所消耗的碘量来计算S2O32-的含量;(4)以1 mL蒸馏水代替培养液作空白试验。计算公式:Y=(V-V0)×C×M×X/50,其中:Y为所含S2O32-的量,单位是g/L;C为滴定的碘标准溶液浓度(0.01 mol/L);M为S2O32-的分子量(112 g/mol);V为滴定样品所消耗的碘液体积;V0为滴定蒸馏水所消耗的碘液体积。
2 结果与分析 2.1 菌株B1-1的形态特征菌株B1-1于28 ℃培养36 h后,在固体基础培养基上菌落呈乳白色,直径约1 mm,圆形,表面凸起,湿润易挑取(图 1A)。随着培养时间的延长,菌落颜色逐渐转变成浅黄色,菌落周围可以观察到透明的溶解圈,这是由于培养基配方里面添加了陈海水,使得某些金属离子(如Ca2+、Mg2+)和SO42-之间相互反应产生沉淀,培养基呈白色浑浊,而菌株B1-1可以氧化硫代硫酸盐产生硫酸盐,使培养基pH值下降,沉淀物质分解[10]。

|
| 图 1 菌株B1-1形态特征图 Figure 1 Morphological characterization of strain B1-1 注:A:菌株B1-1菌落图;B:单细胞TEM图. Note: A: Colony of strain B1-1; B: TEM micrograph of B1-1 cell. |
|
|
菌株B1-1在透射电镜下观察的结果见图 1B:细胞呈短杆状,大小为0.5 μm×1.0 μm,带端生鞭毛。同时部分细胞里面可观察到硫粒,推测菌株B1-1在氧化硫代硫酸盐的过程中有单质硫的积累。部分生理生化结果显示,菌株B1-1为革兰氏阴性,过氧化氢酶实验呈阴性,葡萄糖、乳糖、蔗糖生化管反应均呈阴性,推测该菌株不能利用葡萄糖、乳糖、蔗糖等有机物进行异养生长,为化能无机自养型硫杆菌。
2.2 菌株16S rRNA基因序列分析及其系统发育树的构建根据《伯杰氏细菌鉴定手册》(第9版),盐硫杆菌属(Halothiobacillus sp.)包括4个种,分别为Halothiobacillus neapolitanus、Halothiobacillus halophilus、Halothiobacillus hydrothermalis和Halothiobacillus kellyi[16-17]。本研究对菌株B1-1的16S rRNA基因(1 465 bp)进行测序,并获得GenBank登录号为KU362926。在NCBI数据库的比对结果表明,菌株B1-1与盐硫杆菌属(Halothiobacillus sp.)中的菌株位于同一组,且与最相似的模式菌株Halothiobacillus hydrothermalis (NR025943)相似性为99%。选取GenBank中其他菌株的16S rRNA基因进行同源比对,经过系统发育树的构建,从而确定菌株B1-1在系统发育树上的地位(图 2)。结合菌株的形态学特征,推测菌株B1-1为Halothiobacillus hydrothermalis。
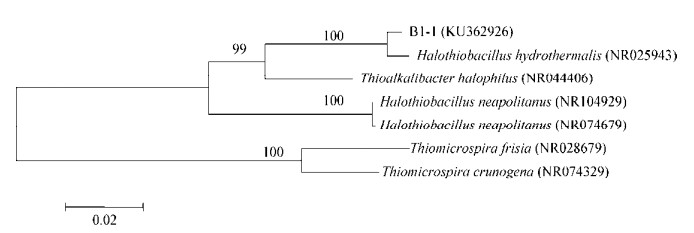
|
| 图 2 菌株B1-1基于16S rRNA基因序列同源性构建的系统发育树 Figure 2 Phylogenetic tree of strain B1-1 based on the 16S rRNA gene sequence 注:括号内为菌株的16S rRNA基因序列在GenBank中的登录号;分支结点处数字为Bootstrap值;标尺的数据为进化距离. Note: Numbers in parentheses represent the accession numbers in the GenBank for the 16S rRNA gene sequences of the strain; The numbers on the branches refer to bootstrap values; Bar (0.02) represents sequence divergence. |
|
|
图 3所示为不同初始pH对菌株B1-1氧化S2O32-能力的影响。初始pH从5.0调至9.0时,菌株B1-1对S2O32-均有一定的氧化能力,说明其对pH的耐受范围较宽。此外,随着初始pH从5.0到9.0递增,一方面,菌株对S2O32-氧化率逐渐上升,依次为10.8%、16.8%、55.4%、85.7%、95.5%;另一方面,菌株氧化S2O32-的延滞期也逐渐延长,初始pH 9.0时的延滞期最长,为72 h。
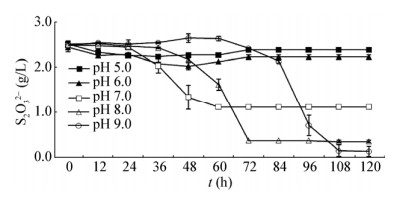
|
| 图 3 不同初始pH对菌株B1-1氧化S2O32-能力的影响 Figure 3 Influence of different intial pH value on the S2O32- oxidation ability of strain B1-1 |
|
|
盐硫杆菌属的细菌均为专性化能无机自养型微生物,可以从还原态硫化物的生物氧化中获得细胞生长所需能量,终产物为硫酸,因此常常导致其生长环境的酸化[18]。因此不同初始pH对菌株B1-1氧化硫代硫酸盐的影响有显著差异。初始pH值过高,菌体对碱性生长环境的适应期较长,这可能是由于硫氧化菌需要先消耗营养物质来产生酸性物质,从而抵消碱性环境对生长的影响,进而延滞期延长;初始pH值过低,菌株对S2O32-氧化率低,这可能是由于酸性产物使得硫氧化菌生长环境迅速酸化,菌体不能适应,过早进入衰亡期[19]。参考《伯杰氏细菌鉴定手册》,Halothiobacillus hydrothermalis的最适pH为7.5-8.0,这与本研究结果较为一致,综合氧化率和延滞期考虑,菌株B1-1的最适初始pH为8.0左右。
2.3.2 不同温度对菌株B1-1氧化硫代硫酸盐的影响硫氧化菌的氧化反应是在各种酶的催化下进行的,适宜的温度环境是保证酶活性的重要条件之一。图 4所示为不同培养温度对菌株B1-1氧化S2O32-能力的影响。当培养温度为20 ℃时,在120 h内菌株B1-1几乎没有氧化S2O32-的能力;当培养温度在25-40 ℃之间时,菌株B1-1均表现一定的氧化能力,其中30 ℃时菌株氧化率最高,达86.4%,且延滞期最短,为36 h。
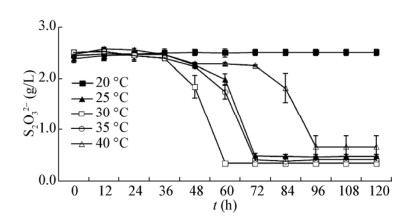
|
| 图 4 不同培养温度对菌株B1-1氧化S2O32-能力的影响 Figure 4 Influence of different temperature on the S2O32- oxidation ability of strain B1-1 |
|
|
林栋青等[18]的研究结果显示,Halothiobacillus sp. TX最适生长温度为30-35 ℃,超出这一温度范围,底物完全氧化所需的时间延长。参考《伯杰氏细菌鉴定手册》,Halothiobacillus hydrothermalis的最适温度为35-40 ℃。本研究结果与前者较为相似,菌株B1-1的适宜生长温度范围为25-35 ℃,温度高于或低于30 ℃均会延长延滞期,其中30 ℃最佳。这可能与菌株B1-1分离自海水网箱养殖区底部沉积物及长期适应较低的环境温度有关。
2.3.3 不同底物浓度对菌株B1-1氧化硫代硫酸盐的影响如图 5所示,底物浓度越低,菌株氧化越彻底;底物浓度高对菌株有一定的抑制作用,表现为延滞期延长。底物浓度为2.5、5.0 g/L时,菌株B1-1对S2O32-的氧化率分别为100%、81.4%,延滞期为36 h;底物浓度为7.5、10.0 g/L时,氧化率分别为53.1%、39.6%,延滞期为48 h。
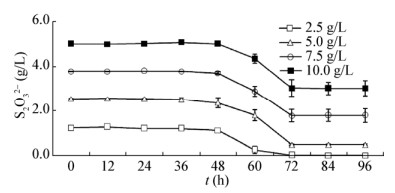
|
| 图 5 不同底物浓度对菌株B1-1氧化S2O32-能力的影响 Figure 5 Influence of different substrate concentration on the S2O32- oxidation ability of strain B1-1 |
|
|
可见,当底物浓度≤10.0 g/L时,底物浓度越高,对S2O32-的最终氧化率越低。一方面,底物过多,存在着相对于微生物需求的潜在过剩能源,同时培养液pH的下降又进一步抑制了S2O32-的氧化,因此底物不能完全被利用,最终氧化率低;另一方面,底物过少,虽然S2O32-可以被充分氧化,但不能有效满足微生物生长需求的能量。因此,适宜的底物浓度要求既可以满足菌株B1-1的生长需求,又可以最大程度地氧化底物。实验结果表明菌株B1-1适宜的底物浓度为5.0 g/L的Na2S2O3·5H2O,相当于20 mmol/L的S2O32-。
2.3.4 不同碳源对菌株B1-1氧化硫代硫酸盐的影响生理生化结果显示,菌株B1-1不能单独利用葡萄糖、乳糖、蔗糖等有机物进行异养生长。图 6所示为添加不同碳源对菌株B1-1氧化S2O32-能力的影响。外加葡萄糖、麦芽糖、蔗糖、淀粉的实验组,培养96 h后S2O32-的氧化率分别为86.4%、86.2%、84.6%、82.8%,对照组为85.7%。可见在基础培养基中添加不同碳源对菌株B1-1氧化S2O32-的影响并不显著,这是由于菌株B1-1是专性化能自养硫氧化微生物,额外添加一定的有机碳源并不能促进其生长及氧化S2O32-。有研究结果发现,某些硫氧化菌如那不勒斯硫杆菌[20]、T. tepidarius[21]是严格自养型微生物,外加有机碳源不仅会降低菌体生物量,还会减少单质硫的生成。因此确定菌株B1-1的最佳碳源为CO2,而且无需其他形式外加碳源辅助。
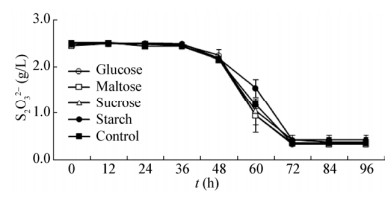
|
| 图 6 不同碳源对菌株B1-1氧化S2O32-能力的影响 Figure 6 Influence of different carbon source on the S2O32- oxidation ability of strain B1-1 |
|
|
图 7所示为添加不同氮源对菌株B1-1氧化S2O32-能力的影响。相比对照组,添加的氮源不同,延滞期长短不同。硫酸铵组和草酸铵组氧化率分别为83.6%、84.1%,延滞期均缩短至12 h;蛋白胨组氧化率为85.5%,延滞期为24 h;硝酸钠组和对照组氧化率分别为80.3%、85.7%,延滞期均为36 h。
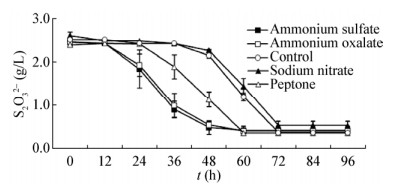
|
| 图 7 不同氮源对菌株B1-1氧化S2O32-能力的影响 Figure 7 Influence of different nitrogen source on the S2O32- oxidation ability of strain B1-1 |
|
|
由此可见,额外添加一定的氮源虽然对S2O32-的最终氧化率无显著影响,但可以有效缩短延滞期,这一方面可能和硫酸铵、草酸铵、蛋白胨中的氨根离子参与调节培养液的pH有关,另一方面可能铵盐是菌株B1-1生长的有效氮源,容易被菌体利用。综合众多学者的研究发现[21-22],无论是自养型或异养型硫氧化菌,添加一定浓度的氯化铵作为氮源可以有效促进菌株的生长。本实验结果表明,额外添加一定的铵盐(硫酸铵、草酸铵)可以缩短延滞期,提高氧化能力,具体添加何种铵盐及其最适添加浓度需要后续进一步的研究。
2.3.6 不同金属离子(Mg2+、Ca2+、K+)对菌株B1-1氧化硫代硫酸盐的影响预实验结果表明,在以NaCl+蒸馏水取代陈海水的基础培养基中,0-40 g/L的NaCl浓度范围内菌株B1-1均没有氧化硫代硫酸盐的能力。为探索陈海水中哪些离子可以协同Na+提高菌株B1-1氧化硫代硫酸盐的能力,设计了本组实验。如图 8所示,相比对照组(添加陈海水) 86.1%的氧化率,添加Mg2+的实验组中S2O32-氧化率最高,达100%;而添加Ca2+、K+的实验组中氧化率分别为4.5%、12.6%。可见,在以NaCl+蒸馏水取代陈海水的基础培养基中,添加一定的Mg2+可以促使菌株最大程度地氧化硫代硫酸盐,而Ca2+、K+对菌株氧化能力的影响甚微。
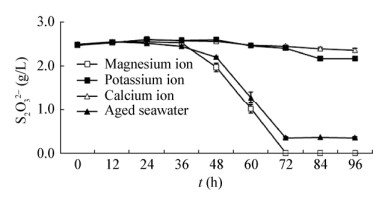
|
| 图 8 不同金属离子对菌株B1-1氧化S2O32-能力的影响 Figure 8 Influence of different metal ions on the S2O32- oxidation ability of strain B1-1 |
|
|
冯守帅等[21]的研究结果显示,添加一定浓度的Mg2+可以促进硫氧化菌的生长,而高浓度Mg2+会抑制菌株的生长。顾问杰等[23]的响应面分析结果表明,牛肉膏和镁离子的交互作用可以大幅提升耐高温假黄色单胞菌的硫氧化性能,硫酸根转化率由36.89%提高到80%以上。本研究结果显示,较高浓度的Mg2+可以显著提高菌株的氧化能力,氧化率达100%。推测Mg2+的添加有利于激活硫氧化菌细胞内的酶,进而提高氧化效率。另外,菌株B1-1分离自海洋环境,对Na+、Mg2+等离子的依赖性和耐受性更强,总体上具有较高的耐盐性。利用Na+和Mg2+相互协同作用,可以促进菌株生长并提高其氧化能力,至于Na+和Mg2+在培养基中的最佳浓度配比,仍需要后续进一步的研究。
3 讨论与结论(1) 本研究从网箱养殖沉积环境中筛选出一株具有较强氧化硫代硫酸盐能力的菌株B1-1,经16S rRNA基因序列同源性分析,结合其形态特征和生理特征,初步鉴定该菌为Halothiobacillus hydrothermalis。
(2) 对Halothiobacillus hydrothermalis B1-1氧化硫代硫酸盐的特性研究表明,菌株B1-1生物氧化的最适pH为8.0,最适生长温度为30 ℃,最适底物浓度为5.0 g/L;最适碳源为CO2,外加碳源对菌株氧化能力无显著影响,外加铵盐(硫酸铵或草酸铵)可以将生物氧化的延滞期缩短至12 h;在以NaCl+蒸馏水取代陈海水的基础培养基中,添加Mg2+可以显著提高菌株的氧化能力,S2O32-氧化率达100%,明显高于添加陈海水的对照组(86.1%)。相比已报道的硫氧化菌[11],Halothiobacillus hydrothermalis B1-1具有更高的硫氧化能力,在网箱养殖环境生物修复方面具有潜在的应用价值。
| [1] |
Peng PF, Hu CQ, Yu ZH, et al. Analysis of spatial-temporal variation and nutritional status of water environment in the Daueng cove[J]. Journal of Tropical Oceanography, 2012, 31(2): 110-117. (in Chinese) 彭鹏飞, 胡超群, 于宗赫, 等. 大鹏澳海水鱼类网箱养殖区水环境的时空变化及营养状态分析[J]. 热带海洋学报, 2012, 31(2): 110-117. DOI:10.3969/j.issn.1009-5470.2012.02.015 |
| [2] |
Wei XG, Wen YM, Wang WQ, et al. Environmental impact of cage culture on bottom water in Yaling bay[J]. Journal of Agro-Environmental Science, 2005, 24(2): 274-278. (in Chinese) 韦献革, 温琰茂, 王文强, 等. 哑铃湾网箱养殖对底层水环境的影响研究[J]. 农业环境科学学报, 2005, 24(2): 274-278. DOI:10.3321/j.issn:1672-2043.2005.02.015 |
| [3] |
Gan JL, Jia XP, Lin Q, et al. A primary study on the risk evaluation of aged cage culture areas[J]. Journal of Fishery Sciences of China, 2001, 8(3): 86-89. (in Chinese) 甘居利, 贾晓平, 林钦, 等. 海水网箱渔场老化风险初探[J]. 中国水产科学, 2001, 8(3): 86-89. DOI:10.3321/j.issn:1005-8737.2001.03.019 |
| [4] |
Zhang S, Yan L, Chen ZB. Geographical distribution of sulfur-oxidizing bacteria[J]. Journal of Heilongjiang Bayi Agricultural University, 2017, 29(2): 68-73. (in Chinese) 张爽, 晏磊, 陈志宝. 硫氧化菌的地域分布特征[J]. 黑龙江八一农垦大学学报, 2017, 29(2): 68-73. DOI:10.3969/j.issn.1002-2090.2017.02.014 |
| [5] |
Marchevsky N, Barroso Quiroga MM, Giaveno A, et al. Microbial oxidation of refractory gold sulfide concentrate by a native consortium[J]. Transactions of Nonferrous Metals Society of China, 2017, 27(5): 1143-1149. DOI:10.1016/S1003-6326(17)60133-X |
| [6] |
Liu YJ, Yang XP, Zhang DW, et al. Effect of pH, inoculation and coal burden on bio-desulfurization of coal by Acidithiobacillus ferrooxidans LX5[J]. Chinese Journal of Environmental Engineering, 2013, 7(2): 759-764. (in Chinese) 刘玉娇, 杨新萍, 张德伟, 等. pH、接种量及固形物含量对氧化亚铁硫杆菌LX5煤炭生物脱硫的影响[J]. 环境工程学报, 2013, 7(2): 759-764. |
| [7] |
Gu XY, Dou PC. Isolation and characterization of Altererythrobacter sp. DT for biotreatment of and sulfur production from thiosulfate-bearing industrial wastewater[J]. Water, Air, & Soil Pollution, 2017, 228: 28. |
| [8] |
Gu XL. Screening and identification of aerobic denitrifying bacteria in marine cage farm sediment and simulated application[D]. Guangzhou: Master's Thesis of Jinan University, 2010 (in Chinese) 古小莉. 海水网箱养殖场沉积物中好氧反硝化细菌的筛选鉴定及模拟应用[D]. 广州: 暨南大学硕士学位论文, 2010 |
| [9] |
Ravichandra P, Gopal M, Annapurna J. Biological sulfide oxidation using autotrophic Thiobacillus sp.: evaluation of different immobilization methods and bioreactors[J]. Journal of Applied Microbiology, 2009, 106(4): 1280-1291. DOI:10.1111/jam.2009.106.issue-4 |
| [10] |
Chen XH, Chen YF, Zheng HD, et al. Isolation, identification and characteristics of a sulfide-oxidizing bacterium in sediment of marine cage culture area[J]. Journal of Fisheries Research, 2016, 38(6): 431-436. (in Chinese) 陈小红, 陈宇锋, 郑惠东, 等. 网箱养殖沉积环境中硫氧化菌的分离鉴定及生长特性[J]. 渔业研究, 2016, 38(6): 431-436. |
| [11] |
Meng X. Screening and identification of bacteria for organic pollutant degradation and sulfuroxidation in sediment in marine cage fish farming area[D]. Shanghai: Master's Thesis of Shanghai Ocean University, 2010 (in Chinese) 孟霞. 网箱养殖沉积物中有机物降解细菌与硫氧化细菌的筛选及鉴定[D]. 上海: 上海海洋大学硕士学位论文, 2010 |
| [12] |
Dong XZ, Cai MY. Common Bacterial Identification System Manual[M]. Beijing: Science Press, 2001: 353-356. (in Chinese) 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001: 353-356. |
| [13] |
Xu HX, Jiang LJ, Li SN, et al. Diversity of culturable sulfur-oxidizing bacteria in deep-sea hydrothermal vent environments of the South Atlantic[J]. Acta Microbiologica Sinica, 2016, 56(1): 88-100. (in Chinese) 徐鈜绣, 姜丽晶, 李少能, 等. 南大西洋深海热液区可培养硫氧化微生物多样性及其硫氧化特性[J]. 微生物学报, 2016, 56(1): 88-100. |
| [14] |
Chen JC, Feng SS, Gao K, et al. Isolation, identification and biodesufurization performance research of salt-tolerant sulfur oxidizing bacteria[J]. Microbiology China, 2015, 42(9): 1651-1661. (in Chinese) 陈金才, 冯守帅, 高凯, 等. 耐盐硫氧化菌的筛选、鉴定及脱硫性能研究[J]. 微生物学通报, 2015, 42(9): 1651-1661. |
| [15] |
Wei FS. Water and Wastewater Monitoring Analysis Method[M]. 4th ed. Beijing: China Environmental Science Press, 2002: 133-135. (in Chinese) 魏复盛. 水和废水监测分析方法[M]. 第4版. 北京: 中国环境科学出版社, 2002: 133-135. |
| [16] |
Kelly DP, Wood AP. Reclassification of some species of Thiobacillus to the newly designated genera Acidithiobacillus gen. nov., Halothiobacillus gen. nov. and Thermithiobacillus gen. nov.[J]. International Journal of Systematic and Evolutionary Microbiology, 2000, 50(2): 511-516. DOI:10.1099/00207713-50-2-511 |
| [17] |
Brenner DJ, Krieg NR, Staley JR. Bergey's Manual® of Systematic Bacteriology. Vol 2: The Proteobacteria, Part B[M]. 2nd ed. New York: Springer, 2005.
|
| [18] |
Lin DQ, Zhang YK, Gu XY. Isolation, identification and characterization of thiosulfate-oxidizing bacterium TX[J]. Microbiology China, 2009, 36(11): 1638-1644. (in Chinese) 林栋青, 张彦科, 顾向阳. 硫代硫酸盐氧化菌TX的分离、鉴定及其生物学特性[J]. 微生物学通报, 2009, 36(11): 1638-1644. |
| [19] |
Wang T. The study of bio-oxidizing sulfide into elemental sulfur[D]. Wuxi: Master's Thesis of Jiangnan University, 2008 (in Chinese) 王庭. 硫化物生物氧化为单质硫的研究[D]. 无锡: 江南大学硕士学位论文, 2008 |
| [20] |
Wang AJ, Liu CS, Han HJ, et al. Modeling denitrifying sulfide removal process using artificial neural networks[J]. Journal of Hazardous Materials, 2009, 168(2/3): 1274-1279. |
| [21] |
Feng SS, Ji YH, Yang HL. Optimization of restrictive factors during process of removing sulfide into elemental sulfur by sulfur oxidizer[J]. Microbiology China, 2016, 43(1): 36-43. (in Chinese) 冯守帅, 计云鹤, 杨海麟. 硫氧化菌种脱除硫化物生成单质硫限制性因素优化[J]. 微生物学通报, 2016, 43(1): 36-43. |
| [22] |
Wang HX. Isolation, identification, degradation characteristics and immobilization of sulfide-oxidizing bacteria[D]. Hangzhou: Master's Thesis of Zhejiang University of Technology, 2011 (in Chinese) 王惠祥. 硫氧化菌的分离鉴定、降解特性及其固定化研究[D]. 杭州: 浙江工业大学硕士学位论文, 2011 |
| [23] |
Gu WJ, Zhao DM, Lu YS, et al. Optimization of oxidation by a thermotolerant Pseudoxanthomonas through response surface methodology[J]. Microbiology China, 2017, 44(4): 991-998. (in Chinese) 顾文杰, 赵冬梅, 卢钰升, 等. 响应面分析法优化耐高温假黄色单胞菌硫氧化性能[J]. 微生物学通报, 2017, 44(4): 991-998. |
 2018, Vol. 45
2018, Vol. 45




