扩展功能
文章信息
- 白飞荣, 姚粟, 凌空, 程池
- BAI Fei-Rong, YAO Su, LING Kong, CHENG Chi
- 黄曲霉和米曲霉的多相鉴定方法
- The polyphasic taxonomy for distinguishing Aspergillus flavus and A. oryzae
- 微生物学通报, 2018, 45(1): 215-226
- Microbiology China, 2018, 45(1): 215-226
- DOI: 10.13344/j.microbiol.china.170025
-
文章历史
- 收稿日期: 2017-01-09
- 接受日期: 2017-09-15
- 优先数字出版日期(www.cnki.net): 2017-10-23
黄曲霉(Aspergillus flavus Link et al.,1809)容易污染农产品,可产生强致癌、致畸的黄曲霉毒素;米曲霉(Aspergillus oryzae Cohn et al.,1884)可产生多种酶类,广泛应用于食品、饲料、酿酒等发酵工业,是具有上千年安全应用历史的生产菌种[1]。二者均与生产和生活紧密相关。
Christensen提出米曲霉是野生黄曲霉种的驯化种[2],Chang等认为米曲霉是黄曲霉的形态学变种[3],二者同属于曲霉属黄绿组,形态相近、基因组高度相似[2-4],传统的分类鉴定方法较难区分二者,很容易出现假阴性或假阳性结果,因此对生产应用的菌种进行准确鉴定至关重要。
目前的研究发现黄曲霉(A. flavus)、寄生曲霉(A. parasiticus)、集蜂曲霉(A. nomius)、A. pseudotamarii、A. bombycis、A. toxicarius、A. parvisclerotigenus、A. minisclerotigenes、A. arachidicola、A. pseudonomius、A. pseudocaelatus等11种曲霉属黄绿组的真菌可产生黄曲霉毒素[5],准确鉴别这些菌种对实际生产及人类健康至关重要。本研究以包括模式菌株在内的22株标准菌株为研究对象,旨在建立一种准确鉴定黄曲霉和米曲霉的多相分类方法。
1 材料与方法 1.1 菌株共22株,其中2株模式菌株(米曲霉CBS10025,黄曲霉CBS10027)购自于荷兰皇家文理学院真菌多样性研究中心(CBS-KNAW);20株标准菌株选取自中国工业微生物菌种保藏中心(CICC),具体编号和学名见表 1。
| 编号 No. | CICC保藏号 Preservation No. | 菌种学名 Scientific name | ITS序列登录号 ITS GenBank accession No. | Β-tubulin序列登录号 BenA GenBank accession No. |
| 1 | CICC 2014 | 米曲霉Aspergillus oryzae | KX462757 | KX462736 |
| 2 | CICC 2022 | 米曲霉Aspergillus oryzae | KX462758 | KX462737 |
| 3 | CICC 2102 | 米曲霉Aspergillus oryzae | KX462759 | KX462738 |
| 4 | CICC 2024 | 黄曲霉Aspergillus flavus | KX462760 | KX462739 |
| 5 | CICC 2195 | 米曲霉Aspergillus oryzae | KX462761 | KX462740 |
| 6 | CICC 2066 | 黄曲霉Aspergillus flavus | KX462762 | KX462741 |
| 7 | CICC 2071 | 黄曲霉Aspergillus flavus | KX462763 | KX462742 |
| 8 | CICC 2074 | 米曲霉Aspergillus oryzae | KX462764 | KX462743 |
| 9 | CICC 2079 | 米曲霉Aspergillus oryzae | KX462765 | KX462744 |
| 10 | CICC 2120 | 黄曲霉Aspergillus flavus | KX462766 | KX462745 |
| 11 | CICC 2385 | 黄曲霉Aspergillus flavus | KX462767 | KX462746 |
| 12 | CICC 2402 | 黄曲霉Aspergillus flavus | KX462768 | KX462747 |
| 13 | CICC 2412 | 黄曲霉Aspergillus flavus | KX462769 | KX462748 |
| 14 | CICC 40015 | 黄曲霉Aspergillus flavus | KX462770 | KX462749 |
| 15 | CICC 40083 | 黄曲霉Aspergillus flavus | KX462771 | KX462750 |
| 16 | CICC 40183 | 黄曲霉Aspergillus flavus | KX462772 | KX462751 |
| 17 | CICC 40186 | 黄曲霉Aspergillus flavus | KX462773 | KX462752 |
| 18 | CICC 40188 | 黄曲霉Aspergillus flavus | KX462774 | KX462753 |
| 19 | CICC 40866 | 黄曲霉Aspergillus flavus | KX462776 | KX462755 |
| 20 | CICC 41205 | 黄曲霉Aspergillus flavus | KX462777 | KX462756 |
| 21 | CBS 100925T | 米曲霉Aspergillus oryzae | MF324888 | MF324894 |
| 22 | CBS 100927T | 黄曲霉Aspergillus flavus | MF324887 | MF324893 |
| 注:T:模式菌株. Note: T: the type strain. | ||||
察氏酵母膏琼脂培养基CYA (g/L):NaNO3 3.0,K2HPO4 1.0,KCl 0.5,MgSO4·7H2O 0.5,FeSO4·7H2O 0.01,酵母膏5.0,蔗糖30.0,琼脂15.0。
产毒培养基AFPA (g/L):蛋白胨10.0,酵母粉20.0,柠檬酸铁0.5,四氯醌0.002,氯霉素15.0,琼脂15.0。
1.3 主要试剂和仪器真菌基因组DNA提取试剂盒购自OMEGA Bio-Tek公司;GoldView购自北京赛百盛基因技术有限公司;溶菌酶购自美国Sigma-Aldrich公司;蛋白酶购自默克化工技术(上海)有限公司;Taq DNA聚合酶、dNTPs、Marker购自天根生化科技有限公司;黄曲霉毒素总量(Aflatoxin total) ELISA检测试剂盒购自普瑞邦(Pribo)北京科技有限公司。光学显微镜,尼康公司。
1.4 方法 1.4.1 传统形态学鉴定方法将试验菌株三点接种于CYA培养基上,25 ℃培养7-15 d,观察菌落培养特征并记录;CYA培养基上25 ℃培养3-5 d,利用光学显微镜进行显微形态的观察。
根据菌落颜色的变化区分黄曲霉和米曲霉(产孢结构持久黄绿色或深绿色为黄曲霉;产孢结构初始为绿色,老后为淡褐色或深褐色为米曲霉[6])。通过产孢结构的差异进行区分二者(黄曲霉特征:孢梗茎壁厚、长度通常小于1 000 μm,分生孢子球形或近球形,壁具明显小刺,直径3.5 μm-4.5 μm,产孢结构单层或双层,小顶囊上一般为单层,罕见同一顶囊上单层和双层同时存在;米曲霉特征:孢梗茎壁薄、很长,通常大于2 500 μm,分生孢子近球形或椭圆形,壁平滑或稍粗糙,长轴直径4.5 μm-8.0 μm,产孢结构单层或双层,同一顶囊上单层和双层可能同时存在[7-10])。
1.4.2 产毒培养基(AFPA)检测方法将试验菌株三点接种于AFPA固体培养基上,30 ℃培养2-3 d,观察AFPA培养基上的培养特征并记录。产毒的黄曲霉在AFPA培养基上,菌落反面呈明显橙黄色(Bright orange yellow),区别于米曲霉的黄褐色或浅黄色[11]。
1.4.3 酶联免疫毒素测定方法将试验菌株在CYA培养基培养7 d,利用无菌解剖刀在菌落四周和中心切5块约5 mm×5 mm的菌落小块,置于1.5 mL灭菌离心管中,加600 μL甲醇-二氯甲烷-乙酸乙酯(1:2:3,体积比),再加60 μL甲酸,利用超声提取60 min,提取完成后转移提取液至新的离心管中,12 000×g离心5 min,真空旋转仪旋干液体,收集毒素沉淀物进行后续试验[12]。
采用竞争酶联免疫方法,在微孔板上预包被黄曲霉毒素抗原,加入样本(或黄曲霉毒素标准品溶液)以及辣根过氧化物酶标记的黄曲霉毒素抗体。样本或标准品溶液中的黄曲霉毒素与预包被在板孔上的黄曲霉毒素抗原竞争结合辣根过氧化物酶标记的黄曲霉毒素抗体。与样本或标准品溶液中的黄曲霉毒素结合的酶标抗体在洗涤时被除去。再加入显色液,读取吸光值。样本的吸光值与其所含残留物黄曲霉毒素抗原的含量成负相关。对照标准曲线即可得出相应残留物黄曲霉毒素的含量。试验设置双孔重复对照。
1.4.4 基于ITS rDNA、β-Tubulin (BenA)基因序列分析的系统发育方法利用真菌基因组DNA提取试剂盒提取试验菌株的基因组DNA,具体步骤参见试剂盒说明书。利用引物ITS5 (5′-GGAAGTAAAAGTCGTAACAA GG-3′)和ITS4 (5′-TCCTCCGCTTATTGATATGC-3′)扩增ITS rDNA序列;引物Bt2a (5′-GGTAACCAAA TCGGTGCTGCTTTC-3′)和Bt2b (5′-ACCCTCAGTG TAGTGACCCTTGGC-3′)扩增β-tubulin基因[5]。PCR反应体系:10×PCR Buffer 5 μL,dNTPs (2.5 mmol/L) 4 μL,模板2 μL,Taq DNA聚合酶(2.5 U/μL) 1 μL,正、反向引物(10 μmol/L)各1 μL,补充去离子水至50 μL。PCR反应条件:94 ℃ 5 min;94 ℃ 50 s,55 ℃ 50 s,72 ℃ 50 s,33个循环;72 ℃ 7 min[13]。PCR产物送北京诺赛进行测序,并将测序序列上传至NCBI数据库,序列登录号见表 1。
将测序结果在GenBank数据库中进行比对分析,以确定其与已知序列的同源关系。确定并下载各菌株的有效序列后,采用ClustalX 1.83进行多序列比对[14],再用MEGA 5.0进行邻接法(Neighbor-Joining)聚类系统发育及分子进化分析1 000次(Bootstrap value)重复自检分析[15]。
1.4.5 产毒基因检测方法黄曲霉毒素合成基因簇包含25个基因,长度大约为70 kb[16]。米曲霉菌株部分不含有产毒基因;部分含有产毒基因,但基因发生突变、缺失或碱基替换,不能正常表达。黄曲霉菌株含有产毒基因,大部分正常表达,产黄曲霉毒素;部分菌株因产毒基因发生突变,不能正常表达产生黄曲霉毒素[3]。
选取3个黄曲霉毒素合成的关键基因进行PCR扩增检测,三者在黄曲霉毒素合成通路中缺一不可,包括调控基因af1R、柄曲霉素转甲氧基酶基因aflO、杂色曲霉素A脱氢酶基因aflM,扩增引物详见Gallo等[17]。扩增β-tubulin基因序列作为基因组和PCR条件的阳性对照,根据上述3个产毒基因的扩增结果,判断该菌株是否产黄曲霉毒素,扩增结果为阴性证明该菌株不产毒;若扩增结果为阳性,需进一步证明该菌株是否产毒[17-19]。
2 结果与分析 2.1 形态学方法鉴定结果菌株在CYA培养基上生长的菌落颜色及产孢结构见图 1,形态学描述见表 2,形态学鉴定结果见表 3。模式菌株CBS 100925具有孢梗茎长、产孢结构少等米曲霉典型的形态特征,模式菌株CBS 100927具有孢梗茎较短、产孢结构多、持久黄绿色、产生菌核等黄曲霉典型的形态特征。标准菌株CICC 2024、2066、2120、40866、41205均为黄曲霉,但形态学观察符合米曲霉特征,鉴定结果出现5个假阴性。

|
| 图 1 菌株形态学和AFPA培养特征 Figure 1 The characteristics of morphological and AFPA 注:图片上的数字1-22代表菌株编号(表 1).图片从左到右依次为:CYA培养基上25 ℃培养7 d的菌落宏观形态;CYA培养基上25 ℃培养7 d的菌落反面照片;CYA培养基上25 ℃培养3-5 d的显微产孢结构;AFPA培养基上30 ℃培养2-3 d的菌落反面颜色. Note: The number 1 to 22 in the picture represents the number of the strain (Table 1). From left to right: Colonies in 7 days at 25 ℃ on CYA; Reverse of colonies in 7 days at 25 ℃ on CYA; Microscopic characteristics in 3-5 days at 25 ℃ on CYA; Reverse colour in 2-3 days at 30 ℃ on AFPA. |
|
|
| 保藏编号 Preservation No. | 宏观形态 Macroscopic characteristics (CYA, 25 ℃, 7 d) | 微观形态(产孢结构) Microscopic characteristics (sporogenous structure) | AFPA上菌落反面颜色 Reverse colour of clones (AFPA) |
| CICC 2014 | 菌落白色,直径61 mm-64 mm,质地丝绒状,表面平坦,无渗出液和可溶性色素产生,反面浅黄色 | 孢梗茎壁稍粗糙,(1 000-3 000) μm×(2.0-6.0) μm;分生孢子头辐射状,直径为15 μm-30 μm;顶囊柱状或退化,直径4.0 μm-15.0 μm,表面部分可育;产孢结构单层,瓶梗(4.0-11.0) μm×(2.3-3.5) μm;分生孢子近球形或椭圆形,长轴直径为3.0 μm-6.0 μm,壁稍粗糙 | 黄褐色 |
| CICC 2022 | 菌落黄绿色,直径53 mm-55 mm,质地丝绒状,表面具放射状皱纹,无渗出液和可溶性色素产生,反面浅黄色 | 孢梗茎壁稍粗糙,(2 000-4 000) μm×(7.0-18.0) μm;分生孢子头辐射状,直径为30 μm-110 μm;顶囊球形或烧瓶形,直径16 μm-35 μm,表面全部可育或3/4可育;产孢结构双层或单层,梗基(4.0-8.0) μm×(2.5-3.8) μm,瓶梗(4.0-12.0) μm×2.8-3.8 μm;分生孢子近球形或椭圆形,长轴直径为4.0 μm-5.0 μm,壁粗糙 | 黄褐色 |
| CICC 2102 | 菌落黄褐色,直径66 mm-69 mm,质地丝绒状,表面具放射状皱纹,无渗出液和可溶性色素产生,反面黄褐色 | 孢梗茎壁稍粗糙,(1 500-3 000) μm×(7.0-11.0) μm;分生孢子头辐射状,直径为45 μm-100 μm;顶囊球形或烧瓶形,直径13 μm-35 μm,表面全部可育或3/4可育;产孢结构双层或单层,梗基(4.0-9.0) μm×(2.5-3.8) μm,瓶梗(5.0-11.0) μm×(2.8-3.5) μm;分生孢子近球形或椭圆形,长轴直径为4.0 μm-6.0 μm,壁粗糙 | 黄褐色 |
| CICC 2024 | 菌落黄绿色,直径53 mm-55 mm,质地丝绒状,中央凸起,无渗出液和可溶性色素产生,反面黄色 | 孢梗茎壁稍粗糙,(1 500-3 500) μm×(8.0-13.0) μm;分生孢子头辐射状,直径为45 μm-80 μm;顶囊球形或烧瓶形,直径25 μm-45 μm,表面全部可育或3/4可育;产孢结构主要为单层,瓶梗(4.0-13.0) μm×(2.5-3.5) μm;分生孢子近球形,直径为4.0 μm-5.0 μm,壁粗糙 | 周围黄色,中央橙黄色 |
| CICC 2195 | 菌落黄绿色,直径61 mm-64 mm,质地丝绒状,表面具放射状皱纹,产生少量褐色渗出液,无可溶性色素产生,反面黄色 | 孢梗茎壁稍粗糙,(2 000-4 000) μm×(6.0-15.0) μm;分生孢子头辐射状,直径为35 μm-80 μm;顶囊球形或烧瓶形,直径15 μm-45 μm,表面3/4可育;产孢结构双层或单层,梗基(6.0-9.0) μm× (2.8-4.0) μm,瓶梗(6.0-17.0) μm×(2.8-4.0) μm;分生孢子近球形或椭圆形,长轴直径为4.0 μm-6.5 μm,壁粗糙 | 黄褐色 |
| CICC 2066 | 菌落黄绿色,直径61 mm-64 mm,质地丝绒状,表面平坦,无渗出液和可溶性色素产生,反面浅黄色 | 孢梗茎壁粗糙,(2 000-5 000) μm×(8.0-14.0) μm;分生孢子头辐射状,直径为30 μm-80 μm;顶囊球形或烧瓶形,直径14 μm-30 μm,表面全部可育或3/4可育;产孢结构双层或单层,梗基(4.0-8.0) μm×(2.5-3.8) μm,瓶梗(4.0-11.0) μm×(2.8-3.8) μm;分生孢子椭圆形,长轴直径为4.0 μm-6.0 μm,壁粗糙 | 周围黄色,中央橙黄色 |
| CICC 2071 | 菌落黄绿色,直径64 mm-67 mm,质地丝绒状,表面平坦,无渗出液和可溶性色素产生,反面浅黄色 | 孢梗茎壁粗糙,(500-1 500) μm×(5.0-15.0) μm;分生孢子头辐射状,直径为30 μm-110 μm;顶囊球形或烧瓶形,直径17 μm-35 μm,表面全部可育或3/4可育;产孢结构双层或单层,梗基(4.0-8.0) μm×(2.5-3.5) μm,瓶梗(5.0-10.0) μm×(2.5-3.8) μm;分生孢子近球形或椭圆形,长轴直径为4.0 μm-5.0 μm,壁粗糙 | 橙黄色 |
| CICC 2074 | 菌落淡黄色,直径51 mm-55 mm,质地丝绒状,表面平坦,无渗出液和可溶性色素产生,反面橄榄黄色 | 孢梗茎壁稍粗糙,(1 500-3 000) μm×(8.0-12.0) μm;分生孢子头辐射状,直径为40 μm-80 μm;顶囊球形或烧瓶形,直径20 μm-35 μm,表面3/4可育;产孢结构双层或单层,梗基(4.0-7.0) μm×(2.5-3.5) μm,瓶梗(5.0-13) μm×(2.5-3.8) μm;分生孢子近球形或椭圆形,长轴直径为3.0 μm-6.0 μm,壁粗糙 | 黄褐色 |
| CICC 2079 | 菌落浅黄褐色,直径57 mm-62 mm,质地丝绒状,表面平坦,无渗出液和可溶性色素产生,反面浅黄色 | 孢梗茎壁平滑或稍粗糙,(2 000-4 000) μm×(8.0-19.0) μm;分生孢子头辐射状,直径为45 μm-125 μm;顶囊球形或烧瓶形,直径20 μm-40 μm,表面全部可育或3/4可育;产孢结构单层,瓶梗(7.0-12.0) μm×(3.0-4.0) μm;分生孢子近球形,长轴直径为4.0 μm-6.0 μm,壁粗糙 | 黄褐色 |
| CICC 2120 | 菌落黄绿色,直径68 mm-72 mm,质地丝绒状,表面有放射状皱纹,无渗出液和可溶性色素产生,反面黄色 | 孢梗茎壁粗糙,(1 000-2 800) μm×(8.0-14.0) μm;分生孢子头辐射状,直径为40 μm-100 μm;顶囊球形或烧瓶形,直径20 μm-40 μm,表面全部可育或3/4可育;产孢结构双层或单层,梗基(4.0-8.0) μm×(2.5-4.8) μm,瓶梗(8.0-25.0) μm×(3.0-4.0) μm;分生孢子近球形或椭圆形,长轴直径为4.0 μm-5.0 μm,壁粗糙 | 橙黄色 |
| CICC 2385 | 菌落黄绿色,直径62 mm-65 mm,质地丝绒状,表面具放射状皱纹,无渗出液和可溶性色素产生,反面浅黄色 | 孢梗茎壁粗糙,(2 000-4 000) μm×(8.0-11.0) μm;分生孢子头辐射状,直径为40 μm-75 μm;顶囊球形或烧瓶形,直径15 μm-30 μm,表面全部可育或3/4可育;产孢结构双层或单层,梗基(4.1-7.9) μm×(2.5-3.5) μm,瓶梗(5.0-9.0) μm×(2.5-3.5) μm;分生孢子近球形或椭圆形,长轴直径为3.0 μm-4.0 μm,壁粗糙 | 橙黄色 |
| CICC 2402 | 菌落深黄绿色,直径70 mm-75 mm,质地丝绒状,表面平坦,无渗出液和可溶性色素产生,反面浅黄色 | 孢梗茎壁粗糙,(400-1 500) μm×(5.0-11.0) μm;分生孢子头辐射状,直径为35 μm-75 μm;顶囊球形或烧瓶形,直径15 μm-30 μm,表面全部可育或3/4可育;产孢结构双层或单层,梗基(4.0-8.0) μm×(2.8-3.8) μm,瓶梗(5.0-9.0) μm×(2.5-3.5) μm;分生孢子近球形或椭圆形,长轴直径为3.0 μm-5.0 μm,壁粗糙 | 橙黄色 |
| CICC 2412 | 菌落黄绿色,直径70 mm-73 mm,质地丝绒状,表面具放射状皱纹,无渗出液和可溶性色素产生,反面浅黄色 | 孢梗茎壁粗糙,(500-1 500) μm×(6.0-12.0) μm;分生孢子头辐射状,直径为40 μm-85 μm;顶囊球形或烧瓶形,直径20 μm-48 μm,表面全部可育或3/4可育;产孢结构双层或单层,梗基(4.2-8.1) μm×(2.5-3.5) μm,瓶梗(5.0-11.0) μm×(2.5-3.8) μm;分生孢子近球形或椭圆形,长轴直径为3.0 μm-4.0 μm,壁粗糙 | 亮橙黄色 |
| CICC 40015 | 菌落黄绿色,直径74 mm-76 mm,质地丝绒状,表面有凸起的白色菌丝团,无渗出液和可溶性色素产生,反面浅黄色 | 孢梗茎壁粗糙,(400-1 300) μm×(6.0-9.0) μm;分生孢子头辐射状,直径为38 μm-90 μm;顶囊球形或烧瓶形,直径13 μm-30 μm,表面全部可育或3/4可育;产孢结构双层或单层,梗基(4.0-8.0) μm×(2.5-3.5) μm,瓶梗(5.0-15.0) μm×(2.0-3.3) μm;分生孢子近球形或椭圆形,长轴直径为3.0 μm-5.0 μm,壁粗糙 | 黄褐色 |
| CICC 40083 | 菌落黄绿色,直径70 mm-75 mm,产生少量白色菌核,质地丝绒状,表面据放射状皱纹,无渗出液和可溶性色素产生,反面浅黄褐色 | 孢梗茎壁粗糙,(1 800-3 500) μm×(8.0-14.0) μm;分生孢子头辐射状,直径为45 μm-110 μm;顶囊球形或烧瓶形,直径20 μm-38 μm,表面全部可育或3/4可育;产孢结构双层或单层,梗基(4.0-8.0) μm×(2.5-3.5) μm,瓶梗(5.0-14.0) μm×(2.5-3.5) μm;分生孢子近球形或椭圆形,长轴直径为3.0 μm-4.0 μm,壁粗糙 | 亮橙黄色 |
| CICC 40183 | 菌落黄绿色,直径70 mm-73 mm,质地丝绒状,表面具放射状皱纹,无渗出液和可溶性色素产生,反面浅黄色 | 孢梗茎壁平滑或稍粗糙,(1 000-2 500) μm×(5.0-15.0) μm;分生孢子头辐射状,直径为40 μm-110 μm;顶囊球形或烧瓶形,直径20 μm-40 μm,表面全部可育或3/4可育;产孢结构双层或单层,梗基(4.0-8.0) μm×(2.5-3.5) μm,瓶梗(5.0-15.0) μm×(2.5-3.8) μm;分生孢子近球形或椭圆形,长轴直径为3.0 μm-5.0 μm,壁稍粗糙 | 亮橙黄色 |
| CICC 40186 | 菌落黄绿色,直径75 mm-78 mm,质地丝绒状,表面平坦、中央产生褐色菌核,无渗出液和可溶性色素产生,反面浅棕色 | 孢梗茎壁粗糙,(150-500) μm×(4.5-10.0) μm;分生孢子头辐射状,直径为40 μm-70 μm;顶囊球形或烧瓶形,直径11 μm-30 μm,表面全部可育或3/4可育;产孢结构双层或单层,梗基(4.0-8.0) μm×(2.5-3.5) μm,瓶梗(4.0-9.0) μm×(2.8-3.8) μm;分生孢子近球形或椭圆形,长轴直径为3.0 μm-4.8 μm,壁粗糙 | 橙黄色 |
| CICC 40188 | 菌落深黄绿色,直径70 mm-73 mm,质地丝绒状,表面具放射状皱纹,无渗出液和可溶性色素产生,反面棕黄色 | 孢梗茎壁粗糙,(200-800) μm×(10-18) μm;分生孢子头辐射状,直径为40 μm-90 μm;顶囊近球形,直径15 μm-45 μm,表面全部可育或3/4可育;产孢结构双层或单层,梗基(5.0-13.0) μm×(2.8-4.0) μm,瓶梗(6.0-11.0) μm×(2.8-4.0) μm;分生孢子椭圆形,长轴直径为4.0 μm-5.0 μm,壁粗糙 | 橙黄色 |
| CICC 40866 | 菌落浅黄绿色,直径73 mm-75 mm,质地丝绒状,表面平坦,无渗出液和可溶性色素产生,反面黄色 | 孢梗茎壁粗糙,(2 000-4 000) μm×(9.5-17.0) μm;分生孢子头辐射状,直径为50 μm-100 μm;顶囊球形或烧瓶形,直径18 μm-40 μm,表面全部可育或3/4可育;产孢结构大多为双层,梗基(4.0-9.0) μm×(2.5-3.5) μm,瓶梗(4.0-14.0) μm×(2.8-3.0) μm;分生孢子椭圆形,长轴直径3.0 μm-4.0 μm,壁粗糙 | 亮橙黄色 |
| CICC 41205 | 菌落橄榄黄色,直径75 mm-77 mm,质地丝绒状,表面平坦,无渗出液和可溶性色素产生,反面黄色 | 孢梗茎壁稍粗糙,(2 500-4 500) μm×(6.0-13.0) μm;分生孢子头辐射状,直径为40 μm-80 μm;顶囊球形或烧瓶形,直径20 μm-40 μm,表面全部可育或3/4可育;产孢结构双层或单层,梗基(4.0-8.0) μm×(2.5-3.5) μm,瓶梗(4.0-11.0) μm×(2.8-3.0) μm;分生孢子近球形,长轴直径2.5 μm-4.0 μm,壁粗糙 | 亮橙黄色 |
| CBS100925 | 菌落浅黄色,产孢结构少,直径75 mm-80 mm,质地丝绒状,表面平坦,无渗出液和可溶性色素产生,反面浅黄色 | 孢梗茎壁平滑或稍粗糙,(2 000-5 500) μm×(5.0-20.0) μm;分生孢子头辐射状,直径为22 μm-65 μm;顶囊球形或烧瓶形,直径13 μm-35 μm,表面1/2或3/4可育;产孢结构双层或单层,梗基(5.0-10) μm×(4.0-6.0) μm,瓶梗(5.0-13.0) μm×(3.5-5.0) μm;分生孢子近球形或椭圆形,长轴直径3.0 μm-5.5 μm,壁稍粗糙 | 浅黄色 |
| CBS100927 | 菌落黄绿色,产孢结构多,直径66 mm-69 mm,质地丝绒状,表面具放射状皱纹,产生大量灰白色的致密菌核,产生大量浅褐色渗出液,无可溶性色素产生,反面浅棕色 | 孢梗茎壁平滑或稍粗糙,(500-1 300) μm×(4.0-15.0) μm;分生孢子头辐射状,直径为40 μm-80 μm;顶囊球形或烧瓶形,直径20 μm-40 μm,表面全部可育或3/4可育;产孢结构双层或单层,梗基(4.0-8.0) μm×(2.5-3.5) μm,瓶梗(4.0-11.0) μm×(2.8-3.0) μm;分生孢子近球形,长轴直径2.5 μm-4.0 μm,壁粗糙 | 亮橙黄色 |
| 编号 No. | CICC保藏号 CICC Preservation number | 标准菌株学名 Science name | 分子系统发育结果 Results of phylogenetic | 形态学鉴定结果 Results of Morphological | 产毒基因扩增结果 Results of toxigenic gene | AFPA培养基检测结果 Results of AFPA | 酶联免疫毒素测定结果 Results of toxin determination |
| 1 | CICC 2014 | 米曲霉 | 米曲霉或黄曲霉 | 米曲霉 | 阴性 | 阴性 | 未产 |
| 2 | CICC 2022 | 米曲霉 | 米曲霉或黄曲霉 | 米曲霉 | 阴性 | 阴性 | 未产 |
| 3 | CICC 2102 | 米曲霉 | 米曲霉或黄曲霉 | 米曲霉 | 阴性 | 阴性 | 未产 |
| 4 | CICC 2024 | 黄曲霉 | 米曲霉或黄曲霉 | 米曲霉 | 阳性 | 不明显 | 产毒 |
| 5 | CICC 2195 | 米曲霉 | 米曲霉或黄曲霉 | 米曲霉 | 阳性 | 阴性 | 未产 |
| 6 | CICC 2066 | 黄曲霉 | 米曲霉或黄曲霉 | 米曲霉 | 阳性 | 不明显 | 产毒 |
| 7 | CICC 2071 | 黄曲霉 | 米曲霉或黄曲霉 | 黄曲霉 | 阳性 | 阳性 | 产毒 |
| 8 | CICC 2074 | 米曲霉 | 米曲霉或黄曲霉 | 米曲霉 | 阳性 | 阴性 | 未产 |
| 9 | CICC 2079 | 米曲霉 | 米曲霉或黄曲霉 | 米曲霉 | 阳性 | 阴性 | 未产 |
| 10 | CICC 2120 | 黄曲霉 | 米曲霉或黄曲霉 | 米曲霉 | 阳性 | 阳性 | 产毒 |
| 11 | CICC 2385 | 黄曲霉 | 米曲霉或黄曲霉 | 黄曲霉 | 阳性 | 阳性 | 产毒 |
| 12 | CICC 2402 | 黄曲霉 | 米曲霉或黄曲霉 | 黄曲霉 | 阳性 | 阳性 | 产毒 |
| 13 | CICC 2412 | 黄曲霉 | 米曲霉或黄曲霉 | 黄曲霉 | 阳性 | 阳性 | 产毒 |
| 14 | CICC 40015 | 黄曲霉 | 米曲霉或黄曲霉 | 黄曲霉 | 阳性 | 阴性 | 未产 |
| 15 | CICC 40083 | 黄曲霉 | 米曲霉或黄曲霉 | 黄曲霉 | 阳性 | 阳性 | 产毒 |
| 16 | CICC 40183 | 黄曲霉 | 米曲霉或黄曲霉 | 黄曲霉 | 阳性 | 阳性 | 产毒 |
| 17 | CICC 40186 | 黄曲霉 | 米曲霉或黄曲霉 | 黄曲霉 | 阳性 | 阳性 | 产毒 |
| 18 | CICC 40188 | 黄曲霉 | 米曲霉或黄曲霉 | 黄曲霉 | 阳性 | 阳性 | 产毒 |
| 19 | CICC 40866 | 黄曲霉 | 米曲霉或黄曲霉 | 米曲霉 | 阳性 | 阳性 | 产毒 |
| 20 | CICC 41205 | 黄曲霉 | 米曲霉或黄曲霉 | 米曲霉 | 阳性 | 阳性 | 产毒 |
| 21 | CBS 100925 | 米曲霉 | 米曲霉或黄曲霉 | 米曲霉 | 阴性 | 阴性 | 阴性 |
| 22 | CBS 100927 | 黄曲霉 | 米曲霉或黄曲霉 | 黄曲霉 | 阳性 | 阳性 | 阳性 |
菌株在AFPA培养基上30 ℃生长2-3 d后,菌落反面颜色及描述分别见图 1和表 2,检测结果见表 3。米曲霉模式菌株CBS 100925菌落反面颜色为浅黄色(阴性),黄曲霉模式菌株CBS 100927菌落反面颜色为亮橙黄色(阳性)。其中菌株CICC 2024和CICC 2066在AFPA培养基上颜色反应不明显,结果无法判定;菌株CICC 40015为黄曲霉,但其AFPA培养基检测结果为阴性。
2.3 酶联免疫方法(ELISA)毒素测定结果菌株的酶联免疫方法毒素测定结果见表 3。结果显示米曲霉模式菌株CBS 100925未产毒素,黄曲霉模式菌株CBS 100927产生毒素,其余米曲霉标准菌株均未检测到黄曲霉毒素;除菌株CICC 40015外,所有黄曲霉标准菌株都检测到一定量的黄曲霉毒素,结合2.2中产毒培养基检测结果,判定CICC 40015为不产黄曲霉毒素的黄曲霉菌种。
2.4 系统发育分析结果试验菌株ITS rDNA、β-tubulin基因序列与相关近缘菌种的系统发育树分别见图 2和图 3。系统发育结果显示,包括模式菌株在内的22株标准菌株聚为同一系统发育支,序列相似性大于99%。由系统发育结果可知,ITS rDNA序列分析可把黄曲霉和米曲霉鉴定为曲霉属黄绿组(Aspergillus section Flavi),β-tubulin基因序列分析结果可鉴定为黄曲霉(Aspergillus flavus)或米曲霉(Aspergillus oryzae),系统发育分析结果见表 3。
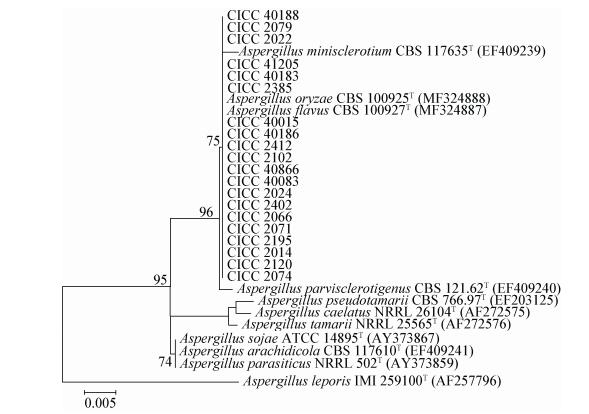
|
| 图 2 基于邻位连接法构建的试验菌株与相关种的ITS rDNA序列系统发育树 Figure 2 Phylogenetic tree of "the experiment strains" and other reference species, based on ITS rDNA sequence by the neighbour-joining method 注:图中发育树节点只显示Bootstrap值大于70%数值(1 000次重复);T:模式菌株;括号内为GenBank登录号;标尺长度代表遗传距离. Note: Bootstrap values (> 70 %) were shown at each branch points (1 000 replicates); T: The type strain; GenBank accession numbers are shown in the parentheses; Scale length represented genetic distance. |
|
|

|
| 图 3 基于邻位连接法构建的试验菌株与相关种的β-Tubulin基因序列系统发育树 Figure 3 Phylogenetic tree of "the experiment strains" and other reference species, based on β-tubulin gene sequence by the neighbour-joining method 注:图中发育树节点只显示Bootstrap值大于70%数值(1 000次重复);T:模式菌株;括号内为GenBank登录号;标尺长度代表遗传距离. Note: Bootstrap values (> 70%) were shown at each branch points (1 000 replicates); T: The type strain; GenBank accession numbers are shown in the parentheses; Scale length represented genetic distance. |
|
|
3个产毒基因PCR扩增的检测结果见图 4,分析结果见表 3。
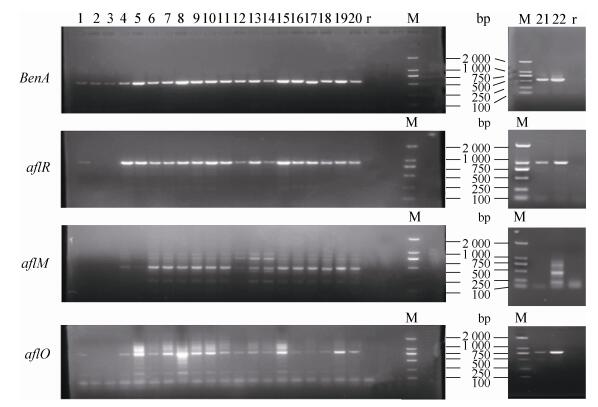
|
| 图 4 产毒素基因PCR扩增产物 Figure 4 PCR amplicons of aflatoxin biosynthesis genes 注:BenA为提取基因组的阳性对照;aflR、aflM、aflO为3个产毒基因;1-22为试验样品编号;r为未加模板的PCR体系对照;M:DL2000 DNA Marker. Note: BenA gene fragment as positive control for PCR reactions; aflR, aflM and aflO were three genes of aflatoxin biosynthesis; r: Blank control of PCR; M: DL2000 DNA Marker. |
|
|
所有试验菌株BenA基因(阳性对照) PCR扩增产物均有条带,大小约600 bp;菌株2、3号aflR产毒基因PCR扩增没有产物条带,其余都有大小约1 000 bp的条带;菌株1、2、3、21号aflM产毒基因PCR扩增没有产物条带,其余都有大小约500 bp的条带;菌株2、3号aflO产毒基因PCR扩增没有产物条带,其余都有大小约800 bp的条带。据文献[17-19]可知,菌株1、2、3、21号产毒为阴性,其余菌株PCR为阳性,是否产毒需进一步进行产毒试验验证。
3 讨论与结论22株标准菌的5种检测方法结果见表 3,其中模式株CBS 100925和CBS 100927检测结果符合米曲霉和黄曲霉的典型特征,根据表 3结果可知ITS rDNA和β-Tubulin基因序列系统发育分析可以排除与黄曲霉和米曲霉相近的菌种,但无法区分黄曲霉和米曲霉;传统形态学鉴定方法出现5个假阴性结果,判别依据主观性较强,要求操作者具有良好的判别经验,容易出现假阴性;产毒培养基检测结果出现3个假阴性,只能鉴别出产毒素的黄曲霉,无法鉴别不产毒素的黄曲霉,容易出现假阴性;产毒基因扩增结果出现3个假阳性,只能鉴别出产毒基因缺失的米曲霉,对于基因发生突变的米曲霉菌株不能鉴别,容易出现假阳性;毒素测定结果出现1个假阴性,只能鉴别出产毒素的黄曲霉,无法鉴别不产毒素的黄曲霉菌株,容易出现假阴性。
综上分析,出现假阳性意味着米曲霉被错误鉴定为黄曲霉,因此会损失一些功能菌株的应用;假阴性意味着黄曲霉被错误鉴定为米曲霉,如果产毒素的黄曲霉应用于食品或饲料生产,后果将很严重。因此,若使用单一方法来鉴别黄曲霉和米曲霉,容易出现假阳性或假阴性结果,风险较高,多相分类鉴定方法是准确区分二者的必选手段。综合本研究的分析结果,推荐使用系统发育分析方法初步鉴定未知菌株为黄曲霉或米曲霉,再利用形态学方法区分二者,最后利用产毒培养基方法或毒素测定方法进行结果验证(推荐使用ELISA或液相方法测定),该组合方法可以准确区分黄曲霉和米曲霉,建议使用该多相方法来确定应用于生产发酵菌种的分类学地位。
以上组合方法具体判定依据如下,首先利用系统发育分析方法将待检菌株鉴定为黄曲霉或米曲霉,再根据形态学特征区分二者,如黄曲霉判定特征为:分离基质广泛,菌落质地丝绒状,部分菌株产菌核,产孢结构大量,始终为黄绿色或深绿色,孢梗茎较短(通常小于1 000 μm),分生孢子近球形、壁明显粗糙;米曲霉判定特征为:主要分离自酿造用曲,从其他自然基物中较少分离到;菌落质地绒毛状,基本不产菌核,产孢结构少,初为浅色(黄色或绿色),老后变为深色(棕色或褐色),孢梗茎很长(通常大于2 500 μm),分生孢子较大(长轴直径4.5 μm-8.0 μm);根据形态学特征区分二者后,再利用产毒培养基验证判定结果,防止假阴性结果的产生,在AFPA培养基上,菌落反面为浅黄色或黄褐色,则该菌株不产毒素;在AFPA培养基上,菌落反面呈亮橙黄色,则该菌株产毒素,为黄曲霉;最后利用液相方法或酶联免疫法进行菌种毒素代谢测定,进一步验证鉴定结果的准确性。
此外,目前已有研究认为一些不产黄曲霉毒素的黄曲霉菌种可应用于工业生产,从而避免一些功能菌种的弃用[17]。所以,应用于生产发酵的微生物菌种是应根据其分类学名限制,还是根据其是否产毒素来限制,有待进一步探讨。
| [1] |
Zhao LF, Xu YJ. Research progress on the application of Aspergillus oryzae[J]. China Brewing, 2006, 25(3): 8-10. 赵龙飞, 徐亚军. 米曲霉的应用研究进展[J]. 中国酿造, 2006, 25(3): 8-10. |
| [2] |
Christensen M. A synoptic key and evaluation of species in the Aspergillus flavus group[J]. Mycologia, 1981, 73(6): 1056-1084. DOI:10.2307/3759676 |
| [3] |
Chang PK, Ehrlich KC. What does genetic diversity of Aspergillus flavus tell us about Aspergillus oryzae?[J]. International Journal of Food Microbiology, 2010, 138(3): 189-199. DOI:10.1016/j.ijfoodmicro.2010.01.033 |
| [4] |
Machida M, Asai K, Sano M, et al. Genome sequencing and analysis of Aspergillus oryzae[J]. Nature, 2005, 438(7071): 1157-1161. DOI:10.1038/nature04300 |
| [5] |
Varga J, Frisvad JC, Samson RA. Two new aflatoxin producing species, and an overview of Aspergillus section Flavi[J]. Studies in Mycology, 2011, 69: 57-80. DOI:10.3114/sim.2011.69.05 |
| [6] |
Qi ZT. Flora Fungorum Sinicorum: Fifth Volumes: Aspergillus and its Related Sexual[M]. Beijing: Science Press, 1997, 78-85. 齐祖同. 中国真菌志:第五卷:曲霉属及其相关有性型[M]. 北京: 科学出版社, 1997, 78-85. |
| [7] |
Hedayati MT, Pasqualotto AC, Warn PA, et al. Aspergillus flavus: human pathogen, allergen and mycotoxin producer[J]. Microbiology, 2007, 153(Pt6): 1677-1692. |
| [8] |
Cohn F. ber schimmelpilze aIs g hrungserreger[J]. Jahresbericht der Schlesischen Gesellschaft für Vaterl ndische Kultur, 1884, 61: 226. |
| [9] |
Zhang GZ, Jia ZZ, Ding XY, et al. The detecting of AFT B1 and the identification of AS3[J]. Microbiology China, 1981(5): 216-219, 226. 张国柱, 贾珍珍, 丁秀英, 等. 发酵菌种黄曲霉毒素B1的测定和AS3.870菌株的鉴定[J]. 微生物学通报, 1981(5): 216-219, 226. |
| [10] |
Luo HB, Yang XD, Li DY, et al. Isolation and identification of Aspergillus flavus from medium-high-temperature Daqu and preliminary research on its safety[J]. Liquor-Making Science & Technology, 2012(12): 37-40. 罗惠波, 杨晓东, 李丹宇, 等. 中高温大曲中黄曲霉的分离鉴定及其安全性初步研究[J]. 酿酒科技, 2012(12): 37-40. |
| [11] |
Pitt JI, Hocking AD. Fungi and Food Spoilage [M]. 3rd ed. Dordrecht/Heidelberg: Springer, 2009, 305-310.
|
| [12] |
Smedsgaard J. Micro-scale extraction procedure for standardized screening of fungal metabolite production in cultures[J]. Journal of Chromatography A, 1997, 760(2): 264-270. DOI:10.1016/S0021-9673(96)00803-5 |
| [13] |
Bai FR, Liu Y, Li H, et al. Separation and identification of parasitic fungus from the leaves of Xiangshan Smorke tree (Cotinus coggygria var. cinere) with wilt[J]. Bulletin of Biology, 2014, 49(5): 51-53, 64. 白飞荣, 刘洋, 李辉, 等. 香山黄栌枯萎病叶片真菌的分离与鉴定[J]. 生物学通报, 2014, 49(5): 51-53, 64. |
| [14] |
Thompson JD, Gibson TJ, Plewniak F, et al. The clustal_x windows interface: flexible strategies for multiple sequence alignment aided by quality analysis tools[J]. Nucleic Acids Research, 1997, 25(24): 4876-4882. DOI:10.1093/nar/25.24.4876 |
| [15] |
Tamura K, Peterson D, Peterson N, et al. MEGA5: molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods[J]. Molecular Biology and Evolution, 2011, 28(10): 2731-2739. DOI:10.1093/molbev/msr121 |
| [16] |
Yu JJ, Chang PK, Ehrlich KC, et al. Clustered pathway genes in aflatoxin biosynthesis[J]. Applied and Environmental Microbiology, 2004, 70(3): 1253-1262. DOI:10.1128/AEM.70.3.1253-1262.2004 |
| [17] |
Gallo A, Stea G, Battilani P, et al. Molecular characterization of an Aspergillus flavus population isolated from maize during the first outbreak of aflatoxin contamination in Italy[J]. Phytopathologia Mediterranea, 2012, 51(1): 198-206. |
| [18] |
General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China. SN/T 2582-2010 Detection of aflatoxigenic strains of aspergillus by PCR[S]. Beijing: Standards Press of China, 2010(in Chinese). 国家质量监督检验检疫总局. SN/T 2582-2010产黄曲霉毒素真菌PCR检测方法[S]. 北京: 中国标准出版社, 2010 |
| [19] |
Tominaga M, Lee YH, Hayashi R, et al. Molecular analysis of an inactive aflatoxin biosynthesis gene cluster in Aspergillus oryzae RIB strains[J]. Applied and Environmental Microbiology, 2006, 72(1): 484-490. DOI:10.1128/AEM.72.1.484-490.2006 |
 2018, Vol. 45
2018, Vol. 45




