扩展功能
文章信息
- 李全乐, 管仁艳, 何璟, 陈浩, 李胜清
- LI Quan-Le, GUAN Ren-Yan, HE Jing, CHEN Hao, LI Sheng-Qing
- 吸水链霉菌ATCC 29253产Hygrocin A发酵条件的优化
- Optimization of fermentation conditions for Hygrocin A production by Streptomyces hygroscopicus ATCC 29253
- 微生物学通报, 2018, 45(1): 146-154
- Microbiology China, 2018, 45(1): 146-154
- DOI: 10.13344/j.microbiol.china.170216
-
文章历史
- 收稿日期: 2017-03-15
- 接受日期: 2017-05-18
- 优先数字出版日期(www.cnki.net): 2017-05-25
2. 华中农业大学农业微生物学国家重点实验室 湖北 武汉 430070
2. State Key Laboratory of Agricultural Microbiology, Huazhong Agricultural University, Wuhan, Hubei 430070, China
Hygrocins是一种萘安莎抗生素,2005年首次从吸水链霉菌(Streptomyces hygroscopicus) ATCC 29253中被分离出来[1],研究发现Hygrocin A具有抗菌活性[2],其降解产物Hygrocin C、D和F对乳腺癌细胞MDA-MB-431 (IC50=0.5、3.0、3.3 μmol/L)及前列腺癌细胞PC3 (IC50=1.9、5.0、4.5 μmol/L)具有显著的细胞毒性[3]。Hygrocin A是9酮萘安莎[4],与利福霉素(Rifamycin)[5]和萘霉素(Naphthomycin)[6]等抗菌活性高的萘安莎抗生素相比[1],它聚酮链较短,容易对其结构进行生物合成改造[7],因而可作为先导化合物,采用化学生物合成方法开发新型药物[8-9],具有十分重要的研究价值。
Hygrocin A的产生菌株主要有雷帕霉素(Rapamycin)产生菌S. hygroscopicus ATCC 29253[10]和格尔德霉素(Geldanamycin)产生菌海洋放线菌Streptomyces sp. LZ35[11]。在常见培养基及发酵条件下,Hygrocin A产量一般很低,不利于开展其合成应用研究。目前,关于Hygrocin A发酵条件优化的文献较少,其原因之一是菌体内Hygrocin A浓度太低,难以直接进行准确检测。我们曾以测定菌体生物量的方式优化了发酵条件[12],优化的发酵培养基不仅提高了Hygrocins的产量,同时还较大幅度地提高了Rapamycin的产量。由于Hygrocin A浓度仍较低,HPLC无法检测到对应峰,该研究并未直接测定Hygrocin A的浓度,而是通过菌丝体量间接估算其产量。
为了进一步提高S. hygroscopicus ATCC 29253菌株发酵产Hygrocin A的水平,为Hygrocin A合成应用研究奠定基础,本文拟采用单因素和正交试验设计结合的方法,以HPLC及LC-MS直接测定Hygrocin A浓度,优化S. hygroscopicus ATCC 29253的培养基成分和培养条件。
1 材料与方法 1.1 材料 1.1.1 菌种S. hygroscopicus ATCC 29253分离自太平洋复活岛的土壤样品,保藏于华中农业大学农业微生物学国家重点实验室微生物次级代谢基因工程室。
1.1.2 培养基种子培养基10.3% YEME (g/L):酵母提取物3.0,葡萄糖10.0,蛋白胨5.0,麦芽提取物3.0,蔗糖103.0,pH 7.0-7.2,0.7×105 Pa灭菌20 min。
发酵培养基M10 (g/L):酵母提取物4.0,麦芽提取物10.0,葡萄糖4.0,pH 7.0-7.2,1×105 Pa灭菌30 min。
1.1.3 主要试剂及仪器乙酸乙酯(AR)、甲醇(AR、GR)、乙醇(AR)购自国药集团化学试剂有限公司;乙腈(GR)和甲酸(GR)购自美国TEDIA公司。
高效液相色谱仪(HPLC)、液相色谱质谱联用仪(LC/MS,液相检测器为Agilent 1260,质谱检测器为6540 UHD Accurate-Mass Q-TOF)、色谱柱(Agilent Zorbax Eclipse XDB-C18 column,4.6 mm× 150 mm×3.5 μm),安捷伦科技(中国)有限公司;高速离心机,德国Eppendoff公司;涡旋振荡器,Scicentific Industries公司;超级洁净工作台,北京东联哈尔仪器制造有限公司;旋转蒸发仪,上海亚荣生化仪器厂。
1.2 方法 1.2.1 培养方法取10 μL S. hygroscopicus ATCC 29253菌种接种于装有5 mL 10.3% YEME培养基的Polyamide (PA)瓶中,30 ℃、200 r/min活化36-40 h待用;取2.5 mL活化液接种到装有50 mL M10培养基的带棱锥形瓶中,30 ℃、200 r/min发酵11 d,在6-11 d每天取样测定Hygrocin A产量,绘制产量曲线。
1.2.2 Hygrocin A定量检测取50 mL已发酵完成的发酵液,4 500 r/min离心10 min收集菌丝体,用50 mL的乙酸乙酯:甲醇:乙酸(80:15:5,体积比)混合萃取剂150 r/min萃取2 h,4 500 r/min离心10 min收集萃取液旋转蒸发至干。用1 mL色谱纯甲醇复溶,然后用0.22 μm有机系滤膜过滤并收集于自动进样瓶中待测。
HPLC及LC-MS检测条件:0-5 min 20%-35% A,5-19 min 35%-55% A,19-20 min 55%-65% A,20-23 min 65%-100% A,23-27 min保持100%,其中A为乙腈,B为0.1%的甲酸水溶液。色谱柱4.6 mm× 150 mm×3.5 μm,检测波长306 nm,流速0.5 mL/min,进样量10 μL,柱温30 ℃。
质谱参数:正离子模式,m/z范围50-1 700,干燥气温度350 ℃,干燥气流速10 L/min,雾化器压力40 psi,毛细管出口电压145 V。样品分析及数据处理系统均使用Agilent Mass Hunter B.05.00软件。
1.2.3 发酵条件设计优化(1) 种子菌龄的优化:取10 μL菌种接种于装有5 mL 10.3% YEME培养基的PA瓶中,30 ℃、200 r/min分别活化12、24、36、48、60 h待用;取2.5 mL活化液分别接种到装有50 mL M10培养基的带棱锥形瓶中,30 ℃、200 r/min发酵10 d。
(2) 碳源的影响:在M10发酵培养基中10.0 g/L麦芽提取物不变的前体下,分别添加4.0 g/L的葡萄糖、蔗糖、麦芽糖、可溶性淀粉、甘油,选择最佳碳源;优化最佳碳源浓度为1.0、2.0、4.0、6.0、8.0 g/L。
(3) 氮源的影响:在M10发酵培养基中10.0 g/L麦芽提取物不变的前体下,分别添加4.0 g/L的酵母提取物、蛋白胨、黄豆饼粉,选择最佳氮源;优化最佳氮源浓度为1.0、2.0、4.0、6.0、8.0 g/L。
(4) 磷酸盐的影响:分别考察添加不同浓度的复合磷酸盐(表 1)和单独使用KH2PO4作磷酸盐时的影响。添加4.0、6.0、8.0、1.0、12.0、14.0 g/L的KH2PO4,与复合磷酸盐中效果最好的进行对比。
| 编号No. | KH2PO4 (g/L) | K2HPO4 (g/L) |
| 1 | 0.0 | 0.0 |
| 2 | 1.0 | 1.0 |
| 3 | 2.0 | 2.0 |
| 4 | 3.0 | 3.0 |
| 5 | 4.0 | 4.0 |
| 6 | 5.0 | 5.0 |
| 7 | 6.0 | 6.0 |
| 8 | 7.0 | 7.0 |
| 9 | 8.0 | 8.0 |
(5) 金属离子的影响:分别考察添加0.0、2.0、4.0、6.0、8.0、10.0 g/L NaCl,以及添加0、0.2、0.5、1.0、2.0、3.0、4.0、5.0 g/L MgCl2对产Hygrocin A的影响。
(6) 正交试验设计:在单因素优化实验基础上,应用SPSS 19.0统计软件设计葡萄糖、黄豆饼粉、K2HPO4+KH2PO4、MgCl2、NaCl等5因素3水平L16(35)正交试验,考察各因素之间的关系。
2 结果与分析 2.1 Hygrocin A产量曲线如图 1所示,从发酵第6–10天,随着发酵时间的增加,Hygrocin A的产量处于逐渐增长状态,这是Hygrocin A大量合成累积的时期;而在第11天时Hygrocin A的产量下降,推测可能是由于Hygrocin A分解导致,所以在之后的实验中均取发酵10 d的发酵液处理并做检测。

|
| 图 1 吸水链霉菌产Hygrocin A曲线 Figure 1 Hygrocin A production curve of S. hygroscopicus ATCC 29253 |
|
|
不同生长期的种子生长状态不同,对发酵的效果有显著的影响[13]。考察了种子菌龄对Hygrocin A产量的影响,结果如图 2所示,供试菌株种子活化48 h、发酵10 d,Hygrocin A产量最高。因此,选取生长48 h的菌株作为种子。
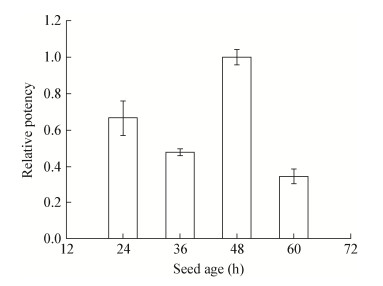
|
| 图 2 种子菌龄对Hygrocin A产量的影响 Figure 2 Effect of seed age on Hygrocin A production |
|
|
细胞干重的50%以上都是碳,而碳源通过直接影响微生物的糖代谢、呼吸、能量、生长及相关代谢影响抗生素等次级代谢产物的合成及分泌,所以碳源对于微生物的次级代谢有重要的影响[14]。实验考察了分别添加葡萄糖等5种实验室常用碳源对Hygrocin A产量的影响,结果如图 3A所示,葡萄糖(Glucose)作为碳源时,Hygrocin A的产量最高。考察了葡萄糖作为碳源时的添加量,结果如图 3B所示,浓度为4.0 g/L时,Hygrocin A产量最高。这是因为作为碳源时,单糖优于双糖和多糖,己糖优于戊糖,葡萄糖可以直接进入糖的代谢途径被降解。然而过多的葡萄糖作为碳源时,由于葡萄糖效应,导致Hygrocin A产量下降。

|
| 图 3 碳源(A)和葡萄糖浓度(B)对Hygrocin A产量的影响 Figure 3 Effect of carbon source (A) and glucose concentration (B) on Hygrocin A production |
|
|
氮源作为合成菌体氨基酸、蛋白质、核酸等物质及抗生素骨架的来源,在微生物的生长过程中有着重要的作用[15]。实验考察了分别添加黄豆饼粉等3种常用氮源对Hygrocin A产量的影响,结果如图 4A所示,黄豆饼粉(Soybean cake meal)作为氮源时Hygrocin A产量最高。如图 4B所示,对于黄豆饼粉添加量的优化方面,在单因素实验中并没有找到最适宜的黄豆饼粉添加量。随着黄豆饼粉添加量的增加,Hygrocin A的产量增加,但发酵液的黏稠度也会相应增大,通氧量减少。而吸水链霉菌作为好氧菌,通氧量的减少会抑制其菌体的生长,Hygrocin A产量也会减少,所以理论上会存在黄豆饼粉的最适宜添加量,将会在之后的正交试验中优化。

|
| 图 4 氮源(A)和黄豆饼粉浓度(B)对Hygrocin A产量的影响 Figure 4 Effect of nitrogen source (A) and soybean cake meal concentration (B) on Hygrocin A production |
|
|
菌体发酵过程中由于前期产酸会引起pH下降,过酸的环境不利于菌体生长,进而不利于次级代谢产物的合成。研究通过加入磷酸盐缓冲液来调节pH,使菌体正常生长。磷酸钾盐既能为细胞生长提供磷源,又能提供对细胞及其酶活性具有重要功能的钾离子,是发酵液中常用的磷酸盐[16]。实验考察了K2HPO4+KH2PO4复合磷酸盐及单一磷酸盐KH2PO4的添加量对Hygrocin A产量的影响,结果如图 5A所示,浓度为1.0 g/L K2HPO4+1.0 g/L KH2PO4时Hygrocin A产量最高,这是由于磷酸盐浓度过低会影响细胞的正常生长,细胞密度不能得到提高,次级代谢产物的合成也相应减少;而磷酸盐浓度过高则会导致细胞生长太过旺盛,合成次级代谢途径反而受到抑制减弱。单一添加KH2PO4时Hygrocin A产量明显低于复合磷酸盐,推测可能由于单一添加KH2PO4时,发酵过程pH变化过大,影响菌体的生长,如图 5B所示。
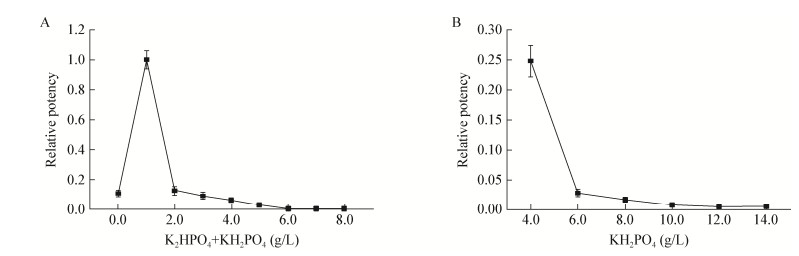
|
| 图 5 K2HPO4+KH2PO4浓度(A)和KH2PO4浓度(B)对Hygrocin A产量的影响 Figure 5 Effect of K2HPO4+KH2PO4 (A) and KH2PO4 concentration (B) on Hygrocin A production |
|
|
钠离子是细胞内非常重要的阳离子之一,它参与细胞的渗透压调节,还与营养物质的吸收有关,协同转运葡萄糖等营养物质,帮助排泄代谢产物。实验考察了NaCl浓度对Hygrocin A产量的影响,结果如图 6所示,随着NaCl浓度的增加,Hygrocin A产量降低,没有添加NaCl的样品中Hygrocin A产量最高。理论上认为NaCl的浓度对Hygrocin A产量的影响应该存在一个拐点,而单因素实验设计时0–2.0 g/L梯度太大,所以在之后的正交试验中优化NaCl浓度。

|
| 图 6 NaCl浓度对Hygrocin A产量的影响 Figure 6 Effect of NaCl concentration on Hygrocin A production |
|
|
镁是细胞内一些酶(如己糖激酶、羧化酶、异柠檬酸脱氢酶和固氮酶)的激活剂,影响蛋白质的合成和基质的氧化,同时还起到稳定核糖体、细胞膜和核酸的作用,细胞在缺少镁的情况下会停止生长。实验考察了MgCl2浓度对Hygrocin A产量的影响,结果如图 7所示,MgCl2浓度为0.5 g/L时,Hygrocin A产量最高;超过0.5 g/L后,随着MgCl2浓度的增加,Hygrocin A产量逐渐减少,可能是由于在MgCl2过多的条件下,细胞生长旺盛,次级代谢反而受到抑制。

|
| 图 7 MgCl2浓度对Hygrocin A产量的影响 Figure 7 Effect of MgCl2 concentration on Hygrocin A production |
|
|
为了考察各因素之间的关系及影响,进一步优化各因素的最佳添加量,应用SPSS 19.0软件,设计葡萄糖、黄豆饼粉、K2HPO4+KH2PO4、MgCl2、NaCl等5因素3水平的正交试验,正交结果如表 2所示,方差分析如表 3所示。
| 处理号 Treatment number |
因素Factor | F麦芽提取物 Malt extract (g/L) |
||||
| A葡萄糖 Glucose (g/L) |
B黄豆饼粉 Soybean meal (g/L) |
C K2HPO4+KH2PO4 (g/L) |
D MgCl2 (g/L) |
E NaCl (g/L) |
||
| 1 | 3.0 | 8.0 | 1.5+1.5 | 0.5 | 1.0 | 10.0 |
| 2 | 5.0 | 12.0 | 1.5+1.5 | 1.0 | 0.5 | 10.0 |
| 3 | 4.0 | 12.0 | 0.5+0.5 | 0.3 | 1.0 | 10.0 |
| 4 | 5.0 | 8.0 | 1.0+1.0 | 0.3 | 1.5 | 10.0 |
| 5 | 4.0 | 8.0 | 1.5+1.5 | 0.3 | 1.5 | 10.0 |
| 6 | 3.0 | 8.0 | 1.0+1.0 | 1.0 | 1.0 | 10.0 |
| 7 | 3.0 | 8.0 | 0.5+0.5 | 0.3 | 0.5 | 10.0 |
| 8 | 3.0 | 12.0 | 0.5+0.5 | 0.5 | 1.5 | 10.0 |
| 9 | 4.0 | 10.0 | 1.0+1.0 | 0.5 | 0.5 | 10.0 |
| 10 | 3.0 | 10.0 | 0.5+0.5 | 1.0 | 1.5 | 10.0 |
| 11 | 3.0 | 12.0 | 1.0+1.0 | 0.3 | 0.5 | 10.0 |
| 12 | 3.0 | 10.0 | 1.5+1.5 | 0.3 | 0.5 | 10.0 |
| 13 | 4.0 | 8.0 | 0.5+0.5 | 1.0 | 0.5 | 10.0 |
| 14 | 5.0 | 8.0 | 0.5+0.5 | 0.5 | 0.4 | 10.0 |
| 15 | 3.0 | 8.0 | 0.5+0.5 | 0.3 | 0.5 | 10.0 |
| 16 | 5.0 | 10.0 | 0.5+0.5 | 0.3 | 1.0 | 10.0 |
| K1 | 17 767.429 | 31 133.146 | 14 147.996 | 19 076.746 | 16 843.513 | |
| K2 | 23 842.479 | 17 024.858 | 16 340.171 | 18 954.308 | 19 210.675 | |
| K3 | 17 223.029 | 10 674.933 | 28 344.771 | 20 801.883 | 22 778.750 | |
| R | 6 619.450 | 20 458.213 | 14 196.775 | 1 847.575 | 5 935.237 | |
| 差异来源 Source of variation |
平方和 Quadratic sum |
自由度 Degree of freedom |
均方 Mean square |
F值 F valve |
P值 P-valve |
| A | 1.182E–8 | 2 | 59 111 163.014 | 2.929 | 0.144 |
| B | 1.275E–9 | 2 | 6.377E–8 | 31.604 | 0.001 |
| C | 5.568E–8 | 2 | 2.784E–8 | 13.797 | 0.009 |
| D | 9 395 714.051 | 2 | 4 697 857.026 | 0.233 | 0.800 |
| E | 94 392 164.171 | 2 | 47 196 082.086 | 2.339 | 0.192 |
根据正交试验的极差分析(表 1)和方差分析(表 2)结果可知,各因素对Hygrocin A产量的影响程度为B > C > A > E > D,即黄豆饼粉 > K2HPO4+KH2PO4 > 葡萄糖 > NaCl > MgCl2。同时由P值可知,黄豆饼粉和K2HPO4+KH2PO4添加量对Hygrocin A产量的影响差异极显著。
综合各因素,适合吸水链霉菌ATCC 29253产Hygrocin A的最佳发酵培养基为M1 (g/L):葡萄糖4.0,黄豆饼粉8.0,K2HPO4 1.5,KH2PO4 1.5,MgCl2 1.0,NaCl 1.5。除了MgCl2浓度与单因素实验结果不太符合外,其余4个因素的单因素优化结果与正交试验结果都吻合,而由正交试验方差分析结果可知,MgCl2浓度对Hygrocin A产量的影响强度最低,而且不同浓度对Hygrocin A产量的影响差异不显著,因此以正交试验中MgCl2浓度的结果为准。
2.9 最优发酵条件的验证为了进一步验证优化结果,分别用初始培养基M10和优化后发酵培养基M1接种相同浓度的种子,在同一条件下培养。结果如图 8所示,在最优发酵条件下Hygrocin A产量是原培养基M10中的6倍,吸水链霉菌中与Hygrocin A同时产生的另一抗生素Rapamycin[1]产量是原始培养基中的5%。
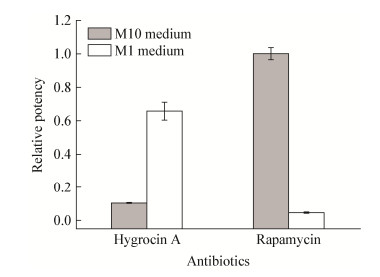
|
| 图 8 优化前后抗生素产量的变化 Figure 8 Changes of antibiotics yield before and after medium optimization |
|
|
安莎霉素类抗生素虽然种类不多,但其生理活性广泛、成药率高,是一类值得重视的抗生素。由于安莎类化合物具有独特的化学结构和显著的生物活性,对安莎类抗生素的生物合成研究吸引着国内外研究者的兴趣。Hygrocin A属于萘安莎霉素并且具有较短聚酮链,对其进行结构改造具有巨大的新药开发潜力。S. hygroscopicus ATCC 29253在一定发酵条件下能同时产生Hygrocin A和Rapamycin两种抗生素,根据它们的生物合成基因簇以及已经报道的生物合成过程,Hygrocin A和Rapamycin都是由Ⅰ型PKS催化合成的大环内酯聚酮化合物,聚酮骨架是由乙二酸盐或丙二酸盐或甲氧基丙二酸等单位缩合而成[2, 17]。另外,Rapamycin的前体4, 5-二羟环己-1-烯羧酸(DHCHC)来自莽草酸代谢途径[17],而Hygrocin A的前体3-氨基-5-羟基苯甲酸(AHBA)来自与莽草酸代谢平行的氨基莽草酸代谢途径[18],推测这两种抗生素在合成过程中可能存在竞争关系。然而在优化条件下可能较多前体物质分配到Hygrocin A合成通路,Hygrocin A产量大幅提高,Rapamycin合成受到抑制,产量明显下降。这说明发酵过程中降低Rapamycin的产量可能有利于Hygrocin A的合成。通过选择培养条件有目的地调节两种抗生素的代谢通量,进而可开展多抗生素同时表达的代谢调控研究。
本研究根据链霉菌发酵所需的营养物质,通过单因素和正交试验设计确定了最优发酵培养基M1 (g/L):葡萄糖4.0,黄豆饼粉8.0,K2HPO4 1.5,KH2PO4 1.5,MgCl2 1.0,NaCl 1.5。优化后的培养基中Hygrocin A产量与其原始培养基M10比较提高了500%,Rapamycin产量同时下降95%。本研究的发酵条件优化方法和结果对于后续研究具有良好的指导作用。
| [1] |
Cai P, Kong FM, Ruppen ME, et al. Hygrocins A and B, naphthoquinone macrolides from Streptomyces hygroscopicus[J]. Journal of Natural Products, 2005, 68(12): 1736-1742. DOI:10.1021/np050272l |
| [2] |
Li SR, Wang HX, Li YY, et al. Biosynthesis of hygrocins, antitumor naphthoquinone ansamycins produced by Streptomyces sp. LZ35[J]. ChemBioChem, 2014, 15(1): 94-102. DOI:10.1002/cbic.201300599 |
| [3] |
Lu CH, Li YY, Deng JJ, et al. Hygrocins C-G, cytotoxic naphthoquinone ansamycins from gdmAI-disrupted Streptomyces sp. LZ35[J]. Journal of Natural Products, 2013, 76(12): 2175-2179. DOI:10.1021/np400474s |
| [4] |
Rasapalli S, Jarugumilli G, Yarrapothu GR, et al. Studies towards the total synthesis of hygrocins A and B[J]. Tetrahedron Letters, 2014, 55(4): 821-825. DOI:10.1016/j.tetlet.2013.12.017 |
| [5] |
Floss HG, Yu TW. Rifamycin-Mode of action, resistance, and biosynthesis[J]. Chemical Reviews, 2005, 105(2): 621-632. DOI:10.1021/cr030112j |
| [6] |
Williams TH. Naphthomycin, a novel ansa macrocyclic antimetabolite. Proton NMR spectra and structure elucidation using lanthanide shift reagent[J]. The Journal of Antibiotics, 1975, 28(1): 85-86. DOI:10.7164/antibiotics.28.85 |
| [7] |
Chen DD, Wu JQ, Liu W. Biosynthesis-based production improvement and structure modification of erythromycin A[J]. Chinese Journal of Biotechnology, 2015, 31(6): 939-954. 陈单丹, 吴杰群, 刘文. 以生物合成为基础的红霉素A的产量提高和结构改造[J]. 生物工程学报, 2015, 31(6): 939-954. |
| [8] |
Lin Z, Chen DD, Liu W. Biosynthesis-based artificial evolution of microbial natural products[J]. Science China Chemistry, 2016, 59(9): 1175-1187. DOI:10.1007/s11426-016-0062-x |
| [9] |
Wang XY, Zhang JX, Cao SH. Progress in studies of rifamycin derivatives[J]. World Notes on Antibiotics, 2015, 29(6): 255-261. 王欣瑜, 张静霞, 曹胜华. 利福霉素类衍生物的研究进展[J]. 国外医药抗生素分册, 2015, 29(6): 255-261. |
| [10] |
Lomovskaya N, Fonstein L, Ruan XA, et al. Gene disruption and replacement in the rapamycin-producing Streptomyces hygroscopicus strain ATCC 29253[J]. Microbiology, 1997, 143(3): 875-883. DOI:10.1099/00221287-143-3-875 |
| [11] |
Shi NN, Wang HX, Lu CH, et al. Ansamycins produced by Streptomyces sp. LZ35[J]. Chinese Pharmaceutical Journal, 2011, 46(17): 1317-1320. 石妞妞, 王浩鑫, 鲁春华, 等. 海洋放线菌Streptomyces sp. LZ35中的安莎霉素类化合物[J]. 中国药学杂志, 2011, 46(17): 1317-1320. |
| [12] |
Wu ZH, Wang MY, He J. Optimization of the fermentation conditions for Hygrocins production by Streptomyces hygroscopicus ATCC 29253[J]. Hubei Agricultural Sciences, 2011, 50(22): 4596-4600. 吴竹华, 王明艳, 何璟. 吸水链霉菌ATCC 29253产Hygrocins的条件优化[J]. 湖北农业科学, 2011, 50(22): 4596-4600. DOI:10.3969/j.issn.0439-8114.2011.22.017 |
| [13] |
Qi HS, Zhao SM, Fu H, et al. Coupled cell morphology investigation and metabolomics analysis improves rapamycin production in Streptomyces hygroscopicus[J]. Biochemical Engineering Journal, 2014, 91: 186-195. DOI:10.1016/j.bej.2014.08.015 |
| [14] |
Shene C, Mardones M, Zamora P, et al. Kinetics of Bifidobacterium longum ATCC 15707 fermentations: effect of the dilution rate and carbon source[J]. Applied Microbiology and Biotechnology, 2005, 67(5): 623-630. DOI:10.1007/s00253-004-1792-2 |
| [15] |
Beltran G, Esteve-Zarzoso B, Rozès N, et al. Influence of the timing of nitrogen additions during synthetic grape must fermentations on fermentation kinetics and nitrogen consumption[J]. Journal of Agricultural and Food Chemistry, 2005, 54(3): 996-1002. |
| [16] |
Yin SL, Zhang YX, Zhang Q, et al. The effect of inorganic phosphate on the biosynthesis of secondary metabolites in Streptomyces[J]. China Biotechnology, 2015, 35(9): 105-113. 尹守亮, 张玉秀, 张琪, 等. 无机磷酸盐对链霉菌合成次级代谢产物的影响[J]. 中国生物工程杂志, 2015, 35(9): 105-113. |
| [17] |
Park SR, Yoo YJ, Ban YH, et al. Biosynthesis of rapamycin and its regulation: past achievements and recent progress[J]. The Journal of Antibiotics, 2010, 63(8): 434-441. DOI:10.1038/ja.2010.71 |
| [18] |
Jung WS, Yoo YJ, Park JW, et al. A combined approach of classical mutagenesis and rational metabolic engineering improves rapamycin biosynthesis and provides insights into methylmalonyl-CoA precursor supply pathway in Streptomyces hygroscopicus ATCC 29253[J]. Applied Microbiology and Biotechnology, 2011, 91(5): 1389-1397. DOI:10.1007/s00253-011-3348-6 |
 2018, Vol. 45
2018, Vol. 45




