扩展功能
文章信息
- 尹清干, 程俊茗, 刘腾飞, 董龙香, 苏惠冰, 胡鲲, 杨先乐
- YIN Qing-Gan, CHENG Jun-Ming, LIU Teng-Fei, DONG Long-Xiang, SU Hui-Bing, HU Kun, YANG Xian-Le
- 环境因子对鳗弧菌生物膜形成的影响
- Characteristics of biofilm formation of pathogenic Vibrio anguillarum
- 微生物学通报, 2018, 45(1): 138-145
- Microbiology China, 2018, 45(1): 138-145
- DOI: 10.13344/j.microbiol.china.170214
-
文章历史
- 收稿日期: 2017-03-15
- 接受日期: 2017-05-15
- 优先数字出版日期(www.cnki.net): 2017-06-26
2. 藁城区农林畜牧局 河北 石家庄 052160
2. Gaocheng District Bureau of Agriculture, Forestry and Animal Husbandry, Shijiazhuang, Hebei 052160, China
鳗弧菌(Vibrio anguillarum)是海水鱼类细菌性疾病的主要病原,在海水和底泥中都可发现,它也是健康鱼类消化道中微生物区系的重要组成部分,一旦条件适宜,如水温升高、水体富营养化时可大量繁殖,从而引起水产经济动物,特别是鱼类的流行性疾病[1]。曾经暴发的流行病给世界范围内海水养殖鱼类、贝类等经济动物的养殖业造成巨大的损失。生物膜(Biofilm,BF)是一种细菌在代谢过程中黏附于非生物或生物基质表面,并且由自身产生的胞外聚合物(主要为胞外多糖、蛋白和胞外DNA)及其基质网包裹的有三维结构的菌细胞群体[2]。大量研究证实,几乎所有细菌在特定条件下均能够形成生物膜,这是细菌为适应环境维持自身生命所发生的变化,生物膜能够增强细菌对外界环境的抵抗力[3]。研究表明,细菌生物膜广泛存在于自然环境中,对外界环境有极强的耐药性,增加细菌对宿主的免疫逃避性[4]。有报道称,鳗弧菌生物膜能使内部细菌抵御噬菌体、抗生素、杀菌剂和机体免疫系统等,造成免疫逃避,在临床上引起慢性、持续感染和多重耐药性[5]。因此,研究鳗弧菌的生物膜对于减少水产经济动物死亡、降低经济损失、减少生态破坏是十分必要的。
1978年,Costerton等[2]最早提出细菌生物膜的概念。直到1987年,Costerton等[6]报道了细菌生物被膜的致病特性及耐药问题,生物膜才引起人们的广泛重视。对于细菌生物膜的耐药机制已有很多研究报道。已有研究发现,细菌生物膜是由蘑菇状或者锥状的大量细菌组成,形成的菌落结构复杂而分工有序,包括主体生物膜层、连接层、条件层、基质层,菌落结构具有不均质性[7]。生物膜内的细菌根据所处位置的不同,可分为表层菌和深层菌。Schauder等[8]研究认为,当应用抗生素后,因药物难以渗入到深层菌,不仅难以有效清除生物膜,而且还可诱导深层细菌产生耐药性。Thurnheer等[9]采用荧光探针检测发现,生物膜的通道是迂回的,这可能正是抗生素渗入生物膜受阻的原因所在。生物膜内的细菌由于生长所需的营养不足、代谢物堆积、氧浓度降低等原因,导致其代谢活性缓慢、生长速度降低,甚至处于休眠期,对抗生素均不敏感[10]。细菌在形成生物膜之后,为了适应新的生长环境,某些在游离条件下不表达的基因被激活或者原本正常表达的基因在生物膜状态下失去表达活性,从而使得生物膜菌株的生物学行为发生改变,导致耐药机制的产生或加强。鳗弧菌造成的巨大危害引起了有关研究者对其致病机理的关注。目前,国内外学者针对鳗弧菌的生物学性状、毒力基因、检测技术以及疫苗研发等方面[11-17]已进行了很多研究,对其他细菌如铜绿假单胞菌[18]、金黄色葡萄球菌[19]等形成的生物膜也进行了大量研究。至今,尚无关于鳗弧菌生物膜形成特性的研究报道,对生物膜形成规律的研究是探讨鳗弧菌致病性的重要基础。
本研究以一株致病性鳗弧菌为对象,探讨环境因素对鳗弧菌成膜能力的影响,以期了解不同环境条件下的鳗弧菌生物膜形成规律,为进一步研究鳗弧菌生理特性提供参考。
1 材料与方法 1.1 材料 1.1.1 菌株致病性鳗弧菌BYK0638由国家水生动物病原库提供,-80 ℃超低温保存。
1.1.2 主要试剂和仪器胰蛋白胨大豆琼脂培养基(TSA)、胰酪大豆胨液体培养基(TSB),杭州百思生物技术有限公司;考马斯亮蓝G-250,南京建成生物工程研究所;细胞计数试剂盒CCK-8 (Cell Counting Kit-8),碧云天生物技术研究所。
96孔酶标板(Corning-3590),国药集团化学有限公司;酶标仪,Microplate Autoreader公司。
1.2 方法 1.2.1 菌悬液的配制鳗弧菌接种于TSB液体培养基中,在生化培养箱中28 ℃、180 r/min振荡培养24 h,10 000 r/min离心1 min,PBS缓冲液清洗菌体沉淀,重复2次,收集细菌细胞,最后用PBS缓冲液将菌悬液的OD600值调至0.8,4 ℃保存备用(约108 CFU/mL)。
1.2.2 鳗弧菌生物膜形成量的测定鳗弧菌生物膜的形成参照Stepanović等[20]的微孔板法并进行适当改良。具体步骤如下:吸取100 ml TSB液体培养基于96孔酶标板小孔中,再加入100 μL菌悬液,20 ℃湿盒中培养20 h,吸出多余的培养基,并用250 μL无菌PBS清洗2次,以去除游离菌。
鳗弧菌生物膜形成量的测定参照袁海兰等[21]的方法,按照CCK-8细胞计数板的使用说明进行试验。形成的鳗弧菌生物膜经洗涤后,每孔加入100 μL TSB液体培养基和10 μL CCK-8工作液,置于28 ℃恒温培养箱中培养3 h后用酶标仪测定每孔的OD450值。实际OD450值为每个试验孔的OD450值减去空白对照孔的OD450值。以无菌培养液为空白对照。
1.2.3 培养条件对鳗弧菌生物膜的影响(1) 培养时间对鳗弧菌生物膜形成的影响:按照1.2.2鳗弧菌生物膜形成方法,测定0、6、12、24、36、48、60、72 h形成生物膜的OD450值。
(2) 初始菌浓度对鳗弧菌生物膜形成的影响:将鳗弧菌浓度调至1.0×108 CFU/mL,进行10倍梯度稀释,按1.2.2的方法,分别得到1.0×108、1.0×107、1.0×106、1.0×105、1.0×104、1.0×103、1.0×102 CFU/mL的菌悬液,测定不同初始鳗弧菌浓度所形成生物膜的OD450值。
(3) 培养温度对鳗弧菌生物膜形成的影响:将鳗弧菌置于4、15、20、25、28、32、37 ℃培养,测定不同培养温度所形成生物膜的OD450值。
(4) 不同pH值对鳗弧菌生物膜形成的影响:按照1.2.2鳗弧菌生物膜形成方法,用HCl和NaOH调节TSB液体培养基的pH值。测定pH分别为3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0时形成生物膜的OD450值。
(5) Ca2+、Mg2+、NaCl对鳗弧菌生物膜形成的影响:分别向TSB液体培养基中添加CaCl2、MgCl2至终浓度为2.00、1.00、0.50、0.25、0.12、0.06、0.03 mmol/L;添加NaCl至终浓度为9%、8%、7%、6%、5%、4%、3%、2%、1%、0。测定所形成生物膜的OD450值。以不添加CaCl2、MgCl2、NaCl的TSB液体培养基为阴性对照。
(6) 不同黏液和组织提取液包被对鳗弧菌生物膜形成的影响:参考Chen等[22]方法制备大黄鱼表皮黏液、鳃黏液以及肌肉提取液、肠提取液、肝脏提取液。采用考马斯亮蓝法将蛋白质含量调整至1 g/L,然后依次用0.45 μl和0.22 μL微孔滤膜过滤除菌,置于4 ℃待用。
在96孔酶标板各孔分别加入200 μL制备的大黄鱼表皮黏液、鳃黏液和肌肉、肠、肝脏提取液,4 ℃包被10 h后弃去,用250 μL PBS缓冲液清洗2次后,按1.2.2鳗弧菌生物膜形成方法,测定黏液和不同组织提取液包被后形成生物膜的OD450值。以未经包被的酶标板为阴性对照。
1.3 数据处理结果以平均数加或减标准偏差表示,用Excel、SPSS 19.0软件进行统计学分析。
2 结果与分析 2.1 培养时间对鳗弧菌生物膜形成的影响如图 1所示,鳗弧菌生物膜的形成与培养时间密切相关。在培养初期,鳗弧菌所形成的生物膜OD450值随着培养时间的延长而增加,约24 h达到峰值,60 h后趋于稳定。继续培养,OD450值随培养时间的延长而逐渐下降,48 h时OD450值不再下降,反而有所上升;60-72 h趋于相对稳定,达到新的平衡。

|
| 图 1 不同培养时间鳗弧菌形成生物膜的OD450值 Figure 1 OD450 values of V. anguillarum biofilms of different incubation times 注:不同字母表示组间数据差异显著(P < 0.05). Note: Data with different letters are significantly different (P < 0.05) among different groups. |
|
|
如图 2所示,鳗弧菌初始菌浓度在102-106 CFU/mL时,形成生物膜的OD450值变化不大,差异不显著;当初始菌浓度达到107 CFU/mL时,OD450值与低浓度时相比差异显著(P < 0.05),而且随着菌浓度的增加而增大。
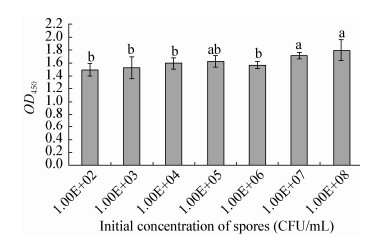
|
| 图 2 不同初始菌浓度鳗弧菌形成生物膜的OD450值 Figure 2 OD450 values of V. anguillarum biofilms of different initial concentration of spores 注:不同字母表示组间数据差异显著(P < 0.05). Note: Data with different letters are significantly different (P < 0.05) among different groups. |
|
|
如图 3所示,在4-25 ℃范围内,随着温度的升高生物膜的形成量逐步增高,4、15、20、25 ℃的生物膜形成量之间均具有显著性差异(P < 0.05);当温度达到25 ℃以后,生物膜的形成量迅速下降,15 ℃和28 ℃的生物膜形成量没有显著性差异;而28、32及37 ℃三者之间的生物膜形成量具显著性差异。
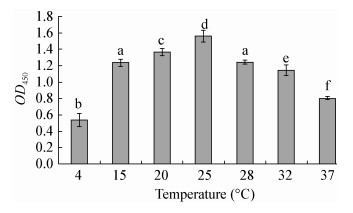
|
| 图 3 不同培养温度鳗弧菌形成生物膜的OD450值 Figure 3 OD450 values of V. anguillarum biofilms of different incubation tempetatures 注:不同字母表示组间数据差异显著(P < 0.05). Note: Data with different letters are significantly different (P < 0.05) among different groups. |
|
|
如图 4所示,初始pH为3.0和12.0的TSB培养基中,鳗弧菌几乎不形成生物膜;pH为4.0-8.0时,OD450值随之显著增大,pH为8.0时OD450值最大;pH 8.0-11.0时,OD450值显著下降(P < 0.05)。
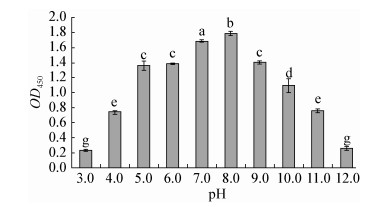
|
| 图 4 不同pH条件下鳗弧菌形成生物膜的OD450值 Figure 4 OD450 values of V. anguillarum biofilms developed at different pH values 注:不同字母表示组间数据差异显著(P < 0.05). Note: Data with different letters are significantly different (P < 0.05) among different groups. |
|
|
如图 5所示,不同浓度CaCl2对于鳗弧菌生物膜形成的影响不大,添加0.03-2.00 mmol/L的Ca2+,试验组的鳗弧菌生物膜形成量虽有所增加,但与对照组相比,差异不显著(P > 0.05)。
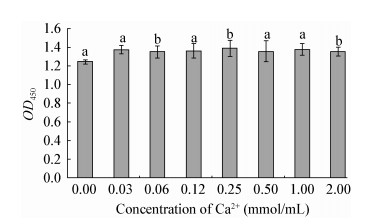
|
| 图 5 鳗弧菌在添加不同浓度Ca2+条件下形成生物膜的OD450值 Figure 5 OD450 values of V. anguillarum biofilms developed under different concentration of Ca2+ 注:不同字母表示组间数据差异显著(P < 0.05). Note: Data with different letters are significantly different (P < 0.05) among different groups. |
|
|
如图 6所示,不同浓度的Mg2+有助于增加鳗弧菌生物膜的形成量。即使少量的添加,试验组与对照组相比,OD450有显著性差异(P < 0.05);MgCl2添加量在0.06-0.50 mmol/L之间时,鳗弧菌生物膜的OD450值随着浓度的增加而增大,而且有显著性差异(P < 0.05);当MgCl2添加量在0.50-2.00 mmol/L之间时,鳗弧菌生物膜的OD450值变化不大,没有显著性差异(P > 0.05)。
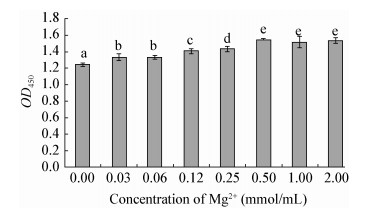
|
| 图 6 鳗弧菌在添加不同浓度Mg2+条件下形成生物膜的OD450值 Figure 6 OD450 values of V. anguillarum biofilms developed under different concentration of Mg2+ 注:不同字母表示组间数据差异显著(P < 0.05). Note: Data with different letters are significantly different (P < 0.05) among different groups. |
|
|
如图 7所示,在一定浓度范围内,鳗弧菌生物膜的形成与盐度有显著性相关。NaCl浓度为2%-8%时鳗弧菌均能形成稳定的生物膜,其生物膜OD450值随NaCl浓度的升高而增大,其生物膜OD450值极显著高于NaCl浓度为0、1%、9%试验组(P < 0.01)。NaCl浓度为5%试验组的生物膜OD450值最大,显著高于其他各试验组的生物膜OD450(P < 0.05)。

|
| 图 7 鳗弧菌在添加不同浓度NaCl条件下形成生物膜的OD450值 Figure 7 OD450 values of V. anguillarum biofilms developed aender different concentration of NaCl 注:不同字母表示组间数据差异显著(P < 0.05). Note: Data with different letters are significantly different (P < 0.05) among different groups. |
|
|
如图 8所示,鳗弧菌在分别经表皮黏液、鳃黏液以及肌肉、肝脏、前肠、后肠组织提取液包被的基质上形成生物膜的OD450值均显著高于对照组(P < 0.05);经鳃黏液和肌肉组织提取液包被的试验组OD450值与其他试验组差异显著(P < 0.05)。
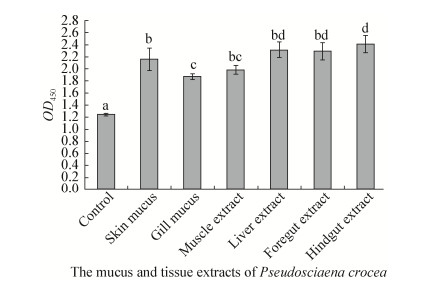
|
| 图 8 鳗弧菌在不同基质上形成生物膜的OD450值 Figure 8 OD450 values of V. anguillarum biofilms developed on different matrix 注:不同字母表示组间数据差异显著(P < 0.05). Note: Data with different letters are significantly different (P < 0.05) among different groups. |
|
|
已有研究发现,细菌生物膜的形成过程虽然不尽相同,但大致可分为几个步骤:(1)菌体黏附至合适的底物;(2)形成微菌落,微菌落融合并形成生物膜的基底层;(3)产生细胞外基质,逐渐成熟形成三维立体结构;(4)生物膜子代细胞的播散[21]。可见生物膜的形成是一个动态的过程,包括早期黏附阶段、中间形成阶段、生物膜成熟和解聚阶段。
本实验结果表明,鳗弧菌生物膜的形成阶段可分为:从0-6 h为早期黏附阶段,主要是液体培养基中的游离菌黏附于酶标板表面并开始繁殖,导致酶标板表面的微生物生物量逐步增加;6-24 h为中间形成阶段,该阶段鳗弧菌生物膜快速增加,表示生物膜内的活菌数不断增多,代谢旺盛,胞外多聚物的分泌增多,是生物膜内生物量增值的重要阶段;24-48 h生物膜形成量呈短暂的降低趋势,可能与菌细胞大量繁殖使营养受到限制有关;48-72 h为成熟阶段,伴随着环境中的营养等生长限制因子的消耗以及代谢产物的累积,菌体的生长代谢开始受到限制,生物膜生长达到一个相对的动态平衡,表现为生物膜形成量趋于稳定[23]。
Pratt等[24]认为,生物膜中的细菌来自于游离细菌的黏附集聚和黏附细菌的繁殖。本文实验结果证明,初始菌浓度在102-106CFU/mL之间时,对于鳗弧菌生物膜的形成影响不大,这是因为较低的游离菌密度导致初期黏附在基质上的细菌量也很少,黏附细菌的生长较慢;只有到初始菌浓度在107CFU/mL以上时,才容易形成大量的生物膜,这与Johnson[25]的研究结果一致。所以可以认为细菌的黏附促进生物膜的形成,细菌的黏附量会随着菌浓度的升高而增加,因此较高的菌浓度有利于生物膜的形成。
鳗弧菌是嗜温菌,适宜生长温度为13-37 ℃[26]。本实验结果显示,在4 ℃时生物膜形成量较少;在温度15-28 ℃时鳗弧菌生物膜形成量较多,两者温度范围基本一致;在37 ℃时仍能形成少量的生物膜。这说明鳗弧菌生物膜的形成与其在生长繁殖和生理活动上的适宜温度基本一致,这也反映了鳗弧菌在活力最好的情况下成膜能力最强。
鳗弧菌的最佳生长pH为8.0,偏碱性[27]。本实验结果显示,在pH为4.0-11.0时,鳗弧菌均能形成生物膜,pH为7.0和8.0时,形成的生物膜量最大,这主要是鳗弧菌有较广的pH适应范围;pH为3.0和12.0时,不形成生物膜,主要是由于鳗弧菌处于极端酸性和碱性环境中,细菌生长受到抑制。
鳗弧菌在含3%-6% NaCl的培养基上能生长,但在无盐的培养基上生长不良[26]。实验中鳗弧菌在NaCl浓度为2%-8%时均能够有效成膜,NaCl为0时几乎不能成膜,而在NaCl浓度为1%、9%时的成膜效果较差,说明鳗弧菌在自然生存盐度范围内都能够成膜,但盐度过高或者过低会影响成膜效果。
在负电性的胞外聚合物基质中,金属阳离子作为交联桥,既增加菌落间的聚集,又增加了菌落与载体间的黏附,能影响到细菌外膜的整体性和稳定性,以及细菌脂多糖稳定[28]。林雅茵等[18]通过对黏液性铜绿假单胞菌(Pseudomnas aeruginosa)生物膜形成的研究发现,Mg2+能够增加细菌的黏附,促进生物膜的形成。本文研究发现,较低的Mg2+浓度有利于鳗弧菌生物膜的形成。在含有0.06-0.50 mmol/L的MgCl2培养基中,随着浓度的增高,鳗弧菌生物膜的形成量越大,说明Mg2+参与了鳗弧菌成膜的调控过程,增强细菌与介质表面负离子结合,形成稳定的二价吸引力,从而提高生物膜黏附在介质表面的稳定性。在CaCl2培养基中,随着浓度的增大OD450值之间没有差异,没有细菌生物膜的形成。
Villasenor等[29]发现,细菌在不同碳源基质上的成膜效果不同。本文发现鳗弧菌在大黄鱼不同部位的黏液和组织提取液上形成的生物膜量各不相同,可能是因为大黄鱼不同部位的黏液和组织提取液所含糖类和蛋白质不相同,而Sutherland[30]研究发现,糖类和蛋白质在生物膜的形成过程中起着重要作用。Chen等[22]研究发现,病原性溶藻弧菌能够黏附于大黄鱼表皮、鳃和肠黏液,其中对肠黏液的黏附作用最强。本研究中,大黄鱼表皮黏液、鳃黏液以及肌肉、肝脏、前肠、后肠组织提取液包被96孔酶标板后形成的生物膜量均显著高于对照组,其中表皮黏液、肝脏、前肠、后肠组织提取液形成的生物膜量最多,两者结果基本一致。
4 结论致病性鳗弧菌BYK0638能形成稳定而明显的生物膜,其生物膜形成与外界环境因子变化有密切关系,培养时间、初始菌浓度、温度、pH、Mg2+、盐度及不同组织和黏液等各种环境因子均能显著影响鳗弧菌生物膜的形成。
| [1] |
Zhan WB. Aquatic Animal Diseases[M]. Beijing: China Agricultural Publishing House, 2004. 战文斌. 水产动物病害学[M]. 北京: 中国农业出版社, 2004. |
| [2] |
Costerton JW, Geesey GG, Cheng KJ. How bacteria stick[J]. Scientific American, 1978, 238(1): 86-95. DOI:10.1038/scientificamerican0178-86 |
| [3] |
Stewart PS, Costerton JW. Antibiotic resistance of bacteria in biofilms[J]. The Lancet, 2001, 358(9276): 135-138. DOI:10.1016/S0140-6736(01)05321-1 |
| [4] |
Mukherjee PK, Mohamed S, Chandra J, et al. Alcohol dehydrogenase restricts the ability of the pathogen Candida albicans to form a biofilm on catheter surfaces through an ethanol-based mechanism[J]. Infection and Immunity, 2006, 74(7): 3804-3816. DOI:10.1128/IAI.00161-06 |
| [5] |
Jia LH, Ning XB. Research progress on Vibrio alginolyticus biofilm[J]. Journal of Anhui Agricultural Sciences, 2014, 42(33): 11866-11868, 11870. 贾玲华, 宁喜斌. 溶藻弧菌生物膜研究进展[J]. 安徽农业科学, 2014, 42(33): 11866-11868, 11870. DOI:10.3969/j.issn.0517-6611.2014.33.089 |
| [6] |
Costerton JW, Cheng KJ, Geesey GG, et al. Bacterial biofilms in nature and disease[J]. Annual Review of Microbiology, 1987, 41(1): 435-464. DOI:10.1146/annurev.mi.41.100187.002251 |
| [7] |
Alahmad A, Wiedmann-al-ahmad A, Faust J, et al. Biofilm formation and composition on different implant materials in vivo[J]. Journal of Biomedical Materials Research Part B: Applied Biomaterials, 2010, 95(1): 101-109. |
| [8] |
Schauder S, Shokat K, Surette MG, et al. The LuxS family of bacterial autoinducers: biosynthesis of a novel quorum-sensing signal molecule[J]. Molecular Microbiology, 2001, 41(2): 463-476. DOI:10.1046/j.1365-2958.2001.02532.x |
| [9] |
Thurnheer T, Gmür R, Shapiro S, et al. Mass transport of macromolecules within an in vitro model of supragingival plaque[J]. Applied and Environmental Microbiology, 2003, 69(3): 1702-1709. DOI:10.1128/AEM.69.3.1702-1709.2003 |
| [10] |
Desai M, Bühler T, Weller PH, et al. Increasing resistance of planktonic and biofilm cultures of Burkholderia cepacia to ciprofloxacin and ceftazidime during exponential growth[J]. Journal of Antimicrobial Chemotherapy, 1998, 42(2): 153-160. DOI:10.1093/jac/42.2.153 |
| [11] |
Zhang XZ, Zhang SX, Li HP, et al. Review on research of Vibrio anguillarum pathogenicity to aquatic animals in mariculture[J]. Modern Fisheries Information, 2007, 22(1): 16-19, 22. 张新中, 张世秀, 李海平, 等. 海水养殖动物致病性(Pathogenicity)鳗弧菌(Vibro anguillarum)的研究综述[J]. 现代渔业信息, 2007, 22(1): 16-19, 22. |
| [12] |
Ge L, Huang J, Li Q. Advance in studies on virulence genes of Vibrio anguillarum[J]. Microbiology China, 2007, 34(3): 584-586. 戈蕾, 黄倢, 李琪. 鳗弧菌毒力相关基因的研究进展[J]. 微生物学通报, 2007, 34(3): 584-586. |
| [13] |
Yu JH, Shen JH, Wang XH, et al. Oral vaccination of sea perch, Lateolabrax japonicas, against Vibrio anguillarum using microencapsulated vaccine[J]. Journal of Fishery Sciences of China, 2001, 8(2): 76-79. 余俊红, 沈继红, 王祥红, 等. 鳗弧菌口服微胶囊疫苗的制备及其对鲈鱼的免疫效果[J]. 中国水产科学, 2001, 8(2): 76-79. |
| [14] |
Wang J, Yan QP, Su YQ, et al. Studies on the rapid detection of Vibrio alginolyticus by indirect fluorescent antibody staining[J]. Marine Sciences, 2004, 26(7): 1-4. 王军, 鄢庆枇, 苏永全, 等. 溶藻弧菌的间接荧光抗体快速检测[J]. 海洋科学, 2004, 26(7): 1-4. |
| [15] |
Zhan WB, Qi JG, Liu HM, et al. Cross reactions between six pathogenic bacteria and their antisera[J]. Journal of Fishery Sciences of China, 2004, 11(1): 14-19. 战文斌, 齐继光, 刘洪明, 等. 水产动物6种主要病原菌与抗血清的免疫交叉反应[J]. 中国水产科学, 2004, 11(1): 14-19. |
| [16] |
Bricknell IR, Bowden TJ, Verner-Jeffreys DW, et al. Susceptivility of juvenile and subadult Atlantic halibut (Hippoglossus hippoglossus L.) to infection by Vibrio anguillarum and efficacy of protection induced by vaccination[J]. Fish & Shellfish Immunology, 2000, 10(4): 319-327. |
| [17] |
Yu JH, Chen JX, Li Y, et al. Detection of Vibrio anguillarum from Lateolabrax japonicus by using Polymerase Chain Reaction (PCR)[J]. Journal of Oceanography of Huanghai & Bohai Seas, 2002, 20(2): 60-64. 余俊红, 陈吉祥, 厉云, 等. 聚合酶链反应(PCR)检测花鲈鳗弧菌感染[J]. 黄渤海海洋, 2002, 20(2): 60-64. |
| [18] |
Lin YY, Yu JL, Lu Q, et al. Effects of Magnesium ions on the mucoid Pseudomonas aeruginosa biofilm[J]. Chinese Journal of Microecology, 2009, 21(6): 515-518. 林雅茵, 余加林, 卢起, 等. 镁离子对黏液型铜绿假单胞菌生物膜形成过程的影响[J]. 中国微生态学杂志, 2009, 21(6): 515-518. |
| [19] |
Zhou W, Shen L, Zhang Y, et al. Effect of andrographolide against Staphylococcus aureus biofilm and its synergistic activity with gentamicin[J]. Journal of Third Military Medical University, 2014, 36(16): 1694-1698. 周薇, 沈犁, 张燕, 等. 穿心莲内酯抗金黄色葡萄球菌生物膜作用及其与庆大霉素的协同作用[J]. 第三军医大学学报, 2014, 36(16): 1694-1698. |
| [20] |
Stepanović S, Vuković D, Dakić I, et al. Modified microtiter-plate test for quantification of staphylococcal biofilm formation[J]. Journal of Microbiological Methods, 2000, 40(2): 175-179. DOI:10.1016/S0167-7012(00)00122-6 |
| [21] |
Yuan HL, Su J, Hu K, et al. Effects of environmental factors on biofilm formation of Saprolegnia[J]. Microbiology China, 2014, 41(9): 1829-1836. 袁海兰, 苏建, 胡鲲, 等. 环境因子对水霉菌生物膜形成的影响[J]. 微生物学通报, 2014, 41(9): 1829-1836. |
| [22] |
Chen Q, Yan QP, Wang KJ, et al. The portal of entry for pathogenic Vibrio alginolyticus into large yellow croaker Pseudosciaene crocea, and characteristics of the bacterial adhesion to the mucus[J]. Diseases of Aquatic Organisms, 2008, 80(3): 181-188. |
| [23] |
Sternberg C, Christensen BB, Johansen T, et al. Distribution of bacterial growth activity in flow-chamber biofilms[J]. Applied and Environmental Microbiology, 1999, 65(9): 4108-4117. |
| [24] |
Pratt LA, Kolter R. Genetic analysis of Escherichia coli biofilm formation: roles of flagella, motility, chemotaxis and type Ⅰ pili[J]. Molecular Microbiology, 1998, 30(2): 285-293. DOI:10.1046/j.1365-2958.1998.01061.x |
| [25] |
Johnson LR. Microcolony and biofilm formation as a survival strategy for bacteria[J]. Journal of Theoretical Biology, 2008, 251(1): 24-34. DOI:10.1016/j.jtbi.2007.10.039 |
| [26] |
Chen JX, Li CF, Yan XH, et al. Studies on biological characteristics of five pathogenic Vibrio anguillarum strains isolated from diseased turbot (Scophthalmus maximus) in Shandong province of China[J]. Chinese High Technology Letters, 2005, 15(6): 92-96. 陈吉祥, 李彩风, 颜显辉, 等. 大菱鲆病原鳗弧菌生物学及分子特征研究[J]. 高技术通讯, 2005, 15(6): 92-96. |
| [27] |
Mo ZL, Mao YX, Chen SY, et al. Classification for one pathogenic Vibrio anguillarum strain isolated from skin-ulcer flounder[J]. Acta Microbiologica Sinica, 2002, 42(3): 263-269. 莫照兰, 茅云翔, 陈师勇, 等. 一株牙鲆皮肤溃烂症病原菌的鉴定[J]. 微生物学报, 2002, 42(3): 263-269. |
| [28] |
Geesey GG, Wigglesworth-Cooksey B, Cooksey KE. Influence of calcium and other cations on surface adhesion of bacteria and diatoms: a review[J]. Biofouling, 2000, 15(1/3): 195-205. |
| [29] |
Villasenor JC, van Loosdrecht MCM, Picioreanu C, et al. Influence of different substrates on the formation of biofilms in a biofilm airlift suspension reactor[J]. Water Science and Technology, 2000, 41(4): 323-330. |
| [30] |
Sutherland IW. Biofilm exopolysaccharides: a strong and sticky framework[J]. Microbiology, 2001, 147(1): 3-9. DOI:10.1099/00221287-147-1-3 |
 2018, Vol. 45
2018, Vol. 45




