扩展功能
文章信息
- 曹际, 马林, 张文畅, 张舒六, 张嘉俊, 李槿年, 黄安宁
- CAO Ji, MA Lin, ZHANG Wen-Chang, ZHANG Shu-Liu, ZHANG Jia-Jun, LI Jin-Nian, HUANG An-Ning
- 大黄鱼源溶藻弧菌的鉴定及其菌蜕制备
- Identification of Vibrio alginolyticus isolated from large yellow croaker (Pseudosciaena crocea) and generation of V. alginolyticus ghosts
- 微生物学通报, 2018, 45(1): 129-137
- Microbiology China, 2018, 45(1): 129-137
- DOI: 10.13344/j.microbiol.china.170186
-
文章历史
- 收稿日期: 2017-03-05
- 接受日期: 2017-04-25
- 优先数字出版日期(www.cnki.net): 2017-05-25
溶藻弧菌(Vibrio alginolyticus)是一种人和海洋动物共患病原菌。早在1979年Schmidt等[1]报道该菌对人类有致病作用,是沿海地区食物中毒和腹泻的重要病原菌。随后发现它还能通过受损皮肤感染大黄鱼(Pseudosciaena crocea)、斜带石斑鱼(Epinephelus coioides)、红笛鲷(Lutjanus erythopterus)等多种海水养殖鱼类,引起鱼类溃疡病、腹水症或出血病的发生与流行,给水产养殖业造成较大的经济损失[2-4]。因此,有效控制溶藻弧菌感染已成为水产养殖业可持续健康发展的迫切要求。
与使用抗生素和化学药物相比,渔用疫苗的研发和应用是防控鱼类细菌性疾病的有效手段,而疫苗的接种途径直接影响免疫效果。注射免疫是现阶段渔用疫苗的主要接种途径,该途径能有效利用抗原而获得良好的免疫效果,但存在费时费力、易伤鱼体、不适用于小规格鱼体等缺点。浸泡免疫操作简单、不伤鱼体,但所需抗原量较大。口服疫苗解决了小规格鱼体免疫问题,也避免了鱼类应激反应,还可同时诱导系统和黏膜免疫应答,是水产养殖生产中最具应用前景的疫苗[5]。目前,已报道的溶藻弧菌疫苗有灭活苗、基因工程亚单位苗、DNA疫苗和弱毒苗[6-9]。虽然这些疫苗具有一定的免疫保护效果,但是前3种疫苗易被体内酶类降解而不能用于口服免疫;减毒活疫苗存在毒力返强以及与野毒株发生重组而出现新毒菌株的危险。由此可见,研发安全高效、制备简单、成本低廉、尤其是适于口服免疫的渔用溶藻弧菌疫苗具有重要意义。
菌蜕(Bacterial ghosts,BGs)是通过诱导PhiX174噬菌体裂解基因E (LysisE)在革兰氏阴性菌中表达所获得的无细胞内容物的细菌空壳。由于菌蜕是以非变性方法制备而成,完好地保留了原始细菌的形态、表面抗原结构和免疫刺激复合物,因此具有良好的免疫原性和内在佐剂活性,既可直接作为疫苗使用,也可充当疫苗递送载体[10]。与传统灭活苗相比,菌蜕因不含细胞内容物而更安全;可以类似活菌方式诱导机体产生强烈的体液和细胞免疫应答,获得更好的免疫效果;易于大规模生产,成本低廉,且制成的冻干苗在室温下可长时间保存。此外,已有实验证实菌蜕通过口服途径免疫动物,能诱导产生有效的黏膜免疫应答,是适合于口服免疫的新型灭活疫苗[11-12]。本研究对分离自患溃疡病大黄鱼的病原弧菌菌株16-3进行表型与分子遗传学鉴定,确定该菌株为溶藻弧菌。同时将构建的温控裂解质粒pBV220-LysisE电转至溶藻弧菌菌株16-3,通过改变温度控制LysisE在重组溶藻弧菌中的表达,在最佳条件下制备出溶藻弧菌菌株16-3菌蜕,为开发渔用溶藻弧菌口服疫苗和菌蜕载体疫苗防治该菌感染奠定了基础。
1 材料与方法 1.1 实验材料 1.1.1 菌株和质粒菌株16-3由本实验室从患溃疡病大黄鱼肝脏中分离并保存,经回归感染试验证实为病原菌,其对实验鱼半数致死量(LD50)为1.6×107 CFU/尾;大肠杆菌DH5α菌株由本实验室保存;温控型表达质粒pBV220购自北京鼎国昌盛生物技术公司;噬菌体PhiX174 RF I DNA购自NEB生物技术公司。
1.1.2 主要试剂和仪器基因组DNA提取试剂盒、质粒提取试剂盒和核酸限制性内切酶等分子生物学试剂,北京天根生化科技有限公司;戊二醛、乙酸异戊酯和磷钨酸,国药集团化学试剂有限公司。
革兰氏阴性杆菌鉴定条ID32 GN和微生物ATB半自动鉴定系统,法国梅里埃公司;紫外可见分光光度计,上海仪电分析仪器有限公司;生化培养箱,上海一恒科学仪器有限公司;医用低温保存箱,海尔特种电器有限公司;台式高速冷冻离心机,美国贝克曼库尔特公司;冷场发射扫描电子显微镜、型透射电子显微镜,日本日立公司。
1.1.3 培养基脑心浸液(BHI)培养基(g/L):脑心浸粉17.5,葡萄糖2.0,蛋白胨10.0,NaCl 5.0,Na2HPO42.5。
LB培养基(g/L):胰蛋白胨10.0,酵母粉5.0,NaCl 10.0,固体培养基加琼脂粉20.0,pH 7.0。
1.2 菌株16-3的鉴定 1.2.1 形态学检查将菌株16-3接种到含3% NaCl的脑心浸液(BHI)培养基,30 ℃、180 r/min培养18 h,取菌液涂片、革兰氏染色、油镜下观察菌体的形态与染色特性。滴加菌液至铜网上,经磷钨酸染色后于透射电镜下观察细菌的形态结构。
1.2.2 生理生化特征测定使用革兰氏阴性杆菌鉴定条ID32 GN和微生物ATB半自动鉴定仪测定菌株16-3的生理生化特性,具体操作按鉴定条说明书进行。
1.2.3 16S rRNA基因PCR扩增与系统发育分析使用基因组DNA提取试剂盒提取菌株16-3的基因组DNA,以细菌16S rRNA基因通用引物(正向引物:5′-AGAGTTTGATCCTGGCTCAG-3′;反向引物:5′-TACGGTTACCTTGTTACGACTT-3′) PCR扩增16S rRNA基因。PCR反应体系(25 μL):10×PCR Buffer 2.5 μL,25 mmol/L MgCl2 1.5 μL,10 mmol/L dNTPs 0.5 μL,5 U/μL Taq酶0.3 μL,10 μmol/L上、下游引物各0.5 μL,模板2.0 μL,ddH2O 17.2 μL。PCR反应条件:94 ℃ 5 min;94 ℃ 30 s,52 ℃ 50 s,72 ℃ 100 s,30个循环;72 ℃ 10 min。PCR扩增后的产物经1.0%琼脂糖凝胶电泳检测目的条带,PCR产物送至生工生物工程(上海)股份有限公司测序,将测得的序列进行Blast检索,选取18条一致性较高的相关序列,采用邻接法构建系统发育树,并通过自举分析进行置信度检测,自举数据集为1 000次。
1.3 裂解基因LysisE的PCR扩增根据PhiX174 RF I DNA中LysisE基因设计引物:5′-CCGGAATTCATGGTACGCTGGACTTTGTG GGATACC-3′ (EcoR Ⅰ);5′-TGCACTGCAGTCACT CCTTCCGCACGTAATT-3′ (Pst Ⅰ)。以PhiX174 RF I DNA为模板,PCR扩增LysisE。PCR反应体系(25 μL):10×PCR Buffer 2.5 μL,MgCl2(25 mmol/L) 1.5 μL,dNTPs (10 mmol/L) 0.5 μL,Taq酶(5 U/μL) 0.5 μL,上、下游引物(10 μmol/L)各1.0 μL,模板1.0 μL,ddH2O 17.0 μL。PCR反应条件:95 ℃ 5 min;95 ℃ 30 s,60 ℃ 30 s,72 ℃ 50 s,30个循环;72 ℃ 10 min。PCR产物经1.0%琼脂糖凝胶电泳鉴定后,使用胶回收试剂盒回收纯化目的片段。
1.4 温控裂解质粒pBV220-LysisE的构建分别将回收纯化的PCR产物和温控诱导表达载体pBV220进行EcoR Ⅰ和Pst Ⅰ双酶切,回收纯化酶切产物并用T4 DNA连接酶于16 ℃连接过夜。将连接产物转化大肠杆菌DH5α感受态细胞,涂布于含Amp (100 mg/L)的LB固体培养基,28 ℃培养至长出菌落。挑取单菌落接种至含Amp (100 mg/L)的LB液体培养基中,28 ℃、150 r/min振荡培养过夜,使用质粒提取试剂盒提取质粒,对质粒进行PCR鉴定和双酶切鉴定,将鉴定正确的重组质粒命名为pBV220-LysisE。
1.5 溶藻弧菌菌蜕的制备 1.5.1 重组溶藻弧菌菌株16-3(pBV220-LysisE)的构建将提取的温控裂解质粒pBV220-LysisE电转至溶藻弧菌菌株16-3感受态细胞,参数为1.8 kV/cm、200 Ω、25 μF、4.9 ms。电转完毕后迅速吸出菌液,加入950 μL预热的SOC液体培养基,28 ℃复苏培养4 h。取复苏后菌液涂布含Amp (100 mg/L)的LB固体培养基,28 ℃培养至长出菌落。按1.3和1.4节方法进行PCR和双酶切鉴定。
1.5.2 重组溶藻弧菌菌株16-3的裂解条件优化取鉴定正确的重组菌株16-3(pBV220-LysisE)接种至3 mL含Amp (100 mg/L)的LB液体培养基中,28 ℃、180 r/min振荡培养过夜。次日,按1:100转接后28 ℃、180 r/min振荡培养至初始OD600值分别为0.2、0.3、0.4和0.5时,迅速将温度升至42 ℃诱导LysisE基因表达以裂解细菌,期间每隔30 min取菌液测OD600值,直至培养物的OD600不再下降为止,绘制溶菌动力曲线。采用倾注平板法检测溶菌前后菌液中的活菌数。即分别对各组诱导溶菌前和溶菌结束后的菌液进行10倍系列稀释,取10-5-10-9稀释菌液各1 mL加入无菌平皿中,再倾注50 ℃左右的含Amp (100 mg/L)的LB固体培养基,每一稀释度做2个重复,28 ℃培养24 h,进行活菌计数。然后,依据公式计算菌蜕裂解效率:裂解效率(%)= (1-诱导后活菌数/诱导前活菌数)×100。通过各组的溶菌动力曲线和裂解效率确定最佳裂解条件。
1.5.3 溶藻弧菌菌株16-3菌蜕的制备在最佳裂解条件下制备溶藻弧菌菌蜕。即重组溶藻弧菌菌株16-3(pBV220-LysisE)种子液按1:100转接至100 mL含Amp (100 mg/L)的LB液体培养基中,28 ℃、180 r/min振荡培养到OD600值为0.3,转至42 ℃诱导培养3 h,4 ℃、8 000 r/min离心10 min收集沉淀。用无菌PBS洗涤3次,再用1/3原体积的PBS重悬沉淀并转移至安瓿瓶中,-80 ℃预冻4 h、真空冷冻干燥24 h后,即为冻干菌蜕。采用倾注平板法对冻干后的菌蜕进行活菌计数。
1.6 溶藻弧菌菌株16-3菌蜕的电镜观察 1.6.1 扫描电镜观察将制备的菌蜕重悬后用2.5%戊二醛固定过夜。次日,用PBS洗涤3次,收集菌体沉淀。菌体沉淀经乙醇逐级脱水、乙酸异戊酯置换、CO2临界点干燥和喷金等步骤处理后,用扫描电镜观察并拍照。
1.6.2 透射电镜观察将制备的菌蜕重悬后用2.5%戊二醛4 ℃固定2 h,再用PBS洗涤3次并重悬。菌液经磷钨酸染色、干燥后,用透射电镜观察并拍照。
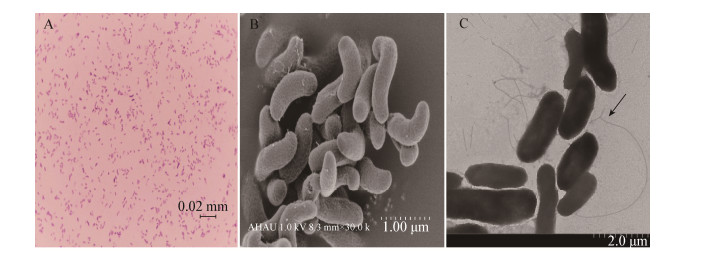
2 结果与分析 2.1 菌株16-3的形态与生理生化特征如图 1所示,光学显微镜下菌株16-3为革兰氏阴性菌、略显弧状、排列不规则;扫描电镜下菌体呈弧形二端钝圆,大小约为(0.50-0.85) μm× (1.40-2.65) μm;透射电镜下可见该菌具有鞭毛,无荚膜、菌毛和芽孢。微生物ATB半自动鉴定系统检测结果(表 1)显示该菌株归属于溶藻弧菌(Vibrio alginolyticus),在种水平上鉴定结果的符合率达92.7%。
|
| 图 1 菌株16-3的形态与结构 Figure 1 Morphology and structure of the strain 16-3 注:A:光镜照片(1 000×);B:扫描电镜照片(30 000×);C:透射电镜照片(6 000×),箭头示鞭毛. Note: A: Light micrograph (1 000×); B: Scanning electron micrograph (30 000×); C: Transmission electron micrograph (6 000×), arrow shows flagellum. |
|
|
| 鉴定项目 Characteristics |
菌株16-3 Strain 16-3 |
溶藻弧菌 ATCC 33787 V. alginolyticus ATCC 33787 |
| L-鼠李糖RHA | + | + |
| N-乙酰葡萄糖胺NAG | + | + |
| D-核糖RIB | + | + |
| 肌醇INO | - | - |
| 蔗糖SAC | - | - |
| D-麦芽糖MAL | + | + |
| 衣康酸盐同化ITA | - | - |
| 辛二酸盐同化SUB | - | - |
| 丙酸盐同化PROP | - | - |
| 乙酸盐ACE | - | - |
| Dl-乳酸盐同化LAT | + | + |
| 丙氨酸同化ALA | - | - |
| 5-酮基-葡萄糖酸5KG | - | - |
| 糖原GLYG | - | - |
| 3-羟基-苯甲酸MOBE | - | - |
| 丝氨酸同化SER | - | - |
| D-甘露醇MAN | + | + |
| D-葡萄糖GLU | + | + |
| 水杨素SAL | - | - |
| D-蜜二糖MEL | - | - |
| L-岩藻糖FUC | - | - |
| D-山梨醇SOR | - | - |
| L-阿拉伯糖ARA | - | - |
| 丙氨酸同化MNT | - | - |
| 癸酸盐同化VALT | - | - |
| 戊酸盐同化CAP | - | - |
| 柠檬酸盐用CIT | + | + |
| 组氨酸同化HIS | + | + |
| 2-酮葡萄糖酸盐2KG | - | - |
| 3-羟基-丁酸盐3OBU | - | - |
| 4-羟基-苯甲酸4pOBE | - | - |
| 脯氨酸PRO | + | + |
| 注:+:阳性;-:阴性.
Note: +: positive; -: negative. |
||
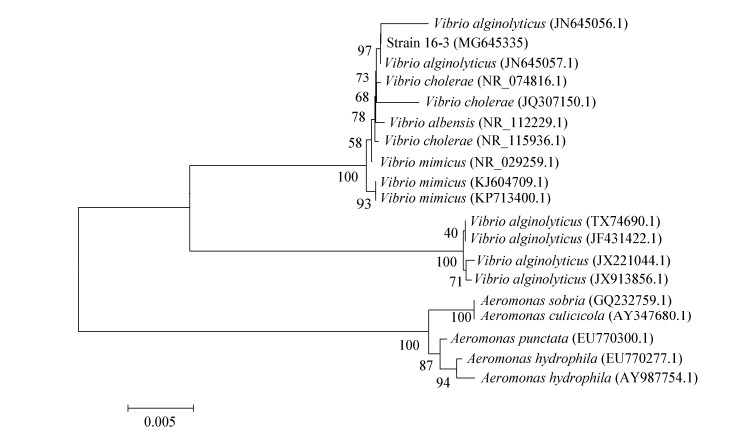
测序结果显示菌株16-3的16S rRNA基因序列长度为1 508 bp。从构建的系统发育树(图 2)可知,菌株16-3与溶藻弧菌参比菌株CPVA110 (GenBank登录号为JN645057.1)自然聚为一支,自举分析置信度为97%,一致性分析显示两者具有99.6%的序列相似性。
|
| 图 2 菌株16-3的16S rRNA基因序列构建的系统进化树 Figure 2 Phylogenetic tree based on 16S rRNA gene sequence of the strain 16-3 注:分支点上的数字表示构建系统树时1 000次计算时形成该节点的百分比;括号中的序号代表菌株的GenBank登录号;标尺0.005代表0.5%的16S rRNA基因序列的进化差异. Note: The bootstrap values (%) presented at the branches were calculated from 1 000 replications; The sequence number in the bracket means the GenBank accession number of the strain; The scale bar 0.005 means 0.5% 16S rRNA gene sequence difference. |
|
|
综合菌株16-3的形态、生理生化和16S rRNA序列的特征,确定菌株16-3为溶藻弧菌。
2.3 温控裂解质粒pBV220-LysisE的鉴定PCR扩增LysisE基因并回收产物,将其与温控表达质粒pBV220连接,构建温控裂解质粒pBV220-LysisE,经PCR鉴定获得了一条大小约276 bp的LysisE基因片段;EcoR Ⅰ/Pst Ⅰ双酶切鉴定获得了两条大小分别为3 667 bp (pBV220质粒)和276 bp (LysisE基因)的目的基因片段(图 3),说明温控裂解质粒pBV220-LysisE构建成功。

|
| 图 3 温控裂解质粒pBV220-LysisE的PCR和双酶切鉴定 Figure 3 Identification of temperature-controlled lysis plasmid pBV220-LysisE by PCR and restriction enzyme digestion with EcoR Ⅰ and Pst Ⅰ 注:M1:DL2000分子量标准;M2:DL10000分子量标准;1:LysisE基因的PCR产物;2:pBV220-LysisE经EcoR Ⅰ和Pst Ⅰ双酶切产物;3:温控裂解质粒pBV220-LysisE. Note: M1: DL2000 DNA Marker; M2: DL10000 DNA Marker; 1: PCR product of LysisE gene; 2: The product of pBV220-LysisE double-digested with EcoR Ⅰ and Pst Ⅰ; 3: temperature-controlled lysis plasmid pBV220-LysisE. |
|
|
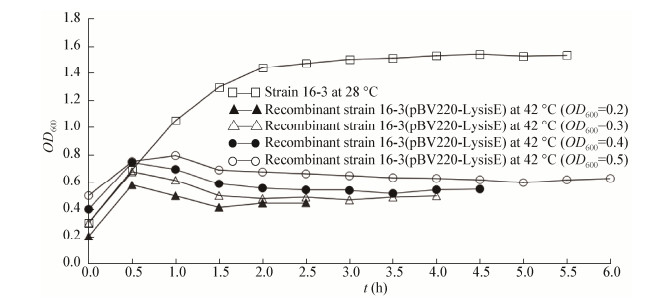
将不同起始浓度的菌株16-3(pBV220-LysisE)菌液同时进行升温诱导,对比其溶菌动力曲线和裂解效率。如图 4所示,当菌液起始OD600值分别为0.2、0.3、0.4和0.5时,分别于诱导后1.5、3.0、4.5和5.0 h时OD600值降至最低,随后OD600值趋于平稳,溶菌结束;而整个过程中,28 ℃培养条件下的溶藻弧菌菌株16-3生长正常,OD600值快速升高后趋于平稳。活菌计数结果显示,起始OD600值为0.2、0.3、0.4和0.5的菌液诱导前的活菌数分别为3×107、2×108、3×108、3.95×108CFU/mL,诱导后的活菌数分别为3.6×107、6.2×106、2.2×107、4.8×107 CFU/mL,依据公式(见1.5.2节)计算其裂解效率分别为88.0%、96.9%、92.7%和87.9%。结果表明溶藻弧菌16-3菌蜕制备的最佳条件是选择起始浓度OD600为0.3的菌液进行诱导,诱导3 h后即可收获菌蜕进行冻干处理。采用倾注平板法对在最佳条件下制备的冻干菌蜕进行活菌计数,发现无活菌存在。
与溶藻弧菌菌株16-3的形态、结构相比(图 1B、C),菌株16-3菌蜕在扫描电镜下细胞的形态与表面结构无明显变化,但在细胞两端或中央出现直径介于40.3-132.0 nm的跨膜溶菌孔道,细胞发生皱缩(图 5A);透射电镜观察结果显示,菌蜕保留了完整的细菌外膜,但细胞内容物流失明显(图 5B)。

|
| 图 5 溶藻弧菌菌株16-3菌蜕的电镜照片 Figure 5 Electron micrograph of V. alginolyticus strain 16-3 ghosts 注:A:菌株16-3菌蜕的扫描电镜照片(30 000×),箭头所示为跨膜溶菌孔道;B:菌株16-3菌蜕的透射电镜照片(4 000×). Note: A: Scanning electron micrograph of the strain 16-3 ghosts (30 000×), arrow indicates transmenbrane lysis tunnels; B: Transmission electron micrograph of the strain 16-3 ghosts (4 000×). |
|
|
细菌的鉴定方法主要包括表型鉴定和分子遗传学鉴定。表型鉴定是通过检查细菌形态和测定细菌生理生化特性对细菌加以分类。传统的生理生化特性测定方法繁琐复杂,目前多使用商业化的细菌鉴定系统,如法国生物梅里埃公司的微生物API和ATB全(半)自动鉴定系统进行快速鉴定[13]。但是,这些鉴定系统是基于细菌在生长阶段利用底物产生代谢物的生化反应进行鉴定的,其实质是酶促反应,容易受到不同培养条件的干扰而使鉴定结果出现误差。细菌16S rRNA基因的高保守性使其作为标记基因广泛应用于细菌分子遗传学鉴定和细菌分子流行病学研究。然而,对于亲缘关系较近的菌种而言,其种间的16S rRNA基因序列相似性较高,导致种水平鉴定的分辨率不高。对此,本研究采用表型鉴定和分子遗传学鉴定相结合方法对分离自大黄鱼溃疡病的病原菌菌株16-3进行鉴定。生理生化特性鉴定结果显示菌株16-3归属于溶藻弧菌,种水平上鉴定结果符合率为92.7%;16S rRNA基因序列系统发育树分析结果显示菌株16-3与溶藻弧菌参考菌株CPVA110自然聚为一支,置信度高达97%。综合表型鉴定和分子遗传学鉴定结果,确定菌株16-3为溶藻弧菌。说明这两种方法在细菌鉴定中可以相互补充,得出更为可靠的鉴定结果。
近年来鱼类细菌性疾病频繁发生,作为一种可用于口服免疫的高效疫苗,菌蜕疫苗在鱼类细菌性疾病防控中的应用已成为研究热点。目前已有较多实验室成功制备了爱德华氏菌、气单胞菌、海豚链球菌、柱状黄杆菌和鳗弧菌的菌蜕疫苗[14-18],但是尚无制备溶藻弧菌菌蜕的报道。菌蜕制备的核心是对裂解基因(LysisE)的稳定抑制和可控转录表达。LysisE可受控于λpL/pR-cI857表达系统,该表达系统处于28 ℃时,阻遏蛋白cIts857结合在pL/pR双启动子区域而抑制LysisE的表达,细菌继续生长;而当培养温度调至42 ℃时,cIts857蛋白的构象发生改变而失活,双启动子诱导LysisE高效表达,实现对细菌的裂解,并且裂解蛋白E的表达量受细菌生长状态的影响[19]。为了有效获得溶藻弧菌菌蜕,本研究比较了不同起始浓度的重组溶藻弧菌菌液对溶菌动力曲线和裂解效率的影响。结果发现当菌液起始OD600值为0.2、0.3、0.4和0.5时,分别于诱导后1.5、3.0、4.5和5.0 h溶菌结束,裂解效率分别为88.0%、96.9%、92.7%和87.9%。综合裂解效率和溶菌时间指标,确定溶藻弧菌菌蜕制备的最佳条件是选择起始浓度OD600为0.3的菌液进行诱导,诱导3 h后即可收集菌蜕。
在菌蜕制备过程中,宿主菌通常无法获得100%的裂解率。对此,一些研究者试图利用裂解基因E和金黄色葡萄球菌核酸酶A基因共表达来实现细菌的完全灭活,但是裂解效果并未得到显著提高[20]。本研究在上述最佳条件下制备溶藻弧菌菌蜕,也未能使细菌完全裂解。为解决这一问题,我们最初尝试将诱导时间从3 h延长至4 h,结果显示残留活菌量更多。随后,又采用在不加保护剂的情况下将菌蜕冷冻干燥28 h,经活菌检测发现残余的活菌被彻底灭活。其原因是在有保护剂的情况冷冻干燥的细菌也不能保证100%存活,无保护剂的冷冻细菌,因冰晶的形成使细菌更不容易存活,因此没有分离到活菌[21]。我们的这一结果与温晶等[22]、吕敏娜等[23]和吴忆春[24]的研究报道类似,至于在冷冻干燥过程中菌蜕结构和免疫原性是否发生变化,仍需要进一步研究。
本研究构建了携带温控裂解质粒的重组溶藻弧菌,并在最佳裂解条件下制备出溶藻弧菌菌蜕,随后将继续大量制备经冻干处理的溶藻弧菌菌蜕疫苗,开展其动物免疫试验,评价其免疫保护效果,为免疫防控水产动物溶藻弧菌病提供物质基础和理论依据。
| [1] |
Schmidt U, Chmel H, Cobbs C. Vibrio alginolyticus infections in humans[J]. Journal of Clinical Microbiology, 1979, 10(5): 666-668. |
| [2] |
Jin S, Wang GL, Zhao QS, et al. Epidemiology of vibriosis in large yellow croaker Pseudosciaena crocea (Richardson) in marine cage culture[J]. Fisheries Science, 2005, 24(1): 17-19. 金珊, 王国良, 赵青松, 等. 海水网箱养殖大黄鱼弧菌病的流行病学研究[J]. 水产科学, 2005, 24(1): 17-19. |
| [3] |
Lee KK. Pathogenesis studies on Vibrio alginolyticus in the grouper, Epinephelus malabaricus, Bloch et Schneider[J]. Microbial Pathogenesis, 1995, 19(1): 39-48. DOI:10.1016/S0882-4010(85)90000-2 |
| [4] |
Damir K, Irena VS, Damir V, et al. Occurrence, characterization and antimicrobial susceptibility of Vibrio alginolyticus in the Eastern Adriatic Sea[J]. Marine Pollution Bulletin, 2013, 75(1/2): 46-52. |
| [5] |
Sommerset I, Kross y B, Biering E, et al. Vaccines for fish in aquaculture[J]. Expert Review of Vaccines, 2005, 4(1): 89-101. DOI:10.1586/14760584.4.1.89 |
| [6] |
Li J, Ma SY, Woo NYS. Vaccination of Silver Sea Bream (Sparus sarba) against Vibrio alginolyticus: protective evaluation of different vaccinating modalities[J]. International Journal of Molecular Sciences, 2015, 17(1): E40. DOI:10.3390/ijms17010040 |
| [7] |
Cai SH, Yao SY, Lu YS, et al. Immune response in Lutjanus erythropterus induced by the major outer membrane protein (OmpU) of Vibrio alginolyticus[J]. Diseases of Aquatic Organisms, 2010, 90(1): 63-68. DOI:10.3354/dao02206 |
| [8] |
Cai SH, Lu YS, Jian JC, et al. Protection against Vibrio alginolyticus in crimson snapper Lutjanus erythropterus immunized with a DNA vaccine containing the OmpW gene[J]. Diseases of Aquatic Organisms, 2013, 106(1): 39-47. DOI:10.3354/dao02617 |
| [9] |
Idris NH, Al-Haj NA, Shamsudin MN, et al. Evaluation of safe attenuated Vibrio alginolyticus for oral vaccination of Lates calcarifer against vibriosis[J]. Research Journal of Biological Sciences, 2009, 4(4): 509-513. |
| [10] |
Langemann T, Koller VJ, Muhammad A, et al. The bacterial ghost platform system: production and applications[J]. Bioengineered Bugs, 2010, 1(5): 326-336. DOI:10.4161/bbug.1.5.12540 |
| [11] |
Wang XP, Lu CP. Mice orally vaccinated with Edwardsiella tarda ghosts are significantly protected against infection[J]. Vaccine, 2009, 27(10): 1571-1578. DOI:10.1016/j.vaccine.2009.01.002 |
| [12] |
Mayr UB, Haller C, Haidinger W, et al. Bacterial ghosts as an oral vaccine: a single dose of Escherichia coli O157:H7 bacterial ghosts protects mice against lethal challenge[J]. Infection and Immunity, 2005, 73(8): 4810-4817. DOI:10.1128/IAI.73.8.4810-4817.2005 |
| [13] |
Shao XH. Analysis of identifying results of ATB expression equipment and manual method[J]. Anhui Medical Journal, 2009, 30(4): 472-473. 邵小华. ATB细菌鉴定仪与手工法鉴定结果比较分析[J]. 安徽医学, 2009, 30(4): 472-473. |
| [14] |
Kwon SR, Lee EH, Nam YK, et al. Efficacy of oral immunization with Edwardsiella tarda ghosts against edwardsiellosis in olive flounder (Paralichthys olivaceus)[J]. Aquaculture, 2007, 269(1/4): 84-88. |
| [15] |
Tu FP, Chu WH, Zhang XY, et al. Effect of oral immunization with Aeromonas hydrophila ghosts on protection against experimental fish infection[J]. Letters in Applied Microbiology, 2010, 50(1): 13-17. DOI:10.1111/lam.2009.50.issue-1 |
| [16] |
Pa CH, Park SJ, Kim KH, et al. Production of recombinant ghost bacterial vaccine against streptococcal disease of olive flounder[J]. Process Biochemistry, 2010, 45(3): 317-322. DOI:10.1016/j.procbio.2009.10.003 |
| [17] |
Zhu WX, Yang GW, Zhang YY, et al. Generation of biotechnology-derived Flavobacterium columnare ghosts by PhiX174 gene E-mediated inactivation and the potential as vaccine candidates against infection in grass carp[J]. Journal of Biomedicine and Biotechnology, 2012, 2012: 760730. |
| [18] |
Kwon SR, Kang YJ, Lee DJ, et al. Generation of Vibrio anguillarum ghost by coexpression of PhiX 174 lysis E gene and staphylococcal nuclease A gene[J]. Molecular Biotechnology, 2009, 42(2): 154-159. DOI:10.1007/s12033-009-9147-y |
| [19] |
Witte A, Bl si U, Halfmann G, et al. PhiX174 protein E-mediated lysis of Escherichia coli[J]. Biochimie, 1990, 72(2/3): 191-200. |
| [20] |
Haidinger W, Mayr UB, Szostak MP, et al. Escherichia coli ghost production by expression of lysis gene E and staphylococcal nuclease[J]. Applied and Environmental Microbiology, 2003, 69(10): 6106-6113. DOI:10.1128/AEM.69.10.6106-6113.2003 |
| [21] |
Niu XY, Deng LL, Zeng KF, et al. Application of protectants in freeze-dried microorganism[J]. Science and Technology of Food Industry, 2015, 36(1): 390-394, 399. 牛晓影, 邓丽莉, 曾凯芳, 等. 保护剂在微生物真空冷冻干燥中的应用[J]. 食品工业科技, 2015, 36(1): 390-394, 399. |
| [22] |
Wen J, Kou ZH, Yu H, et al. Preparation and identification of Salmonella enterica Ty21a bacterial ghosts[J]. Chinese Journal of Zoonoses, 2011, 27(6): 479-483. 温晶, 寇志华, 于虹, 等. 人伤寒沙门菌Ty21a菌蜕的制备[J]. 中国人兽共患病学报, 2011, 27(6): 479-483. |
| [23] |
Lv MN, Qin ZH, Yu JS, et al. Immunogenicity of baterial ghosts from Escherichia coli O78 isolated from ducklings[J]. Chinese Journal of Preventive Veterinary Medicine, 2010, 11(9): 712-715. 吕敏娜, 覃宗华, 余劲术, 等. 鸭源大肠杆菌O78菌蜕的制备及免疫原性研究[J]. 中国预防兽医学报, 2010, 11(9): 712-715. |
| [24] |
Wu YC. Production and lysis efficiency of pig pathogenic Escherichia coli O139 ghost[J]. Chinese Veterinary Science, 2013, 43(5): 476-479. 吴忆春. 猪大肠杆菌O139菌影的制备及其裂解效率[J]. 中国兽医科学, 2013, 43(5): 476-479. |
 2018, Vol. 45
2018, Vol. 45