扩展功能
文章信息
- 许焰, 吴群, 徐岩
- XU Yan, WU Qun, XU Yan
- 酱香型白酒酿造主要功能菌株对拜耳接合酵母的作用
- Effects of main functional strains on Zygosaccharomyces bailii in Chinese Maotai-flavor liquor fermentation
- 微生物学通报, 2018, 45(1): 42-53
- Microbiology China, 2018, 45(1): 42-53
- DOI: 10.13344/j.microbiol.china.170190
-
文章历史
- 收稿日期: 2017-03-07
- 接受日期: 2017-04-21
- 优先数字出版日期(www.cnki.net): 2017-07-04
拜耳接合酵母是酱香型白酒发酵过程中的优势菌株[1-2],认识其在白酒发酵中的功能,对于解析白酒酿造机制具有重要作用。虽然在其他发酵食品中拜耳接合酵母被认为是腐败酵母,能够导致蛋黄酱、沙拉酱、调味汁和葡萄酒等食品的腐败[3-4]。但近期研究表明,在葡萄酒酿造过程中,拜耳接合酵母可以与酿酒酵母一同启动发酵,增加葡萄酒中乙酯的产量,提高葡萄酒的品质[5]。因此,研究拜耳接合酵母与其他酿造微生物的相互作用,有助于正确认识拜耳接合酵母在食品发酵中的功能。
酱香型白酒酿造是一个多菌种混合发酵的复杂过程,微生物间的相互作用会对个体生理代谢产生较大影响,进而影响白酒的品质[6-7]。在酱香型白酒酿造过程中,微生物以细菌和酵母占据绝对优势[8]。酵母中以拜耳接合酵母和酿酒酵母为绝对优势菌株,进行酒精生产及多种风味物质合成,对白酒的产酒率、酒质至关重要[2, 6, 9];细菌中则以芽孢杆菌和乳酸菌为绝对优势菌株,其中地衣芽孢杆菌能够产生C4类化合物,如吡嗪类、芳香族类、酸类及酚类化合物等,是产酱香型风味的重要贡献菌株[10];乳酸杆菌的主要代谢产物乳酸,可用于形成白酒中乳酸乙酯及其他重要香味成分[7, 11]。酿酒酵母、地衣芽孢杆菌、乳酸杆菌的功能都已研究得比较全面[6-11],但是拜耳接合酵母的功能目前还不清晰。因此,研究拜耳接合酵母与白酒中主要酿造微生物的相互作用,对解析拜耳接合酵母在酱香型白酒酿造过程中的功能及完善酱香型白酒酿造理论体系具有重要意义。
本文以拜耳接合酵母作为出发菌株,分别构建酿酒酵母、布氏乳酸杆菌及地衣芽孢杆菌的纯培养和混合培养发酵体系,并结合转录组学从分子层面研究其相互作用机制,这有利于深入了解拜耳接合酵母在酱香型白酒酿造过程中的发酵特征及代谢机制,同时进一步完善酱香型白酒酿造理论体系,对实现白酒酿造过程中微生物的定向调节与控制具有重要价值。
1 材料与方法 1.1 材料 1.1.1 菌种拜耳接合酵母(Zygosaccharomyces bailii) CGMCC4745、酿酒酵母(Saccharomyces cerevisiae) CCTCCM2014463、地衣芽孢杆菌(Bacillus licheniformis) CGMCC3962及布氏乳酸杆菌(Lactobacillus buchneri)[12]均筛选自茅台酱香型白酒发酵酒醅,为本实验室的保藏菌株。
1.1.2 培养基平板培养基:Z. bailii和S. cerevisiae采用YPD培养基[6],B. licheniformis采用LB培养基[6],L. buchneri采用MRS培养基[7]。发酵培养基:高粱汁发酵培养基[6]。
1.1.3 主要试剂和仪器氯化钠、无水葡萄糖、琼脂粉、乙醇、三氯乙酸,国药集团化学试剂(北京)有限公司;MRS培养基、酵母浸膏、蛋白胨,Oxoid公司;SYBR Green Supermix、PCR试剂、RNA提取试剂盒,宝生物工程(大连)有限公司;液化酶、糖化酶,江苏锐阳生物科技有限公司。
实时荧光定量PCR仪,美国Applied Biosystems公司;精密pH计,美国Mettle-Toledo公司;液相色谱仪、气相色谱质谱联用仪,美国Agilent公司;PCR仪,德国Eppendorf公司;凝胶成像仪,美国Protein Simple公司。
1.2 方法 1.2.1 菌株培养将−80 ℃冻藏的Z. bailii、S. cerevisiae、L. buchneri和B. licheniformis分别于对应的平板培养基中活化,挑取单菌落接入高粱汁培养基中培养16 h作为种子液,最后分别按1×106 CFU/mL浓度接入装有50 mL发酵培养基的250 mL锥形瓶中发酵培养。培养方式为酵母纯培养、细菌纯培养以及Z. bailii分别与S. cerevisiae、L. buchneri和B. licheniformis按1:1比例进行混合培养。发酵条件为30 ℃、200 r/min好氧培养48 h。定时取样,测定发酵液中的生物量、pH、乙醇及风味物质含量,并取24 h Z. bailii纯培养、Z. bailii与B. licheniformis混合培养的发酵样品做转录组学分析。
1.2.2 生物量测定采用实时荧光定量PCR (qPCR)的方法进行生物量测定。Z. bailii以26S rRNA基因为目标基因设计专一性引物ZBF和ZBR[13];S. cerevisiae以MRP2为目标基因设计专一性引物SCF和SCR[14];L. buchneri以16S rRNA为目标基因设计专一性引物LBF和LBR;B. licheniformis以16S rRNA基因为目标基因设计专一性引物BLF和BLR (表 1)。用平板计数法计数Z. bailii、S. cerevisiae、L. buchneri和B. licheniformis纯培养发酵液中的浓度,各菌株分别稀释涂布于对应的平板培养基中,培养至长出单菌落后进行平板计数。同时,取1 mL各菌株发酵液提取基因组,以连续10倍梯度稀释液作为模板进行qPCR,建立基因拷贝数与活菌数之间的标准曲线。实时荧光定量PCR反应体系为20 µL:SYBR Green Supermix 10 µL,上、下游引物(20 µmol/L) 0.4 µL,模板1 µL,ddH2O 8.2 µL。反应条件为:98 ℃ 3 min;98 ℃ 3 s,60 ℃ 30 s,共40个循环,每次反应结束后,读板温度从60 ℃梯度升温至95 ℃,每隔0.5 ℃读板一次,绘制溶解曲线。以阈值循环数Ct值为纵坐标,活菌数的对数为横坐标绘制标准曲线。各菌株的专一性引物序列及实时荧光定量PCR标准曲线如表 1所示。
| 引物 Primers |
序列 Sequences (5'→3') |
标准曲线 Standard curves (x: Log (CFU/mL),y: Ct) |
| ZBF | CATGGTGTTTTGCGCC | y=−3.488 2x+43.750,R2=0.999 7 |
| ZBR | CGTCCGCCACGAAGTGGTAGA | |
| SCF | GGACTCTGGACATGCAAGAT | y=−3.055 3x+43.387,R2=0.998 3 |
| SCR | ATACCCTTCTTAACACCTGGC | |
| LBF | AGCAGTAGGGAATCTTCCA | y=−3.233 9x+40.235,R2=0.999 4 |
| LBR | ATTYCACCGCTACACATG | |
| BLF | AAAGCTGATTTGAAAGTCATTGGAGAT | y=−3.249 3x+41.081,R2=0.997 9 |
| BLR | GAGTGGCGAGCGTATCATAGTC |
纯培养及混合培养实验中,定时提取1 mL发酵液中总DNA作为模板,采用相同条件进行实时荧光定量PCR特异性扩增,根据标准曲线计算每毫升发酵液中的活菌数。
1.2.3 检测pH使用pH计测定发酵液的pH。
1.2.4 乙醇含量测定乙醇采用HPLC法测定[6]。样品处理:将700 μL发酵液与700 μL三氯乙酸(10%)混合,4 ℃放置1 h,最后用0.22 μm针头式滤器过滤。标准曲线为:y=0.000 056 5x−2.05,R2=0.999 8,x为峰面积,y为乙醇浓度(g/L)。
1.2.5 风味物质含量测定采用气相色谱-质谱(GC-MS)方法对挥发性产物进行检测[15]。样品处理:取8 mL发酵液,加入装有3 g NaCl的顶空进样瓶中,并添加10 μL浓度为100 mg/L的薄荷醇为内标。
1.2.6 转录组测序当Z. bailii纯培养及其与B. licheniformis混合培养至对数中后期时,8 000 r/min离心5 min收集菌体,用无菌水洗涤1次,随后于液氮中速冻10 min以上,保存于−80备用。转录组序列测定由上海派森诺生物技术有限责任公司完成,使用Illumina NextSeq 500高通量测序平台,测序方法详见参考文献[16]。转录组测序中用RPKM (Reads Per Kilo bases per Million reads)值衡量每个基因在样本中的表达量,计算公式为:RPKM=Total exon reads/(Mapped reads (millions)×Exon length (kb))。通过DESeq方法[17]筛选差异表达基因,只有Fold change≥2且P < 0.05的基因才被认为是差异表达基因。纯培养及混合培养下Z. bailii的转录组测序数据已提交至DDBJ数据库,序列号分别为DRX082892和DRX082894。
1.2.7 转录组测序结果荧光定量PCR验证对于进行转录组测序的样品,使用RNA提取试剂盒抽提其RNA,后用随机引物反转录成cDNA,使用基因特异性引物,采用实时荧光定量PCR方法检测转录组测序结果的可靠性。以ACT1为内参基因,引物如下:5′-CGTTTCTATCCAGGC CGTGT-3′ (上游引物)和5′-GATGGCATGAGGCAT CGAGA-3′ (下游引物)。基因特异性引物如下:ENO1:5′-AGGTGCTGAGGTTTACCAGC-3′ (上游引物)和5′-TCTAGAGCCTCTTCGGCAGT-3′ (下游引物);MEP2:5′-AGGTATGTTTGCTGCGGTGA-3′ (上游引物)和5′-ACAGCTAACCATCCTTGGGC-3′ (下游引物);RGI1:5′-CGCAAGTTTGTGCGTCA CTT-3′ (上游引物)和5′-TTCGCATCGTCGGCATA GTG-3′ (下游引物)。
2 结果与分析 2.1 混合培养体系中Z. bailii和主要酿造微生物对彼此生长特征的影响以Z. bailii、S. cerevisiae、L. buchneri及B. licheniformis纯培养为对照,研究在混合培养体系下相互作用对微生物生长特征的影响。如图 1A所示,Z. bailii与S. cerevisiae共培养时的生物量明显低于纯培养,表明Z. bailii的生长受到S. cerevisiae的抑制。推测原因是S. cerevisiae产生的乙醇、有毒化物质或营养竞争等抑制了Z. bailii的生长[18]。Z. bailii与L. buchneri共培养时发酵前期的生长与纯培养接近,发酵后期生物量低于纯培养。Z. bailii与B. licheniformis共培养时的生长和纯培养一致,表明Z. bailii的生长不受B. licheniformis影响。以上结果显示,Z. bailii的生长受到S. cerevisiae抑制,但几乎不受L. buchneri及B. licheniformis的影响。

|
| 图 1 纯培养及混合培养体系中Z. bailii (A)、S. cerevisiae (B)、L. buchneri (C)与B. licheniformis (D)生长曲线 Figure 1 The growth curve of Z. bailii (A), S. cerevisiae (B), L. buchneri (C) and B. licheniformis (D) in single and mixed cultures 注:Z:Z. bailii纯培养;S:S. cerevisiae纯培养;L:L. buchneri纯培养;B:B. licheniformis纯培养;Z+S:Z. bailii和S. cerevisiae混合培养;Z+L:Z. bailii和L. buchneri混合培养;Z+B:Z. bailii和B. licheniformis混合培养. Note: Z: Single culture of Z. bailii; S: Single culture of S. cerevisiae; L: Single culture of L. buchneri; B: Single culture of B. licheniformis; Z+S: Mixed culture of Z. bailii and S. cerevisiae; Z+L: Mixed culture of Z. bailii and L. buchneri; Z+B: Mixed culture of Z. bailii and B. licheniformis. |
|
|
同时,在与Z. bailii混合培养体系下,S. cerevisiae纯培养和共培养时的生长接近,没有明显差异,表明Z. bailii对S. cerevisiae的生长没有影响(图 1B);L. buchneri在共培养发酵前期的生物量高于纯培养,后期与纯培养趋于一致,表明Z. bailii对L. buchneri的生长起促进作用,原因可能是Z. bailii的某些产物(如大分子物质、蛋白酶等)促进了L. buchneri的生长(图 1C)[19];B. licheniformis共培养下的生长远低于纯培养,推测是由于混合培养时Z. bailii产生的酸类物质导致pH下降,从而抑制了B. licheniformis的生长(图 1D、图 2)[20]。此外,如图 2所示,除B. licheniformis纯培养时的pH上升外,其他培养模式下pH变化都呈下降趋势,这将有利于白酒中酸类物质的生成,而酸类物质对白酒的风味和品质有重要贡献[21]。

|
| 图 2 纯培养及混合培养体系中pH变化 Figure 2 pH change in single and mixed cultures 注:Z:Z. bailii纯培养;S:S. cerevisiae纯培养;L:L. buchneri纯培养;B:B. licheniformis纯培养;Z+S:Z. bailii和S. cerevisiae混合培养;Z+L:Z. bailii和L. buchneri混合培养;Z+B:Z. bailii和B. licheniformis混合培养. Note: Z: Single culture of Z. bailii; S: Single culture of S. cerevisiae; L: Single culture of L. buchneri; B: Single culture of B. licheniformis; Z+S: Mixed culture of Z. bailii and S. cerevisiae; Z+L: Mixed culture of Z. bailii and L. buchneri; Z+B: Mixed culture of Z. bailii and B. licheniformis. |
|
|
乙醇是白酒的主体物质,在白酒酿造中起极其重要的作用。白酒中,酵母是乙醇的主要贡献菌,Z. bailii与S. cerevisiae都可以进行乙醇的生产。发酵过程中,Z. bailii的最高乙醇含量为3.18 g/L,S. cerevisiae的最高乙醇含量为9.99 g/L (图 3)。以酵母纯培养为对照分析相互作用对酵母乙醇代谢的影响。
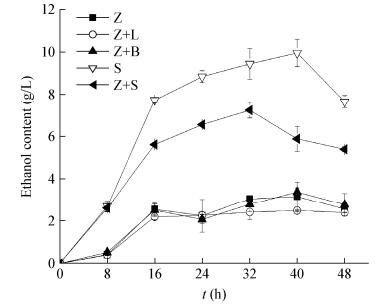
|
| 图 3 纯培养及混合培养下产乙醇曲线 Figure 3 The ethanol production curve in single and mixed cultures 注:Z:Z. bailii纯培养;S:S. cerevisiae纯培养;Z+L:Z. bailii和L. buchneri混合培养;Z+B:Z. bailii和B. licheniformis混合培养;Z+S:Z. bailii和S. cerevisiae混合培养. Note: Z: Single culture of Z. bailii; S: Single culture of S. cerevisiae; Z+L: Mixed culture of Z. bailii and L. buchneri; Z+B: Mixed culture of Z. bailii and B. licheniformis; Z+S: Mixed culture of Z. bailii and S. cerevisiae. |
|
|
如图 3所示,与S. cerevisiae混合培养时乙醇产量较纯培养乙醇总和明显下降,发酵终点时乙醇产量下降了约47%。分析原因,一方面Z. bailii共培养时的生物量低于纯培养导致乙醇下降;另一方面S. cerevisiae的乙醇生产能力明显优于Z. bailii (图 3),乙醇产量显著下降表明Z. bailii对S. cerevisiae的乙醇代谢有抑制作用。与L. buchneri及B. licheniformis混合培养时,Z. bailii共培养下的乙醇产量与纯培养接近,没有明显差异,表明Z. bailii的乙醇代谢几乎不受L. buchneri和B. licheniformis影响。
2.3 混合培养体系中Z. bailii和主要酿造微生物风味物质代谢差异风味物质是白酒的重要组成部分,决定了白酒的品质[21]。以Z. bailii、S. cerevisiae、L. buchneri及B. licheniformis的纯培养为对照,研究在混合培养体系下微生物的风味物质代谢情况。
如图 4A所示,在Z. bailii与S. cerevisiae 混合培养体系下,共培养时风味物质总量为41 363.10 μg/L,较Z. bailii、S. cerevisiae纯培养风味总和(47 102.46 μg/L)下降约12%。除总酯含量上升外,总醇、总酸、总醛、总酚和总酮相较于纯培养模式都有所下降,其中总酸和总酚下降显著,分别下降71%和42%。Z. bailii对酸类和酚类物质生产有贡献,其产酸能力约为S. cerevisiae的一半,产酚能力与S. cerevisiae相当(图 4A)。前期研究表明Z. bailii的生长受到S. cerevisiae的抑制(图 1A),所以共培养时Z. bailii生物量的下调可能是导致风味物质含量下降的原因之一。
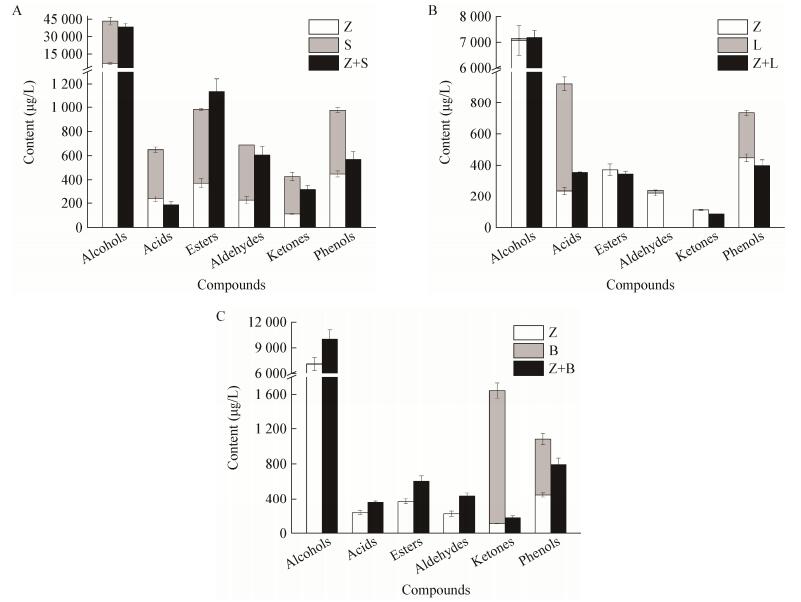
|
| 图 4 纯培养及混合培养下各种类风味物质含量 Figure 4 Content of various flavor compounds in single and mixed cultures 注:Z:Z. bailii纯培养;S:S. cerevisiae纯培养;Z+S:Z. bailii和S. cerevisiae混合培养;L:L. buchneri纯培养;Z+L:Z. bailii和L. buchneri混合培养;B:B. licheniformis纯培养;Z+B:Z. bailii和B. licheniformis混合培养. Note: Z: Single culture of Z. bailii; S: Single culture of S. cerevisiae; Z+S: Mixed culture of Z. bailii and S. cerevisiae; L: Single culture of L. buchneri; Z+L: Mixed culture of Z. bailii and L. buchneri; B: Single culture of B. licheniformis; Z+B: Mixed culture of Z. bailii and B. licheniformis. |
|
|
在Z. bailii与L. buchneri混合培养体系下,共培养时风味物质总量为8 385.49 μg/L,较Z. bailii、L. buchneri纯培养风味总和(9 538.19 μg/L)下降约12%。共培养时除总醇含量不变外,总酸、总酯、总醛、总酮和总酚含量都有所下降,其中醛类物质已检测不到,酸类和酚类含量下降显著,分别下降61%和46% (图 4B)。共培养时,二者发酵后期的生物量均低于纯培养(图 1A、C),推测发酵终点时风味物质含量的下调是由于发酵后期二者生物量下降导致的。
在Z. bailii与B. licheniformis混合培养体系下,共培养时风味物质总量为12 134.99 μg/L,较Z. bailii、B. licheniformis纯培养风味总和(10 685.91 μg/L)上升约14%。其中总醇、总酸、总酯和总醛含量显著上升,分别上升41%、36%、44%和73%;而总酮和总酚含量显著下降,分别下降90%和35%。如图 4C所示,纯培养时,Z. bailii能够生成酸类、酯类、醛类和大量醇类物质,而B. licheniformis只能产生极少量的醇类物质,不产生酸类、酯类和醛类物质。混合培养时,这4类风味物质含量明显上升,推测原因是B. licheniformis的存在使这4类风味物质的代谢在Z. bailii中得到加强,促进了Z. bailii相关风味物质代谢。此外,酮类和酚类物质主要由B. licheniformis产生,而共培养时B. licheniformis生物量显著下降(图 1D),这可能是导致总酮和总酚含量明显下降的原因(图 4C)。以上结果表明,混合培养时,S. cerevisiae及L. buchneri会降低Z. bailii的风味物质代谢,但是B. licheniformis可能对Z. bailii风味物质代谢起到促进作用。
2.4 基于转录组学B. licheniformis对Z. bailii的作用研究Z. bailii与B. licheniformis混合培养时,风味物质产量明显提高,其中总醇、总酸、总酯和总醛含量分别较纯培养上升41%、36%、44%和73%,推测是由于B. licheniformis的共存对Z. bailii风味物质代谢有促进作用。因此,运用转录组学比较Z. bailii纯培养及其与B. licheniformis共培养下基因转录表达的情况。
2.4.1 转录测序结果Z. bailii在纯培养与混合培养模式下发酵到对数中后期,收集细胞,采用高通量测序检测Z. bailii全基因组基因表达水平。
全基因组表达谱结果表明相对于单菌发酵,混菌发酵模式下,Z. bailii中共有119个基因表达显著改变(≥2-fold,P < 0.05),其中53个基因表达显著上调,66个基因表达显著下调。对这些基因进行KEGG Pathway功能差异富集分析,结果显示这些基因共涉及25个代谢途径,其中差异显著的代谢途径主要有碳水化合物代谢、能量代谢、其他氨基酸代谢和翻译途径(P < 0.05) (图 5)。在白酒酿造过程中,Z. bailii主要利用碳水化合物和氨基酸进行乙醇及风味化合物生产[22-23],此过程需要消耗大量能量来供给自身生长代谢。因此,对Z. bailii中涉及碳水化合物代谢、氨基酸代谢和能量代谢相关的差异表达基因进行深入分析。
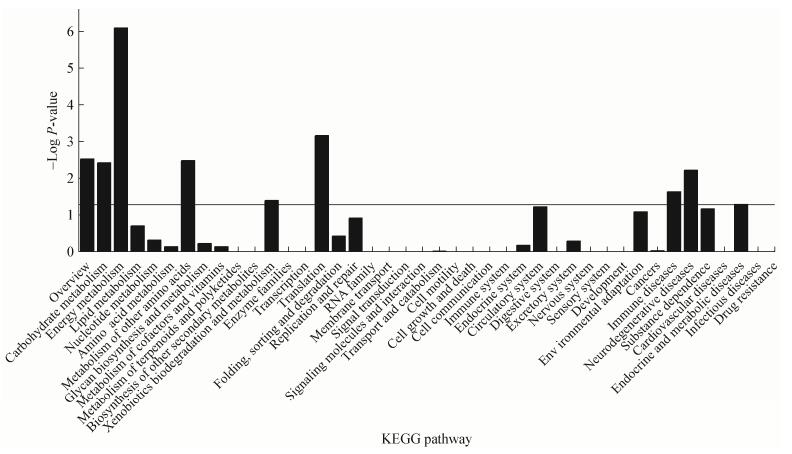
|
| 图 5 KEGG pathway功能差异富集分析 Figure 5 KEGG pathway enrichment analysis 注:图中的黑线代表P=0.05. Note: The black line in figure represented P=0.05. |
|
|
共培养体系中,B. licheniformis能够促进Z. bailii醇类、酸类、酯类和醛类风味物质的产生。通过Harris途径(图 6),葡萄糖经过糖酵解途径和TCA循环合成中间体α-酮酸,α-酮酸再经过Ehrlich途径的最后两步代谢生成相应的风味化合物[22-23]。

|
| 图 6 Z. bailii中风味物质代谢途径分析 Figure 6 The metabolic pathways of flavor compounds in Z. bailii 注:基因上标表示37条件下该基因的变化倍数. Note: The superscript numbers indicated the fold change of each gene at 37. |
|
|
转录组分析结果显示混合培养体系下,Z. bailii中与糖异生途径相关的基因FBP (编码果糖-1, 6-二磷酸酶)表达显著下调,一定程度上抑制了糖异生途径,促进了碳水化合物的分解代谢(表 2)。同时,糖酵解途径中GAPDH、PGM1和ENO1基因表达显著上调,有利于糖酵解途径向丙酮酸和TCA循环进行,进一步代谢生成乙醇及相关风味化合物。此外,编码丙酮酸脱羧酶的基因PDC1表达显著上调,丙酮酸脱羧酶能够促进丙酮酸转化为乙醛,并能将中间产物α-酮酸脱羧形成相应的醛类物质,从而促进相关风味物质合成(图 6)[24]。碳水化合物代谢也是乙醇的主要来源,但实验结果表明Z. bailii与B. licheniformis共培养时乙醇含量没有明显差异。转录组分析结果显示,与乙醇代谢直接相关的基因(ADH)并没有显著变化[25],因此碳水化合物代谢中表达上调的基因可能更多涉及风味代谢,而不是乙醇代谢。qPCR验证ENO1表达提高为6.22倍,与转录组测序结果基本一致。由此可见,B. licheniformis会促进Z. bailii中与Harris途径相关基因的表达上调,从而提高其风味物质代谢能力。
| 名称 Name |
功能 Function |
变化倍数 Fold change |
P值 P-value |
| FBP | Fructose-1, 6-bisphosphatase | −9.52 | 0.02 |
| PGM1 | Phosphoglycerate mutase 1 | 6.41 | 0.04 |
| ENO1 | Enolase 1 | 6.57 | 0.04 |
| GAPDH | Glyceraldehyde-3-phosphate dehydrogenase | 7.71 | 0.03 |
| PDC11 | Pyruvate decarboxylase | 7.91 | 0.03 |
| PDC12 | Pyruvate decarboxylase | 7.76 | 0.03 |
| PDC13 | Pyruvate decarboxylase | 7.61 | 0.03 |
| PDC14 | Pyruvate decarboxylase | 6.75 | 0.04 |
| PDC15 | Pyruvate decarboxylase | 6.32 | 0.05 |
| 注:基因下标表示该基因的不同拷贝. Note: The subscript numbers indicated different copies of genes. |
|||
通过Ehrlich途径[23],氨基酸依次在转氨酶、酮酸脱羧酶以及醇脱氢酶或醛脱氢酶作用下生成相应的醇类物质或酸类物质(图 6)。
转录组结果表明,编码铵转运蛋白的基因MEP2表达显著上调,有利于铵离子的转运,而铵离子可用于谷氨酸的生物合成及提供酵母细胞生长所需氮源,有助于酵母中氨基酸的生物合成(表 3)[26]。此外在Ehrlich途径中,PDC1基因表达上调(表 2),有利于α-酮酸转化为醛类物质,并进一步代谢为相应的醇类、酸类等风味物质。同时,分析结果表明与含硫氨基酸合成代谢相关的基因METW和METC表达也显著上调,能够促进L-同型半胱氨酸的生物合成,进而转化为其他含硫氨基酸或代谢为含硫化合物(表 3)[27]。qPCR验证MEP2表达提高为6.20倍,与转录组测序结果基本一致。由此可见,B. licheniformis会提高Z. bailii氨基酸的代谢活力,有利于风味物质合成。
| 名称 Name |
功能 Function |
变化倍数 Fold change |
P值 P-value |
| MEP21 | Ammonium transporter MEP2 | 7.50 | 0.03 |
| MEP22 | Ammonium transporter MEP2 | 9.08 | 0.02 |
| METW1 | Putative cystathionine gamma-synthase YLL058W | 6.73 | 0.04 |
| METW2 | Putative cystathionine gamma-synthase YLL058W | 6.99 | 0.04 |
| METC | Putative cystathionine beta-lyase | 12.80 | 0.04 |
| 注:基因下标表示该基因的不同拷贝. Note: The subscript numbers indicated different copies of genes. |
|||
混合培养过程中,Z. bailii的生长代谢都需要消耗能量,结合转录组数据分析与能量代谢相关的差异表达基因,研究其能量代谢差异。
转录组分析表明,与Z. bailii呼吸生长相关的基因RGI1表达显著上调(表 4)。该基因在细胞呼吸生长过程中,参与能量代谢的调控并有助于调节细胞生长[28]。氧化磷酸化过程作为重要的产能过程,生物体内95%的ATP来自这种方式。转录组分析显示与氧化磷酸化过程相关的基因COX1、CYB表达显著上调,而QCR6表达显著下调(表 4)。COX1是细胞色素c氧化酶的重要组成部分,CYB和QCR6是细胞色素c还原酶的重要组成部分。同时,编码细胞色素b2的基因CYB2表达也上调,该酶促进L-乳酸氧化成丙酮酸,并伴随ATP的生成[29]。糖酵解中编码3-磷酸甘油醛脱氢酶的基因GAPDH表达上调,该酶催化的反应中能形成一个高能磷酸基团,此高能磷酸基团可将能量转移给ADP形成ATP,供酵母生长代谢。此外,ATP合成酶相关的基因ATP9表达也显著上调,该酶能在跨膜质子动力势的推动下合成ATP。转录组分析显示,CYB和ATP9只有共培养模式下才会表达,其RPKM值分别为157.63和807.90,表明B. licheniformis会促使Z. bailii中一些原本不表达的基因进行表达,进而促进其能量代谢。qPCR验证RGI1表达提高为11.98倍,与转录组测序结果基本一致。Z. bailii中与能量代谢相关基因的表达整体呈上调趋势,说明Z. bailii与B. licheniformis相互作用时,会消耗更多的能量用于自身生长代谢。
| 名称 Name |
功能 Function |
变化倍数 Fold change |
P值 P-value |
| RGI1 | Respiratory growth induced protein 1 | 16.22 | 0.01 |
| QCR6 | Cytochrome b-c1 complex subunit 6 | −6.18 | 0.05 |
| COX1 | Cytochrome c oxidase subunit 1 | 1 536.53 | 0.01 |
| CYB2 | Cytochrome b2, mitochondrial | 7.75 | 0.03 |
Z. bailii作为酱香型白酒酿造过程中的优势菌株,对白酒的乙醇及风味生产有积极贡献[9]。通过对Z. bailii与主要白酒酿造微生物相互作用的研究,结合转录组学探索其在酱香型白酒酿造中的发酵特征及代谢机制,正确认识其白酒酿造中的功能。研究发现,Z. bailii与B. licheniformis共培养时的生长及乙醇代谢没有变化,但其醇类、酸类、酯类和醛类风味物质的代谢明显提高,分别上升41%、36%、44%和73%。同时Z. bailii与S. cerevisiae共培养时,其生物量、乙醇及风味代谢下降;与L. buchneri共培养时,其风味代谢也下调。这些变化表明白酒发酵过程中,Z. bailii能与主要酿造微生物相互作用,影响自身的生长、乙醇及风味物质代谢,进而对白酒酿造的品质产生影响。
同时,应用转录组技术分析Z. bailii纯培养及其与B. licheniformis共培养时基因的转录表达情况,发现Z. bailii中共有119个基因表达显著改变,并主要富集于碳水化合物代谢、能量代谢、其他氨基酸代谢等途径。碳水化合物和氨基酸是风味物质的主要来源,其代谢途径中相关基因的表达上调将有助于Z. bailii风味物质的合成。转录组学分析从分子水平上进一步说明B. licheniformis对Z. bailii的风味代谢有促进作用。同时,基于转录组学B. licheniformis对Z. bailii的作用研究,为后续研究Z. bailii分子代谢调控及其与微生物相互作用提供理论参考。
本研究对于深入认识酱香型白酒酿造过程中Z. baili与S. cerevisiae、L. buchneri、B. licheniformis的相互作用关系及互作机制具有重要意义,为白酒组合发酵技术的应用及白酒酿造过程中微生物的定向调节与控制提供一定理论参考。同时,转录组学的应用及数据的深入挖掘,为从分子角度全面认识微生物相互作用机制提供指导。
| [1] |
Wu Q, Chen LQ, Xu Y. Yeast community associated with the solid state fermentation of traditional Chinese Maotai-flavor liquor[J]. International Journal of Food Microbiology, 2013, 166(2): 323-330. DOI:10.1016/j.ijfoodmicro.2013.07.003 |
| [2] |
Shao MK, Wang HY, Xu Y, et al. Yeast community structure and its impact on flavor components during the fermentation process of Chinese Maotai-flavor liquor[J]. Microbiology China, 2014, 41(12): 2466-2473. 邵明凯, 王海燕, 徐岩, 等. 酱香型白酒发酵中酵母群落结构及其对风味组分的影响[J]. 微生物学通报, 2014, 41(12): 2466-2473. |
| [3] |
Tristezza M, Lourenço A, Barata A, et al. Susceptibility of wine spoilage yeasts and bacteria in the planktonic state and in biofilms to disinfectants[J]. Annals of Microbiology, 2010, 60(3): 549-556. DOI:10.1007/s13213-010-0085-5 |
| [4] |
Rossi F, Gaio E, Torriani S. Staphylococcus aureus and Zygosaccharomyces bailii as primary microbial contaminants of a spoiled herbal food supplement and evaluation of their survival during shelf life[J]. Food Microbiology, 2010, 27(3): 356-362. DOI:10.1016/j.fm.2009.11.011 |
| [5] |
Garavaglia J, Schneider RDCDS, Camargo Mendes SD, et al. Evaluation of Zygosaccharomyces bailii BCV 08 as a co-starter in wine fermentation for the improvement of ethyl esters production[J]. Microbiological Research, 2015, 173: 59-65. DOI:10.1016/j.micres.2015.02.002 |
| [6] |
Meng X, Wu Q, Wang L, et al. Improving flavor metabolism of Saccharomyces cerevisiae by mixed culture with Bacillus licheniformis for Chinese Maotai-flavor liquor making[J]. Journal of Industrial Microbiology & Biotechnology, 2015, 42(12): 1601-1608. |
| [7] |
Zhang Y, Du H, Wu Q, et al. Impacts of two main lactic acid bacteria on microbial communities during Chinese Maotai-flavor liquor fermentation[J]. Microbiology China, 2015, 42(11): 2087-2097. 张艳, 杜海, 吴群, 等. 酱香型白酒发酵中两株主要乳酸菌对酿造微生物群体的影响[J]. 微生物学通报, 2015, 42(11): 2087-2097. |
| [8] |
Wang CL, Shi DJ, Gong GL. Microorganisms in Daqu: a starter culture of Chinese Maotai-flavor liquor[J]. World Journal of Microbiology and Biotechnology, 2008, 24(10): 2183-2190. DOI:10.1007/s11274-008-9728-0 |
| [9] |
Zhuang XJ, Wu Q, Xu Y. Physiological characteristics of Zygosaccharomyces bailii and its interaction with Bacillus licheniformis in Chinese Maotai-flavor liquor making[J]. Microbiology China, 2017, 44(2): 251-262. 庄孝杰, 吴群, 徐岩. 酱香型白酒酿造拜耳接合酵母生理代谢特征及其与地衣芽孢杆菌相互作用[J]. 微生物学通报, 2017, 44(2): 251-262. |
| [10] |
Zhang R, Wu Q, Xu Y. Aroma characteristics of Moutai-flavour liquor produced with Bacillus licheniformis by solid-state fermentation[J]. Letters in Applied Microbiology, 2013, 57(1): 11-18. DOI:10.1111/lam.12087 |
| [11] |
Li WQ. Relationship between Luzhou flavor liquor, lactic acid bacteria, lactic acid and ethyl lactate[J]. Liquor Making, 2010, 37(3): 90-93. 李维青. 浓香型白酒与乳酸菌、乳酸、乳酸乙酯[J]. 酿酒, 2010, 37(3): 90-93. |
| [12] |
Wu LL, Wang HY, Xu Y, et al. Differences of lactic acid bacteria community between soy sauce aroma style and light aroma style liquor fermentation[J]. Microbiology China, 2013, 40(12): 2182-2188. 吴莉莉, 王海燕, 徐岩, 等. 酱香型与清香型白酒发酵过程中乳酸菌菌群的差异性分析[J]. 微生物学通报, 2013, 40(12): 2182-2188. |
| [13] |
Rawsthorne H, Phister TG. A real-time PCR assay for the enumeration and detection of Zygosaccharomyces bailii from wine and fruit juices[J]. International Journal of Food Microbiology, 2006, 112(1): 1-7. DOI:10.1016/j.ijfoodmicro.2006.05.003 |
| [14] |
Salinas F, Garrido D, Ganga A, et al. Taqman real-time PCR for the detection and enumeration of Saccharomyces cerevisiae in wine[J]. Food Microbiology, 2009, 26(3): 328-332. DOI:10.1016/j.fm.2008.12.001 |
| [15] |
Fan WL, Hu GY, Xu Y. Quantification of volatile terpenoids in Chinese medicinal liquor using headspace-solid phase microextraction coupled with gas chromatography-mass spectrometry[J]. Food Science, 2012, 33(14): 110-116. 范文来, 胡光源, 徐岩. 顶空固相微萃取-气相色谱-质谱法测定药香型白酒中萜烯类化合物[J]. 食品科学, 2012, 33(14): 110-116. |
| [16] |
Lu XW, Wu Q, Zhang Y, et al. Genomic and transcriptomic analyses of the Chinese Maotai-flavored liquor yeast MT1 revealed its unique multi-carbon co-utilization[J]. BMC Genomics, 2015, 16: 1064. DOI:10.1186/s12864-015-2263-0 |
| [17] |
Anders S, Huber W. Differential expression of RNA-Seq data at the gene level-the DESeq package[R]. DESeq Version 1. 13. 0. Heidelberg: European Molecular Biology Laboratory, 2013 https://www.mendeley.com/research-papers/differential-expression-rnaseq-data-gene-level-deseq-package/
|
| [18] |
Zhai MC, Piao YZ, Wang XY, et al. The mutual inhibition between yeasts in the fermentation process of wine[J]. Chinese Journal of Microecology, 2011, 23(1): 18-21. 翟明昌, 朴永哲, 王祥余, 等. 葡萄酒发酵过程中酵母菌之间相互抑制作用的研究[J]. 中国微生态学杂志, 2011, 23(1): 18-21. |
| [19] |
Yan B, He YF. A review on symbiotic mechanisms between lactic acid bacteria and yeasts[J]. Food Science, 2012, 33(3): 277-281. 闫彬, 贺银凤. 乳酸菌与酵母菌共生机理综述[J]. 食品科学, 2012, 33(3): 277-281. DOI:10.7506/spkx1002-6630-201703058 |
| [20] |
Peng SQ, Wu Q, Xu Y. Tolerance characteristics of Bacillus licheniformis CGMCC3963 and tolerance mechanisms based on transcriptome analysis[J]. Microbiology China, 2014, 41(12): 2395-2403. 彭素琴, 吴群, 徐岩. 产酱香地衣芽孢杆菌CGMCC3963耐受特征及基于转录组学的耐受机制分析[J]. 微生物学通报, 2014, 41(12): 2395-2403. |
| [21] |
Zhu SK, Lu X, Ji KL, et al. Characterization of flavor compounds in Chinese liquor Moutai by comprehensive two-dimensional gas chromatography/time-of-flight mass spectrometry[J]. Analytica Chimica Acta, 2007, 597(2): 340-348. DOI:10.1016/j.aca.2007.07.007 |
| [22] |
Chen ECH. The relative contribution of Ehrlich and biosynthetic pathways to the formation of fusel alcohols[J]. Journal of the American Society of Brewing Chemists, 1978, 36: 0039. |
| [23] |
Ehrlich F. über die Bedingungen der Fusel?lbildung und über ihren Zusammenhang mit dem eiweiüaufbau der Hefe[J]. Berichte der Deutschen Chemischen Gesellschaft, 1907, 40(1): 1027-1047. DOI:10.1002/(ISSN)1099-0682 |
| [24] |
ter Schure EG, Flikweert MT, van Dijken JP, et al. Pyruvate decarboxylase catalyzes decarboxylation of branched-chain 2-oxo acids but is not essential for fusel alcohol production by Saccharomyces cerevisiae[J]. Applied and Environmental Microbiology, 1998, 64(4): 1303-1307. |
| [25] |
de Smidt O, du Preez JC, Albertyn J. Molecular and physiological aspects of alcohol dehydrogenases in the ethanol metabolism of Saccharomyces cerevisiae[J]. FEMS Yeast Research, 2012, 12(1): 33-47. DOI:10.1111/fyr.2012.12.issue-1 |
| [26] |
Bogonez E, Satrústegui J, Machado A. Regulation by ammonium of glutamate dehydrogenase (NADP+) from Saccharomyces cerevisiae[J]. Microbiology, 1985, 131(6): 1425-1432. DOI:10.1099/00221287-131-6-1425 |
| [27] |
Perpète P, Duthoit O, de Maeyer S, et al. Methionine catabolism in Saccharomyces cerevisiae[J]. FEMS Yeast Research, 2006, 6(1): 48-56. DOI:10.1111/fyr.2006.6.issue-1 |
| [28] |
Domitrovic T, Kozlov G, Freire JCG, et al. Structural and functional study of YER067W, a new protein involved in yeast metabolism control and drug resistance[J]. PLoS One, 2010, 5(6): e11163. DOI:10.1371/journal.pone.0011163 |
| [29] |
Cunane LM, Barton JD, Chen ZW, et al. Crystallographic study of the recombinant flavin-binding domain of Baker's yeast flavocytochrome b2: comparison with the intact wild-type enzyme[J]. Biochemistry, 2002, 41(13): 4264-4272. DOI:10.1021/bi0119870 |
 2018, Vol. 45
2018, Vol. 45




