扩展功能
文章信息
- 周杨, 万强, 蔡芷荷, 卢勉飞, 吴清平, 李健顺
- ZHOU Yang, WAN Qiang, CAI Zhi-He, LU Mian-Fei, WU Qing-Ping, LI Jian-Shun
- 环介导等温扩增技术在食品中痢疾志贺氏菌快速检测
- Loop-mediated isothermal amplification-based rapid detection for Shigella dysenteriae in food samples
- 微生物学通报, 2017, 44(9): 2247-2254
- Microbiology China, 2017, 44(9): 2247-2254
- DOI: 10.13344/j.microbiol.china.170054
-
文章历史
- 收稿日期: 2017-01-18
- 接受日期: 2017-05-22
- 优先数字出版日期(www.cnki.net): 2017-06-05
2. 广东省微生物研究所 广东 广州 510070;
3. 广东环凯生物科技有限公司 广东 肇庆 526238
2. Guangdong Institute of Microbiology, Guangzhou, Guangdong 510070, China;
3. Guangdong Huankai Biologic Sci. & Tech. Co. Ltd., Zhaoqing, Guangdong 526238, China
志贺氏菌(Shigella)为兼性厌氧型革兰氏阴性菌,可通过消化道传播并引发机体急性感染性痢疾,因此也被称为痢疾杆菌[1]。志贺氏菌附着力、侵袭力强,其进入机体后能分泌大量的内、外毒素,造成腹痛、腹泻、局部黏膜炎症甚至溃疡、坏死等病症,尤其对婴幼儿具有致命性危害[2-3]。流行病学显示,感染性痢疾多发于6−9月,主要为患病者进食被志贺氏菌污染的食物所致,且具有感染率高、致死率高等特点。据统计,全球每年有1.6亿人被感染,死亡人数高达110万,而我国细菌性痢疾感染者多为福氏志贺氏菌(S. flexneri)和宋氏志贺氏菌(S. sonnei)引起,由于地域广袤、卫生条件有限等原因,食品受到志贺氏菌污染致使痢疾、腹泻等疾患暴发较为普遍,因此志贺氏菌是食品安全领域的重点监测对象[4-7],建立并应用快速、准确的志贺氏菌检测方法具有重要意义。
当前已建立了多种志贺氏菌检验检疫方法,主要包括采用传统培养基法(病原微生物分离鉴定、形态学鉴定以及自动化鉴定方法)、自动酶联荧光免疫技术以及核酸扩增(PCR)技术等[8-10],但这些方法表现出检测周期长、操作复杂、成本高、费时费力以及检出效率低等不足。环介导恒温扩增技术(Loop-mediated isothermal amplification,LAMP)是由Notomi等[11]于2000年开发的一种新型的核酸体外等温扩增技术。该技术利用两对特殊引物和具有单链置换活性的Bst DNA聚合酶,在恒温条件下使引物顺利与模板结合并进行链置换扩增反应,扩增过程不超过1 h,大大节省了检测时间,且无需复杂仪器辅助,其结果判读、灵敏度、特异性、检测范围以及应用成本等远优于其他分子检测方法。当前,LAMP技术大量应用于食源性致病菌检测领域的研究,如检测大肠杆菌(Escherichia coli)[12]、单核细胞增生李斯特氏菌(Listeria monocytogenes)[13]、副溶血性弧菌(Vibrio parahaemolyticus)[14]、粪肠球菌(Enterococcus faecalis)[15]、沙门氏菌(Salmonella)[16]等,同时也有志贺氏菌相关的检测研究[17-18],不过数量较少,且在实际应用中(如操作流程、结果判读以及大量实际样品验证等方面)十分欠缺。鉴于此,我们研究建立了基于LAMP技术的志贺氏菌快速检测方法,采用钙黄绿素作为显色指示剂,实现检测结果的可视化判读,并应用于实际样品检测中,检测效果佳。
1 材料与方法 1.1 菌株、试剂和培养基各种标准菌株:痢疾志贺氏菌(S. dysenteriae) CMCC(B) 51105,福氏志贺氏菌(S. flexneri) CMCC (B) 51572,宋内氏志贺氏菌(S. sonnei) CMCC(B) 51592,福氏志贺氏菌(S. flexneri) ATCC 12022,鲍氏志贺氏菌(S. boydii) ATCC 9207,副溶血性弧菌(V. parahaemolyticus) ATCC 17802,金黄色葡萄球菌(Staphylococcus aureus) ATCC 6538,肠出血性大肠杆菌O157:H7 (E. coli O157:H7) NTCT 12900,阪崎肠杆菌(Enterobacter sakazakii) ATCC 29544,铜绿假单胞菌(Pseudomonas aeruginosa) CMCC(B) 10104,枯草芽孢杆菌(Bacillus subtilis) CMCC(B) 63303,伤寒沙门氏菌(S. typhi) CMCC(B) 50098,粪肠球菌(E. faecalis) ATCC 33186,产气肠杆菌(Enterobacter aerogenes) ATCC 13048,单核细胞增生李斯特菌(L. monocytogene) CMCC(B) 54002,肺炎链球菌(Streptococcus pneumoniae) CMCC(B) 31001,均由广东环凯微生物科技有限公司提供。
Tris-base、KCl、(NH4)2SO4、MgSO4·7H2O、MgCl2、钙黄绿素、甜菜碱、十二烷基硫酸钠,广州化学试剂厂;Bst DNA polymerase,NEB公司;Taq DNA polymerase、10×PCR buffer、dNTPs以及合成的各种引物,生工生物工程(上海)股份有限公司。研究中使用的培养基和配套试剂产品如志贺氏菌增菌肉汤、麦康凯(MAC)琼脂、木糖赖氨酸脱氧胆酸盐(XLD)琼脂、三糖铁(TSI)琼脂、营养琼脂斜面、葡萄糖铵培养基、尿素琼脂、β-半乳糖苷酶培养基、氨基酸脱羧酶试验培养基、西蒙氏柠檬酸盐琼脂、志贺氏菌诊断血清、生化鉴定试剂盒由广东环凯微生物科技有限公司提供。
供试食品样品来自于广州地区10个不同市场,包括肉与肉制品、水产品、乳制品以及速冻食品共4类150份代表性食品,另有人工污染样品11份。
1.2 主要仪器Shock Mixer-1型高速振荡样品处理器、HKP-9172A型恒温培养箱、WBK-4B水浴恒温箱,广东环凯微生物科技有限公司;ABI-9700 PCR仪,美国ABI公司;3K15型台式高速离心机,德国Sigma公司;DYY-6B型稳压稳流电泳仪,北京市六一仪器厂;Easy Spiral型螺旋接种仪,法国Interscience公司。
1.3 主要方法 1.3.1 LAMP检测体系的建立: 从NCBI (National Center for Biotechnology Information)数据库中搜索获取志贺氏菌特异性的侵袭性质粒抗原H基因(ipaH)[19-20]序列,通过多重序列比对,选择其高度保守区序列,经在线设计软件Primer Explorer V4 (http://primerexplorer.jp/e/index.html)选取高度保守区序列的多个不同位点设计出3对LAMP引物,包括外引物F3/B3、内引物FIP/BIP以及环引物LF/LB,同时设计相应的PCR反应引物对PF/PR,具体序列见表 1。利用单因素控制法,并根据相关报道以及前期预实验设计不同因素(包括氯化镁浓度、甜菜碱浓度、Bst DNA polymerase浓度、dNTPs浓度、引物B3/F3与FIP/BIP的配比、反应温度以及反应的时间)的梯度(如氯化镁的浓度梯度设置为0、1、3、4、5、6、7、8、10 mmol/L),逐个条件进行LAMP反应测试,获取检测所需的最佳反应体系,其中单个反应组分主要包括2×反应液(按照1 mol/L氯化镁、20 mol/L甜菜碱、1 mol/L硫酸铵、2 mol/L硫酸镁、10%曲拉通X-100、500 mmol/L氯化钾和2 mol/L Tris-HCl混合得到)、Bst DNA polymerase (8 U/μL)、dNTPs (10 mmol/L)、3对引物混合物(FIP/BIP 1.6 μmol/L,FL/BL 0.8 μmol/L,F3/B3 0.2 μmol/L)、显色液、超纯水以及检测样品DNA。| Primer name | Sequence (5′→3′) | Size (bp) | |
| LAMP | F3 | ACTCTCCCAGTGTGCTTTGAT | 21 |
| B3 | CTTTTCGTGAAAAATTGAAA | 20 | |
| FIP | TCCGCGACACGTTCCCTCTATTGTCAGTACGCTTCGCC | 38 | |
| BIP | TGCCGATTTGAAGGCCGGTACACCGTGGTCCGTTCTGAA | 39 | |
| LF | TGGCATGCTTTGAACAGATAA | 21 | |
| LB | TATTGAGTTCGTTCTAATCAACT | 23 | |
| PCR | PF | AACATTACCCGACTTACCGG | 20 |
| PR | CACTCGCGCTGTGCCAGGAG | 20 | |
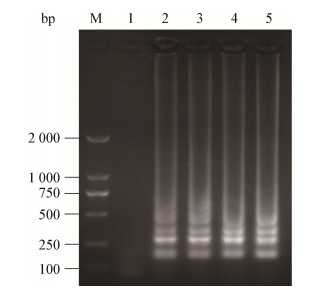
确立检测中25 μL的LAMP反应体系包括:2×反应液5 μL、Bst DNA polymerase (8 U/μL) 1 μL、dNTPs (10 mmol/L) 2 μL、3对引物混合物(FIP/BIP 1.6 μmol/L,FL/BL 0.8 μmol/L,F3/B3 0.2 μmol/L) 2 μL、DNA模板2.5 μL、显色液2.5 μL、超纯水2.5 mL。充分混匀后置于水浴锅中61 ℃反应50 min,最后经肉眼观察,根据检测管中显色试剂的颜色变化判读检测结果,具体为阳性显示绿色,阴性显示浅橙红色(未变色),并经琼脂糖凝胶电泳检测观察各个样品反应情况,阳性样品检测管呈明显荧光绿,条带清晰,阴性样品检测管未见颜色变化,未见明显条带,见图 1、2。另外,PCR反应体系为:10×PCR buffer 2.5 μL,Taq DNA polymerase (5 U/μL) 1 μL,dNTPs (10 mmol/L) 0.5 μL,引物混合物(PF/PR 0.5 μmol/L) 2.5 μL,DNA模板2.5 μL,超纯水16 μL。PCR反应条件为:94 ℃ 5 min;94 ℃ 30 s,57 ℃ 30 s,72 ℃ 30 s,35个循环;72 ℃ 5 min,其结果经琼脂糖凝胶电泳检测观察。

|
| 图 1 LAMP快速检测显色图 Figure 1 Results of change in color of LAMP-based detection method 注:M:Marker DL2000;1:非志贺氏菌标准菌株样品;2−5:志贺氏菌标准菌株样品. Note: M: Marker DL2000; 1: Non-Shigella standard sample; 2−5: Shigella standard strain samples. |
|
|
|
| 图 2 LAMP快速检测电泳图 Figure 2 Electrophoretic results of LAMP product of change in color 注:M:Marker DL2000;1:非志贺氏菌标准菌株样品;2−5:志贺氏菌标准菌株样品. Note: M: Marker DL2000; 1: Non-Shigella standard sample; 2−5: Shigella standard strain samples. |
|
|
5株志贺氏菌标准菌株样品均显示明显荧光绿色,即为检测阳性;而11株非志贺氏菌标准菌株样品仍为反应前的浅橘红色,即为检测阴性,且以上平行测试结果一致,见表 2。
| 菌株名称 Strain name |
菌株编号 Strain number |
检测结果 Detection result |
| S. dysenteriae | CMCC(B) 51105 | + |
| S. flexneri | CMCC(B) 51572 | + |
| S. sonnei | CMCC(B) 51592 | + |
| S. flexneri | ATCC 12022 | + |
| S. boydii | ATCC 9207 | + |
| V. parahaemolyticus | ATCC 17802 | - |
| S. aureus | ATCC 6538 | - |
| E. coli O157:H7 | NTCT 12900 | - |
| E. sakazakii | ATCC 29544 | - |
| P. aeruginosa | CMCC(B) 10104 | - |
| B. subtilis | CMCC(B) 63303 | - |
| S. typhi | CMCC(B) 50098 | - |
| E. faecali | ATCC 33186 | - |
| E. aerogenes | ATCC 13048 | - |
| L. monocytogene | CMCC(B) 54002 | - |
| S. pneumonia | CMCC(B) 31001 | - |
| 注:+:LAMP检测显示明显的荧光绿,阳性;-:LAMP检测未出现颜色变化,阴性. Note: +: Positive with obvious fluorescent green; -: Negative with no color changes. |
||
当稀释倍数在100−106倍时,对应的检测管均显示明显荧光绿色,即为检测阳性;而稀释倍数在107−108时,对应的检测管仍为反应前的浅橘红色,即为检测阴性,见图 3,以上平行测试结果一致。并经琼脂糖凝胶电泳检测以上不同浓度样品对应的反应产物,显示出明显的梯状条带,见图 4。而PCR检测结果显示,只有在稀释倍数在100−105倍时,出现较明显的产物条带,见图 5。经比较LAMP检测灵敏度比PCR检测高出1个数量级,LAMP检验限达到1.6×101 CFU/mL。

|
| 图 3 灵敏度试验显色结果 Figure 3 Chromogenic results for sensitivity |
|
|

|
| 图 4 LAMP检测灵敏度试验显色产物电泳结果 Figure 4 Electrophoretic results of LAMP product in sensitivity test |
|
|

|
| 图 5 PCR检测灵敏度试验产物电泳结果 Figure 5 Electrophoretic results of PCR product for sensitivity |
|
|
通过对161份样品进行检测,结果显示在肉与肉制品、水产品、乳制品、速冻食品以及人工污染样品中,LAMP检测方法与传统方法的准确度分别为98.0%、100%、100%、96.7%和100%;在150份实际样品中,其检测准确度为99.3%,二者检测结果具有较高的一致性(χ2=2.137,P=1.035),见表 3。
| 样品类型 Sample type |
样品名称 Sample name |
检出数/被检测样品数(份/份) Positive cases/total cases of sample (n/n) |
LAMP检出准确度 LAMP method detection accuracy (%) |
|
| LAMP检测 LAMP method |
传统方法检测 Traditional method |
|||
| 肉与肉制品 Meat and meat products |
Pork | 1/10 | 1/10 | 98.0 |
| Mutton | 1/10 | 1/10 | ||
| Beef | 0/10 | 0/10 | ||
| Preserved meat | 0/10 | 0/10 | ||
| Ground pork | 1/10 | 1/10 | ||
| 水产品 Aquatic products |
Yellow croaker | 0/10 | 0/10 | 100 |
| Crucian | 0/10 | 0/10 | ||
| Chub | 0/10 | 0/10 | ||
| Grass carp | 0/10 | 0/10 | ||
| 乳制品 Dairy products |
Pasteurised milk | 1/10 | 1/10 | 100 |
| Skim milk | 1/10 | 1/10 | ||
| Yoghourt | 0/10 | 0/10 | ||
| 速冻食品 Quick-frozen food |
Dumplings | 1/10 | 1/10 | 96.7 |
| Frozen drumstick | 1/10 | 0/10 | ||
| Beef roll | 0/10 | 0/10 | ||
| 合计Total | 7/150 | 6/150 | 99.3 | |
| 人工污染样品 Artificially contaminated samples |
11/11 | 11/11 | 100 | |
在我国多为食源性的福氏志贺氏菌引发痢疾,目前主要通过传统方法对其检测,已无法满足检测需求,因此建立高效、快速的检测方法对志贺氏菌病原体的早期筛查以及相关疾病控制至关重要。LAMP技术针对致病菌特异性靶基因的多个位点设计引物,经Bst DNA聚合酶催化可在恒温条件(60−65 ℃)下60 min完成核酸扩增反应,具有高效、快速的特点。但由于LAMP反应体系中涉及到的成分较多,其不同浓度配比会影响LAMP反应效率,如Mg2+会与反应产物结合形成焦磷酸镁,LAMP反应体系中MgCl2浓度过低或者过高,都会影响反应;甜菜碱能维持DNA双链的不稳定性,进而大大减少碱基堆积,提高LAMP反应效率[23-24]。本研究中根据相关报道以及前期预实验设计不同因素(包括MgCl2浓度、甜菜碱浓度、Bst DNA polymerase浓度、dNTPs浓度、引物B3/F3与FIP/BIP的配比、反应温度以及反应的时间)的梯度[25],逐个进行LAMP反应测试,最终综合获取检测所需的最佳反应体系。另外,本研究采用自配的裂解液(主要包含Tris-base、盐酸和SDS),经热裂解法获取核酸样品,直接避免了增菌液、核酸样品等对该LAMP反应体系的影响。
为保证LAMP检测的特异性,靶基因的选取至关重要,本研究通过资料搜集以及序列比对,选取ipaH上的高度保守区域,并运用在线软件设计LAMP引物,这也是整个检测体系中关键所在。另外,本研究中引入了环引物[26],虽然不加入环引物时LAMP反应也能正常进行,但加入环引物能提高反应效率,缩短反应时间,从而更能满足快速检测的需求。在结果判读方面,之前通过琼脂糖凝胶电泳检测直接观察LAMP反应梯状条带,也可直接通过肉眼观察反应产物,如反应时Mg2+会与反应产物焦磷酸结合形成焦磷酸镁,产生白色混浊物,但有时该浊度不便观察,需借助仪器帮助;反应产物双链DNA可结合荧光染料SYBR Green Ⅰ染色,如有扩增产物时,反应变绿色,反之仍为橙色,但该染料价格较高,且操作时需反应后开盖加入,会造成额外的气溶胶污染[27],可能影响其他反应结果。本研究中,采用经配比优化的钙黄绿素-Mn2+指示剂,价格低廉,颜色观察效果明显,且在反应前加入指示剂,均优于之前的结果判读方法。
本研究通过标准菌株鉴定,证实本检测方法对检测志贺氏菌具有好的特异性,灵敏度测试得其最低检验限为1.6×101 CFU/反应,与之前有关LAMP技术检测志贺氏菌报道相当[28-29],且经比较,本LAMP检测灵敏度比PCR检测高出1个数量级,无需PCR仪等昂贵仪器,操作简便,因此优于PCR检测方法。另外,根据GB/T4789.5-2012[21],志贺氏菌传统检测方法一般经常规培养,分离了解其培养特性、形态学特征,并进一步通过生化鉴定和血清学试验进行属(种)的鉴定,该一系列过程操作复杂且耗时长(一般3−5 d),且需要各种培养基以及试剂等,大大增加了检测成本;而LAMP法整个检测流程简单,而且可直接通过肉眼判读结果,从而大幅提高了检测效率。本研究中,经LAMP检测方法对161份代表性的实际样品和人工污染样品进行检测,并与传统检测方法对比,结果显示符合率较高,可行且可靠。综上所述,本LAMP检测方法能够满足在基层现场快速检测的需求,具有广阔的应用前景。
| [1] |
Ogawa M, Yoshimori T, Suzuki T, et al. Escape of Intracellular Shigella from Autophagy[J]. Science, 2005, 307(5710): 727-731. DOI:10.1126/science.1106036 |
| [2] |
Zhu L, Wang HL. Type three secretion system and pathogenesis of Shigella spp.——a review[J]. Acta Microbiologica Sinica, 2010, 50(11): 1446-1451. (in Chinese) 朱力, 王恒樑. 志贺氏菌Ⅲ型分泌系统及其致病机理[J]. 微生物学报, 2010, 50(11): 1446-1451. |
| [3] |
Guerrero L, Calva JJ, Morrow AL, et al. Asymptomatic Shigella in fections in a cohort of Mexican children younger than two years of age[J]. Pediatric Infectious Disease Journal, 1994, 13(7): 597-602. DOI:10.1097/00006454-199407000-00003 |
| [4] |
Abu-Elyazeed RR, Wierzba TF, Frenck RW, et al. Epidemiology of Shigella-associated diarrhea in rural Egyptian children[J]. American Journal of Tropical Medicine and Hygiene, 2004, 71(3): 367-372. |
| [5] |
Liu W, Wang Y. Study on the distribution and drug resistance in 663 strains of Shigella[J]. Anhui Preventive Medicine, 2006, 12(2): 99-101. (in Chinese) 刘文, 王毅. 663株志贺氏菌流行分布及耐药性变迁的实验研究[J]. 安徽预防医学杂志, 2006, 12(2): 99-101. |
| [6] |
Ru WP, Huang LL, Zhao JY, et al. Analysis on the epidemic and aetiological character of bacillary dysentery in Henan province from 2005 to 2009[J]. Modern Preventive Medicine, 2010, 37(21): 4139-4141. (in Chinese) 茹维平, 黄丽莉, 赵嘉咏, 等. 河南省2005~2009年细菌性痢疾流行概况及病原特性分析[J]. 现代预防医学, 2010, 37(21): 4139-4141. |
| [7] |
Huang YP, Tang GP, Cai XH, et al. Analysis and surveillance on bacillary dysentery data of Guizhou Province from 2005–2011[J]. Modern Preventive Medicine, 2014, 41(11): 2092-2094. (in Chinese) 黄艳萍, 唐光鹏, 蔡星和, 等. 2005–2011年贵州省细菌性痢疾监测分析[J]. 现代预防医学, 2014, 41(11): 2092-2094. |
| [8] |
Shu C, Jiang CL, Zhong CP, et al. Establishment of a multiplex PCR detection method for three foodborne pathogens[J]. Science and Technology of Food Industry, 2014, 35(12): 49-54. (in Chinese) 舒畅, 姜琛璐, 钟慈平, 等. 三种食源性致病菌多重PCR检测方法的建立[J]. 食品工业科技, 2014, 35(12): 49-54. |
| [9] |
Ito K, Watanabe H, Toyosato M, et al. Genetic analysis of Shigella pathogenesis and rapid detection method of Shigella virulence gene by the polymerase chain reaction[J]. Nippon Rinsho Japanese Journal of Clinical Medicine, 1992, 50(Suppl): 368-372. |
| [10] |
Miyahara M. Simultaneous enrichment detection method for four types of pathogenic bacteria in food[J]. Biocontrol Science, 2005, 10(3): 91-96. DOI:10.4265/bio.10.91 |
| [11] |
Notomi T, Okayama H, Masubuchi H, et al. Loop-mediated isothermal amplification of DNA[J]. Nucleic Acids Research, 2000, 28(12): E63. DOI:10.1093/nar/28.12.e63 |
| [12] |
Kumar S, Mondal KK. Visual detection of Escherichia coli contamination in milk and fruit juice using loop-mediated isothermal amplification[J]. Journal of Food Science and Technology, 2015, 52(11): 7417-7424. DOI:10.1007/s13197-015-1779-2 |
| [13] |
de Costa APR, de Lira Nunes M, Mendes-Marques CL, et al. Loop-Mediated Isothermal Amplification (LAMP) for the Detection of Listeria monocytogenes and major pathogenic serotypes[J]. American Journal of Analytical Chemistry, 2014, 5(16): 1057-1064. DOI:10.4236/ajac.2014.516112 |
| [14] |
Xue CB, Xu ZJ, Huang ZL, et al. Development and application of loop-mediated isothermal amplification (LAMP) method for detection of Vibrio parahaemolyticus[J]. Food Science, 2012, 33(20): 262-264. (in Chinese) 薛超波, 许镇坚, 黄朱梁, 等. 环介导等温扩增技术检测创伤弧菌方法的建立与应用[J]. 食品科学, 2012, 33(20): 262-264. |
| [15] |
Xu XK, Zhang SH, Wu QP, et al. Development and application of a loop-mediated isothermal amplification (LAMP) method for rapid and sensitive detection of Enterococcus faecalis in Drinking Water[J]. Journal of Food Safety, 2014, 34(2): 103-110. DOI:10.1111/jfs.2014.34.issue-2 |
| [16] |
Techathuvanan C, D'Souza DH. Reverse-transcriptase loop-mediated isothermal amplification as a rapid screening/monitoring tool for Salmonella enterica detection in liquid whole eggs[J]. Journal of Food Science, 2012, 77(4): M200-M205. DOI:10.1111/j.1750-3841.2011.02601.x |
| [17] |
Soli KW, Kas M, Maure T, et al. Evaluation of colorimetric detection methods for Shigella, Salmonella, and Vibrio cholerae by loop-mediated isothermal amplification[J]. Diagnostic Microbiology & Infectious Disease, 2013, 77(4): 321-323. |
| [18] |
Song MM. Rapid detection of Shigella using loop-mediated isothermal amplification[D]. Baoding: Master's Thesis of Hebei Agricultural University, 2009 (in Chinese) 宋明明. 环介导等温扩增技术快速检测志贺氏菌的研究[D]. 保定: 河北农业大学硕士学位论文, 2009 http://kns.cnki.net/KCMS/detail/detail.aspx?filename=ahny201114001&dbname=CJFD&dbcode=CJFQ |
| [19] |
Minami M, Ohta MT, Ohkura T, et al. Use of a combination of brushing technique and the loop-mediated isothermal amplification method as a novel, rapid, and safe system for detection of Helicobacter pylori[J]. Journal of Clinical Microbiology, 2006, 44(11): 4032-4037. DOI:10.1128/JCM.00898-06 |
| [20] |
Song TY, Toma C, Nakasone N, et al. Sensitive and rapid detection of Shigella and enteroinvasive Escherichia coli by a loop-mediated isothermal amplification method[J]. FEMS Microbiology Letters, 2005, 243(1): 259-263. DOI:10.1016/j.femsle.2004.12.014 |
| [21] |
Ministry of Health of the People's Republic of China. GB/T4789.5-2012 Food Microbiological Inspection: Shigella Inspection[S]. Beijing: China Standards Press, 2012 (in Chinese) 中华人民共和国卫生部. GB/T4789. 5-2012食品微生物学检验志贺氏菌检验[S]. 北京: 中国标准出版社, 2012 |
| [22] |
Ministry of Health of the People's Republic of China. GB 4789.2-2010 National food safety standard Food microbiological examination:Aerobic plate count[S]. Beijing: China Standards Press, 2010 (in Chinese) 中华人民共和国卫生部. GB4789. 2-2010食品微生物学检验菌落总数测定[S]. 北京: 中国标准出版社, 2010 |
| [23] |
Lusetti SL, Shaw JJ, Cox MM. Magnesium ion-dependent activation of the RecA protein involves the C terminus[J]. Journal of Biological Chemistry, 2003, 278(18): 16381-16388. DOI:10.1074/jbc.M212916200 |
| [24] |
Meddeb-Mouelhi F, Dulcey C, Beauregard M. High transformation efficiency of Bacillus subtilis with integrative DNA using glycine betaine as osmoprotectant[J]. Analytical Biochemistry, 2012, 424(2): 127-129. DOI:10.1016/j.ab.2012.01.032 |
| [25] |
Zhang SK, Zhang XZ, Wang Y, et al. Reaction system optimization for the detection of Salmonella by loop-mediated isothermal amplification technology[J]. Journal of Anhui Agricultural Sciences, 2010, 38(22): 11727-11729. (in Chinese) 张胜凯, 张先舟, 王羽, 等. 环介导等温扩增技术检测沙门氏菌反应体系的优化[J]. 安徽农业科学, 2010, 38(22): 11727-11729. DOI:10.3969/j.issn.0517-6611.2010.22.022 |
| [26] |
Koide Y, Maeda H, Yamabe K, et al. Rapid detection of mecA and spa by the loop-mediated isothermal amplification (LAMP) method[J]. Letters in Applied Microbiology, 2010, 50(4): 386-392. DOI:10.1111/lam.2010.50.issue-4 |
| [27] |
Mori Y, Kanda H, Notomi T. Loop-mediated isothermal amplification (LAMP): recent progress in research and development[J]. Journal of Infection and Chemotherapy, 2013, 19(3): 404-411. DOI:10.1007/s10156-013-0590-0 |
| [28] |
Zhong QP, Wang L, Wang B, et al. Loop-mediated isothermal amplification method for rapid detection of Shigella dysenteriae[J]. Applied Mechanics and Materials, 2011, 140(2): 369-373. |
| [29] |
Li SY, Zhou QJ, Zhang YJ, et al. Visual detection of Shigella based on loop-mediated isothermal amplification combined with a lateral flow dipstick[J]. Microbiology China, 2016, 43(7): 1616-1626. (in Chinese) 李尚阳, 周前进, 张严峻, 等. 环介导等温扩增联合横向流动试纸条可视化检测志贺氏菌[J]. 微生物学通报, 2016, 43(7): 1616-1626. |
 2017, Vol. 44
2017, Vol. 44




