扩展功能
文章信息
- 韩文霞, 李伟泽, 李小峰, 张寒, 杨时珍, 杜江凤, 景欢, 程传彬
- HAN Wen-Xia, LI Wei-Ze, LI Xiao-Feng, ZHANG Han, YANG Shi-Zhen, DU Jiang-Feng, JING Huan, CHENG Chuan-Bin
- 蛇足石杉中产石杉碱甲内生真菌的分离和鉴定
- Isolation and identification of endophytic fungus producing Huperzine A from Huperzia serrata
- 微生物学通报, 2017, 44(9): 2153-2160
- Microbiology China, 2017, 44(9): 2153-2160
- DOI: 10.13344/j.microbiol.china.170160
-
文章历史
- 收稿日期: 2017-02-28
- 接受日期: 2017-06-23
- 优先数字出版日期(www.cnki.net): 2017-06-28
2. 石家庄机械化步兵学院 河北 石家庄 050083
2. Shijiazhuang Institute of Mechanized Infantry, Shijiazhuang, Hebei 050083, China
阿尔茨海默病又称老年痴呆症(Alzheimer’s disease,AD),随着老龄化的加剧,已经成为继心脑血管疾病和癌症之后,危害老年人生命健康的“第四位杀手”[1-4]。目前乙酰胆碱酯酶抑制剂类药物处于AD治疗药物市场上的主导地位,其中石杉碱甲(Huperzine A,HupA)作为AD治疗的有效药物,具有良好的应用前景[5]。
HupA其化学名为(5R, 9R, 11E)-5-氨基-11-亚乙基-5, 6, 9, 10-四氢-7-甲基-5, 9-亚甲环芳辛并-2(1H)-吡啶酮,分子式为C15H18N2O,分子量为242.3。HupA系石杉科植物次生代谢生物碱,是从民间草药千层塔中分离得到的一种新型石松类单体生物碱,具有多靶点作用,不仅能够阻断AchE对Ach的降解而增加脑内Ach的浓度以提高学习和记忆功能,还能对抗多种因素诱发的氧化应激和细胞凋亡等神经元毒性作用[6]。目前HupA主要是从天然植株中提取和化学合成两种途径获得。天然蛇足石杉资源主要来源于柳叶马尾杉、蛇足石杉等,但天然植株资源有限[7],而且HupA在全草中含量甚微,因此仅靠天然植株来获取HupA远远满足不了临床的需求;化学合成HupA工艺复杂繁琐、成本高,加之副产物多、纯化困难[8-9],在临床应用中具有潜在毒性。因此,利用生物合成方法获得HupA受到越来越多的关注。国内外研究学者对HupA生物合成做了大量研究,结果表明采用生物合成生产HupA是一种新型、高效、环保的合成方法[5]。
利用生物合成获得HupA的方法主要有微生物发酵、生物转化等方法。但是,至今因菌种的HupA产量较小而无法工业化生产。已有实验证明从野生蛇足石杉[Huperzia serrate (Thunb.) Trev,石杉科,石杉属]中可以分离获得产HupA的菌株[10-13]。目前国内外主要是从我国蛇足石杉中分离出炭角菌目(Xylariales)真菌,芽生菌属(Blastomyces)、支顶孢属(Acremonium)、葡萄孢属(Botrytis)、炭角菌属(Xycarialern)、柄孢壳菌属(Podospora)等属的菌株,以及黄曲霉(Aspergillus flavus)、芽枝状枝孢霉(Cladosporium cladosporioides)、纤姿拟青霉(Paecilonmyces tennis)、胶胞炭疽菌(C. gheosporioide ES026)、产黄青霉属(Penicillium chrysogenum)等真菌,已有报道显示,这些内生真菌分离物的石杉碱甲产量甚微,离工业化生产石杉碱甲还有很大距离[14]。
本文主要从四川省广元市旺苍县汉王山采集获得的野生蛇足石杉中分离获得内生真菌,并对产HupA菌株进行鉴定,以期获得高产、可稳定遗传的内生真菌,为进一步利用生物合成HupA开发新的菌种资源奠定基础。
1 材料与方法 1.1 材料 1.1.1 植物材料: 供试野生蛇足石杉(H. serrate)于2014年9月中下旬在四川省广元市旺苍县汉王山(海拔2 005.4 m) 900 m−1 500 m范围采集。采集时保留完整植株的根、茎、叶,并携带根际土壤一并带回实验室。 1.1.2 主要试剂和仪器: 石杉碱甲对照品,批号102518-79-6,纯度≥98%,上海思域化工科技有限公司;薄层色谱硅胶、琼脂糖凝胶电泳,陕西执信科技有限公司;Ezup柱式抽提试剂盒,货号SK8259,生工生物工程(上海)股份有限公司。恒温培养箱(BSP-400),中国上海博讯公司;恒温摇床(ZHNY-2112B),中国天津欧诺公司;高速冷冻离心机(5424R),德国Eppendorf公司;旋转蒸发仪(RE-2000),上海亚荣生化仪器厂;显微镜(E100),中国尼康公司;扫描电子显微镜(JCM6000),上海千欣仪器有限公司;高效液相色谱仪(Agilent 1100),美国Agilent公司;生物安全柜(A2型,1389),美国Thermo Scientific公司。
1.2 内生真菌的分离纯化及产生物碱菌株的筛选参考闵长莉和汪学军[12]内生真菌的分离纯化方法,分离蛇足石杉根、茎、叶中的内生真菌,直到得到纯化的内生真菌为止,内生真菌分离率的计算参照苏经迁[15]的方法进行。将纯化的内生菌分别接入装有100 mL马铃薯葡萄糖液体培养基[16]的250 mL锥形瓶中(每个菌株接3瓶),28 ℃、220 r/min振荡培养5 d,设置3个重复。内生真菌在振荡培养5 d后,培养滤液于10 000 r/min离心15 min[15]后用于生物碱的测定。产生物碱菌株筛选操作参考生物碱沉淀法及酸性染料比色的方法[15]进行。菌株的活化和传代采用PDA培养基[16]进行。
1.3 石杉碱甲的提取取产生物碱菌株的培养滤液经离心后获得上清液50 mL,采用氯仿-乙醚-氯仿提取方法提取石杉碱甲收集有机相,将氯仿萃取液蒸干后用色谱级甲醇定容到5 mL,测定发酵上清液产石杉碱甲的含量[16]。
1.4 薄层层析测定薄层层析(TLC)参照Zhang等[13]方法进行。展开剂为氯仿:丙酮:异丙醇(4:4:2,体积比),显色剂为0.3%高锰酸钾溶液,层析板采用GF254硅胶板。
1.5 高效液相色谱测定 1.5.1 色谱条件: 高效液相色谱柱为Agilent C18柱(4.60 mm×250 mm,5 μm);色谱条件为:流动相为甲醇-0.1%甲酸(75:25,体积比);流量1.0 mL/min;柱温25 ℃,进样量20 μL;检测波长310 nm。通过样品和石杉碱甲对照品色谱峰保留时间的数值来进一步判断菌株是否产石杉碱甲[12]。 1.5.2 标样溶液制备及精密度试验与线性方程建立: 精密称取HupA标准样20 mg,溶于20 mL蒸馏水中,依次制备成0.050、0.025、0.012 5、0.006、0.003 mg/mL质量浓度,分别进样20 μL。每次做5次重复,以确定精密度良好。以峰面积与对应标准品质量绘制标准曲线,得线性回归方程。通过线性回归方程计算所分离获得菌株产石杉碱甲的含量。 1.6 产石杉碱甲菌株的形态特征采用点接法将蛇足石杉内生真菌接种于PDA培养基上进行形态学研究,参照真菌的分类鉴定方法调查分离菌株的形态学基本特征[16]。
1.7 产石杉碱甲菌株的分子系统学特征产石杉碱甲菌株的基因组DNA提取按照Ezup柱式抽提试剂盒进行,真菌菌种鉴定通用引物ITS1和ITS4由生工生物工程(上海)股份有限公司提供。PCR反应体系:基因组DNA (20−50 ng/μL) 0.5 μL,10×Buffer (Mg2+) 2.5 μL,dNTPs (各2.5 mmol/L) 1 μL,酶0.2 μL,F (10 μmol/L) 0.5 μL,R (10 μmol/L) 0.5 μL,加双蒸水至25 μL。PCR反应条件:94 ℃ 4 min;94 ℃ 45 s,55 ℃ 45 s,72 ℃ 1 min,30个循环;72 ℃ 10 min。PCR产物经1%琼脂糖电泳检测后送生工生物工程(上海)股份有限公司进行测序。所测得的rDNA-ITS序列以Neighbour-joining方法构建进化树,参考rDNA-ITS序列选择和基于中点定根法标准,另选择从蛇足石杉分离获得的另一株可产石杉碱甲的毛霉属真菌作为外群。
1.8 产石杉碱甲菌株的遗传稳定性采用连续传代方法进行产石杉碱甲菌株的遗传稳定性研究。产石杉碱甲野生菌株经试管传代后接种到马铃薯葡萄糖液体培养基中进行培养,发酵条件保持一致。考察野生菌株经第5、10、15、20次传代后菌株产石杉碱甲的能力,每代传代间隔时间为1个月。石杉碱甲产量检测方法参照文中1.5的方法进行。
2 结果与分析 2.1 内生真菌的分离和培养从四川省广元市旺苍县汉王山采集的蛇足石杉的根、茎、叶组织内共获得40株内生真菌。这些菌株以叶片中获得的内生真菌分离率最高,为45%,茎中为30%,根中为25%。分离获得的40株内生真菌经培养后获得培养滤液,通过生物碱沉淀法及酸性染料比色共筛选方法进行筛选,从中共筛选出7株产生物碱内生真菌。
2.2 HupA的检测经马铃薯葡萄糖液体培养基培养后的菌株,离心获得上清液50 mL,采用氯仿-乙醚-氯仿提取方法提取石杉碱甲收集有机相,蒸干后用色谱级甲醇定容到5 mL后获得可用于TLC检测的样品。对所获得的7株内生真菌提取物经TLC检测,菌株NSH-5出现与标准品Rf值相似(图 1)。

|
| 图 1 菌株NSH-5马铃薯葡萄糖液体培养滤液中HupA的TLC分析 Figure 1 TLC analysis of fungal NSH-5 HupA formation in potato dextrose broth 注:3:石杉碱甲标准品. A:1:内生真菌NSH-5培养滤液提取物;2:NSH-5培养滤液提取物与石杉碱甲标准品混合物. B:1:不产石杉碱甲菌株培养滤液提取物;2:马铃薯葡萄糖培养基培养滤液提取物. Note: 3: A standard HupA sample. A: 1: NSH-5 HupA; 2: The minture of NSH-5 metabolite and HupA. B: 1: The metabolite of the fungal with no HupA; 2: The extracts filtrate of potato dextrose medium culture. |
|
|
HPLC分析结果表明标准品出峰时间为8.805 min (图 2),线性回归方程为y=−16.407 13 + 1 059.604 31x,R=0.997 58。菌株NSH-5培养滤液提取物出峰时间为9.020 min (图 3),二者出峰时间接近,当向菌株NSH-5培养滤液提取物中添加标准品后HPLC出峰时间重叠,不产HupA菌株培养滤液提取物HPLC出峰时间见图 4,结果表明NSH-5培养滤液提取物中存在石杉碱甲,产石杉碱甲含量为11.76 mg/100 mL。

|
| 图 2 标准品HupA的HPLC分析 Figure 2 Detection of standard HupA by HPLC analysis |
|
|
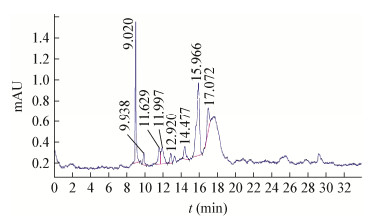
|
| 图 3 菌株NSH-5的HPLC分析 Figure 3 Detection of the fungal HupA produced by NSH-5 with HPLC analysis |
|
|

|
| 图 4 不产石杉碱甲菌株的HPLC分析 Figure 4 Detection of the fungal with no HupA produced by other fungal strain with HPLC analysis |
|
|
菌株NSH-5在PDA平板上28 ℃黑暗中产生的气生菌丝直径约3.5 μm,浓密、发达,呈棉絮状,4 d后菌落直径约为4.0 cm,生长速度较快。菌落正表面较松,呈苍白色絮状,背面中心呈浅黄棕色(图 5A、B)。分生孢子梗长55 μm−125 μm,宽3.2 μm−4.8 μm,从气生菌丝长出,不分枝或呈轮枝状分枝,单瓶梗产孢,分生孢子排列呈链状或形成假头状(图 5C-1、2),有隔菌丝(图 5D);产大小两种分生孢子,大分生孢子少,呈镰刀形,细长,中部较直,两端略弯,3−6个分隔,大小为(20.1−35.9) μm× (2.8−4.2) μm (图 5E-1,F-1、2、3、4);小分生孢子多,形状多变,呈卵圆形至棍棒状,1−2分隔,大小为(4.3−10.5) μm×(2.0−3.1) μm (图 5E-2、3,G,H);没有观察到厚垣孢子。以上特征与轮枝镰孢菌(Fusarium verticillioides)的形态特征一致[17-19]。

|
| 图 5 产石杉碱甲菌株NSH-5的菌落及分生孢子形态 Figure 5 Morphological characters of strain NSH-5 注:A、B:在PDA培养基28 ℃恒温培养4 d形成苍白色至浅黄棕色的菌落,A正面,B反面;C:单瓶梗产孢,分生孢子排列呈链状或形成假头状,图中数字1处标记为分生孢子排列形成链状,数字2处标记为分生孢子排列形成假头状;D:有隔菌丝;E−H:大型和小型分生孢子,其中E-1与F1−4为镰刀状大分生孢子,大小为(20.1−35.9) μm×(2.8−4.2) μm,E-2、E-3与G、H为小分生孢子,大小为(4.3−10.5) μm×(2.0−3.1) μm. A、B标尺为20 mm,C、D标尺为50 μm,E、F标尺为20 μm,G标尺为100 μm,H标尺为10 μm. Note: A and B: Forming white to pale yellow brown colony on PDA at 28 ℃ for 4 d, A: The obverse side, B: The reverse side; C: Valse conidia heads or conidia in chains forming from apical tips of monophialides, 1: Valse conidia in chains forming from apical tips of monophialides, 2: Valse conidia heads forming from apical tips of monophialides; D: Septate hypha; E−H: Macroconidia and microconidia, E-1 and F1-4: Sickle macroconidium, size is (20.1−35.9) μm×(2.8−4.2) μm, E-2, E-3 and G, H: Clavate microconidia, size is (4.3−10.5) μm×(2.0−3.1) μm. Bars: A, B=20 mm; C, D=50 μm; E, F=20 μm; G=100 μm; H=10 μm. |
|
|
NSH-5菌株DNA扩增条带经琼脂糖凝胶电泳测定大小为500 bp左右,且上下无杂带。以ITS1和ITS4为引物,在菌株NSH-5基因组DNA中扩增出532 bp片段,将测得的ITS-rDNA序列经NCBI上Blast比对并申请GenBank登录号(KX853851),菌株NSH-5 rDNA-ITS序列与Fusarium verticillioides BPFus 01和Fusarium verticillioides UZ487相似性均达100%,使用MEGA 7.0软件ClustalW方法,以Neighbour-joining方法构建进化树,在分支上标记1 000次重复获得的自展检验Bootstrap值,进化树构建结果见图 6。综合菌株NSH-5形态学和ITS序列分析,将菌株NSH-5鉴定为轮枝镰孢NSH-5株(Fusarium verticillioides NSH-5)。

|
| 图 6 菌株NSH-5基于rDNA-ITS的系统发育学分析 Figure 6 Phylogenetic tree constructed based on ITS sequences of NSH-5 注:分支点上的数字表示构建系统树时1 000次计算形成该节点的百分比;括号内为GenBank登录号;标尺长度代表遗传距离. Note: The bootstrap values (%) presented at the branches were calculated from 1 000 replications; Numbers in parentheses are GenBank accession numbers; The scale bar represents the evolution of the rDNA-ITS genome sequences. |
|
|
菌株NSH-5经连续传代后测定野生菌株经第5、10、15、20次传代后菌株的培养滤液产石杉碱甲的能力,经过20次传代的菌株与野生菌株产石杉碱甲能力无显著性差异(p=0.244 26) (表 1)。
| 传代次数 Number of batches |
石杉碱甲产量 Yielding of HupA (mg/100 mL) |
| 0 | 11.76 |
| 5 | 11.79 |
| 10 | 11.82 |
| 15 | 11.78 |
| 20 | 11.72 |
实验分离所获得的内生真菌中,从叶片中分离获得一株可产HupA且20次传代后具有较好遗传稳定性的菌株,根据形态学和分子生物学鉴定该菌株为轮枝镰孢菌。该菌株的发现及应用有望为生物合成HupA提供新的菌种资源,为解决临床HupA供应不足与价格较高的问题及AD的治疗提供药物保障,同时为濒危药用植物资源有效保护提供一种切实可行的方法。
目前,AD发病率飙升,HupA供应不足成为阻碍AD治疗的瓶颈,如何高效、环保、低成本获得HupA成为亟待解决的重大技术问题。目前已报道菌株的HupA产量[13, 15, 20-21]见表 2,实验所获得的轮枝镰孢菌NSH-5株HupA产量为11.76 mg/100 ml,与以往发现菌株相比其产量有所提高[13, 15, 20-22],但其产量离工业化生产还有很大距离。鞠錾[22]及周树良等[23]通过改变培养条件提高菌株生物合成石杉碱甲的能力,但是,经单因子和正交试验优化后的发酵条件所获得的石杉碱甲产量离工业化生产依然有很大距离,从而难以进入大规模生产。因此对已发现菌株的生物合成机理研究和对产石杉碱甲相关基因改造及菌种稳定表达体系的构建将成为下一步实验研究的主要任务。
| 菌株 Strain |
石杉碱甲产量 Yielding of HupA |
参考文献 Reference |
| Paecilonmyces tennis YS-13 | 21.0 μg/L | [15] |
| Xylariales SY-02 | 26.4 μg/L | [15] |
| Aspergillus flavus LF40 | 80.1 μg/g dcw | [20] |
| Cladosporium cladosporioides LF70 | 56.84 μg/g dcw | [13] |
| Shiraia sp. Slf14 | 327.8 μg/L | [22] |
| Blastomyces sp.HA15 | 20−30 μg/g dcw | [10] |
| Fusarium verticillioides NSH-5 | 11.76 mg/100 ml | 本研究 |
| Note: μg/g dcw: HupA per dry weight of mycelium. | ||
Bunsupa等的研究结果表明:HupA生物合成是以赖氨酸脱羧酶介导赖氨酸脱羧开始[24],在内生真菌生物合成HupA途径中,加入赖氨酸后真菌表达所获取的HupA远远高于未添加组[25]。并且,在赖氨酸脱羧酶作用后接着由铜胺氧化酶催化尸胺生成四氢吡啶,然后经过一系列的酶促反应才能最终生成HupA。但是,已证明赖氨酸脱羧酶和铜胺氧化酶不是影响HupA表达的关键酶类,因此研究影响经由赖氨酸起始合成HupA过程中的关键酶类显得尤为重要。由于酶的表达受基因序列和相关基因(作用元件)的调控。据此,后期实验研究将对产石杉碱甲菌株改变一定诱变条件,如应用紫外线诱变原生质体等方法对产石杉碱甲菌株进行菌种生物诱变改造条件研究,拟对诱变菌株中筛选得到的有效基因序列编码的关键酶进行预测研究和功能验证,阐明基因调节及关键酶在HupA生物合成途径中的作用机制。为进一步利用生物合成方法工业化生产石杉碱甲奠定基础。
| [1] |
Zhu N, Lin JZ, Chen QZ, et al. Anti-inflammatory effect of Huperzine A on protection of rat neural stem cells in vitro[J]. Chinese Journal of Pathophy Siology, 2013, 29(7): 1160-1164. (in Chinese) 朱宁, 林继宗, 陈庆状, 等. 石杉碱甲的抗炎作用及其对大鼠神经干细胞的保护作用[J]. 中国病理生理学杂志, 2013, 29(7): 1160-1164. |
| [2] |
Wang BS, Wang H, Wei ZH, et al. Efficacy and safety of natural acetylcholinesterase inhibitor Huperzine A in the treatment of Alzheimer's disease: an updated meta-analysis[J]. Journal of Neural Transmission, 2009, 116(4): 457-465. DOI:10.1007/s00702-009-0189-x |
| [3] |
Zhu Y, Bao ZJ, Ma YX. The progress research of conversion of intervention MCI combined by Huperzine A and aspirin[J]. Chinese Journal of Gerontology, 2011, 31(9): 1691-1693. (in Chinese) 竺越, 保志军, 马永兴. 石杉碱甲及阿司匹林联用干预MCI转化率研究进展[J]. 中国老年学杂志, 2011, 31(9): 1691-1693. |
| [4] |
Li XN, Li XJ, Wang HT, et al. Effect of Yizhi Capsules on learning and memory disorder in rat with Aβ1-42-induced Alzheimer's disease[J]. Chinese Traditional Patent Medicine, 2014, 36(11): 2233-2237. (in Chinese) 李雪娜, 李向军, 王宏涛, 等. 益智胶囊对Aβ1-42致阿尔茨海默病大鼠学习记忆障碍的影响[J]. 中成药, 2014, 36(11): 2233-2237. DOI:10.3969/j.issn.1001-1528.2014.11.001 |
| [5] |
Chen HQ, Wan YH, Jiang SA, et al. Alzheimer's disease research in the future: bibliometric analysis of cholinesterase inhibitors from 1993 to 2012[J]. Scientometrics, 2014, 98(3): 1865-1877. DOI:10.1007/s11192-013-1132-3 |
| [6] |
Yu MN, Li FM, Liu JY. 82 cases of treatment multiple infarction dementia used by piece of Huperzine A[J]. Chinese Traditional Patent Medicine, 2013, 35(10): 2307-2308. (in Chinese) 于麦娜, 李凤梅, 刘剑英. 石杉碱甲片治疗多梗死性痴呆82例[J]. 中成药, 2013, 35(10): 2307-2308. DOI:10.3969/j.issn.1001-1528.2013.10.061 |
| [7] |
Ferreira A, Rodrigues M, Fortuna A, et al. Huperzine A from Huperzia serrata: a review of its sources, chemistry, pharmacology and toxicology[J]. Phytochemistry Reviews, 2016, 15(1): 51-85. DOI:10.1007/s11101-014-9384-y |
| [8] |
Ding R, Lu YY, Yao HQ, et al. A new approach to the bicyclo[3.3.1]nonane framework of Huperzine A-like molecules via palladium-catalyzed intramolecular γ-arylation[J]. Science China Chemistry, 2012, 55(6): 1097-1100. DOI:10.1007/s11426-011-4480-y |
| [9] |
Qi SH, Xu Y, Xiong HR, et al. Antifouling and antibacterial compounds from a marine fungus Cladosporium sp. F14[J]. Word Journal of Microbiology and Biotechnology, 2009, 25(3): 399-406. DOI:10.1007/s11274-008-9904-2 |
| [10] |
Ju Z, Wang J, Pan SL. Isolation and preliminary identification of the endophytic fungi which produce Hupzine A from four species in Hupziaceae and determination of Huperzine A by HPLC[J]. Fudan University Journal of Medical Sciences, 2009, 36(4): 445-449. (in Chinese) 鞠錾, 王俊, 潘胜利. 4种石杉科植物中产石杉碱甲的内生真菌的分离及初步鉴定和HPLC测定石杉碱甲的含量[J]. 复旦学报:医学版, 2009, 36(4): 445-449. |
| [11] |
Zhou HH, Jia XS, Gao YM, et al. The content of Hupzine A determinated by Thin layer scanning method from frilling Shi Sha sinopec Chinese fir alkali[J]. Journal of Chinese Medicinal Metarials, 2008, 31(2): 235-237. (in Chinese) 周汉华, 贾宪生, 高言明, 等. 薄层扫描法测定皱边石杉中石杉碱甲的含量[J]. 中药材, 2008, 31(2): 235-237. |
| [12] |
Min CL, Wang XJ. Isolation and identification of a Huperzine A-producing endophytic fungi from Huperzia serrata[J]. Natural Product Research and Development, 2013, 25(5): 590-593. (in Chinese) 闵长莉, 汪学军. 蛇足石杉产石杉碱甲内生真菌的分离鉴定[J]. 天然产物研究与开发, 2013, 25(5): 590-593. |
| [13] |
Zhang ZB, Zeng QG, Yan RM, et al. Endophytic fungus Cladosporium cladosporioides LF70 from Huperzia serrata produces Huperzine A[J]. World Journal of Microbiology and Biotechnology, 2011, 27(3): 479-486. DOI:10.1007/s11274-010-0476-6 |
| [14] |
Han WX, Song T, Li WZ, et al. Progress on the research methods for developing new resources of Huperzine A[J]. Hainan Medical Journal, 2015, 26(15): 2275-2278. (in Chinese) 韩文霞, 宋涛, 李伟泽, 等. 产石杉碱甲新资源研究方法探索[J]. 海南医学, 2015, 26(15): 2275-2278. DOI:10.3969/j.issn.1003-6350.2015.15.0819 |
| [15] |
Su JQ. Alkaloid and Huperzine A production from endophytic fungi isolated from Huperziaceae[D]. Fuzhou: Master's Thesis of Fujian Normal University, 2011 (in Chinese) 苏经迁. 产生物碱和石杉碱甲石杉科植物内生真菌的研究[D]. 福州: 福建师范大学硕士学位论文, 2011 http://cdmd.cnki.com.cn/article/cdmd-10394-1012266576.htm |
| [16] |
Han WX, Song T, Yang SZ, et al. Identification of alkaloids and Huperzine A-producing endophytic fungi isolated from wild Huperzia serrata[J]. Journal of International Pharmaceutical Research, 2015, 42(4): 507-512. (in Chinese) 韩文霞, 宋涛, 杨时珍, 等. 野生蛇足石杉产生物碱和石杉碱甲内生真菌分离鉴定[J]. 国际药学研究杂志, 2015, 42(4): 507-512. |
| [17] |
Lesile JF, Summerell BA, Bullock S. The Fusarium Laboratory Manual[M]. Ames, Iowa, USA: Blackwell Publishing, 2006.
|
| [18] |
Hirata T, Kimishima E, Aoki T, et al. Morphological and molecular characterization of Fusarium verticillioides from rotten banana imported into Japan[J]. Mycoscience, 2001, 42(2): 155-166. DOI:10.1007/BF02464132 |
| [19] |
Tong YT, Yan DH, Peng WX, et al. Identification and biological characteristics of Fusarium verticillioides (Saccardo) nirenberg causing leaf blight on Ti plant (Cordvline fruticosa Chevalier)[J]. Journal of Guangdong Ocean University, 2016, 36(4): 89-95. (in Chinese) 童依婷, 晏冬华, 彭文煊, 等. 朱蕉叶枯病菌的鉴定及生物学特性[J]. 广东海洋大学学报, 2016, 36(4): 89-95. |
| [20] |
Wang Y. Isolation and characterization of endophytic Huperzine A-producing fungi from Huperzia serrata[D]. Nanchang: Master's Thesis of Jiangxi Normal University, 2011 (in Chinese) 汪涯. 产石杉碱甲蛇足石杉内生真菌的分离与鉴定[D]. 南昌: 江西师范大学硕士学位论文, 2011 http://cdmd.cnki.com.cn/article/cdmd-10414-1011236645.htm |
| [21] |
Wang JX. Study on isolation and fermentation condition of a Huperzine A-producing endophytic fungus, Shiraia sp. Slf14, from Huperzia serrata[D]. Nanchang: Master's Thesis of Jiangxi Normal University, 2010 (in Chinese) 王吉祥. 一株产石杉碱甲蛇足石杉内生真菌的分离及其发酵条件的初步研究[D]. 南昌: 江西师范大学硕士学位论文, 2010 http://cdmd.cnki.com.cn/article/cdmd-10414-1011031377.htm |
| [22] |
Ju Z. Isolation and preliminary identification of the endophytic fungi which produce Hupzine A from four species in Hupziaceae and determination of Huperzine A by HPLC[D]. Shanghai: Master's Thesis of Fudan University, 2009 (in Chinese) 鞠錾. 四种石杉科植物中产生石杉碱甲的内生真菌的分离、鉴定和其石杉碱甲含量的测定[D]. 上海: 复旦大学硕士学位论文, 2009 http://cdmd.cnki.com.cn/Article/CDMD-10246-2010057708.htm |
| [23] |
Zhou SL, Yang F, Lan SL, et al. Huperzine A producing conditions from endophytic fungus in SHB Huperzia serrata[J]. Journal of Microbiology, 2009, 29(3): 32-36. (in Chinese) 周树良, 杨帆, 兰时乐, 等. 千层塔内生真菌SHB发酵产石杉碱甲条件的研究[J]. 微生物学杂志, 2009, 29(3): 32-36. |
| [24] |
Bunsupa S, Katayama K, Ikeura E, et al. Lysine decarboxylase catalyzes the first step of quinolizidine alkaloid biosynthesis and coevolved with alkaloid production in Leguminosae[J]. Plant Cell, 2012, 24(3): 1202-1216. DOI:10.1105/tpc.112.095885 |
| [25] |
Yan RM, Zhang ZB, Wang Y, et al. Efficient strategy for maintaining and enhancing the Huperzine A production of Shiraia sp. Slf14 through inducer elicition[J]. Journal of Industrial Microbiology & Biotechnology, 2014, 41(7): 1175-1179. |
 2017, Vol. 44
2017, Vol. 44




