扩展功能
文章信息
- 朱良全, 孙晔, 孙翠丽, 程汝佳, 彭永, 叶俊贤, 刘郁夫, 高强, 丁家波
- ZHU Liang-Quan, SUN Ye, SUN Cui-Li, CHENG Ru-Jia, PENG Yong, YE Jun-Xian, LIU Yu-Fu, GAO Qiang, DING Jia-Bo
- 两种不同保护剂冻干的仔猪副伤寒活疫苗质量比较
- Comparison of swine paratyphoid live vaccines lyophilized with two different stabilizers
- 微生物学通报, 2017, 44(9): 2137-2144
- Microbiology China, 2017, 44(9): 2137-2144
- DOI: 10.13344/j.microbiol.china.170082
-
文章历史
- 收稿日期: 2017-01-30
- 接受日期: 2017-05-08
- 优先数字出版日期(www.cnki.net): 2017-06-06
2. 北京中海生物科技公司 北京 100081;
3. 山东农业大学动物科技学院 山东 泰安 271018
2. Beijing Zhonghai Biotec Co. Ltd., Beijing 100081, China;
3. College of Animal Science, Shandong Agricultural University, Tai'an, Shandong 271018, China
肠道沙门氏菌(Salmonella)是最常见的人畜共患病原菌,由其引起的食物中毒病例占世界第一位或第二位[1]。根据其对宿主适应性或嗜性不同,可分为3个群,其中一群为特定动物的偏嗜性沙门氏菌,如猪霍乱沙门氏菌等[2]。猪霍乱沙门氏菌是我国感染猪的主要致病性沙门氏菌之一,该菌高度适应猪,主要引起幼猪和架子猪的败血症及肠炎,但近几年由该菌导致的食物中毒频有发生,引起国内外高度关注[3-9]。
疫苗免疫是预防和控制猪霍乱沙门氏菌病的有效途径[2, 9]。20世纪60年代,房晓文等[10]选用抗原性良好的猪霍乱沙门氏菌强毒株C78-1在含有醋酸铊的普通肉汤中传代培养500代后,筛选出一株遗传稳定、免疫原性好的弱毒株C500 (现称CVCC79500),并制备了仔猪副伤寒活疫苗(简称“常规苗”,下同),其毒力稳定、安全,对仔猪有坚强免疫力,已在我国应用40余年,现每年生产约1.5亿头份,免疫效力确实[10-13]。但该疫苗在生产中一直沿用1.5%明胶和5%蔗糖作为冻干保护剂,需要−15 ℃保存,存在冻干存活率低、在较高温度下保护功能较差的缺点[12]。另外,低温(−15 ℃)保存给边远地区疫苗储运和使用带来困难[13]。2007年,本课题组根据保护剂基质与猪霍乱沙门氏菌菌体相容性特点,研制出以PVP、水溶性明胶、山梨醇、199培养基、L-谷氨酸钠等为主要成分的耐热保护剂及配套冻干工艺,为破解疫苗生产工艺难题提供了解决方案[14]。2015年本课题组在2007年的研究基础上,研制出仔猪副伤寒耐热保护剂活疫苗(简称“耐热苗”,下同)并获得国家新兽药注册证书,至今已有3家公司获得农业部批准文号并实现产品上市[15-16]。现将试制的3批耐热苗与传统苗按现行《中国兽药典》中的质量标准项进行系统检定[17],并对结果进行全面比较,为科学评价两种疫苗的质量提供参考。
1 材料 1.1 菌种生产用菌种:猪霍乱沙门氏菌(CVCC79500株) (编号SC200808,2008.11.6冻干,2 mL/瓶);检验用菌种(CVCC79102株) (编号JY200808,2008.11.13冻干,2 mL/瓶),均由北京中海生物科技有限公司科研部制备。
1.2 主要试剂和培养基普通琼脂(又称营养琼脂,批号:20100102)、普通肉汤培养基(又称营养肉汤,批号:20100102)、1.5%明胶和5%蔗糖冻干保护剂、20%铝胶生理盐水(批号:20100102)、纯粹检验用硫乙醇酸盐培养基(TG)、酪胨琼脂(GA)和葡萄糖蛋白胨汤(GP)(批号:20100102),均由中国兽医药品监察所培养基组按《中华人民共和国兽用生物制品规程(2000版)》(以下简称《规程》[12])配制及供应。
仔猪副伤寒活疫苗合成培养基(主要成分为胰酪蛋白胨、酵母粉等,批号为201001)[14, 18]及仔猪副伤寒活疫苗耐热保护剂(主要成分为聚乙烯吡咯烷酮(Polyvinylpyrrolidone,简称PVP)、水溶性明胶、山梨醇、199培养基、L-谷氨酸钠等,批号为201011)[18],均由北京中海生物科技有限公司配制及提供。
1.3 动物兔:体重1.5−2.0 kg,普通级;仔猪:体重12–15 kg,猪霍乱沙门氏菌抗体阴性,断乳健康。动物均由中国兽医药品监察所实验动物组采购并提供。
1.4 主要仪器30 L发酵罐,上海高机生物工程有限公司;高速离心机,日立公司;冻干机,Edwards公司;水分测定仪,METTLER TOLEDO公司;76-1型高频电火花真空度测定仪,华西科创(北京)科技有限公司。
2 方法 2.1 仔猪副伤寒耐热苗及常规苗的制备 2.1.1 种子繁殖及发酵培养: 种子液按《规程》[12]进行繁殖和制备。将种子液按2% (体积比)接种于合成培养基(30 L发酵罐盛装培养基20 L)中,按文献[18]报道的发酵工艺及参数培养18 h,培养过程中根据pH值变化用灭菌的50%葡萄糖溶液控制pH值为7.5−7.6。 2.1.2 配苗、分装及冻干: 培养结束后,以3 500 r/min离心20 min,弃去上清。然后用保护剂(耐热保护剂或者1.5%明胶5%蔗糖)悬浮至菌液终浓度3×1010−5×1010 CFU/mL,即为制苗用菌液。按《规程》[12]取样并经半成品检验(活菌计数及纯粹检验)合格后,定量分装(3 mL/瓶),分别按各自的冻干曲线进行冻干,各冻干3批,每批冻干约200瓶。其中耐热苗(批号为1001、1002、1003) 采用文献[14]报道中的冻干曲线,常规苗(批号为1011、1012、1013) 采用《规程》[12]中冻干曲线。取冻干前后样品各3瓶,按现行《中国兽药典》[17]要求进行活菌计数,计算冻干前后活菌存活率(冻干菌存活率),详见公式(1)。

|
(1) |
选取3批耐热苗及3批常规苗,每批各30瓶,按现行《中国兽药典》[17]进行2.2.1−2.2.6项检验。
2.2.1 物理性状检验: 随机取待检疫苗(5瓶/批),重点检查冻干团块表面有无结晶和塌陷,合格疫苗其冻干团块表面应无结晶和塌陷。 2.2.2 纯粹性检验: 随机取待检疫苗(3瓶/批),用5 mL普通肉汤混合溶解后,每瓶样品分别接种TG小管、GA斜面各2支,每支0.2 mL,1支置37 ℃培养,1支置25 ℃培养,另接种1支GP小管,置25 ℃培养,观察7 d。若37 ℃及25 ℃接种TG小管呈均匀混浊,革兰氏染色均为红色、无杂菌且37 ℃及25 ℃接种GA斜面肉眼观察菌落生长纯粹,经革兰氏染色均为阴性小杆菌,则说明无其他厌氧和需氧性菌生长;若25 ℃接种GP小管呈均匀混浊,革兰氏染色均为红色、无杂菌,则表明无霉菌和腐生菌生长。如果TP、GA及GP均无杂菌,则判为纯粹检验合格;否则,判为纯粹检验不合格[12, 17]。 2.2.3 活菌计数: 任取疫苗3瓶,每瓶疫苗分别加入适量蛋白胨水稀释成0.5头份/mL,然后10倍倍比稀释至10−7,取最后一支稀释度试管菌液,接种3个普通琼脂平板,每个平板接种0.1 mL,使菌液均匀散开,置37 ℃培养箱晾干后,翻转平板。待接菌平板37 ℃培养24 h,肉眼观察菌落,并在平板底面点数,算出每瓶3个平板的平均菌落数。所得平均菌落数乘以稀释倍数,即为总活菌数。 2.2.4 安全性: 每批疫苗取3瓶,用生理盐水混合稀释至2头份/mL,皮下注射家兔2只,1.0 mL/只,临床观察21 d,记录存活情况。如果2只兔均健活,说明疫苗安全;如果1只健活、1只非特异性死亡(剖检的心、肝、脾、肺、肾等脏器未分离到猪霍乱沙门氏菌),则需加倍量(4只兔)重检一次,如果全部健活,则说明疫苗安全,否则判定疫苗安全性检验不合格[12, 17]。 2.2.5 剩余水分: 每批抽样4瓶,每瓶疫苗称量好(瓶重+样重),然后减去瓶重,获得样品干前重量。随后将样品移入无水氯化钙的干燥罐中,称量获得样重;并运用真空干燥箱,将瓶在2.67 kPa (20 mmHg)以下,以66 ℃干燥3 h,通入经过无水氯化钙吸水的干燥空气,待室温后称取瓶重。干燥失重=(干前瓶重+样重)−(干后瓶重+样重)。疫苗水分含量按公式(2) 计算,应不超过4%。
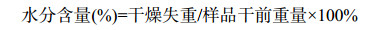
|
(2) |

|
(3) |

|
(4) |
耐热苗及常规苗按《中国兽药典》标准项检定结果见表 1。表 1结果显示,3批耐热苗及常规苗纯粹性、物理性状、剩余水分、真空度、安全检验均符合现行《中国兽药典》[17]要求。不过,耐热苗的水分含量普遍低于常规苗,其真空度优于常规苗。
| 疫苗 Vaccine |
批号 Batch No. |
物理性状 Physical properties |
纯粹检验 Pureness test |
剩余水分 Residual moisture (%) |
真空度 Vacuity |
活菌计数 (×108CFU/头份) Viable bacterial counts (×108 CFU/dose) |
安全检验* Safety* |
|||||
| 37 ℃ | 25 ℃ | |||||||||||
| TG | GA | TG | GA | GP | ||||||||
| 耐热苗 TS vaccine |
1001 | 均为白色海绵状疏松团块 | - | 均纯粹生长 | - | 均纯粹生长 | - | 1.99 1.89 1.92 1.93 |
均为白色辉光 | 45.2 | 2/2兔健活 | |
| 1002 | - | - | - | 1.87 1.86 1.91 1.94 |
52.2 | 2/2兔健活 | ||||||
| 1003 | - | - | - | 1.75 1.86 1.81 1.84 |
47.6 | 2/2兔健活 | ||||||
| 常规苗 Traditional vaccine |
1101 | 均为白色海绵状疏松团块 | - | 均纯粹生长 | - | 均纯粹生长 | - | 2.79 2.88 2.95 2.93 |
均为白色辉光 | 47.2 | 2/2兔健活 | |
| 1102 | - | - | - | 2.75 2.86 2.81 3.01 |
46.4 | 2/2兔健活 | ||||||
| 1103 | - | - | - | 3.05 2.96 2.81 2.88 |
50.4 | 2/2兔健活 | ||||||
| 注:-:均匀混浊,革兰氏染色均为红色,无杂菌;*:分母为免疫接种兔数量,分子为健活兔数量. Note: -: uniform turbidity, Gram stain red, no contaminated bacterium; *: The denominator was the number of vaccinated rabbits and the numerator was the number of health rabbits. |
||||||||||||
耐热苗和常规苗冻干菌存活率及耐老化试验结果见表 2。表 2显示,耐热苗的冻干菌存活率为83.1%−88.2%,常规疫苗为52.3%−61.4%;37 ℃保存7 d,耐热苗的活菌存活率为82.9%−88.8%,常规苗为54.7%−60.2%。冻干后无论耐热苗还是常规苗物理性状均良好,冻干物质均为白色海绵状疏松团块,经37 ℃保存7 d耐老化试验后,耐热苗物理性状仍良好,而常规苗干缩1/4−1/2。
| 疫苗 Vaccine |
批号 Batch No. |
冻干前活菌数 (×108 CFU/头份) viable bacteria counts before lyophilization (×108 CFU/dose) |
冻干后 after lyophilization |
37 ℃ 7 d 37 ℃ for 7 days |
||||
| 物理性状 physical properties |
冻干菌存活率 Survival ratio (%) |
物理性状 physical properties |
活菌存活率 Survival ratio (%) |
|||||
| 热苗 TS vaccine |
1001 | 56.0 | 均为白色海绵状疏松团块 | 88.2 | 均为白色海绵状疏松团块 | 83.6 | ||
| 1002 | 58.5 | 83.1 | 82.9 | |||||
| 1003 | 59.1 | 86.4 | 88.8 | |||||
| 常规苗 Traditional vaccine |
1101 | 90.8 | 均为白色海绵状疏松团块 | 52.3 | 均为白色海绵状疏松团块 | 58.5 | ||
| 1102 | 99.1 | 56.2 | 60.2 | |||||
| 1103 | 81.7 | 61.4 | 54.7 | |||||
耐热苗和常规苗保存期试验结果见图 1。图 1显示,3批耐热苗4 ℃保存27个月菌存率达91.1%−93.4%。常规疫苗4 ℃保存12个月菌存率仅为57.6%−64.6%。当常规苗4 ℃保存超过12个月时,其计算出的活菌数已达不到现行《中国兽药典》[17]规定的30×108 CFU/头份标准。因此,为确保疫苗质量,确定耐热苗4 ℃有效保存期为24个月,常规苗4 ℃有效保存期为9个月。

|
| 图 1 疫苗在4保存不同时间后活菌菌存率 Figure 1 The bacteria survival ratio of two vaccines after stored at 4 ℃ Note: *: p < 0.05. |
|
|
耐热苗和常规苗效力试验比较结果见图 2。如图 2所示,仔猪以1头份最小标准剂量(3×109 CFU活菌)免疫后,以1 MLD猪霍乱沙门氏菌强毒攻毒,耐热苗无论口服还是肌肉注射免疫均为100%保护,常规苗口服免疫达100%保护,而肌肉注射免疫为80%保护(攻毒后第9 d死亡1只),不免疫攻毒对照仔猪均100%死亡(攻毒后6 d死亡2只,7 d死亡1只,10 d死亡2只)。所有死亡仔猪均呈明显败血症状,其剖检后在肝、脾、肺、肾等组织均可分离到猪霍乱沙门氏菌。可见,两种疫苗免疫保护效力确实,耐热苗肌肉注射免疫保护率略优于常规苗,口服免疫两者保护率一致。

|
| 图 2 两种疫苗在仔猪中对强毒猪霍乱沙门氏菌的免疫保护率 Figure 2 The protective ratio of two vaccine against virulent challenge in piglets |
|
|
(1) 仔猪副伤寒耐热保护剂活疫苗相较于传统保护剂冻干的仔猪副伤寒活疫苗,具有冻干菌存活率高、耐老化性能好、可实现4 ℃长期保存的优点。两种疫苗安全性良好、免疫效力确实,这与以往兽用病毒类疫苗的研究结论一致。由耐热保护剂及其冻干工艺研制的仔猪副伤寒耐热保护剂活疫苗实现了我国现有兽用细菌活疫苗工艺和技术上的革新。目前除该耐热苗外,《中国兽药典》收载的17种细菌类活疫苗,还未有其他既能保持良好耐老化性能又能提高冻干菌存活率的疫苗获国家认可[14, 17]。
(2) 冷冻会对细菌产生一定的破坏作用,其机理非常复杂,目前尚无统一的理论,但普遍认为是由机械效应和溶质效应引起的[19-20]。如果无保护剂,细菌在经历低温后很难存活下来。由于不同细菌的菌体特点及组成有差别,比如革兰氏阴性菌与革兰氏阳性菌,其保护剂理论上是有差异的。传统保护剂(如1.5%明胶和5%蔗糖,5%脱脂牛奶和10%蔗糖等)系通用的保护剂配方,因此制成的仔猪副伤寒活疫苗存在冻干菌存活率整体偏低、有效保存期较短、实际应用效果差的缺点[12, 17]。
(3) 耐热保护剂相对传统保护剂而言,含有多成分的大分子物质和小分子物质,以及传统保护剂所没有的抗氧化剂[14]。其大分子物质(如PVP、水溶性明胶、199培养基等)在冻干过程中组成耐热性构架,阻断热源对构架内细菌热传导性和热辐射性杀伤;其小分子物质(如山梨醇、谷氨酸钠、磷酸氢二钾、磷酸二氢钾等)与菌液形成均匀悬液,直接保护细菌以防止干燥过程中的最终水分含量过低;其抗氧化剂可阻止细菌在干燥状态下与氧接触,降低新陈代谢引起死亡[21-23]。另外,耐热保护剂中含有的PVP可抑制磷酸盐的结晶,从而避免系统pH值降低[24];采用PVP与其他赋形剂(如甘露醇等)联合使用,其抗断裂的强度可提高3–25倍,保证了冻干物料的颜色和质地均匀,在相对高温下使制品不收缩[25]。
(4) 耐热苗水分含量普遍比传统苗低,主要在于保护剂和冻干曲线的不同。耐热保护剂中含有抗氧化剂成分,水分含量低可有效阻止与氧接触,降低新陈代谢引起死亡[14, 21-23];其次,耐热苗二次干燥阶段维持时间长,如耐热苗在25–30 ℃维持6–8 h以上,而常规苗在25–28 ℃仅保持3 h以内[12, 14]。此外,据报道残余水分质量分数为1%–3%时菌体的相对存活率较高,而高于5%时菌体存活率明显降低、贮存期缩短[26]。
(5) 对于试验中耐热苗肌肉注射攻毒结果优于常规苗,可能是因为耐热保护剂成分中含有佐剂的缓释功能,不过该结论仍需大量临床试验进行进一步验证。
| [1] |
Manzano M, Cocolin L, Astori G, et al. Development of a PCR microplate-capture hybridization method for simple, fast and sensitive detection of Salmonella serovars in food[J]. Molecular and Cellular Probes, 1998, 12(4): 227-234. DOI:10.1006/mcpr.1998.0176 |
| [2] |
Lu CP. Veterinary Microbiology[M]. 4th Edition. Beijing: China Agriculture Press, 2010, 107-113. (in Chinese) 陆承平. 兽医微生物学[M]. 第4版. 北京: 中国农业出版社, 2010, 107-113. |
| [3] |
Li HY. An investigation report of food poisoning caused by Salmonella enterica[J]. Guide of China Medicine, 2008, 6(5): 86-87. (in Chinese) 李怀玉. 一起猪霍乱沙门氏菌引起食物中毒的调查报告[J]. 中国医药指南, 2008, 6(5): 86-87. |
| [4] |
Wang JZ, Zhong DM. One strain of Salmonella choleraesuis isolated from pus in the upper arm[J]. The Medical Journal of Industrial Enterprise, 2005, 18(3): 48. (in Chinese) 王俊智, 仲冬梅. 从上臂脓液中分离1株猪霍乱沙门氏菌[J]. 工企医刊, 2005, 18(3): 48. |
| [5] |
Guan P, Zhang DD, Chen YG, et al. One case from human Salmonella choleraesuis septicemia[J]. Chinese Journal of Convalescent Medicine, 2008, 17(4): 244-245. (in Chinese) 关平, 张大东, 陈跃光, 等. 人猪霍乱沙门氏菌败血症1例[J]. 中国疗养医学, 2008, 17(4): 244-245. |
| [6] |
Ku YW, McDonough SP, Palaniappan RUM, et al. Novel attenuated Salmonella enterica serovar Choleraesuis strains as live vaccine candidates generated by signature-tagged mutagenesis[J]. Infection and Immunity, 2005, 73(12): 8194-8203. DOI:10.1128/IAI.73.12.8194-8203.2005 |
| [7] |
Chiu CH, Su LH, Chu C. Salmonella enterica serotype choleraesuis:epidemiology, pathogenesis, clinical disease, and treatment[J]. Clinical Microbiology Reviews, 2004, 17(2): 311-322. DOI:10.1128/CMR.17.2.311-322.2004 |
| [8] |
Hsueh PR, Teng LJ, Tseng SP, et al. Ciprofloxacin-resistant Salmonella enterica Typhimurium and Choleraesuis from pigs to humans, Taiwan[J]. Emerging Infectious Diseases, 2004, 10(1): 60-68. DOI:10.3201/eid1001.030171 |
| [9] |
Liu QF, Cui SJ. Swine salmonella disease etiology, epidemiology, diagnosis and treatment progress[J]. Swine Industry Science, 2009, 26(12): 24-28. (in Chinese) 刘芹防, 崔尚金. 猪沙门氏菌病病原学、流行病学、诊断及防治进展[J]. 猪业科学, 2009, 26(12): 24-28. DOI:10.3969/j.issn.1673-5358.2009.12.005 |
| [10] |
Fang XW, Li YL, Huang CB, et al. Live vaccine against swine paratyphoid from the attenuated smooth strain C500 of Salmonella cholerae-suis[J]. Acta Veterinaria et Zootechnica Sinica, 1981, 12(2): 99-106. (in Chinese) 房晓文, 李扬陇, 黄昌炳, 等. 仔猪副伤寒弱毒菌苗的研究[J]. 畜牧兽医学报, 1981, 12(2): 99-106. |
| [11] |
Huang CB, Feng WD, Xue MQ, et al. Oral administration of the live vaccine against swine paratyphoid[J]. Scinentia Agricultura Sinica, 1981, 14(6): 89-94. (in Chinese) 黄昌炳, 冯文达, 薛民权, 等. 仔猪副伤寒弱毒通气培养冻干苗口服免疫研究[J]. 中国农业科学, 1981, 14(6): 89-94. |
| [12] |
The Ministry of Agriculture of the People's Republic of China. Veterinary Biological Product Rule 2000, People's Republic of China[S]. Beijing:Chemical Industry Press, 2000(in Chinese) 中华人民共和国农业部. 中华人民共和国兽用生物制品规程2000版[S]. 北京: 化学工业出版社, 2000 |
| [13] |
Su DP, Zhang YP, He DS. Research progress of swine Salmonella vaccine[J]. Swine Industry Science, 2009, 26(12): 42-44. (in Chinese) 苏丹萍, 张艳萍, 贺东生. 猪沙门氏菌病疫苗研究进展[J]. 猪业科学, 2009, 26(12): 42-44. DOI:10.3969/j.issn.1673-5358.2009.12.010 |
| [14] |
Zhu LQ, Wang D, Sun Y, et al. Method for producing paratyphus living vaccine for piglets:China, CN101912608B[P]. 2012-08-22(in Chinese) 朱良全, 王栋, 孙晔, 等. 一种仔猪副伤寒活疫苗的生产方法: 中国, CN101912608B[P]. 2012-08-22 |
| [15] |
Zhu LQ, Sun Y, Jiang H, et al. Study of the application parameters for thermo-stabilizer in the manufacture of swine paratyphoid live vaccine[J]. Microbiology China, 2017, 44(9): 2128-2136. (in Chinese) 朱良全, 孙晔, 蒋卉, 等. 仔猪副伤寒活疫苗中耐热保护剂应用相关参数的研究[J]. 微生物学通报, 2017, 44(9): 2128-2136. |
| [16] |
Zhu LQ, Sun Y, Wang D, et al. Paratyphus Thermo-stable Vaccine for Piglets, Live (CVCC79500 Strain). People's Republic of China new veterinary drug registration certificate (Three), No:(2015) a new veterinary drug certificate No. 07[S]. 2015-01-21(in Chinese) 朱良全, 孙晔, 王栋, 等. 仔猪副伤寒耐热保护剂活疫苗(CVCC79500株). 中华人民共和国新兽药注册证书(三类), 证号: (2015) 新兽药证字07号[S]. 2015-01-21 |
| [17] |
China Veterinary Pharmacopoeia Committee. People's Republic of China Veterinary Pharmacopoeia (2015Edition) Three[S]. Beijing:China Agriculture Press, 2016(in Chinese) 中国兽药典委员会. 《中华人民共和国兽药典》 2015版(三部)[S]. 北京: 中国农业出版社, 2016 |
| [18] |
Zhu LQ, Sun Y, Liu YT, et al. Study on the application on the fermentation process for production of paratyphoid live vaccine in synthetic medium[J]. Chinese Journal of Veterinary Drug, 2016, 50(3): 16-20. (in Chinese) 朱良全, 孙晔, 刘延亭, 等. 仔猪副伤寒活疫苗合成培养基发酵工艺应用研究[J]. 中国兽药杂志, 2016, 50(3): 16-20. |
| [19] |
Hua ZZ. Freeze Drying Technology[M]. Beijing: Science Press, 2006. (in Chinese) 华泽钊. 冷冻干燥新技术[M]. 北京: 科学出版社, 2006. |
| [20] |
Zhao HG, Lin XC. Freeze Drying Technology[M]. Wuhan: Huazhong University of Science and Technology Press, 1990, 174-175. (in Chinese) 赵鹤皋, 林秀诚. 冷冻干燥技术[M]. 武汉: 华中理工大学出版社, 1990, 174-175. |
| [21] |
Wang D, Wang LY, Xu ZQ. The freeze drying protective agent for live vaccine of livestock and poultry[J]. Agricultural Market Weekly, 2004(23): 9-10. (in Chinese) 王栋, 王利永, 徐中清. 畜禽活疫苗耐热冻干保护剂[J]. 农产品市场周刊, 2004(23): 9-10. |
| [22] |
Zhao Y, Yu ZJ. A brief talk on the types and mechanism of heat protection agent for animal vaccine[J]. China Swine Industry, 2016(2): 38-42. (in Chinese) 赵燕, 喻正军. 浅谈动物疫苗耐热保护剂的种类及作用机理[J]. 中国猪业, 2016(2): 38-42. |
| [23] |
Tan CJ, Meng YH. Research progress of heat resistant freeze drying protective agent for veterinary vaccine[J]. The Chinese Livestock and Poultry Breeding, 2011, 7(6): 16-18. (in Chinese) 谭长江, 孟宇航. 兽用疫苗耐热冻干保护剂的研究进展[J]. 中国畜禽种业, 2011, 7(6): 16-18. |
| [24] |
Anchordoquy TJ, Carpenter JF. Polymers protect lactate dehydrogenase during freeze-drying by inhibiting dissociation in the frozen state[J]. Archives of Biochemistry and Biophysics, 1996, 332(2): 231-238. DOI:10.1006/abbi.1996.0337 |
| [25] |
Jennings TA. Lyophilization:Introduction and Basic Principles[M]. Denver, Colorado: Interpharm Press, 1999.
|
| [26] |
Li GW, Zheng CY, Tang B. Cryobiology[M]. Changsha: Hunan Science and Technology Press, 1998. (in Chinese) 李广武, 郑从义, 唐兵. 低温生物学[M]. 长沙: 湖南科学技术出版社, 1998. |
 2017, Vol. 44
2017, Vol. 44




