扩展功能
文章信息
- 朱良全, 孙晔, 蒋卉, 彭小薇, 范学政, 许冠龙, 丁家波
- ZHU Liang-Quan, SUN Ye, JIANG Hui, PENG Xiao-Wei, FAN Xue-Zheng, Xu Guan-Long, DING Jia-Bo
- 仔猪副伤寒活疫苗中耐热保护剂应用相关参数的研究
- Study of the application parameters for thermo-stabilizer in the manufacture of swine paratyphoid live vaccine
- 微生物学通报, 2017, 44(9): 2128-2136
- Microbiology China, 2017, 44(9): 2128-2136
- DOI: 10.13344/j.microbiol.china.170067
-
文章历史
- 收稿日期: 2017-01-24
- 接受日期: 2017-03-14
- 优先数字出版日期(www.cnki.net): 2017-03-16
2. 北京中海生物科技有限公司 北京 100081
2. Beijing Zhonghai Biotec Co. Ltd., Beijing 100081, China
沙门氏菌是引起公共卫生安全的常见人畜共患病原菌,其中猪霍乱沙门氏菌是引起1−4月龄仔猪副伤寒的主要致病菌[1-3]。长期以来,我国一直采用冻干的仔猪副伤寒活疫苗(C500株)预防和控制该病[4]。此疫苗在我国已应用40余年,毒力稳定、安全,对仔猪有坚强免疫力,市场免疫效果确实,在防控中起到了重要作用[5-7]。
但该疫苗生产应用中呈现的突出问题为冻干存活率低,在较高温度下(如37保护功能较差[7]。目前国内14个生产仔猪副伤寒活疫苗的兽用生物制品企业,冻干存活率一般为50%−60%。存活率低使疫苗中含有大量死亡菌体,死亡菌体崩解产生的内毒素,是产生过敏反应的因素之一。据报道,每年0.07%−0.10%的猪接种后出现呕吐、痉挛、全身发疳、死亡等症状[4]。另外,该疫苗常需要−15以下保存,给边远地区储存运输和使用带来困难。
究其原因主要在于疫苗生产一直沿用20世纪60−70年代落后的冻干工艺,疫苗采用1.5%明胶、5%蔗糖作为冻干保护剂。该保护剂是所有动物细菌活疫苗通用的保护剂配方,其组方简单,与菌体相容性不匹配。耐热保护剂按照保护剂与菌体相容性特性设计,具有改善冻干抗原的品质以及产品保存温度特点,为国内外研究的热点和难点[8-12]。
不过由于其具有较高的科技含量,因此其配方一般为专利产品或商业秘密,几乎无报道。课题组在试验前期研究中已成功研制出与猪霍乱沙门氏菌菌体相容性较好的耐热保护剂[13],运用其冻干的疫苗在37保存7 d的耐老化试验中表现出良好的性能,其37保存7 d后细菌活菌存活率达70%以上。耐热保护剂含有的大分子物质形成耐热性构架,可阻断构架外热源对构架内细菌的热传导性和热辐射性杀伤,增强对细菌的保护作用;含有的小分子物质使悬浮于保护剂中的细菌在冷冻干燥过程中尽量保持存活状态,使干燥样品中的最终水分含量不致过低,防止蛋白质变性,减少细菌失活[14]。
研制成功耐热保护剂破解了冻干活疫苗技术核心壁垒,而进行耐热保护剂配套应用参数研究是实现耐热保护剂活疫苗广泛应用的重要途径。据报道,影响耐热保护剂作用效果的因素众多[15-23],如冻干曲线、活菌浓度、菌体菌龄、感作时间等。本文以仔猪副伤寒活疫苗为模型,系统研究影响耐热保护剂作用效果的因子,从而明确耐热保护剂在仔猪副伤寒活疫苗使用中相关参数,以期为耐热保护剂的科学应用和制备细菌类耐热保护剂冻干活疫苗提供参考。
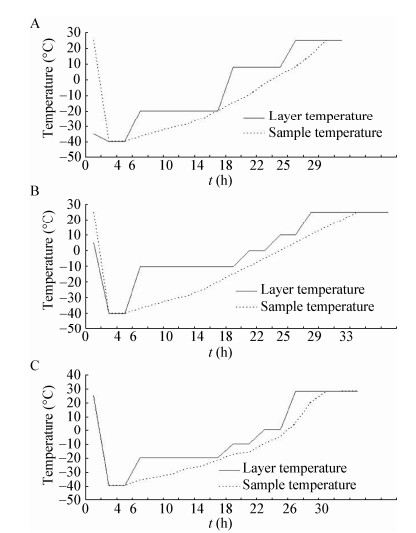
1 材料与方法 1.1 材料 1.1.1 生产用菌种: 猪霍乱沙门氏菌(CVCC79500株,原称C500株) (编号SC200608,2006.11.6冻干,2 mL/瓶),由北京中海生物科技有限公司制备。 1.1.2 培养基: 仔猪副伤寒活疫苗合成培养基[5, 13](主要成分为胰酪蛋白胨、酵母粉等,批号为201001) 及仔猪副伤寒活疫苗耐热保护剂[13](主要成分为PVP、水溶性明胶、山梨醇、199培养基、L-谷氨酸钠等,批号为201011),均由北京中海生物科技有限公司配制及提供。普通肉汤、普通琼脂培养基、蛋白胨水、生理盐水由中国兽医药品监察所培养基室按照《中华人民共和国兽用生物制品规程(2000版)》(以下简称《规程》[7])配制及提供。 1.1.3 主要仪器: 高速离心机CR22G CAT,No. S101636,日立公司(HITACHI);冻干机Lyoflex 2.0,爱德华公司(Edwards);30 L发酵罐,BIOF-2000型,上海高机生物工程有限公司;ZKJL-1高频电火花真空检测器,上海家君真空仪表制造有限公司。 1.2 方法 1.2.1 种子繁殖、发酵培养及制苗用菌液制备: 种子液按《规程》[7]进行繁殖和制备。将种子液按培养基总量的2%接种于合成培养基(30 L发酵罐盛装培养基20 000 mL)中,按文献报道的发酵工艺及参数培养12−21 h[5],培养过程中根据pH值变化用灭菌的50%葡萄糖溶液控制pH值7.5−7.6。培养结束后,以3 500 r/min离心20 min,弃去上清,用生理盐水悬浮至适当浓度,即为制苗用菌液。 1.2.2 耐热保护剂配套冻干曲线的筛选: 分别取1.2.1项制备的制苗用菌液50 mL与耐热保护剂等量混合后,定量分装(2 mL/瓶),按兽用生物制品常用的3种冻干工艺,分别设计成3种冻干曲线(冻干曲线1、冻干曲线2及冻干曲线3,分别为图 1A、图 1B及图 1C)进行冻干。然后分别取冻干前、后以及冻干后置37保存7 d的疫苗样品各3瓶按《规程》[7]进行活菌计数。按《规程》[7]要求抽样比较冻干后样品性状、水分含量、真空度。通过下列公式计算冻干菌存活率(冻干前后活菌存活率,见公式1) 以及耐老化试验活菌存活率(37保存7 d样品前后活菌存活率,见公式2),并根据结果确定冻干曲线。试验共进行2次。
|
| 图 1 冻干曲线 Figure 1 Freeze-drying curve 注:A:冻干曲线1;B:冻干曲线2;C:冻干曲线3. Note: A: Freeze-drying curve 1; B: Freeze-drying curve 2; C: Freeze-drying curve 3. |
|
|
公式1:

|
公式2:

|
冻干曲线1:箱体−35 ℃时产品进箱,−40 ℃维持4 h,升华阶段,将产品由−35 ℃升至−20 ℃维持10 h,启动真空泵,当箱体内真空达到最大时,给板层加热,将板层温度控制在8 ℃,维持8 h,一次干燥完毕。将板层温度提高到25 ℃维持6 h,产品出箱,全程耗时约28 h。冻干曲线如图 1A所示。
冻干曲线2:箱体0−4 ℃时产品进箱,开启制冷系统,以每分钟1 ℃的速度降至−40 ℃,维持4 h。启动真空泵,当箱体内真空达到最大时,给板层加热,将板层温度控制在−10 ℃,维持12−14 h,一次干燥完毕。进行二次干燥,每间隔2 h升温10 ℃,在25 ℃维持8 h左右出箱。疫苗冻干全程耗时28−32 h,冻干曲线如图 1B所示。
冻干曲线3:产品室温进箱,开启制冷系统,以每min 1 ℃的速度降至−40 ℃,维持约4 h。升华干燥阶段,启动真空泵,将产品从−40 ℃升温至−20 ℃,维持10 h,一次干燥完毕。在每间隔2 h升温10 ℃,在28 ℃维持8 h左右出箱,疫苗冻干全程耗时28−32 h。冻干曲线如图 1C所示。
1.2.3 耐热保护剂对应的最适冻干菌龄筛选: 分别取37 ℃发酵培养12 h (对数生长前期)、15 h (对数生长中期)、18 h (对数生长末期或稳定前期)、21 h (稳定后期)的制苗用菌液各1 000 mL,与预热至37 ℃的1 000 mL耐热保护剂等量混匀后,定量分装至7 mL西林瓶中(2 mL/瓶),按1.2.2筛选出的冻干曲线进行冻干。分别取冻干前、后以及冻干后置37 ℃保存7 d疫苗样品各3瓶按《规程》[7]进行活菌计数。试验共进行2次。 1.2.4 耐热保护剂适宜的配苗浓度筛选: 按1.2.3结果中确定的参数获得的制苗用液2 000 mL,分成5组(每组400 mL),经3 500 r/min离心20 min后,菌泥分别用生理盐水悬浮成5组不同浓度制苗用菌液,然后与预热至37 ℃的耐热保护剂等量混匀成5组不同终浓度:第1组菌液浓度约9×1010 CFU/mL;第2组菌液浓度约7×1010 CFU/mL;第3组菌液浓度约5×1010 CFU/mL;第4组菌液浓度约3×1010 CFU/mL;第5组菌液浓度约1×1010 CFU/mL。然后定量分装(2 mL/瓶),每组70瓶,按1.2.2筛选出的冻干曲线进行冻干。分别取冻干前、后以及冻干后置37 ℃保存7 d疫苗样品各3瓶按《规程》[7]进行活菌计数。试验共进行2次。 1.2.5 耐热保护剂与菌体合适的感作时间筛选: 按1.2.3结果中确定的参数获得的制苗用液1 500 mL,分成3组(每组500 mL),经3 500 r/min离心20 min后,菌泥分别用适量生理盐水悬浮,然后将耐热保护剂与制苗用菌液等量混悬成1.2.4中确定的浓度,分别置2−8 ℃感作0、24、48 h,然后定量分装(2 mL/瓶),每组70瓶,按1.2.2筛选出的冻干曲线进行冻干。分别取冻干前、后以及冻干后置37 ℃保存7 d疫苗样品各3瓶按《规程》[7]进行活菌计数。试验共进行2次。 1.2.6 耐热保护剂保存期试验: 耐热保护剂保存温度及时间:将3批耐热保护剂(批号分别为1011、1012、1013),每批3 000 mL,置2−8 ℃保存40 d,并在0、10、20、30及40 d各时间阶段分别取样500 mL。配苗、冻干及活菌计数:按1.2.3、1.2.4项结果,将上述不同保存时间的耐热保护剂与等份的制苗用菌液等量混悬成的1.2.5项优化浓度,充分混匀后定量分装(2 mL/瓶),按1.2.2筛选出的冻干曲线进行冻干。分别取冻干前、后以及冻干后置37 ℃保存7 d疫苗样品各3瓶按《规程》[7]进行活菌计数。
1.2.7 耐热保护剂活疫苗的最佳分装量筛选: 按1.2.3、1.2.4及1.2.5项优化结果,将耐热保护剂与制苗用菌液等量混匀,分别在7 mL西林瓶中以2、3、4 mL分装,各分装70瓶,按1.2.2筛选出的冻干曲线进行冻干。分别取冻干前、后以及冻干后置37 ℃保存7 d疫苗样品各3瓶按《规程》[7]进行活菌计数。试验共进行2次。 2 结果与分析 2.1 配套冻干曲线筛选结果表 1结果显示,采用冻干曲线1冻干的仔猪副伤寒耐热保护剂活疫苗表面有结晶、底部萎缩;采用冻干曲线3冻干的仔猪副伤寒耐热保护剂活疫苗有少量结晶、表面下凹;采用冻干曲线2冻干猪霍乱沙门氏菌(CVCC79500株)效果最好,冻干后不结晶,冻干菌存活率达82%;耐老化活菌存活率为91%,均高于其它两种曲线。
| 冻干曲线 Freeze-drying curve |
冻干产品 Freeze-drying product |
冻干前活菌数 Number of viable bacteria before lyophilization (×108 CFU/mL) |
冻干后 After lyophilization |
37 ℃ 7 d | |||||
| 性状 Properties |
剩余水分 Residual moisture (%) |
真空度 Vacuity |
冻干后活菌数 Number of viable bacteria after lyophilization (×108 CFU/mL) |
活菌存活率 Survival ratio of live bacteria (%) |
活菌数 Number of viable bacteria (×108 CFU/mL) |
活菌存活率 Survival ratio of live bacteria (%) |
|||
| 1 | 结晶、底部萎缩 surface crystallization and bottom shrinkage |
2.53、2.64、 3.68、3.76 |
10/10紫色 辉光 Purple glow |
467 | 364 | 78 | 283 | 78 | |
| 2 | 未见结晶,表面平坦 No crystallization, surface flatness |
1.74、1.64、 1.73、1.81 |
10/10紫色 辉光 Purple glow |
466 | 382 | 82 | 347 | 91 | |
| 3 | 有少量结晶,表面下凹 A small amount of crystallization and the lower concave on the surface |
2.12、1.96、 1.81、2.32 |
10/10紫色 辉光 Purple glow |
456 | 332 | 73 | 295 | 89 | |
| 注:分母代表检样瓶数;分子代表合格瓶数. Note: the denominator represents the numbers of test bottles; The numerator represents the qualified bottles. |
|||||||||
表 2结果显示,不同收获时间菌体其冻干前后的冻干菌存活率差异大,发酵培养15−18 h,其冻干菌存活率较高,尤以18 h最好,而发酵培养12 h和21 h冻干菌存活率较低。对于37 ℃保存7 d耐老化试验结果可以看出,不同收获时间的活菌存活率差异较小,综合冻干菌存活率及耐老化试验活菌存活率的活菌数结果,选择18 h最适。
| 试验次数 Number of test |
收获时间 Harvest time (h) |
冻干前后 Before or after lyophilization |
37 ℃ 7 d | ||||
| 冻干前活菌数 Number of viable bacteria before lyophilization (×108 CFU/mL) |
冻干后活菌数 Number of viable bacteria after lyophilization (×108 CFU/mL) |
冻干菌存率 Survival ratio of live bacteria (%) |
活菌数 Number of viable bacteria (×108 CFU/mL) |
活菌存活率 Survival ratio of live bacteria (%) |
|||
| 1 | 12 | 439 | 224 | 51 | 188 | 84 | |
| 15 | 462 | 256 | 55 | 223 | 87 | ||
| 18 | 539 | 420 | 78 | 357 | 85 | ||
| 21 | 443 | 259 | 58 | 233 | 90 | ||
| 2 | 12 | 455 | 204 | 45 | 165 | 81 | |
| 15 | 450 | 318 | 71 | 286 | 90 | ||
| 18 | 456 | 369 | 81 | 354 | 96 | ||
| 21 | 485 | 271 | 56 | 265 | 98 | ||
表 3结果显示,菌液浓度低,冻干菌存活率高,而37 ℃保存7 d耐老化试验结果基本一致。因《规程》[1]要求每头份不少于30×108 CFU/mL,考虑到每瓶疫苗的头份数,因而适宜菌液浓度为3×1010−5×1010 CFU/mL。
| 试验次数 Number of test |
冻干前后 Before or after lyophilization |
37 ℃ 7 d | ||||
| 冻干前活菌数 Number of viable bacteria before lyophilization (×108 CFU/mL) |
冻干后活菌数 Number of viable bacteria after lyophilization (×108 CFU/mL) |
冻干菌存率 Survival ratio of live bacteria (%) |
活菌数 Number of viable bacteria (×108 CFU/mL) |
活菌存活率 Survival ratio of live bacteria (%) |
||
| 1 | 902.5 | 395.3 | 43.8 | 287.7 | 72.8 | |
| 703.1 | 416.9 | 59.3 | 323.9 | 77.7 | ||
| 500.7 | 372.0 | 74.3 | 292.7 | 78.7 | ||
| 300.8 | 238.5 | 79.3 | 185.3 | 77.7 | ||
| 100.3 | 91.3 | 91.0 | 66.7 | 73.1 | ||
| 2 | 891.4 | 434.1 | 48.7 | 345.5 | 79.6 | |
| 685.2 | 402.2 | 58.7 | 314.5 | 78.2 | ||
| 495.2 | 347.1 | 70.1 | 254.8 | 73.4 | ||
| 297.1 | 213.0 | 71.7 | 160.6 | 75.4 | ||
| 198.1 | 151.9 | 76.7 | 121.8 | 80.2 | ||
| 99.0 | 81.9 | 82.8 | 63.8 | 77.9 | ||
表 4结果显示,保护剂与菌体在2−8 ℃感作24 h,冻干菌存活率高于其它时间;而37 ℃保存7 d耐老化试验结果基本一致。
| 试验次数 Number of test |
2−8 ℃感作时间 The interaction time of 2−8 ℃ (h) |
冻干前后 Before or after lyophilization |
37 ℃ 7 d | ||||
| 冻干前活菌数 Number of viable bacteria before lyophilization (×108 CFU/mL) |
冻干后活菌数 Number of viable bacteria after lyophilization (×108 CFU/mL) |
冻干菌存率 Survival ratio of live bacteria (%) |
活菌数 Number of viable bacteria (×108 CFU/mL) |
活菌存活率 Survival ratio of live bacteria (%) |
|||
| 1 | 0 | 462 | 353.0 | 76.4 | 264.7 | 75 | |
| 24 | 456 | 388.9 | 85.3 | 315.0 | 81 | ||
| 48 | 415 | 274.3 | 66.1 | 230.4 | 84 | ||
| 2 | 0 | 457 | 313.0 | 68.5 | 256.6 | 82 | |
| 24 | 444 | 401.8 | 90.5 | 337.5 | 84 | ||
| 48 | 472 | 281.7 | 59.7 | 236.6 | 84 | ||
表 5结果显示,3批耐热保护剂置2−8 ℃保存40 d冻干菌存活率为83.7%−87.5%,置37 ℃保存7 d活菌存活率为82.9%−87.4%,与配制当日的结果基本一致(冻干菌存活率为82.9%−87.0%;活菌存活率为83.7%−85.0%)。
| 批号 Batch |
2−8 ℃保存时间 Storage time (d) |
冻干前后 Before or after lyophilization |
37 ℃ 7 d | ||||
| 冻干前活菌数 Number of viable bacteria before lyophilization (×108 CFU/mL) |
冻干后活菌数 Number of viable bacteria after lyophilization (×108 CFU/mL) |
冻干菌存率 Survival ratio of live bacteria (%) |
活菌数 Number of viable bacteria (×108 CFU/mL) |
活菌存活率 Survival ratio of live bacteria (%) |
|||
| 1011 | 0 | 52 | 45.2 | 87.0 | 38.4 | 85.0 | |
| 10 | 44.9 | 86.3 | 37.2 | 82.8 | |||
| 20 | 45.1 | 86.7 | 38.1 | 84.4 | |||
| 30 | 45.2 | 87.0 | 38.4 | 85.0 | |||
| 40 | 45.5 | 87.5 | 38.6 | 84.8 | |||
| 1012 | 0 | 62 | 51.4 | 82.9 | 43.0 | 83.7 | |
| 10 | 52.2 | 84.2 | 43.6 | 83.5 | |||
| 20 | 51.7 | 83.4 | 44.3 | 85.8 | |||
| 30 | 52.2 | 84.2 | 43.6 | 83.5 | |||
| 40 | 53.1 | 85.6 | 44.0 | 82.9 | |||
| 1013 | 0 | 56 | 47.6 | 85.0 | 40.0 | 84.1 | |
| 10 | 45.6 | 81.4 | 38.3 | 84.1 | |||
| 20 | 48.8 | 87.2 | 40.4 | 82.9 | |||
| 30 | 47.6 | 85.0 | 40.0 | 84.1 | |||
| 40 | 46.8 | 83.7 | 40.9 | 87.4 | |||
表 6结果显示,7 mL西林瓶疫苗装量3 mL或4 mL,其冻干菌存活率与2 mL基本一致,置37 ℃保存7 d的活菌存活率相对高出3−7个百分点。
| 试验次数 Number of test |
7 mL西林瓶苗液装量 Packing volume in vials of 7 mL (mL) |
冻干前后 Before or after lyophilization |
37 ℃ 7 d | ||||
| 冻干前活菌数 Number of viable bacteria before lyophilization (×108 CFU/mL) |
冻干后活菌数 Number of viable bacteria after lyophilization (×108 CFU/mL) |
冻干菌存率 Survival ratio of live bacteria (%) |
活菌数 Number of viable bacteria (×108 CFU/mL) |
活菌存活率 Survival ratio of live bacteria (%) |
|||
| 1 | 2 | 456 | 325.1 | 71.3 | 289.3 | 89 | |
| 3 | 334.2 | 73.3 | 307.4 | 92 | |||
| 4 | 327.0 | 71.7 | 310.6 | 95 | |||
| 2 | 2 | 472 | 394.1 | 83.5 | 303.4 | 77 | |
| 3 | 411.5 | 87.2 | 341.5 | 83 | |||
| 4 | 393.6 | 83.4 | 330.6 | 84 | |||
保护剂、配套冻干曲线及应用参数研究是决定细菌活疫苗质量的关键技术。本研究中采用的耐热保护剂、冻干曲线2及相关应用参数,可使冻干菌存活率稳定达到70%以上,其37 ℃保存7 d的活菌存活率也可稳定达到70%以上,显著优于传统苗的水平[24-26]。现有的中国兽药典[27]及《规程》[7]规定一旦仔猪副伤寒活疫苗冻干菌存活率低于50%,疫苗只能用于口服,不能用于注射。若因疫苗存活率低采用口服,加上现代规模化养殖场均采用经消毒剂处理的自来水,严重影响免疫效果。
耐热冻干工艺产品可克服传统保护剂(如1%−2%明胶5%蔗糖,5%脱脂牛奶10%蔗糖等)冻干产品在储运和应用等环节引发的疫苗失活和免疫失败[10, 12]。除了耐热保护剂自身因素,如耐热保护剂中大分子物质主要形成耐热框架和间接隔热层;小分子物质主要与菌体形成悬液,起直接作用[8-9]。其在冻干工艺中发挥应有效能,与细菌的状态、保护剂与细菌在冷冻应激状态下的协调配合紧密相关[15-23]。
细菌生长分为4个期,迟缓期、对数生长期、稳定期和衰亡期[1]。菌龄是影响冻干菌存活率的重要因素,应选择对数生长期末期和稳定期前期收获的细菌进行冻干,这对细菌抗冷冻效应以及提高冻干后的存活率是有益的[17]。根据已有的仔猪副伤寒活疫苗发酵工艺参数研究确定[5],通过不同收获时间菌体比较试验,发现在对数生长末期或稳定前期(发酵培养18 h),菌体冻干菌存活率达78%–81%。而到21 h,进入稳定期后期菌体老化,其冻干菌存活率明显下降。
配苗比例也是影响耐热保护剂作用的重要因素[18-20],菌液浓度高,保护剂分子有效保护菌体的资源就会相对不足,冻干菌存活率低。菌液浓度低,则保护剂有效利用资源不足,导致成本升高。考虑疫苗头份数,疫苗每头份不低于3×109 CFU,每瓶疫苗通常一般不少于20头份[7],确定适宜配苗浓度为3×1010−5×1010 CFU/mL。
经过冷(热)应激处理,微生物自身要发生一系列物理和化学变化,包括一系列蛋白的合成,称为冷(热)应激(休克)蛋白。冷(热)应激蛋白的存在使菌体的适温能力增强,这种过程可看成是微生物在温度变化时的一种自我保护机制[17]。适当延长耐热保护剂与菌体混合作用时间,有利于保护剂中小分子充分渗入菌体内,提高菌体的抗冻能力。但如果细菌暴露在空气中的时间过长,某些菌体会产生过氧化氢蓄积,造成死亡。因此应根据各种菌的特性并通过实验来寻找最适平衡时间[22, 26]。耐热保护剂与菌体感作时间结果表明,当菌体与耐热保护剂2−8 ℃作用24 h,其冻干菌存活率最高,为85.3%−90.1%,其耐老化试验结果基本一致。
耐热保护剂中含有蛋白等生物大分子物质,存在衰变期,进行耐热保护剂的保存期研究是确保保护剂品质和性能的保证[14]。置2−8 ℃保存40 d与配制当日的冻干菌存活率、活菌存活率结果基本一致。为确保效果,将耐热保护剂2−8 ℃有效期定为30 d。
充分利用西林瓶的空间,提高疫苗分装量,是降低成本、提高疫苗头份数的重要手段,研究结果发现,在7 mL西林瓶中分装量达3 mL或4 mL,其冻干菌存活率与2 mL分装量基本一致,而其耐老化结果中活菌存活率相对升高3−7个百分点,主要由于瓶中菌液的分装高度增加,冻干中延长了冷冻时间、升华时间以及解析干燥时间[15-16]。
| [1] |
Lu CP. Veterinary Microbiology[M]. 4th Edition. Beijing: China Agriculture Press, 2007, 107-113. (in Chinese) 陆承平. 兽医微生物学[M]. 第4版. 北京: 中国农业出版社, 2007, 107-113. |
| [2] |
Yang ZS, Fang H. Human and Animal Pathogenic Bacteria[M]. Shijiazhuang: Hebei Science & Technology Press, 2003, 497-544. (in Chinese) 杨正时, 房海. 人及动物病原细菌学[M]. 石家庄: 河北科学技术出版社, 2003, 497-544. |
| [3] |
Liu QF, Cui SJ. Swine Salmonella disease etiology, epidemiology, diagnosis and treatment progress[J]. Swine Industry Science, 2009(12): 24-28. (in Chinese) 刘芹防, 崔尚金. 猪沙门氏菌病病原学、流行病学、诊断及防治进展[J]. 猪业科学, 2009(12): 24-28. DOI:10.3969/j.issn.1673-5358.2009.12.005 |
| [4] |
Su DP, Zhang YP, He DS. Research progress of swine Salmonella vaccine[J]. Swine Industry Science, 2009, 26(12): 42-44. (in Chinese) 苏丹萍, 张艳萍, 贺东生. 猪沙门氏菌病疫苗研究进展[J]. 猪业科学, 2009, 26(12): 42-44. DOI:10.3969/j.issn.1673-5358.2009.12.010 |
| [5] |
Zhu LQ, Sun Y, Liu YT, et al. Study on the application on the fermentation process for production of paratyphoid live vaccine in synthetic medium[J]. Chinese Journal of Veterinary Drug, 2016, 50(3): 16-20. (in Chinese) 朱良全, 孙晔, 刘延亭, 等. 仔猪副伤寒活疫苗合成培养基发酵工艺应用研究[J]. 中国兽药杂志, 2016, 50(3): 16-20. |
| [6] |
Zhu LQ, Sun Y, Li CY, et al. Establishment of the growth curve of paratyphoid live vaccine strain for production and its application in synthetic medium[J]. Chinese Journal of Veterinary Drug, 2016, 50(2): 51-56. (in Chinese) 朱良全, 孙晔, 李聪研, 等. 仔猪副伤寒活疫苗生产用菌株生长曲线的建立及合成培养基初步应用[J]. 中国兽药杂志, 2016, 50(2): 51-56. |
| [7] |
Committe for Veterinary Biological Product Rule, Ministry of Agriculture, China. Veterinary Biological Product Rule 2000, People's Republic of China[S]. Beijing:Chemical Industry Press, 2010(in Chinese) 中华人民共和国农业部. 《中华人民共和国兽用生物制品规程》 2000版[S]. 北京: 化学工业出版社. |
| [8] |
Zhao Y, Yu ZJ. A brief talk on the types and mechanism of heat protection agent for animal vaccine[J]. Prevention and Control of Swine Diseases, 2016(2): 38-42. (in Chinese) 赵燕, 喻正军. 浅谈动物疫苗耐热保护剂的种类及作用机理[J]. 猪病防控, 2016(2): 38-42. |
| [9] |
Tan CJ, Meng YH. Research progress of heat resistant freeze drying protective agent for veterinary vaccine[J]. The Chinese Livestock Breeding, 2011(6): 16-18. (in Chinese) 谭长江, 孟宇航. 兽用疫苗耐热冻干保护剂的研究进展[J]. 中国畜禽种业, 2011(6): 16-18. |
| [10] |
Liu QY, Zhang C, Ren XY, et al. Advance of hyophilized heat resisting activity vaccines for animals[J]. China Animal Husbandry and Veterinary, 2007, 34(4): 91-93. (in Chinese) 刘秋燕, 张昶, 任向阳, 等. 兽用常温耐热型弱毒活疫苗的研究进展[J]. 中国畜牧兽医, 2007, 34(4): 91-93. |
| [11] |
Luo ZF, Fang YK. A preliminary study on heat preservation and freeze drying protective agent in veterinary frozen working vaccine[J]. Guangdong Animal Husbandry and Veterinary Science and Technology, 2002, 27(3): 37-38. (in Chinese) 罗镇藩, 房宜康. 耐热冻干保护剂在兽用冻干活疫苗中的初步研究[J]. 广东畜牧兽医科技, 2002, 27(3): 37-38. |
| [12] |
Yang ZL, Wu X, Rao DA, et al. Heat resistant freeze drying protective agent and its application in veterinary frozen working vaccine[J]. Sichuan Animal & Veterinary Sciences, 2003, 30(12): 33-34. (in Chinese) 杨泽林, 吴宣, 饶德安, 等. 耐热冻干保护剂及其在兽用冻干活疫苗中的应用[J]. 四川畜牧兽医, 2003, 30(12): 33-34. DOI:10.3969/j.issn.1001-8964.2003.12.021 |
| [13] |
Zhu LQ, Wang D, Sun Y, et al. LA kind of production method of piglet paratyphoid vaccine:China, 201010254597.4[P]. 2010-12-15(in Chinese) 朱良全, 王栋, 孙晔, 等. 一种仔猪副伤寒活疫苗的生产方法: 中国, 201010254597. 4[P]. 2010-12-15 |
| [14] |
Sun DP, Hu YQ. Stabilizing excipients in the freeze-dried protein formulations and their protective mechanisms[J]. Progress in Pharmaceutical Sciences, 2003, 27(4): 201-205. (in Chinese) 孙东坡, 胡一桥. 蛋白质冷冻干燥制品中的保护剂及其保护机制[J]. 药学进展, 2003, 27(4): 201-205. |
| [15] |
Hua ZZ. Freeze Drying Technology[M]. Beijing: Science Press, 2006. (in Chinese) 华泽钊. 冷冻干燥新技术[M]. 北京: 科学出版社, 2006. |
| [16] |
Zhao HG, Lin XC. Freeze Drying Technology[M]. Wuhan: Huazhong University of Science and Technology Press, 1990, 174-175. (in Chinese) 赵鹤皋, 林秀诚. 冷冻干燥技术[M]. 武汉: 华中理工大学出版社, 1990, 174-175. |
| [17] |
Zhang YH, Huo GC, Guo L. Research advance of the freeze-drying techctic acid bacterial[J]. Journal of Northeast Agricultural University, 2005, 36(6): 799-803. (in Chinese) 张英华, 霍贵成, 郭鸰. 乳酸菌冷冻干燥技术研究进展[J]. 东北农业大学学报, 2005, 36(6): 799-803. |
| [18] |
Palmfeldt J. Optimisation of initial cell concentration enances freeze-drying tolerance of Pseudomonas chlororaphis[J]. Cryobiology, 2003, 47(1): 21-29. DOI:10.1016/S0011-2240(03)00065-8 |
| [19] |
Liu ZM, Luo CX. Studies on characteristics of freeze-dried of actic acid bacterial[J]. China Dairy Industry, 2002, 30(5): 30-33. (in Chinese) 刘振民, 骆承庠. 乳酸菌冻干特性的研究[J]. 中国乳品工业, 2002, 30(5): 30-33. |
| [20] |
Wright CT, Klaenhammer TR. Calcium-induced alteration of cellular morphology affecting the resistance of Lactobacillus acidophilus to freezing[J]. Applied and Environmental Microbiology, 1981, 41(3): 807-815. |
| [21] |
Lin Y. Study on protective agent for Bifidobacterium bifidum during freeze drying[J]. Scientific experiment and research, 2002(6): 4-7. (in Chinese) 林云. 双歧杆菌冻干保护剂条件的研究[J]. 科学试验与研究, 2002(6): 4-7. |
| [22] |
Kim WS, Khunajkr N, Dunn NW. Effect of cold shock on protein synthesis and on cryotllerance of cells frozen for long periods in Laclococcus lactis[J]. Cryobiology, 1998, 37(1): 86-91. DOI:10.1006/cryo.1998.2104 |
| [23] |
Broadbent JR, Lin C. Effect of heat shock or cold shock treatment on the resistance of Lactococcus lactis to freezing and lyophilization[J]. Cryobiology, 1999, 39(1): 88-102. DOI:10.1006/cryo.1999.2190 |
| [24] |
Cui SB, Wang HD, Yu LM, et al. Effect of peptone on the numbers of bacteria in culture fluid and living bacteria rate after lyophilizing of living paratyphoid vaccine for piglet[J]. Chinese Journal of Veterinary Drug, 2003, 37(2): 44-45. (in Chinese) 崔水保, 王红东, 于亮明, 等. 蛋白胨对仔猪副伤寒疫苗培养菌数和冻干后活菌率的影响[J]. 中国兽药杂志, 2003, 37(2): 44-45. |
| [25] |
Ma ZY, Zhang DP, Liu X. Screening the semi-composed culture medium used in producing paratyphus living vaccine for piglets[J]. Chinese Journal of Veterinary Drug, 2005, 39(4): 13-14. (in Chinese) 马振宇, 张大鹏, 刘欣. 仔猪副伤寒活疫苗半合成培养基的配方筛选试验[J]. 中国兽药杂志, 2005, 39(4): 13-14. |
| [26] |
Zheng TX, Zhang Y, Xing YG, et al. Study on key technologies of the production process for piglet paratyphoid live vaccine (C500 Strain)[J]. China Animal Health, 2016, 18(7): 6-8. (in Chinese) 郑铁鑫, 张影, 邢育钢, 等. 仔猪副伤寒活疫苗(C500株)生产工艺关键技术研究[J]. 中国动物保健, 2016, 18(7): 6-8. |
| [27] |
China Veterinary Pharmacopoeia Committee. People's Republic of China Veterinary Pharmacopoeia (2015 Edition) Three[S]. Beijing:China Agriculture Press, 2016:112(in Chinese) 中国兽药典委员会编. 《中华人民共和国兽兽药典》2015版[S]. 北京: 中国农业出版社, 2016: 112 |
 2017, Vol. 44
2017, Vol. 44




