扩展功能
文章信息
- 张燕可, 冯守帅, 杨海麟, 黄兴, 唐嘉鼎, 吴泉钱, 顾利星
- ZHANG Yan-Ke, FENG Shou-Shuai, YANG Hai-Lin, HUANG Xing, TANG Jia-Ding, WU Quan-Qian, GU Li-Xing
- 苯系物降解菌Pseudomonas putida SW-3的筛选及其降解苯的研究
- Isolation and characterization of benzene degradation strain Pseudomonas putida SW-3
- 微生物学通报, 2017, 44(9): 2096-2103
- Microbiology China, 2017, 44(9): 2096-2103
- DOI: 10.13344/j.microbiol.china.160876
-
文章历史
- 收稿日期: 2016-11-30
- 接受日期: 2017-01-19
- 优先数字出版日期(www.cnki.net): 2017-01-20
2. 无锡市城市环境卫生有限公司 江苏 无锡 214122
2. Wuxi City Environmental Sanitation Co. Ltd., Wuxi, Jiangsu 214122, China
苯系物是苯及其衍生物的总称,被广泛用于油漆、纺织、合成橡胶等行业,是人类活动排放的常见污染物,代表性的有苯(benzene)、甲苯(toluene)、苯乙烯(styrene)等。由于苯系物有较强的挥发性,其生产和运输过程易造成大气污染,形成光化学烟雾[1]。许多苯系物对人体有较大毒性,如苯、甲苯、苯乙烯不仅有遗传毒性还能够对中枢神经系统产生麻痹作用,引起急性中毒,其中苯、苯乙烯已经是明确的致癌物[2]。
生物法处理苯系物废气的工艺简单,成本低廉,无二次污染,因此受到广泛关注。段传人等[3]筛选到的真菌Aspergillus versicolor 8 d内对439.3 mg/L苯的降解率达78.56%。Jiang等[4]从工业石油废水中筛选到的细菌Comamonas sp.能够在32 h内将150 mg/L的BTEX (benzene,toluene,ethylbenzene和o-,m-,和p-xylene)完全降解。Reardon等[5]的研究显示,Pseudomonas putida F1能够在15 h内将15 mg/L的苯和甲苯完全降解。已报道文献中,菌种对较高浓度苯系物的降解周期偏长,处理效率偏低,菌株对苯系物的吸附、摄取鲜有研究。因此从典型工业现场筛选高效苯系物降解菌,分析菌株的降解特性具有重要意义。本文以苯系物中具有代表性的苯、甲苯和苯乙烯为唯一碳源,从石化公司废水处理系统中筛选出一株苯系物降解菌,研究其对苯系物的降解特性,探讨底物间相互作用对降解情况的影响,为苯系物的生物处理提供理论依据。
1 材料与方法 1.1 主要试剂和仪器苯、甲苯和苯乙烯,国药集团化学试剂有限公司。GC-2010气相色谱仪,岛津企业管理(中国)有限公司。
1.2 菌株和培养基菌株筛选自中国石油辽阳石化分公司动力厂450#污水处理系统的污水。
无机盐培养基(g/L):K2HPO4 1.550,NaH2PO4 0.825,NH4Cl 1.340,MgSO4·7H2O 0.500,CaCl2 0.075,1 mL微量元素溶液(g/L,FeSO4·7H2O 4.500,ZnSO4·7H2O 0.148,MnSO4·H2O 0.258,CoCl2·6H2O 0.024,NiCl2·6H2O 0.022,CuCl2 0.013,Na2MoO4·2H2O 0.100,H3BO3 0.062),1×105 Pa灭菌30 min,灭菌后添加经0.22 μm微孔滤膜过滤的苯、甲苯、苯乙烯的混合物(体积比为1:1:1) 作为碳源。无机盐固体培养基在液体培养基的基础上添加2%琼脂。LB培养基配方参考於建明等[6]的研究。
1.3 菌株的分离纯化污水摇匀后以5% (体积比)的接种量转接至含200 mg/L苯系混合物的无机盐培养基,30、170 r/min条件下每2 d转接一次进行驯化培养。培养过程用封口膜密封瓶口,防止苯系物挥发。驯化中的菌液稀释涂布无机盐固体培养基,挑选单菌落进行平板划线分离。
1.4 菌株的鉴定菌株的形态及生理生化特性的鉴定参考《常见细菌系统鉴定手册》[7]。分子生物学鉴定以菌株基因组为模板,采用通用引物27F (5′-AGAGTTTGA TCMTGGCTCAG-3′)和1492R (5′-GGTTACCTTG TTACGACTT-3′)扩增16S rRNA基因[8]。扩增产物送生工生物工程(上海)股份有限公司测序,测得结果在GenBank中进行同源性比对,利用MEGA 5.0软件构建系统发育树。
1.5 菌株对单一底物和混合底物的降解情况向盛有50 mL无机盐培养基的250 mL锥形瓶中分别加入适量的单一底物苯、甲苯、苯乙烯以及等比例互相混合的苯、甲苯和苯乙烯,使每个锥形瓶中的底物浓度为200 mg/L,定时测定培养液中残留的底物,计算降解率。
1.6 菌株吸附、摄取苯的机理采用BATH法[9]测定细胞的疏水性。乳化能力和排油圈直径的测定参考文献[10]。
以代表性的苯为研究对象考察SW-3对苯系物的吸附量及胞内储存量。菌悬液接种于含200 mg/L苯的无机盐培养基,分别在2、4、6、8、10、15、20、25、30、35、40、45、50 min时离心菌体(4 000 r/min,10 min),无机盐培养基清洗1次,乙醇/丁醇/氯仿(体积比10:10:1) 清洗2次,再用无机盐培养基清洗2次,合并清洗液(清洗液中的苯含量即为细胞表面吸附的苯含量);对收集的菌体进行超声破壁并离心,上清液中的苯含量即为胞内的苯富集量[10]。
1.7 分析方法 1.7.1 苯系物浓度的测定: 称重法取5 g培养液于20 mL的顶空瓶中,采用顶空气相色谱法测定苯、甲苯和苯乙烯的含量。顶空条件:炉温80,定量环温度90,传输线温度100,平衡时间30 min,GC循环时间31 min。色谱条件:色谱柱:HP-INNOWAX (30 m×0.25 mm×0.25 mm);柱温:40保持3 min,之后15升温到90,保持3.5 min;进样口温度:220;FID检测器温度:250;载气(N2)流量2 mL/min;H2流量30 mL/min;空气流量300 ml/min;分流比10:1。在该气相色谱条件下,苯、甲苯和苯乙烯的出峰时间分别在2.797、4.142和6.975 min。 1.7.2 降解率计算方法: 降解率=(苯系物减少量-苯系物挥发量)/(苯系物初始量-苯系物挥发量) ×100%。 1.7.3 菌体生物量的测定: 采用可见分光光度法测定不同浓度培养液在600 nm下的吸光值(OD600),同时测定不同浓度培养液对应的菌体干重,每个浓度做3个平行,绘制吸光值与细胞干重标准曲线,根据不同吸光值计算细胞干重[6]。 1.7.4 菌体的透射电镜观察: 将SW-3分别接种于LB培养基和含200 mg/L苯的无机盐培养基,培养32 h,菌液经适当稀释后滴在铜网膜上,待样品干燥后,通过透射电镜观察不同培养条件下菌体的形态结构。 2 结果与分析 2.1 苯系物降解菌的分离和鉴定经3次纯种分离纯化,从工业石油废水筛得一株苯系物降解菌SW-3。在LB固体培养基培养36 h可形成表面光滑、边缘整齐的浅黄色圆形菌落(图 1B)。观察LB培养基中菌体的透射电镜图(图 1C和1D)可知,SW-3为杆菌,大小约为0.5 μm×1.6 μm,具有单端鞭毛和不规则荚膜。菌株SW-3的具体生理生化特性如表 1所示,接触酶阳性、淀粉水解和甲基红试验阴性,与於建明等[6]报道的苯乙烯降解菌P. putida的生理特性一致。
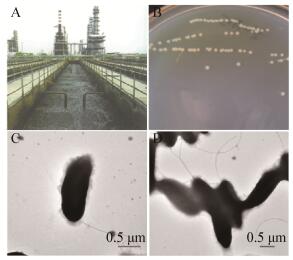
|
| 图 1 采样点和SW-3的菌落及透射电镜图 Figure 1 Sampling point, colony morphology and TEM photos of SW-3 注:A:采样点;B:SW-3的菌落形态;C、D:SW-3透射电镜图. Note: A: Sampling point; B: Colony morphology of SW-3; C, D: TEM photos of SW-3. |
|
|
| 项目 Item |
结果 Result |
| 革兰氏染色 Gram staining test |
- |
| 接触酶试验 Contact enzyme test |
+ |
| 尿素水解 Urea hydrolysis test |
- |
| 明胶水解 Gelation hydrolysis |
- |
| 甲基红试验 Methy1 Red test |
- |
| V-P试验 V-P test |
- |
| 吲哚试验 Indole test |
- |
| 柠檬酸盐试验 Citrate utilization test |
+ |
| H2S产生 H2S production |
- |
| 酪氨酸水解 Tyrosine hydrolylsis |
- |
| 硝酸盐还原 Nitrate reduction test |
+ |
| 淀粉水解 Starch hydrolysis |
- |
| 注:+:阳性;-:阴性. Note: +: Positive; -: Negative. |
|
对菌株SW-3的16S rRNA基因测序得到1 398 bp序列,上传至NCBI获得GenBank登录号为KU170625。系统发育树如图 2所示,菌株SW-3与Pseudomonas putida D15 (EU046322.1) 的序列相似性达100%,D15是来源于土壤的铁载体产生菌,菌落呈圆形、表面光滑且有一定黏性,显微镜下细胞呈短杆状,革兰氏染色阴性[11]。结合16S rRNA基因分析和生理生化鉴定确定SW-3为恶臭假单胞菌Pseudomonas putida。

|
| 图 2 基于菌株SW-3的16S rRNA基因序列构建的系统发育树 Figure 2 Neighbour-Joining phylogenetic tree based on nearly complete 16S rRNA gene sequences of strain SW-3 注:括号中的序列号代表菌株的GenBank登录号;分支点上的数字代表计算1 000次聚类至同一分支概率,标尺刻度代表0.5%的序列差异. Note: Number in parenthesis represent the sequence's accession number in GenBank. The numbers at each branch point in the percentage supported by bootstrap. Bar: 0.5% sequence divergence. |
|
|
将菌悬液以5%的接种量投加到苯系物总浓度为200 mg/L无机盐培养基,以预实验确定的最适降解条件(30、pH 7.0、170 r/min、底物浓度200 mg/L)进行培养。如图 3所示,苯的降解速率最高,接种后32 h降解率达到87.87%;其次是甲苯,48 h达最大降解率81.56%;苯乙烯的降解在初始的24 h较为缓慢,随后迅速增加,在40 h时达最大降解率72.81%。SW-3最大比生长速率出现在第7.5 h,最大值为0.195 0 h-1,单位菌体(干重)对苯、甲苯和苯乙烯的最大降解速率分别为0.072、0.035、0.019 g/(L·h)。随着底物的消耗逐渐进入稳定期,在40 h时菌体量的积累达最大值0.145 g/L。

|
| 图 3 P. putida的动力学特性 Figure 3 Kinetic characteristics of P. putida 注:A:苯系物的降解情况;B:菌株的比生长速率和底物的比降解速率. Note: A: Degradation of benzene series; B: Specific growth rate of P. putida and specific degradation rate of substrates. |
|
|
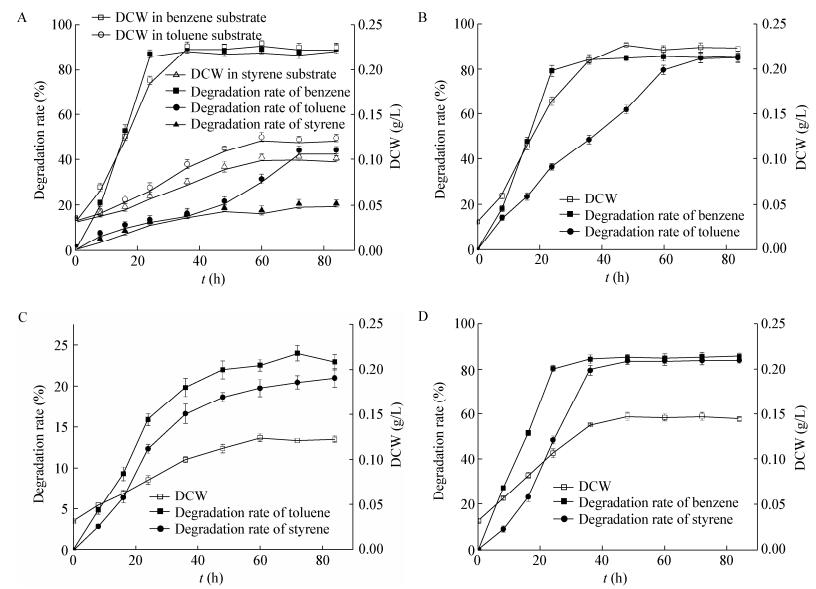
|
| 图 4 不同底物中的菌体干重和底物降解情况 Figure 4 DCW and degradation of substrates in different substrates 注:A:单一底物中的菌体干重和底物降解情况;B:苯和甲苯中的菌体干重和底物降解情况;C:甲苯和苯乙烯中的菌体干重和底物降解情况;D:苯和苯乙烯中的菌体干重和底物降解情况. Note: A: DCW and degradation of each benzene series in the single substrate; B, C, D: DCW and degradation of each benzene series in benzene and toluene, toluene and styrene, benzene and styrene. |
|
|
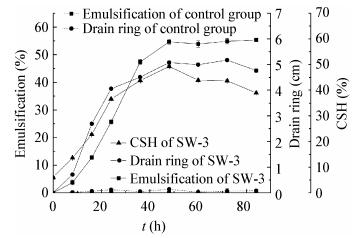
|
| 图 5 细胞乳化性、排油圈和疏水性随时间的变化 Figure 5 Change of emulsification, drain ring and CSH with time |
|
|
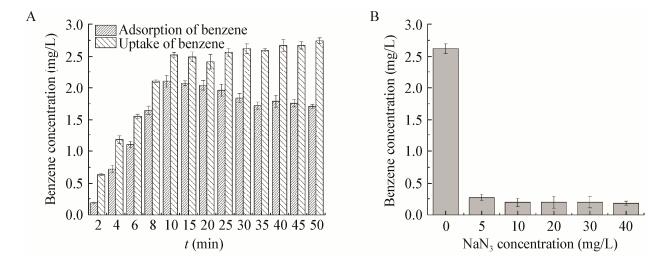
|
| 图 6 SW-3对苯系物的吸附和摄取情况 Figure 6 Adsorption and uptake of benzene series by SW-3 注:A:吸附和富集苯浓度随时间的变化;B:NaN3对SW-3富集苯的抑制作用. Note: A: Change of adsorption and enrichment benzene with time; B: Inhibition of NaN3 to SW-3. |
|
|

|
| 图 7 苯培养下的SW-3透射电镜图 Figure 7 TEM photos of SW-3 under benzene series |
|
|
(1) 以苯、甲苯和苯乙烯为唯一碳源,筛选到一株苯系物降解菌。经鉴定,该菌为Pseudomonas putida,命名为SW-3菌株。
(2) 在苯系物最佳降解条件下,SW-3的最大比生长速率为0.195 0 h-1;单位菌体(干重)对苯、甲苯和苯乙烯的最大降解速率分别为0.072、0.035和0.019 g/(L·h),接种40 h降解率分别达86.83%、80.32%和72.81%。
(3) 菌SW-3能够降解单一底物的苯、甲苯和苯乙烯,且对苯的降解效果最佳。在双底物降解实验中,甲苯的降解能够被苯乙烯抑制,而苯乙烯的降解在有苯和甲苯存在时显著提高。
(4) 乳化性、排油圈、细胞疏水性和透射电镜观察等分析表明SW-3在自身分泌的表面活性剂的协助下以耗能的方式运输苯。
| [1] |
Asenjo NG, Álvarez P, Granda M, et al. High performance activated carbon for benzene/toluene adsorption from industrial wastewater[J]. Journal of Hazardous Materials, 2011, 192(3): 1525-1532. DOI:10.1016/j.jhazmat.2011.06.072 |
| [2] |
Fuchs G, Boll M, Heider J. Microbial degradation of aromatic compounds-from one strategy to four[J]. Nature Reviews Microbiology, 2011, 9(11): 803-816. DOI:10.1038/nrmicro2652 |
| [3] |
Duan CR, Hu J, Song YA, et al. Isolation and identification of a benzene-degrading strain and choice of packing material during degradation of benzene in biofilter[J]. Chinese Journal of Environmental Engineering, 2012, 6(7): 2388-2394. (in Chinese) 段传人, 胡江, 宋永安, 等. 高效苯降解菌的筛选鉴定及其在生物过滤塔处理苯的填料选择[J]. 环境工程学报, 2012, 6(7): 2388-2394. |
| [4] |
Jiang B, Zhou ZC, Dong Y, et al. Biodegradation of benzene, toluene, ethylbenzene, and o-, m-, and p-xylenes by the newly isolated bacterium Comamonas sp. JB[J]. Applied Biochemistry and Biotechnology, 2015, 176(6): 1700-1708. DOI:10.1007/s12010-015-1671-6 |
| [5] |
Reardon KF, Mosteller DC, Rogers JB. Biodegradation kinetics of benzene, toluene, and phenol as single and mixed substrates for Pseudomonas putida F1[J]. Biotechnology and Bioengineering, 2000, 69(4): 385-400. DOI:10.1002/(ISSN)1097-0290 |
| [6] |
Yu JM, Liu L, Cai WJ, et al. Identification and characteristics of a Pseudomonas putida strain with the capable of efficiently degrade styrene[J]. China Environmental Science, 2014, 34(6): 1564-1571. (in Chinese) 於建明, 刘靓, 蔡文吉, 等. 一株苯乙烯高效降解菌的分离鉴定及降解特性研究[J]. 中国环境科学, 2014, 34(6): 1564-1571. |
| [7] |
Dong XZ, Cai MY. Common Bacterial Manual System Identification[M]. Beijing: Science Press, 2001, 348-392. (in Chinese) 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001, 348-392. |
| [8] |
Feng SS, Yang HL, Xin Y, et al. Isolation of an extremely acidophilic and highly efficient strain Acidithiobacillus sp. for chalcopyrite bioleaching[J]. Journal of Industrial Microbiology & Biotechnology, 2012, 39(11): 1625-1635. |
| [9] |
Lin J, Zeng JJ, Liu ST, et al. Cell surface hydrophobicity of Ralstonia solanacearum[J]. Microbiology China, 2011, 38(1): 45-50. (in Chinese) 林娟, 曾金晶, 刘树滔, 等. 青枯菌细胞表面的疏水性[J]. 微生物学通报, 2011, 38(1): 45-50. |
| [10] |
Liu YS. Research on treatment efficiency and biodegradation mechanism of long chain alkanes in coal gasification wastewater by MBBR[D]. Harbin: Doctoral Dissertation of Harbin Institute of Technology, 2014(in Chinese) 刘音颂. 生物强化技术处理煤制气废水中长链烷烃的效能及机理研究[D]. 哈尔滨: 哈尔滨工业大学博士学位论文, 2014 http://cdmd.cnki.com.cn/Article/CDMD-10213-1014084934.htm |
| [11] |
Yu SF, Ding YQ, Yao LT, et al. Isolation, identification and resistant features of a siderophores producting bacteria from peanut rhizosphere[J]. Letters in Biotechnology, 2008, 19(5): 701-703. (in Chinese) 于素芳, 丁延芹, 姚良同, 等. 一株花生根际铁载体产生菌的分离鉴定及耐药性分析[J]. 生物技术通报, 2008, 19(5): 701-703. |
| [12] |
Song J, Shin S, Jang HS, et al. Kinetics and simulations of substrate interactions during the biodegradation of benzene, toluene, p-xylene and styrene[J]. Journal of Environmental Science and Health Part A-Toxic/Hazardous Substances & Environmental Engineering, 2012, 47(7): 1027-1035. |
| [13] |
Huang XR, Zhang CW, Zhang RJ, et al. Isolation, identification and degrading properties of PAHs-degrading bacteria[J]. Microbiology China, 2016, 43(5): 965-973. (in Chinese) 黄兴如, 张彩文, 张瑞杰, 等. 多环芳烃降解菌的筛选、鉴定及降解特性[J]. 微生物学通报, 2016, 43(5): 965-973. |
| [14] |
Zedelius J, Rabus R, Grundmann O, et al. Alkane degradation under anoxic conditions by a nitrate-reducing bacterium with possible involvement of the electron acceptor in substrate activation[J]. Environmental Microbiology Reports, 2011, 3(1): 125-135. DOI:10.1111/emi4.2011.3.issue-1 |
| [15] |
Rocha CA, Pedregosa AM, Laborda F. Biosurfactant-mediated biodegradation of straight and methyl-branched alkanes by Pseudomonas aeruginosa ATCC 55925[J]. AMB Express, 2011, 1: 9. DOI:10.1186/2191-0855-1-9 |
 2017, Vol. 44
2017, Vol. 44




