扩展功能
文章信息
- 郭琼, 肖琳, 于忆潇, 王楚楚, 缪爱军, 宋晓骏, 杨柳燕
- GUO Qiong, XIAO Lin, YU Yi-Xiao, WANG Chu-Chu, MIAO Ai-Jun, SONG Xiao-Jun, YANG Liu-Yan
- 以圆币草发酵液为碳源时硫酸盐还原菌处理重金属废水
- Using Hydrocotyle verticillata fermentation broth as a carbon source for sulfate-reducing bacteria to treat wastewater containing heavy metals
- 微生物学通报, 2017, 44(9): 2019-2028
- Microbiology China, 2017, 44(9): 2019-2028
- DOI: 10.13344/j.microbiol.china.160932
-
文章历史
- 收稿日期: 2016-12-19
- 接受日期: 2017-03-13
- 优先数字出版日期(www.cnki.net): 2017-04-05
有色金属冶炼、电镀、制药、制革等行业会产生大量的含硫酸盐重金属废水,废水中含有的Cd2+、Cu2+、Ni2+、Pb2+和Hg2+等重金属离子进入环境或生态系统中,会长期存留、积累或在环境、生物体中迁移转化,产生持续的危害,如日本发生的痛痛病和广东镉大米事件就是由镉迁移转化和积累引起的,对人体产生了巨大危害[1]。近年来,利用硫酸盐还原菌将硫酸盐还原为硫化氢,进而与废水中的重金属离子反应生成难溶固体硫化物而将重金属离子去除的方法逐渐得以应用[2]。在有合适的碳源及电子供体的条件下,硫酸盐还原菌转化产生硫化物和碳酸氢盐,重金属离子与硫化物反应生成难溶的金属硫化物,产生的酸度被碳酸氢根中和,反应过程如方程式(1)-(3) 所示[3],其中Me2+代表金属离子,例如Zn2+、Cu2+、Ni2+、Pb2+等。

|
(1) |

|
(2) |

|
(3) |
由于硫酸盐还原菌不能降解多糖、蛋白质或脂质,它的生长取决于提供能量来源的发酵细菌的活性[4],低廉易得的碳源成为利用生物过程处理重金属废水的一个限制因素。国内外学者已将多种混合有机碳源作为硫酸盐还原菌能量的来源,包括蘑菇基肥、稻草、藻类、动物粪便和皮革废水等[5-8]。Chang等[5]和Zagury等[9]研究了硫酸盐还原菌对天然有机废物的利用,包括橡木屑、橡木发酵物、蘑菇渣、剩余污泥、富含有机物的土壤,研究发现经初步降解的有机质更易被硫酸盐还原菌所利用。
大型水生植物对污染水体有良好的净化效果,简单易行,有利于恢复自然水生生态系统,被广泛应用于水体富营养化治理和人工湿地污水处理中[10]。由于大型水生植物生长繁殖快、生物量大、水分和有机质含量高,植物体衰亡后,如果不及时收割处置,容易造成二次污染[11],因此,大型水生植物的资源化利用是不可忽视的问题。通过厌氧发酵生产挥发性有机酸和其他有机质是实现大型水生植物减量化和资源化的新途径,同时利用发酵产生的有机酸作为碳源,利用硫酸盐还原菌处理重金属废水,不仅减轻了人工湿地大型水生植物的二次污染问题,而且能有效治理重金属废水,具有十分重要的现实意义。本研究对圆币草进行厌氧发酵,将其纤维素和多聚糖转化为小分子的脂肪酸和醇类,进而作为硫酸盐还原菌的碳源,以期同时解决人工湿地水生植物资源化利用和硫酸盐还原生物处理重金属废水有机碳源缺乏的问题。
1 材料与方法 1.1 实验材料 1.1.1 硫酸盐还原菌的来源和富集: 从某污水处理厂采集厌氧污泥并富集硫酸盐还原菌,硫酸盐还原菌富集培养基为(g/L):NH4Cl 1.00,KH2PO40.50,MgSO4·7H2O 0.06,CaCl20.06,FeSO4·7H2O 0.50,Na2SO44.50,乳酸钠3.50,酵母膏1.00。富集过程为:在250 mL具塞锥形瓶中分装200 mL的液体培养基,在1×105 Pa灭菌30 min,接种50 mL厌氧污泥至瓶口充满状态,密封于37培养。当培养液变为墨汁色且瓶口散发臭鸡蛋气味时,在瓶口放置湿润的醋酸铅试纸,试纸变黑(硫酸盐还原菌大量繁殖),取10 mL厌氧污泥转移至新鲜的培养基中,相同培养条件下重复培养5-7次以富集硫酸盐还原菌,得到硫酸盐还原菌为主的厌氧污泥。
1.1.2 主要试剂和仪器: 本试验中所用试剂均为分析纯级别,购自国药集团化学试剂有限公司。便携式pH计(HQ30D),美国哈希公司;离心机(Centrifuge 5810R),德国Eppendorf公司;离子色谱(ICS-1000),美国戴安公司;电感耦合等离子体质谱(ICP-MS,NexION300),美国珀金埃尔默公司。 1.1.3 圆币草发酵液的制备: 采集人工湿地中圆币草,称取0.5 kg,洗净后粉碎,置于体积为5 L的发酵罐中,加入厌氧污泥200 mL和曝氮气20 min的超纯水4 L,在37下厌氧发酵8 d。发酵液用6层纱布过滤以去除圆币草残渣,收集滤液,在4保存备用。本实验所用发酵液COD (Chemical oxygen demand)为3 800 mg/L,所含挥发性有机酸为(mg/L):乙酸1 110.3、丙酸465.5、异丁酸17.4、正丁酸24.4、异戊酸34.0、正戊酸14.4。 1.2 实验方法 1.2.1 硫酸盐还原菌对圆币草发酵液的利用: 以250 mL聚乙烯瓶为批次试验反应器,接种5 mL以硫酸盐还原菌为优势菌群的厌氧污泥,探究硫酸盐还原菌以水生植物发酵液作为碳源的利用情况,同时设置以乙醇、乙酸钠、乳酸钠、葡萄糖和蔗糖为碳源的对照组。批次试验反应器进水为(mg/L):Na2SO4 370.0、NH4Cl 19.0、KH2PO4 4.4。以圆币草发酵液作为硫酸盐还原菌的碳源,批次试验反应器中初始COD为300 mg/L,各对照组COD也设置为300 mg/L。取样分析测定反应器液体中pH值以及COD、硫酸盐和硫化物含量。 1.2.2 以圆币草发酵液为碳源去除重金属试验: 以250 mL聚乙烯瓶为批次试验反应器,接种5 mL以硫酸盐还原菌为优势菌群的厌氧污泥,探究以水生植物发酵液为其碳源对低浓度多种重金属混合废水的处理效果,反应器进水为(mg/L):NH4Cl 19.0、KH2PO4 4.40、CuCl2 1.06、Pb(NO3)2 0.08、NiCl2·6H2O 0.40、Cd(NO3)2 0.02。以圆币草发酵液作为硫酸盐还原菌的碳源,批次试验反应器中初始COD为300 mg/L,设置3组硫酸盐浓度250.0、60.0和42.8 mg/L。由于细菌具有吸附重金属离子能力,因此,开展了灭活菌体对该4种重金属离子吸附能力的研究,接种5 mL灭活菌体,其余条件保持一致。取样分析测定液体中pH值以及COD、硫酸盐、Pb2+、Cd2+、Cu2+和Ni2+离子含量。为探究硫酸盐还原菌以水生植物发酵液作为碳源时对较高浓度水平的重金属离子的去除能力,以250 mL聚乙烯瓶为批次试验反应器,Pb2+、Cd2+、Cu2+和Ni2+四种重金属离子分别设置为1 mg/L和10 mg/L两个浓度组,批次试验反应器中其余进水为(mg/L):NH4Cl 19.0、KH2PO4 4.4、COD 300.0、硫酸盐88.8。取样分析测定pH值以及COD、硫酸盐、Pb2+、Cd2+、Cu2+和Ni2+离子含量。
1.2.3 死菌体的制备: 从硫酸盐还原菌富集培养液中取出20 mL污泥,用去离子水清洗2次后移入50 mL离心管中,加入20 mL超纯水,6 000 r/min离心15 min,弃去上清液,彻底清洗残留在污泥上的培养液,转入250 mL锥形瓶中,加入100 mL超纯水,在1×105 Pa灭菌30 min得到高温灭活的死菌体,弃去上清,在4保存。 1.2.4 分析方法: 分析项目包括pH值以及硫酸盐浓度、4种重金属离子(Pb2+、Cd2+、Cu2+、Ni2+)、硫化物和COD含量。所有检测项目均采用国家规定的标准方法。pH值使用便携式pH计测定,测定前用标准pH缓冲溶液进行校正。硫酸盐浓度采用离子色谱法测定,COD值采用重铬酸钾滴定法测定,硫化物采用碘量法测定,重金属离子用电感耦合等离子体质谱测定。 2 结果与分析 2.1 添加圆币草发酵液反应器中硫酸盐还原率和硫化物生产量在添加圆币草发酵液COD/SO42-为1.2的批次试验反应器中,接种以硫酸盐还原菌为优势菌的污泥后,24 h内硫酸盐浓度迅速降低,48 h时硫酸盐还原效率为26%,此后硫酸盐生物还原作用减弱(图 1)。还原反应前5 h,反应器中没有检测到硫化物,这可能是由于产生的硫化物与废水重金属离子反应,生成难溶的金属硫化物沉淀所致。随着硫酸盐还原反应生成硫化物数量增加,反应器中硫化物含量在24 h时达到最高值8.34 mg/L。

|
| 图 1 添加圆币草发酵液的反应器中硫酸盐及硫化物浓度变化 Figure 1 Sulfate and sulfide concentration in the reactor fed with Hydrocotyle verticillata fermented broth as a function of time |
|
|
将添加圆币草发酵液体系的硫酸盐还原效率与其他5种对照碳源进行比较(图 2)发现,在添加乙醇和乳酸钠的反应器中,硫酸盐生物还原率可达41.6%和34.0%,硫酸盐还原菌对乙醇和乳酸钠表现出良好的利用率,这与文献[12-14]报道相同。在添加葡萄糖、蔗糖和乙酸钠的批次试验反应器中,硫酸盐生物还原效率分别仅为19.0%、18.7%和12.0%。相比于葡萄糖、蔗糖和乙酸钠,圆币草发酵液更适合作为硫酸盐还原菌的碳源。相比于乙醇和乳酸钠,大型水生植物发酵液的优势在于成本低廉,并可实现大型水生植物的资源化利用。碳源作为硫酸盐还原菌生长的能源和电子供体,是影响其生长的关键因素。Cao等[15]研究了不同电子供体对硫酸盐还原菌生长的影响,结果表明硫酸盐还原菌利用顺序为有机酸、挥发性脂肪酸盐、醇类和糖类,并指出在醋酸盐含量高的情况下,硫酸盐还原效率会降低,与本试验结果相同。

|
| 图 2 添加圆币草发酵液及对照碳源反应器中硫酸盐还原过程 Figure 2 Sulfate concentration variation in reactors fed with Hydrocotyle verticillata fermented broth and other different carbon sources as control |
|
|
在添加圆币草发酵液的反应器中硫酸盐还原率随初始COD/SO42-增大而提高(图 3),COD/SO42-为1.2、5.0和7.0时,硫酸盐最大还原率分别为24.4%、43.6%和60.0%。Boshoff等[7]将烘干的藻类作为硫酸盐还原菌的碳源,并探索了在高COD/SO42-比例(8.1、11.2和15.0) 下的硫酸盐还原效率,结果表明在COD/SO42-为8.1时硫酸盐的还原效率更高。过高的COD/SO42-比例下硫酸盐还原菌不占优势,产甲烷菌比硫酸盐还原菌更具有竞争优势。过高的有机物加入,不仅不利于硫酸盐还原,而且导致出水COD升高,因此,需要探索反应器中COD的变化过程。

|
| 图 3 不同COD/SO42-比例下硫酸盐还原效率 Figure 3 Sulfate reduction rate in reactors of different COD:SO42- ratio |
|
|
添加圆币草发酵液的反应器中,随着硫酸盐的还原,COD浓度不断下降(图 4)。在硫酸盐被还原的同时,反应器中COD可以得到去除。接种以硫酸盐还原菌为优势菌的厌氧污泥,试验12 h时圆币草发酵液COD去除率可达42.3%。在反应48 h时,反应器中COD由初始的300 mg/L降至42.6 mg/L,去除率达到85.8%。与其他常用碳源(乙醇、乳酸钠、蔗糖、葡萄糖和乙酸钠)相比,圆币草发酵液同样可以被微生物有效利用。添加圆币草发酵液作为硫酸盐还原菌的碳源,能有效促进硫酸盐还原菌的生长,实现对低浓度重金属废水的深度净化,同时圆币草发酵液具有良好的微生物可利用性,COD去除率较高。
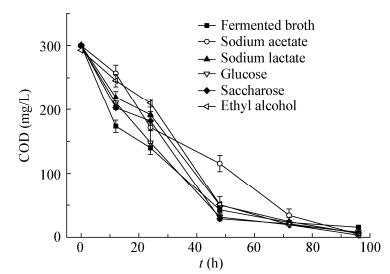
|
| 图 4 添加圆币草发酵液和对照碳源时反应器中COD变化过程 Figure 4 Variation of COD in reactors fed with Hydrocotyle verticillata fermented broth and other different carbon sources as control |
|
|
在添加圆币草发酵液的批次试验反应器中pH变化过程如图 5所示。硫酸盐的还原需要足够的氢,反应器中有机物的氧化可以产生氢离子。在相同的COD初始浓度下,添加圆币草发酵液反应器中pH值上升幅度低于乳酸钠组,但是高于乙醇、葡萄糖和蔗糖组,与乙酸钠组相当。硫酸盐还原菌的活性越强,还原硫酸盐生成的硫化物就越多,消耗的H+也多,从而导致反应器中pH值升高,有利于重金属沉淀去除,反应器中pH的变化可以一定程度上反映硫酸盐还原菌的活性。圆币草发酵液是一种良好的硫酸盐还原菌碳源,有效促进其生长,因此利用圆币草发酵液作为其碳源处理低浓度重金属废水是可行的。

|
| 图 5 添加圆币草发酵液及对照碳源的反应器中pH变化 Figure 5 Variation of pH in reactors fed with Hydrocotyle verticillata fermented broth and other different carbon sources as control |
|
|
在添加圆币草发酵液COD/SO42-为1.2、5.0和7.0的批次试验反应器中重金属离子均得到有效去除,观察到反应器中液体变黑,而死菌体组和未添加重金属组中没有此现象,说明反应器中液体变黑不是由于菌体吸附或微生物生长引起的,而是由于金属硫化物的产生。试验结束时Pb2+、Cd2+和Cu2+重金属离子的去除率均大于90%,Ni2+的去除率为89.6% (图 6)。与空白组相比,在添加圆币草发酵液的反应器中,反应5 h时Pb2+、Cd2+和Cu2+重金属离子的去除率已达90.2%、94.5%和95.5%。此时,反应器中Ni2+的去除率较低,为36.8%。到39 h时,Ni2+的去除率提高至89.6%,Pb2+、Cd2+和Cu2+重金属离子去除率基本不变。常温下金属硫化物的溶度积常数都很小,CdS、CuS、PbS和NiS的溶度积分别为1.4×10-23、4.0×10-38、1.0×10-29和3.0×10-21,因此可以利用金属硫化物的这个性质去除废水中的多种重金属离子[16]。

|
| 图 6 反应12 h时的不同试验反应器中液体颜色变化 Figure 6 Phenomena of different reactors at 12 h 注:左为未添加重金属的厌氧污泥组,中为添加圆币草发酵液及重金属的处理组,右为添加重金属的死菌体吸附组 Note: Left is the sludge group without heavy metals; Middle is the group added heavy metals and Hydrocotyle verticillata fermented broth; Right is the group added sterilized sludge and heavy metals. |
|
|
由于细菌细胞壁的多聚糖具有氨基和羧基,可以吸附重金属离子,因此开展了死菌体对该4种重金属离子吸附能力的研究(图 7),反应时间为5 h时,死菌体对Ni2+、Cu2+、Cd2+和Pb2+重金属离子的去除率分别为26.6%、25.3%、57.5%和35.3%,去除率基本稳定。通过确定死菌体的重金属吸附能力,判断菌体吸附在重金属离子去除中的贡献率。据已有文献报道,程素春等[17]筛得的菌株在36 h达到对数期,刘艳等[18]筛得的菌株在12 h进入对数生长期,在本试验中Pb2+、Cd2+和Cu2+在反应5 h时去除率已超过90%,且反应器内观察到液体变黑,说明有金属硫化物生成。硫酸盐还原菌利用发酵液中碳源,以硫酸盐为电子供体,将其还原为硫化物,由于形成金属硫化物的离子键作用力更强,会夺取菌体表面吸附的重金属离子形成金属硫化物沉淀。因此,在接种活性硫酸盐还原菌的情况下,菌体对Ni2+、Cu2+、Cd2+和Pb2+重金属离子的吸附不是其去除的主要途径。同时在长期处理的情况下,菌体还存在吸附饱和现象,因此,硫酸盐还原产生硫化物沉淀重金属离子是生物处理法去除重金属离子的主要途径。

|
| 图 7 反应器中添加硫酸盐还原菌和死菌体后4种重金属离子变化过程 Figure 7 Ni2+, Cu2+, Cd2+ and Pb2+ concentrations in reactors with live sulfate-reducing bacteria or death bacteria as a function of time |
|
|
如图 8所示,反应器中COD/SO42-为5.0的条件下,添加1 mg/L和10 mg/L Ni2+、Cu2+、Cd2+和Pb2+的批次试验反应器中,4种重金属离子在试验期间均得到有效去除。4种重金属离子初始浓度为1 mg/L时,试验结束时Ni2+、Cu2+、Cd2+和Pb2+的去除率分别为93.5%、98.9%、99.0%和96.4%。当4种重金属离子初始浓度为10 mg/L时,试验结束时Ni2+、Cu2+、Cd2+和Pb2+去除率分别为90.3%、99.1%、98.5%和95.2%。如表 1所示,Ni2+、Cu2+、Cd2+和Pb2+四种重金属离子在1 mg/L和10 mg/L的浓度水平下,反应器中硫酸盐生物还原过程均未受到明显的抑制作用,硫酸盐最大去除率与对照组相近。在添加10 mg/L Cu2+的反应器中硫酸盐还原率高于对照组,这是由于Cu2+会与硫酸盐还原菌代谢产生的硫化物形成金属硫化物沉淀,减弱S2-的反馈抑制作用,同时也减轻了硫化氢对硫酸盐还原菌的毒害作用,提高了硫酸盐还原效率。由此可知,以圆币草发酵液作为硫酸盐还原菌的碳源,不仅对低浓度重金属废水有良好的处理效果,在重金属离子浓度较高的情况下也有良好的处理效果,而且10 mg/L的4种重金属离子Ni2+、Cu2+、Cd2+和Pb2+对硫酸盐还原菌的活性不会产生抑制作用。

|
| 图 8 反应器中添加1 mg/L (A)和10 mg/L (B) 4种重金属离子浓度变化过程 Figure 8 Ni2+, Cu2+, Cd2+ and Pb2+ concentrations in reactors with initial concentrations of 1 mg/L (A) and 10 mg/L (B) as a function of time |
|
|
| 组别 Group (1 mg/L) |
硫酸盐还原效率 Sulfate reduction rate (%) |
组别 Group (10 mg/L) |
硫酸盐还原效率 Sulfate reduction rate (%) |
| Cu2+ | 43.03±1.85 | Cu2+ | 47.05±2.01 |
| Cd2+ | 44.18±2.08 | Cd2+ | 45.87±1.69 |
| Ni2+ | 42.98±1.09 | Ni2+ | 41.60±1.56 |
| Pb2+ | 42.76±2.75 | Pb2+ | 44.09±3.11 |
| 对照组 Control |
43.60±2.98 |
硫酸盐还原菌分布广泛,是一类能进行硫酸盐异化还原反应的严格厌氧菌,在环境污染治理中具有广阔的应用前景[19]。硫酸盐还原菌抗逆性强,广泛分布于土壤、沉积物、生活污水和工业废水中。厌氧条件下,硫酸盐还原菌可以把硫酸盐还原为硫化物,进而与水中的金属离子反应生成难溶的金属硫化物沉淀[20]。利用硫酸盐还原菌处理重金属废水主要通过以下3种途径:(1) 硫酸盐还原菌将SO42-还原为S2-,与重金属离子反应生成难溶的金属硫化物去除重金属;(2) 硫酸盐还原菌将SO42-转化为S2-从而使被处理废水的pH值升高,有利于重金属离子形成氢氧化物沉淀被去除;(3) 硫酸盐还原菌代谢过程中分解有机物会产生CO2,部分重金属可以与CO32-反应转化为不溶性的碳酸盐而去除[21]。国内外已有许多研究报道利用硫酸盐生物还原过程处理含硫酸盐工业废水、酸性矿山废水[22-23]。Pagnanelli等[24]利用硫酸盐还原菌固定床反应器处理含铬(Ⅵ)废水,铬(Ⅵ)去除率可达到90%-100%。Teclu等[25]尝试以糖蜜作为硫酸盐还原菌的碳源处理地下水中的砷。Lefticariu等[26]尝试以有机基质混合物(树叶堆肥、酿造谷物残渣、草木屑、甜乳清粉和粪便)作为硫酸盐还原菌的碳源,进行野外试验原位处理酸性矿山废水,结果表明添加有机基质对于刺激硫酸盐还原菌的生长并进一步去除酸性矿山废水中的重金属离子是至关重要的。Benner等[27]利用可渗透反应墙处理被酸性矿山废水污染的地下水,运行至第三年地下水中硫酸盐和铁离子浓度减少量分别超过1 000 mg/L和250 mg/L。Huisman等[28]采用Thioteq技术将硫酸盐生物还原产生硫化物,回收重金属硫化物,同时降低了出水中重金属离子浓度。硫酸盐还原菌还被应用于烟气生物脱硫中,与传统方法相比,该方法运行成本低,可回收单质硫,并能同时去除烟气中的重金属[29-30]。然而,利用硫酸盐还原菌处理重金属废水均需要额外投加碳源,增加处理成本,因此,需要解决的一个关键问题是找到一种适合硫酸盐还原菌利用且廉价的碳源。国内外多位学者尝试以有机废物作为硫酸盐还原菌的碳源,Gon alves等[31]将酿酒厂酒糟作为厌氧反应器碳源,Cd和Zn的去除率超过99%。苏宇等[6]以稻草和污泥作为硫酸盐还原菌碳源对重金属废水进行处理,结果表明添加稻草可以促进硫酸盐还原作用,Cu2+的去除率超过99%。Gibert等[32]和Zhang等[33]尝试利用羊和家禽粪便作为硫酸盐还原菌的碳源,结果表明粪便的生物可降解性高,刺激硫酸盐还原菌生长效果良好。Ayala-Parra等[34]将小球藻作为硫酸盐还原菌的碳源处理含铜废水,小球藻可作为电子供体有效促进硫酸盐生物还原作用,产生的硫化物与Cu2+反应,去除率超过99.5%。Chang等[5]研究结果表明,硫酸盐还原菌不能直接利用多糖、蛋白质和脂质,发酵后的有机质相比于未经处理的有机质更适合作为硫酸盐还原菌的基质促进其生长,因此,探索新碳源一直是硫酸盐还原生物处理重金属废水热点所在。
圆币草是处理富营养水体中常用的大型水生植物,其生长速度快、生物量大,不及时收割处置易造成二次污染。目前,传统的水生植物资源化利用途径有用作饲料、肥料和生产能源燃料等。本研究将圆币草厌氧发酵后富含有机酸的发酵液作为硫酸盐还原菌的碳源,一方面考虑到硫酸盐还原菌无法直接利用蛋白质、多糖等复杂有机质,经过发酵处理可以更好地促进硫酸盐还原菌的生长,另一方面实现了水生植物资源化[35]。结果表明,圆币草发酵液可以作为硫酸盐还原菌的电子供体促进其生长,效果优于葡萄糖、蔗糖和乙酸钠,是一种合适且廉价的碳源。同时,将圆币草发酵液作为硫酸盐还原菌的碳源处理含重金属废水,在批次试验中4种重金属离子Cd2+、Cu2+、Pb2+和Ni2+的去除率分别达到95.2%、98.7%、93.0%和89.6%。利用圆币草发酵液作为硫酸盐还原菌碳源处理重金属废水过程中,反应体系中pH值不断升高,有利于去除重金属离子。圆币草发酵液作为碳源时,反应器中COD下降变化趋势与葡萄糖等为碳源时一致,残留COD数量少,有利于出水COD达标。因此,利用大型水生植物厌氧发酵产生挥发性脂肪酸等有机物质,添加至重金属生物处理反应器中,可以深度净化重金属废水并实现大型水生植物的资源化,不仅有效解决了人工湿地大型水生植物处置难题,而且提高了生物反应器去除重金属离子的能力,实现了低浓度重金属废水的深度处理。
4 结论(1) 硫酸盐还原菌能有效利用大型水生植物发酵液中有机物,还原硫酸盐处理低浓度重金属废水。在批次试验反应器中,添加水生植物发酵液为碳源,COD/SO42-为1.2、5.0、7.0时硫酸盐最大还原率分别为24.4%、43.6%和60.0%。
(2) 圆币草发酵液作为硫酸盐还原菌碳源效果优于葡萄糖、蔗糖,具有良好的生物可利用性。相比于乙醇和乳酸钠,其优势在于廉价易得,并可以实现大型水生植物的资源化利用。
(3) 以圆币草发酵液为碳源的批次试验反应器中,接种以硫酸盐还原菌为优势菌的厌氧污泥,对低浓度多种重金属混合废水有良好的处理效果,4种重金属离子(Cd2+、Cu2+、Pb2+、Ni2+)去除率分别达到95.2%、98.7%、93.0%、89.6%。同时,硫酸盐还原菌利用圆币草发酵液作为碳源,对10 mg/L的Ni2+、Cu2+、Cd2+和Pb2+四种重金属废水仍有良好的处理效果,去除率均超过90%,且硫酸盐还原菌的活性没有受到抑制。
因此,大型水生植物发酵液作为硫酸盐还原菌的碳源可应用于重金属废水生物处理,并实现水生植物的资源化,一举二得。将来需进一步开展大型水生植物发酵液直接净化含重金属的电镀等废水研究,争取早日实现工程化应用。
| [1] |
Zhang ML, Wang HX. Biological treatment of acidic coal refuse using sulphate-reducing bacteria with chicken manure as carbon source[J]. Environmental Technology, 2014, 35(23): 2947-2955. DOI:10.1080/09593330.2014.925980 |
| [2] |
Pagnanelli F, Viggi CC, Toro L. Isolation and quantification of cadmium removal mechanisms in batch reactors inoculated by sulphate reducing bacteria:biosorption versus bioprecipitation[J]. Bioresource Technology, 2010, 101(9): 2981-2987. DOI:10.1016/j.biortech.2009.12.009 |
| [3] |
Drury WJ. Treatment of acid mine drainage with anaerobic solid-substrate reactors[J]. Water Environment Research, 1999, 71(6): 1244-1250. DOI:10.2175/106143096X122375 |
| [4] |
Viggi CC, Pagnanelli F, Cibati A, et al. Biotreatment and bioassessment of heavy metal removal by sulphate reducing bacteria in fixed bed reactors[J]. Water Research, 2010, 44(1): 151-158. DOI:10.1016/j.watres.2009.09.013 |
| [5] |
Chang IS, Shin PK, Kim BH. Biological treatment of acid mine drainage under sulphate-reducing conditions with solid waste materials as substrate[J]. Water Research, 2000, 34(4): 1269-1277. DOI:10.1016/S0043-1354(99)00268-7 |
| [6] |
Su Y, Wang J, Peng SC, et al. Rice straw and sewage sludge as carbon sources for sulfate-reducing bacteria treating acid mine drainage[J]. Environmental Science, 2010, 31(8): 1858-1863. (in Chinese) 苏宇, 王进, 彭书传, 等. 以稻草和污泥为碳源硫酸盐还原菌处理酸性矿山排水[J]. 环境科学, 2010, 31(8): 1858-1863. |
| [7] |
Boshoff G, Duncan J, Rose PD. The use of micro-algal biomass as a carbon source for biological sulphate reducing systems[J]. Water Research, 2004, 38(11): 2659-2666. DOI:10.1016/j.watres.2004.03.031 |
| [8] |
Lefticariu L, Walters ER, Pugh CW, et al. Sulfate reducing bioreactor dependence on organic substrates for remediation of coal-generated acid mine drainage:field experiments[J]. Applied Geochemistry, 2015, 63: 70-82. DOI:10.1016/j.apgeochem.2015.08.002 |
| [9] |
Zagury GJ, Kulnieks Ⅵ, Neculita CM. Characterization and reactivity assessment of organic substrates for sulphate-reducing bacteria in acid mine drainage treatment[J]. Chemosphere, 2006, 64(6): 944-954. DOI:10.1016/j.chemosphere.2006.01.001 |
| [10] |
Huang Y, Fu YG, Zhao JF. Research progress on mechanisms of phytoremediation for eutrophic water[J]. Journal of Agro-Environment Science, 2005, 24(S1): 379-383. (in Chinese) 黄亚, 傅以钢, 赵建夫. 富营养化水体水生植物修复机理的研究进展[J]. 农业环境科学学报, 2005, 24(S1): 379-383. |
| [11] |
Wu HT, Lü XG, Yang Q. Factors affecting litter decomposition of wetland herbaceous macrophytes[J]. Chinese Journal of Ecology, 2006, 25(11): 1405-1411. (in Chinese) 武海涛, 吕宪国, 杨青. 湿地草本植物枯落物分解的影响因素[J]. 生态学杂志, 2006, 25(11): 1405-1411. DOI:10.3321/j.issn:1000-4890.2006.11.021 |
| [12] |
Nagpal S, Chuichulcherm S, Livingston A, et al. Ethanol utilization by sulfate-reducing bacteria:an experimental and modeling study[J]. Biotechnology and Bioengineering, 2000, 70(5): 533-543. DOI:10.1002/(ISSN)1097-0290 |
| [13] |
Zhou JM, Zhou XM, Li YG, et al. Bacterial communities in haloalkaliphilic sulfate-reducing bioreactors under different electron donors revealed by 16S rRNA MiSeq sequencing[J]. Journal of Hazardous Materials, 2015, 295: 176-184. DOI:10.1016/j.jhazmat.2015.04.010 |
| [14] |
Oyekola OO, Van Hille RP, Harrison STL. Kinetic analysis of biological sulphate reduction using lactate as carbon source and electron donor:effect of sulphate concentration[J]. Chemical Engineering Science, 2010, 65(16): 4771-4781. DOI:10.1016/j.ces.2010.05.014 |
| [15] |
Cao JY, Zhang GJ, Mao ZS, et al. Influence of electron donors on the growth and activity of sulfate-reducing bacteria[J]. International Journal of Mineral Processing, 2012, 106-109: 58-64. DOI:10.1016/j.minpro.2012.02.005 |
| [16] |
Yong RN, Mohamed AMO, Warkentin BP. Principles of Contaminant Transport in Soils[M]. Amsterdam: Elsevier Science Publishers, 1992.
|
| [17] |
Cheng SC, Chen TH, Wang J, et al. Separation of sulfate reducing bacteria from the mixed area of landfill and tailings in Xiangshan[J]. Acta Mineralogica Sinica, 2014, 32(2): 175-180. (in Chinese) 程素春, 陈天虎, 王进, 等. 向山垃圾填埋场-尾矿混合带硫酸盐还原菌分离[J]. 矿物学报, 2014, 32(2): 175-180. |
| [18] |
Liu Y, Dang Y, Liu Y, et al. Isolation and identification of a sulfate-reducing bacteria DSRBa and its characterization[J]. Journal of Agro-Environment Science, 2011, 30(1): 176-182. (in Chinese) 刘艳, 党云, 刘云, 等. 一株硫酸盐还原菌DSRBa的分离鉴定及特性分析[J]. 农业环境科学学报, 2011, 30(1): 176-182. |
| [19] |
Xu WH, Liu YG, Zeng GM, et al. Sulfate-reducing bacteria and research progress of Cr (Ⅵ) reduction by sulfate-reducing by sulfate-reducing bacteria[J]. Microbiology China, 2009, 36(7): 1040-1045. (in Chinese) 徐卫华, 刘云国, 曾光明, 等. 硫酸盐还原菌及其还原解毒Cr (Ⅵ)的研究进展[J]. 微生物学通报, 2009, 36(7): 1040-1045. |
| [20] |
Benedetto JS, de Almeida SK, Gomes HA, et al. Monitoring of sulfate-reducing bacteria in acid water from uranium mines[J]. Minerals Engineering, 2005, 18(13/14): 1341-1343. |
| [21] |
Su BQ, Li YX. Biological reduction of sulfate and the removal of heavy metals[J]. Industrial Water Treatment, 2005, 25(9): 1-4. (in Chinese) 苏冰琴, 李亚新. 硫酸盐生物还原和重金属的去除[J]. 工业水处理, 2005, 25(9): 1-4. DOI:10.11894/1005-829x.2005.25(9).1 |
| [22] |
Sánchez-Andrea I, Sanz JL, Bijmans MFM, et al. Sulfate reduction at low pH to remediate acid mine drainage[J]. Journal of Hazardous Materials, 2014, 269: 98-109. DOI:10.1016/j.jhazmat.2013.12.032 |
| [23] |
Tsukamoto TK, Killion HA, Miller GC. Column experiments for microbiological treatment of acid mine drainage:low-temperature, low-pH and matrix investigations[J]. Water Research, 2004, 38(6): 1405-1418. DOI:10.1016/j.watres.2003.12.012 |
| [24] |
Pagnanelli F, Viggi CC, Cibati A, et al. Biotreatment of Cr (Ⅵ) contaminated waters by sulphate reducing bacteria fed with ethanol[J]. Journal of Hazardous Materials, 2012, 199-200: 186-192. DOI:10.1016/j.jhazmat.2011.10.082 |
| [25] |
Teclu D, Tivchev G, Laing M, et al. Determination of the elemental composition of molasses and its suitability as carbon source for growth of sulphate-reducing bacteria[J]. Journal of Hazardous Materials, 2009, 161(2/3): 1157-1165. |
| [26] |
Lefticariu L, Walters ER, Pugh CW, et al. Sulfate reducing bioreactor dependence on organic substrates for remediation of coal-generated acid mine drainage:field experiments[J]. Applied Geochemistry, 2015, 63: 70-82. DOI:10.1016/j.apgeochem.2015.08.002 |
| [27] |
Benner SG, Blowes DW, Ptacek CJ, et al. Rates of sulfate reduction and metal sulfide precipitation in a permeable reactive barrier[J]. Applied Geochemistry, 2002, 17(3): 301-320. DOI:10.1016/S0883-2927(01)00084-1 |
| [28] |
Huisman JL, Schouten G, Schultz C. Biologically produced sulphide for purification of process streams, effluent treatment and recovery of metals in the metal and mining industry[J]. Hydrometallurgy, 2006, 83(1/4): 106-113. |
| [29] |
Gao K, Feng SS, Chen JC, et al. Restrictive factors and their effects on microbial sulfate-reducing phase during flue gas desulfurization[J]. Microbiology China, 2014, 41(9): 1749-1756. (in Chinese) 高凯, 冯守帅, 陈金才, 等. 微生物烟气脱硫中硫酸盐还原阶段的限制性因素及其影响[J]. 微生物学通报, 2014, 41(9): 1749-1756. |
| [30] |
Gong J, Zhang ZM. Research progress in microbiol removal of sulfur dioxide[J]. Microbiology China, 2004, 31(3): 162-165. (in Chinese) 贡俊, 张肇铭. 微生物法去除二氧化硫的研究进展[J]. 微生物学通报, 2004, 31(3): 162-165. |
| [31] |
Gonçalves MMM, Da Costa ACA, Leite SGF, et al. Heavy metal removal from synthetic wastewaters in an anaerobic bioreactor using stillage from ethanol distilleries as a carbon source[J]. Chemosphere, 2007, 69(11): 1815-1820. DOI:10.1016/j.chemosphere.2007.05.074 |
| [32] |
Gibert O, de Pablo J, Cortina JL, et al. Chemical characterisation of natural organic substrates for biological mitigation of acid mine drainage[J]. Water Research, 2004, 38(19): 4186-4196. DOI:10.1016/j.watres.2004.06.023 |
| [33] |
Zhang ML, Wang HX. Organic wastes as carbon sources to promote sulfate reducing bacterial activity for biological remediation of acid mine drainage[J]. Minerals Engineering, 2014, 69: 81-90. DOI:10.1016/j.mineng.2014.07.010 |
| [34] |
Ayala-Parra P, Sierra-Alvarez R, Field JA. Algae as an electron donor promoting sulfate reduction for the bioremediation of acid rock drainage[J]. Journal of Hazardous Materials, 2016, 317: 335-343. DOI:10.1016/j.jhazmat.2016.06.011 |
| [35] |
Yang LY, Zhang W, Chen QK, et al. Resources utilization of macrophytes[J]. Water Resources Protection, 2016, 32(5): 5-10. (in Chinese) 杨柳燕, 张文, 陈乾坤, 等. 大型水生植物的资源化利用[J]. 水资源保护, 2016, 32(5): 5-10. DOI:10.3880/j.issn.1004-6933.2016.05.002 |
 2017, Vol. 44
2017, Vol. 44




