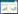扩展功能
文章信息
- 周杨, 万强, 蔡芷荷, 卢勉飞, 吴清平, 李健顺
- ZHOU Yang, WAN Qiang, CAI Zhi-He, LU Mian-Fei, WU Qing-Ping, LI Jian-Shun
- 基于环介导恒温扩增技术的大肠杆菌O157:H7快速检测试剂盒的评价
- Evaluation of loop-mediated isothermal amplification based kits for rapid detection of Escherichia coli O157:H7
- 微生物学通报, 2017, 44(8): 1996-2004
- Microbiology China, 2017, 44(8): 1996-2004
- DOI: 10.13344/j.microbiol.china.160853
-
文章历史
- 收稿日期: 2016-11-23
- 接受日期: 2017-02-09
- 优先数字出版日期(www.cnki.net): 2017-03-23
2. 广东省微生物研究所 广东 广州 510070;
3. 广东环凯生物科技有限公司 广东 肇庆 526238
2. Guangdong Institute of Microbiology, Guangzhou, Guangdong 510070, China;
3. Guangdong Huankai Biologic Sci. & Tech. Co. Ltd., Zhaoqing, Guangdong 526238, China
大肠杆菌(Escherichia coli) O157:H7是肠埃希氏菌中血清型毒力较强的菌种代表,引发以腹泻为主的动物源性传染病[1-2]。大肠杆菌O157:H7传播途径众多,包括食源性传播、水源性传播以及人畜接触传播等,其中以食源性传播更为普遍[3]。近年来,我国大多数地区均出现大肠杆菌O157:H7感染疫情,一般为患病者进食被该致病菌污染的食物所致,并且表现出明显的季节性暴发,多集中在7-9月[4-6]。大肠杆菌O157:H7可感染所有年龄阶段的人群,特别是儿童和老人发病率较高,并且会引发多种严重的并发症,如溶血性尿毒综合征(HUS)和血栓形成性血小板减少性紫癫(TTP),具有毒力强、病死率高等特点[7-8]。截止目前,尚未发现有预防大肠杆菌O157:H7感染的疫苗,因此有关该菌感染疫情的控制多集中在对食品、水源等的早期检测方面。当前已建立了多种大肠杆菌O157:H7检测方法,主要包括采用传统培养基法(病原微生物分离鉴定、形态学鉴定及自动化鉴定方法)、酶联免疫技术、核酸探针技术、核酸扩增(PCR)技术等[9-10],但这些方法表现出检测周期长、操作复杂、仪器昂贵、成本高等不足,并且多局限在实验室检测,难以满足在基层现场的快速检测需求。
环介导恒温扩增技术(Loop-mediated isothermal amplification,LAMP)是由Notomi等于2000年开发的一种新型的体外等温扩增特异核酸片段的技术[11-12]。该技术利用两对特殊引物和具有链置换活性的Bst (Bacillus stearothermophilus) DNA聚合酶,能在65℃左右恒温条件下使引物顺利与模板结合并进行链置换扩增反应,无需复杂仪器,大大节省了反应时间,其结果判读、灵敏度、特异性、检测范围及应用成本等远优于其他分子检测方法,因此基于该技术的检测产品将更适用于基层单位的快速检测需求。鉴于此,根据我国现有相关质检行业标准技术文件,本研究对研制的基于LAMP技术的大肠杆菌O157:H7快速检测试剂盒的性能和检测质量水平进行测试和评价。选取不同生产批次的试剂盒,对该试剂盒检测大肠杆菌O157:H7的特异性、灵敏度、准确度、重复性、保质期及运输稳定性等进行分析,评价了该试剂盒用于各类不同食品样品的大肠杆菌O157:H7检测的适用性。
1 材料与方法 1.1 主要材料和试剂E. coli O157:H7 ATCC 35150、E. coli O157:H7 ATCC 43889、E. coli O157:H7 ATCC 700728、E. coli O157:H7 NTCT 12900、E. coli O157:H7 CMCC(B) 44828、金黄色葡萄球菌(Staphylococcus aureus) ATCC 25923、福氏志贺氏菌(Shigella flexneri) CMCC(B) 51572、铜绿假单胞菌(Pseudomonas aeruginosa) ATCC 9027、粪肠球菌(Enterococcus faecali) ATCC 29212、阪崎肠杆菌(Enterobacter sakazakii) ATCC 29544、副溶血性弧菌(Vibrio parahaemolyticus) ATCC 17802、单核细胞增生李斯特菌(Listeria monocytogene) ATCC 19115、肠炎沙门氏菌(Salmonella enteritidis) ATCC 13076、产气肠杆菌(Enterobacter aerogenes) ATCC 13048、乙型溶血性链球菌(Beta-hemolytic streptococcus) ATCC 21059、枯草芽孢杆菌(Bacillus subtilis) CMCC(B) 63501、E. coli CMCC(B) 44102和肺炎链球菌(Streptococcus pneumoniae) CMCC(B) 31001均由广东环凯微生物科技有限公司提供。
大肠杆菌O157:H7的LAMP快速检测试剂盒共5批次(分别为20150313、20150412、20150511、20150610、20150712),由本实验室研制,其核心构建组分包括干粉试剂、复溶液、显色液、裂解液、阳性对照、阴性对照。胰蛋白胨大豆琼脂(TSA)、改良EC肉汤(mEC)、改良山梨醇麦康凯琼脂培养基(CT-SMAC)、三糖铁琼脂(TSI)、月桂硫酸盐胰蛋白胨肉汤-MUG (MUG-LST)、氧化酶试剂、革兰氏染色液、大肠杆菌O157:H7诊断血清、MID生化鉴定试剂盒、半固体琼脂、O157显色琼脂由广东环凯微生物科技有限公司提供。
供试食品样品在全国8个地区(澳门、郑州、乌鲁木齐、杭州、南京、石家庄、银川及呼和浩特)进行抽样,包括肉与肉制品、蔬菜以及速冻食品共3类14种代表性食品。
1.2 主要仪器Shock Mixer-1型高速振荡样品处理器、HKP-9172A型恒温培养箱、WBK-4B水浴恒温箱,广东环凯微生物科技有限公司;3K15型台式高速离心机,德国Sigma公司;DYY-6B型稳压稳流电泳仪,北京市六一仪器厂;Easy Spiral型螺旋接种仪,法国Interscience公司。
1.3 方法 1.3.1 标准菌株DNA样品制备: 取各个菌的新鲜培养物,挑取半环菌落置于50 μL裂解液,充分悬浮后99 ℃水浴15 min,12 000 r/min离心10 min后取上清,即为粗提标准菌株DNA样品,-40 ℃保存备用。 1.3.2 实际样品DNA制备: 从各地采集的样品中每份取25 g置于225 mL mEC肉汤,根据GB/T4789.36-2008《食品微生物学检验大肠杆菌O157:H7/NM检验》[13]方法进行前处理及增菌,取增菌液1 mL到1.5 mL无菌离心管中,6 000 r/min离心5 min;弃上清,加入30 μL裂解液,悬浮后99 ℃水浴15 min,12 000 r/min离心10 min,取上清,即得样品粗提DNA,-40 ℃保存备用。 1.3.3 特异性试验: 用5株大肠杆菌O157:H7标准菌株和13株非大肠杆菌O157:H7标准菌株,分别制备其DNA样品。每份标准菌株DNA样品采用3个平行测试,操作方法严格按照试剂盒说明书(http://www.huankai.com/product/detail_105017001_100001015_100111153991255.html)进行,并与试剂盒所提供的阳性样品对比,反应后的反应液呈荧光绿色为阳性,浅橘红色为阴性。 1.3.4 灵敏度试验: 取大肠杆菌O157:H7标准菌株NTCT12900新鲜培养物,挑取一环菌落置于30 mL生理盐水中,振荡摇匀,使菌体均匀悬浮其中,并经生理盐水梯度稀释,稀释倍数分别为100、101、102、103、104、105、106、107、108倍,分别取以上不同稀释倍数的稀释液50 μL进行螺旋计数。同时取以上不同稀释倍数的稀释液制备DNA样品,具体方法为:分别取各个稀释倍数的稀释液50μL置于200 μL预灭菌PCR管中,6 000 r/min离心5 min;弃上清,加入12.5μL试剂盒中提供的裂解液,充分悬浮后经99 ℃水浴15 min,12 000 r/min离心10 min,取上清即得到各个稀释倍数的菌液所对应的DNA粗提样品。用大肠杆菌O157:H7快速检测试剂盒,取以上粗提DNA样品2.5 μL进行测试,其中每份DNA样品采用8个平行测试,与试剂盒提供的阳性样品对比,反应后的反应液呈荧光绿色为阳性,浅橘红色为阴性。另外,经琼脂糖凝胶电泳检测观察各个样品反应情况,与计数结果进行对比,并计算最低检验限。菌落计数方式参照GB4789.2-2010《食品微生物学检验菌落总数测定》[14],该试剂盒最低检验限(CFU)=(本试剂盒检测能检测到的最高稀释倍数的50 μL菌液对应的含菌量)/5。 1.3.5 实际样品检测: 取25 g经处理过后的样品置于225 mL mEC肉汤中,36±1 ℃分别培养10 h和18 h。取10 h的培养液经热裂解法获取DNA样品,用LAMP试剂盒进行测试。取18 h的培养液参照GB/T4789.36-2008方法进行测试,并对可疑菌落进行鉴定,然后进行统计分析。具体包括:(1) 检出特异性=该试剂盒检测和传统检测方法均为阴性结果例数/传统检测方法为阴性结果例数×100%;(2) 检出灵敏度=该试剂盒检测和传统检测方法均为阳性结果例数/传统检测方法为阳性结果例数×100%;(3) 检出准确度=(该试剂盒检测和传统检测方法均为阳性结果例数+该试剂盒检测和传统检测方法均为阴性结果例数)/被检测所有样品例数×100%,即表示该试剂盒检测和传统检测方法结果的一致性。 1.3.6 重复性验证: 参照1.3.4的灵敏度检测结果,选取大肠杆菌O157:H7标准菌株NTCT12900新鲜培养物,挑取一环菌落置于30 mL生理盐水中,振荡摇匀,使菌体均匀悬浮其中,并进一步经生理盐水稀释为101和105倍,经热裂解法获取相应的DNA样品,分别作为高菌量和低菌量目标菌检测样品,另外取无菌生理盐水作为阴性检测样品。用以上5批试制的检测试剂盒,每个批次分别取以上高菌量的目标菌检测样品、低菌量的目标菌检测样品及阴性检测样品各2.5 μL进行测试,每份DNA样品采用10个平行测试,其中,批间或批内检测重复性=批间或批内检测符合数/检测总数×100%。 1.3.7 保质期验证: 取5批试制的检测试剂盒置于4 ℃保存,分别于保存后1、3、6、9和12个月进行随机检测,均取1.3.6中的低菌量目标菌样品作为检测样品,每个批次的试剂盒取10个平行测试。 1.3.8 稳定性验证: 将5批试制的检测试剂盒与冰袋同时置于泡沫盒中,在42 ℃下储存96 h,每24 h对各个批次的检测试剂盒抽检一次,均取1.3.6中的低菌量目标菌样品作为检测样品,每个批次的试剂盒取10个平行测试。试剂盒中心的温度变化见图 1。
|
| 图 1 试剂盒中心的温度变化曲线 Figure 1 Temperature variation curve of the kit |
|
|
采用SPSS 19.0软件进行统计学整理和分析,计量资料以标准差(x±s)表示,进行t检验,计数资料则行χ2检验,P<0.05表示差异有统计学意义。
2 结果与分析 2.1 特异性试验5株大肠杆菌O157:H7标准菌株样品均显示明显荧光绿色,即为检测阳性;而13株非大肠杆菌O157:H7标准菌株样品仍为反应前的浅橘红色,即为检测阴性,而且以上平行测试结果一致,见表 1和图 2。
| 序号 Serial No. |
菌株名称 Strain |
菌株编号 Strain No. |
检测结果 Detection result |
| 1 | E. coli O157:H7 | ATCC35150 | + |
| 2 | E. coli O157:H7 | ATCC43889 | + |
| 3 | E. coli O157:H7 | ATCC700728 | + |
| 4 | E. coli O157:H7 | NTCT12900 | + |
| 5 | E. coli O157:H7 | CMCC(B)44828 | + |
| 6 | S. aureus | ATCC25923 | - |
| 7 | S. flexneri | CMCC(B)51572 | - |
| 8 | P. aeruginosa | ATCC9027 | - |
| 9 | E. faecali | ATCC29212 | - |
| 10 | E. sakazakii | ATCC29544 | - |
| 11 | V. parahaemolyticus | ATCC17802 | - |
| 12 | L. monocytogene | ATCC19115 | - |
| 13 | S. enteritidis | ATCC13076 | - |
| 14 | E. aerogenes | ATCC13048 | - |
| 15 | B. hemolytic streptococcus | ATCC21059 | - |
| 16 | B. subtilis | CMCC(B)63501 | - |
| 17 | E. coli | CMCC(B)44102 | - |
| 18 | S. pneumonia | CMCC(B)31001 | - |
| 注:+:LAMP检测显示明显的荧光绿,阳性;-:LAMP检测未出现颜色变化,阴性. Note: +: positive with obvious fluorescent green; -: negative with no color changes. | |||
稀释倍数在100-106时,对应的检测管均显示明显荧光绿色,即为检测阳性;而稀释倍数在107-108时,对应的检测管仍为反应前的浅橘红色,即为检测阴性,见图 3,以上平行测试结果一致。

|
| 图 3 灵敏度试验显色结果 Figure 3 Chromogenic result for sensitivity |
|
|
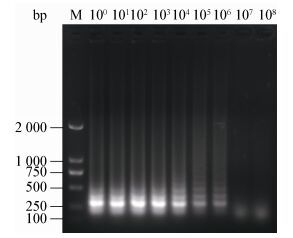
经琼脂糖凝胶电泳检测以上不同菌量样品对应的反应产物,如图 4所示,低于稀释倍数106的样品均能显示出现明显的梯状条带,结果表明该试剂盒最低检验限为29 CFU (稀释倍数为106)。
|
| 图 4 灵敏度试验显色产物对应电泳结果 Figure 4 Electrophoretic results of LAMP product in sensitivity test Note: M: DL2000 marker. |
|
|
通过对3类14种代表性食品进行检测,结果显示,在肉与肉制品、蔬菜和速冻类食品中,该试剂盒相对于传统检测方法的检出灵敏度均为100%,检出准确度分别为89.6%、96.9%和93.8%,总体的检出准确度为92.9% (表 2),总体上两种方法的检测结果具有较高的一致性,具体数据见表 2和表 3。
| 样品类型 Sample type |
检出特异性 Detection specificity (%) |
检出灵敏度 Detection sensitivity (%) |
检出准确度 Detection accuracy (%) |
| 肉与肉制品Meat and meat products | 86.1 | 100 | 89.6 |
| 蔬菜Vegetable | 96.7 | 100 | 96.9 |
| 速冻食品Quick-frozen food | 92.3 | 100 | 93.8 |
| 合计Total | 91.3 | 100 | 92.9 |
| 样品类型 Sample’s type |
样品名称 Sample’s name |
该试剂盒检测 By the kits |
传统方法检测 By the traditional methods |
| 肉与肉制品Meat and meat products | 猪肉 | 6/8 | 4/8 |
| 羊肉 | 1/8 | 1/8 | |
| 牛肉 | 2/8 | 1/8 | |
| 鸡肉 | 6/8 | 5/8 | |
| 腊肉 | 0/8 | 0/8 | |
| 猪肉糜 | 2/8 | 1/8 | |
| 合计 | 17/48 | 12/48 | |
| 蔬菜Vegetable | 西红柿 | 0/8 | 0/8 |
| 生菜 | 1/8 | 1/8 | |
| 香菜 | 1/8 | 0/8 | |
| 黄瓜 | 1/8 | 1/8 | |
| 合计 | 3/32 | 2/32 | |
| 速冻食品Quick-frozen food | 饺子 | 4/8 | 2/8 |
| 冻鸡腿 | 1/8 | 1/8 | |
| 冻鸡翅 | 2/8 | 2/8 | |
| 牛肉卷 | 1/8 | 1/8 | |
| 合计Total | 8/32 | 6/32 |
对高菌量的目标菌和阴性菌样品的检测中,该试剂盒批间以及批内检测重复率均为100%;对低菌量的目标菌样品的检测中,5批试剂盒批内检测重复率分别为90%、90%、100%、100%和90%,批间检测重复率为94%,见表 4。
| 批次 Batches |
阴性检测样品 Negative samples |
低浓度检测样品 Low concentration samples |
高浓度检测样品 High concentration samples |
| 20150313 | 0/10 | 9/1 | 10/0 |
| 20150412 | 0/10 | 9/1 | 10/0 |
| 20150511 | 0/10 | 10/0 | 10/0 |
| 20150610 | 0/10 | 10/0 | 10/0 |
| 20160712 | 0/10 | 9/1 | 10/0 |
保质期内各个月份的所有检测反应后均能出现明显荧光绿色,不同保存时间段的检测效率均为100%,批间差异不明显(P>0.05),见表 5。
| 保存时间(月) Time (months) |
荧光绿例数/抽检例数 Fluorescent green cases/Total cases (n/n) |
检测效率 Detection efficiency (%) |
||||
| 20150313 | 20150412 | 20150511 | 20150610 | 20150712 | ||
| 1 | 10/10 | 10/10 | 10/10 | 10/10 | 10/10 | 100 |
| 3 | 10/10 | 10/10 | 10/10 | 10/10 | 10/10 | 100 |
| 6 | 10/10 | 10/10 | 10/10 | 10/10 | 10/10 | 100 |
| 9 | 10/10 | 10/10 | 10/10 | 10/10 | 10/10 | 100 |
| 12 | 10/10 | 10/10 | 10/10 | 10/10 | 10/10 | 100 |
模拟不同时间段的所有检测反应后均能出现明显荧光绿色,不同储存时间段的检测效率均为100%,批间差异不明显(P>0.05),见表 6。
| 储藏时间(小时) Time (h) |
荧光绿例数/抽检例数 Positive cases/negative cases (n/n) |
检测效率 Detection efficiency (%) |
||||
| 20150313 | 20150412 | 20150511 | 20150610 | 20150712 | ||
| 24 | 10/10 | 10/10 | 10/10 | 10/10 | 10/10 | 100 |
| 48 | 10/10 | 10/10 | 10/10 | 10/10 | 10/10 | 100 |
| 72 | 10/10 | 10/10 | 10/10 | 10/10 | 10/10 | 100 |
| 96 | 10/10 | 10/10 | 10/10 | 10/10 | 10/10 | 100 |
LAMP技术是一种新型核酸扩增技术,鉴于其恒温、高效等特点,扩增效率大大优于PCR技术。但其反应体系更加复杂[15],一般需要将各个成分配置成相关溶液,致使操作繁琐。加之LAMP反应普遍较PCR更为灵敏,应用过程中防止污染十分必要,而过于频繁的操作也易导致相关试剂、检测区间的污染,致使假阳性结果的发生。另外,在LAMP反应体系中,部分试剂需要冷冻储存(如LAMP引物、dNTPs、Bst DNA聚合酶),尤其是其核心成分Bst DNA聚合酶要求在-20 ℃条件下储存,
温度过高会直接造成酶活性丧失,从而无法达到检测效果。本研究通过工艺设计,将试剂盒中需要冷冻储存的试剂进行干粉化。保质期验证实验表明,该试剂盒在4 ℃条件下能保存较长时间(9个月),但不建议保存更长时间;短期温度变化(0-42 ℃)稳定性验证实验表明,该试剂盒能适应较长时间(多达72 h)以及较高温度(42 ℃)环境存储,稳定性较好,从而便于长途运输,但为保证检测效果,不建议长期储存以及过长时间运输。总体上,该试剂盒能适应高温长途运输,其使用操作也大大简化,降低了相应成本,方便现场应用。另外,对LAMP反应结果的判读,之前相关研究中多有提及,主要包括经琼脂糖凝胶电泳检测观察其反应产物梯状条带,以及经肉眼直接观察反应产物,如LAMP反应体系中的Mg2+会与反应产物焦磷酸结合形成焦磷酸镁,产生白色混浊物,但有时该浊度不便观察,需借助仪器帮助;反应产物双链DNA可结合荧光染料SYBR Green I染色,如有扩增产物时,反应变绿色,反之,仍为橙色。但该染料价格较高,且操作时需反应后开盖加入,会造成额外的气溶胶污染[16],可能影响其他反应结果。本研究中采用经配比优化的钙黄绿素-Mn2+指示剂,价格低廉、颜色观察效果明显,且在反应前加入指示剂,使结果判读更加方便、可靠。
传统大肠杆菌O157:H7检验参照GB/ T4789.36-2008[13],如一般被运用的常规培养法是根据大肠杆菌O157:H7的培养特性、形态学特征、生化特征、血清学试验进行属(种)的鉴定;免疫磁珠捕获技术是通过对大肠杆菌O157:H7进行选择性的增菌,然后利用免疫磁珠进行选择性捕获,后将磁性颗粒涂布到选择性琼脂平板上进行分离。以上过程操作复杂且耗时长(一般3-5 d),且需要各种试剂及培养基等,大大提高了检测成本。另外,标准中提到的全自动酶联荧光免疫分析仪筛选法是基于在自动VIDAS仪器上进行双抗体夹心酶联荧光免疫分析的检测方法;全自动病原菌检测系统筛选法则是利用PCR扩增并检测细菌DNA中特异性片段来判断目标菌的存在,以上均需要复杂的试剂及仪器,操作流程以及结果判读复杂,尤其是难以在基层检验单位推行。然而本试剂盒是针对大肠杆菌O157:H7靶基因设计引物,在恒温条件下可达到快速扩增,整个检测流程简单(前期仅需通过热裂解获取食品样品DNA,加之试剂反应时间仅需50 min左右),并且可直接通过肉眼观察得出结果,加之本实验验证结果也表明该试剂盒的特异性、灵敏度、准确度、重复性等指标均较好。
此外,利用本试剂盒与传统检测方法对采集自各个地区的实际食品样品进行同步检测,其结果具有较高的一致性。通常食品中的大肠杆菌O157:H7含量较少[17],因此在实际检测中有可能因样品采集不当、增菌效果不佳等因素导致漏检[18],而GB/T4789.36-2008[13]中提到通过应用免疫磁珠捕获法对样品中目标进行富集,以提高其检测效率[19],本试剂盒将来也有望通过与免疫磁珠捕获法相结合,并进一步优化检测结果。总之,本研究参照商品化食品检测试剂盒评价方法[20]和食品微生物检验方法确认技术规范[21]提供的评价方案,证实了该试剂盒能够满足在基层现场快速检测的需求,具有广阔的应用前景。
| [1] |
Ogura Y, Ooka T, Asadulghani, et al. Extensive genomic diversity and selective conservation of virulence-determinants in enterohemorrhagic Escherichia coli strains of O157 and non-O157 serotypes[J]. Genome Biology, 2007, 8(7): R138. DOI:10.1186/gb-2007-8-7-r138 |
| [2] |
Fernandez-Brando RJ, Miliwebsky E, Mejías MP, et al. Shiga toxin-producing Escherichia coli O157:H7 shows an increased pathogenicity in mice after the passage through the gastrointestinal tract of the same host[J]. Journal of Medical Microbiology, 2012, 61: 852-859. DOI:10.1099/jmm.0.041251-0 |
| [3] |
Vugia D, Cronquist A, Hadler J, et al. Preliminary FoodNet Data on the incidence of infection with pathogens transmitted commonly through Food-10 sites, United States, 2004[J]. Mmwr Morbidity and Mortality Weekly Report, 2007, 54(14): 352-356. |
| [4] |
Xu K. 2003-2012 Chinese intestinal analysis of Escherichia coli O157:H7 pathogenic microbiology bibliometrics[J]. The Journal of Medical Theory and Practice, 2014, 27(4): 425-427. (in Chinese) 徐奎. 2003-2012年中国肠出血性大肠杆菌O157:H7病原微生物学文献计量学分析[J]. 医学理论与实践, 2014, 27(4): 425-427. |
| [5] |
Yang JC, Jing HQ, Wan M, et al. Aetiological analysis and study on E. coli O157:H7 in epidemic area[J]. China Public Health, 2002, 18(8): 970-971. (in Chinese) 杨晋川, 景怀琦, 万马, 等. 对流行地区的E. coli O157:H7病原学分析及研究[J]. 中国公共卫生, 2002, 18(8): 970-971. DOI:10.11847/zgggws2002-18-08-42 |
| [6] |
Zhang J, Xia SL, Hong MA. The epidemiological investigation on infection cases of Shiga's Toxin-Producing E. coli O157:H7 in Easten Henan, China[J]. Strait Journal of Preventive Medicine, 2003, 9(5): 26-28. |
| [7] |
Karpac CA, Lee A, Kunnel BS, et al. Endemic Esherichia coli O157:H7 infections and hemolytic-uremic syndrome in Oklahoma, 2002-2005[J]. Journal of the Oklahoma State Medical Association, 2007, 100(11): 429-433. |
| [8] |
Torres AG, Kaper JB. Multiple elements controlling adherence of Enterohemorrhagic Escherichia coli O157:H7 to HeLa cells[J]. Infection & Immunity, 2003, 71(9): 4985-4995. |
| [9] |
Amani J, Ahmadpour A, Fooladi AAI, et al. Detection of E. coli O157:H7 and Shigella dysenteriae toxins in clinical samples by PCR-ELISA[J]. Brazilian Journal of Infectious Diseases, 2015, 19(3): 278-284. DOI:10.1016/j.bjid.2015.02.008 |
| [10] |
Safavieh M, Ahmed MU, Ng A, et al. High-throughput real-time electrochemical monitoring of LAMP for pathogenic bacteria detection[J]. Biosensors and Bioelectronics, 2014, 58: 101-106. DOI:10.1016/j.bios.2014.02.002 |
| [11] |
Notomi T, Okayama H, Masubuchi H, et al. Loop-mediated isothermal amplification of DNA[J]. Nucleic Acids Research, 2000, 28(12): e63. DOI:10.1093/nar/28.12.e63 |
| [12] |
Tomita N, Mori Y, Kanda H, et al. Loop-mediated isothermal amplification (LAMP) of gene sequences and simple visual detection of products[J]. Nature Protocols, 2008, 3(5): 877. DOI:10.1038/nprot.2008.57 |
| [13] |
The Ministry of Health of the People's Republic of China, China National Standardization Management Committee. GB/T 4789.36-2008 Microbiological examination of food hygiene-Examination of Escherichia coli O157:H7/NM[S]. Beijing: China Standards Press, 2008(in Chinese) 中华人民共和国卫生部, 中国国家标准化管理委员会. GB/T4789. 36-2008食品微生物学检验: 大肠埃希氏菌O157: H7/NM检验[S]. 北京: 中国标准出版社, 2008 |
| [14] |
The Ministry of Health of the People's Republic of China. GB 4789.2-2010 National food safety standard Food microbiological examination:Aerobic plate count[S]. Beijing: China Standards Press, 2010(in Chinese) 中华人民共和国卫生部. GB 4789. 2-2010食品安全国家标准食品微生物学检验: 菌落总数测定[S]. 北京: 中国标准出版社, 2010 |
| [15] |
Zhang XH, He KW, Ye Q, et al. Establishment of loop-mediated isothermal amplification technique for rapid detection of E. coli O157[J]. Chinese Journal of Veterinary Science, 2013, 33(7): 1027-1031. (in Chinese) 张雪寒, 何孔旺, 叶青, 等. 快速检测大肠杆菌O157的LAMP方法的建立与评价[J]. 中国兽医学报, 2013, 33(7): 1027-1031. |
| [16] |
Chu YN, Feng LY, Zhang JY, et al. A systematic review of the research progress and improvement of loop-mediated isothermal amplification[J]. Microbiology China, 2015, 42(4): 729-735. (in Chinese) 初亚男, 封利颖, 张婕妤, 等. 环介导等温扩增技术改进的研究进展[J]. 微生物学通报, 2015, 42(4): 729-735. |
| [17] |
Mori Y, Kanda H, Notomi T. Loop-mediated isothermal amplification (LAMP): recent progress in research and development[J]. Journal of Infection and Chemotherapy, 2013, 19(3): 404-411. DOI:10.1007/s10156-013-0590-0 |
| [18] |
Jin X, Xu HY, Xie JH, et al. Progress in detection of foodborne pathogen Escherichia coli O157:H7[J]. Food Science and Technology, 2015, 40(5): 339-343. (in Chinese) 金鑫, 许恒毅, 谢建华, 等. 食源性致病大肠杆菌O157:H7检测方法研究进展[J]. 食品科技, 2015, 40(5): 339-343. |
| [19] |
Zhao L, Xu ZQ, Zhou YP, et al. Application of immunize magnetic beads in the jsolation of E. coli O157:H7 and PCR detection of its virulence genes[J]. Chinese Journal of Veterinary Medicine, 2015, 51(5): 77-79. (in Chinese) 赵璐, 苏战强, 周银萍, 等. 免疫磁珠法分离大肠杆菌O157:H7及毒力基因的PCR检测[J]. 中国兽医杂志, 2015, 51(5): 77-79. |
| [20] |
The State Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China. SN/T 2775-2011 Evaluation method of commercial food testing kit[S]. Beijing: China Standards Press, 2011(in Chinese) 中华人民共和国国家质量监督检验检疫总局. SN/T 2775-2011商品化食品检测试剂盒评价方法[S]. 北京: 中国标准出版社, 2011 |
| [21] |
The State Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China. SN/T 3266-2012 Technical specification for validation of microbiological examination of food products[S]. Beijing: China Standards Press, 2013(in Chinese) 国家质量监督检验检疫总局. SN/T 3266-2012食品微生物检验方法确认技术规范[S]. 北京: 中国标准出版社, 2013 |
 2017, Vol. 44
2017, Vol. 44