扩展功能
文章信息
- 孔祥雪, 李宝珍, 杨金水
- KONG Xiang-Xue, LI Bao-Zhen, YANG Jin-Shui
- 微藻去除重金属镉的抗性机理研究进展
- Research progress in microalgae resistance to cadmium stress
- 微生物学通报, 2017, 44(8): 1980-1987
- Microbiology China, 2017, 44(8): 1980-1987
- DOI: 10.13344/j.microbiol.china.170172
-
文章历史
- 收稿日期: 2017-03-01
- 接受日期: 2017-05-02
- 优先数字出版日期(www.cnki.net): 2017-05-09
镉(Cd)是严重污染水体的重金属元素之一,主要来源于电镀、冶炼、合金制造、塑料、电池、采矿、肥料生产等[1]。Cd对人体的毒性仅次于汞和铅,人长期食用Cd污染的食物会引起痛痛病(即骨癌病)和肾衰竭。2004年1月1日至2013年12月,我国共发生Cd污染事件19起。国务院发布的《“十三五”国家食品安全规划》中明确强调“十三五”期间将严格推进重金属污染源头治理,因此水体中重金属Cd的去除至关重要。
常见的重金属处理方法有化学沉降、离子螯合、活性炭吸附和离子交换法[2-3],但这些方法不仅复杂、昂贵,而且应用起来还会受技术和经济条件的限制[4]。然而生物吸附所用的生物材料具有廉价、环保、易回收金属离子等优点,使其具有明显的优势[5]。因此,生物吸附技术在重金属处理方面受到了广泛的关注。
具有吸收重金属能力的生物有多种,如植物、真菌、细菌和微藻。微藻种类多、分布广、适应性强、价廉易得、对重金属具有较高的吸附能力[6],而且微藻具有高的含油量(含量占细胞干重的10%-80%),是生产生物柴油的绝佳材料[7]。Yang等[8]研究了Cd胁迫下产油微藻Chlorella minutissima UTEX 2341对Cd的吸附积累能力和产油能力,发现其在吸附Cd的同时胞内油脂含量可以达到20.98% (对照为10.82%),是对照组的1.9倍以上,而且提取后的油脂中Cd含量极低,为微克级,符合中国柴油的生产标准。因此,采用水体重金属的微藻吸附技术同时耦合微藻柴油的生产技术,不仅可以提升污水处理的经济效益,而且可以促进微藻柴油的产业化发展。但是目前对Cd抗性机理的研究多以细菌、真菌、植物为主,以微藻为对象的研究较少,因此本文针对目前关于微藻抗Cd胁迫的研究成果进行综述,以期对今后该领域的研究提供帮助。主要集中在以下3个方面:(1) Cd胁迫对微藻叶绿素和细胞结构的影响;(2) Cd的胞外吸附积累机理;(3) Cd的胞内积累脱毒机理。
1 不同微藻去除Cd的性能比较微藻是需要用显微镜观察的微型藻类的总称,占藻种的70%,多数属于绿藻门和硅藻门。影响微藻去除重金属的因素很多,如微藻种类、生物量及其细胞大小,pH,温度,与重金属的接触时间,重金属的初始浓度,其他有竞争性的金属离子的存在等[5]。每种微藻由于自身生理特性的原因而对Cd的耐受能力不同,即使同一属的微藻对Cd的耐受能力也有很大差异,如Cd对扁藻属的Tetraselmis gracilis和Tetraselmis suecica的半抑制浓度(EC50)分别为1.8 mg/L和7.9 mg/L[9]。此外,耐受能力高的微藻对Cd的去除能力不一定高。Folgar等研究了杜氏盐藻Dunaliella salina对Cd的耐受能力与去除能力的关系,发现Dunaliella salina具有较高的耐受能力(EC50:48.9 mg/L),但其对Cd的去除量仅有0.565 mg/L[9]。对几种不同绿藻和硅藻去除Cd的能力进行比较,具体如表 1所示。从表 1中可以看出,不同藻种对Cd的去除能力存在很大的差异。其中硅藻Chaetoceros calcitrans对Cd的去除量可达1 055.27 mg/g,比细菌Staphylococcus xylosus (250 mg/g)高出3倍;绿藻Chlorella minutissima UTEX 2341和Scenedesmus abundans对Cd也具有很好的去除能力。因此筛选高Cd去除能力的藻种并以其为研究材料,无论是对微藻抗Cd机制的研究,还是高效微藻生物吸附剂的开发,都是十分必要的。
| 藻 Algae |
pH | 镉去除量 Cd removal (mg/g) |
年份 Year |
|
| 硅藻 Diatom |
Navicula pelliculosa | - | ~0.025 | 2009[10] |
| Planothidium lanceolatum | 7.0 | 275.510 | 2012[11] | |
| Chaetoceros calcitrans | 8.0 | 1 055.270 | 2012[12] | |
| Phaeodactylum tricornutum | 8.2 | 67.100 | 2014[13] | |
| 绿藻 Green algae |
Scenedesmus abundans | 8.0 | 574.000 | 2009[14] |
| Scenedesmus obliquus | 7.0 | 0.087 | 2009[14] | |
| Desmodesmus pleiomorphus (ACOI 561) | 4.0 | 85.300 | 2010[15] | |
| Desmodesmus pleiomorphus (L) | 4.0 | 61.200 | 2010[15] | |
| Tetraselmis suecica | - | 40.220 | 2010[16] | |
| Scenedesmus quadricauda | - | 24.960 | 2011[17] | |
| Pseudochlorococcum typium | 7.0 | 5.480 | 2012[18] | |
| Tetraselmis chuii | 8.0 | 13.460 | 2012[12] | |
| Chlorella vulgaris | 6.6 | 3.600 | 2014[19] | |
| Chlorella minutissima UTEX 2341 | 6.0 | 303.030 | 2015[8] | |
| Chlorella sorokiniana | 5.0 | 29.080 | 2016[20] |
光合作用是植物生长发育的基础,是植物生长的物质和能量来源。Cd胁迫能够影响微藻细胞叶绿素含量和细胞结构的变化,进而影响光合作用和藻的生长。
2.1 Cd胁迫对叶绿素含量的影响有研究表明低浓度的Cd不影响藻体的生长或对微藻生长有略微的促进作用。Nowicka等[21]研究发现,1.12 mg/L CdCl2胁迫Chlamydomonas reinhardtii一周后,其叶绿素的合成几乎不受影响。Shanab等[18]研究了拟绿球藻Pseudochlorococcum typicum、栅藻Scenedesmus quadricauda var. quadrispina (Chlorophyta)对5-100 mg/L Cd的抗性及去除能力,结果表明低浓度的Cd (5-20 mg/L)可促进叶绿素a的合成。但是低浓度Cd促进叶绿素合成的作用机理目前尚不清楚。Cheng等[22]研究了不同浓度Cd对绿藻Chlorella vulgaris的胁迫影响,发现随着Cd含量的增加,叶绿素a、b和类胡萝卜素的含量减少,在Cd含量为7 mg/L时藻的生长受到抑制,此时叶绿素a、b和类胡萝卜素含量分别下降93.37%、74.32%和71.88%。Nowicka等[21]研究发现Chlamydomonas reinhardtii在11.24 mg/L CdCl2胁迫培养一周后,50%的叶绿素合成受到抑制,当Cd浓度达到22.48 mg/L时,叶绿素完全降解。孔祥雪[23]发现Auxenochlorella protothecoides UTEX 2341在224.82 mg/L Cd胁迫培养120 h时叶绿素含量相比对照下降了11.25%;337.23 mg/L Cd胁迫下叶绿素的含量相比对照下降了57.5%。这一方面证实了高浓度Cd胁迫确实可破坏叶绿素的合成,另一方面也证实了Auxenochlorella protothecoides UTEX 2341对Cd具有较强的耐受能力,在高浓度Cd存在条件下叶绿素的抑制程度远远低于已有研究报道。
2.2 Cd胁迫对微藻细胞结构的影响Cd胁迫能够导致微藻细胞器发生退化或形态呈现多样化等。Shanab等[18]采用10 mg/L Cd胁迫拟绿球藻Pseudochlorococcum typicum 48 h后观察,在其细胞表面观察到高电子密度图层,同时淀粉颗粒在蛋白核周围大量积累且细胞器发生衰退。作者认为细胞表面的高电子密度图层是藻在Cd胁迫下的一种自我保护机制,同时淀粉颗粒的积累是其细胞器(叶绿体、蛋白核、线粒体)衰退后的一种能量储存形式。Wang等[24]对Cd胁迫96 h的小球藻Chlorella pyrenoidosa进行超微结构观察,发现对照中的细胞器易于区分,结构完整而清晰。相反,Cd胁迫的藻细胞结构明显破坏,胞质异质化、空泡化,液泡形态呈现多样化,细胞壁也发生了改变。Yang等[8]采用透射电镜观察了Chlorella minutissima UTEX 2341在67.45 mg/L Cd胁迫下的形态特征,发现正常藻细胞呈圆形,表面较光滑,细胞内部及外部均无明显高电子密度颗粒;Cd胁迫下大部分细胞器解体不易区分,细胞壁和细胞内部出现明显的电子密度较高的Cd的聚集体,表明藻细胞可通过胞外吸附和胞内聚集降低Cd对细胞的毒性。
虽然Cd可引起微藻细胞结构的破坏,但微藻可通过以下方式来解除镉的毒性作用。(1) 细胞表面的快速被动吸附:该过程不需要代谢活动,速度快,可逆。该过程中重金属被吸附在细胞表面的功能基团上,从而避免Cd进入胞内造成破坏;(2) 细胞外到内的慢速主动运输:该过程为代谢依赖的过程,速度慢,不可逆。包括金属离子经过细胞膜的运输进入胞内细胞器中积累,或者和胞内富含巯基的复合物结合从而脱毒[15]。当胞外吸附不足以应对过量的重金属时,胞内机制开启脱毒功能[25]。
3 Cd的胞外吸附机理微藻细胞抵抗Cd胁迫的第一道防线为细胞壁,其在微藻吸附Cd的过程中起着重要的作用。Chojnacka等[26]认为藻细胞壁的组分如肽聚糖、糖醛酸、磷壁酸、多糖、蛋白质,这些物质均属于聚合电解质,聚合电解质携带的带电基团对于不同金属有不同的亲和力和特异性,能通过物理吸附、离子交换、化学吸附、络合、螯合、微沉降和截留作用结合环境中的Cd并形成沉淀,这一过程不需要代谢活动,速度快,可逆,从而阻止Cd进入细胞产生毒性。
Belghith等[27]发现在150 mg/L Cd胁迫下,杜氏盐藻的细胞表面大约吸附了95%的Cd离子。Macfie等[28]研究了有细胞壁的莱茵衣藻和无细胞壁的莱茵衣藻对Cd的吸附能力,发现有细胞壁的莱茵衣藻吸附的Cd量是无细胞壁莱茵衣藻的2倍左右。Santiago-Martínez等[29]研究了纤细裸藻Euglena gracilis对Cd的吸附依赖于细胞壁的组分,发现可能具有结合Cd离子能力的氨基酸(谷氨酸,天冬氨酸,半胱氨酸)和一些糖类(木糖,鼠李糖,海藻糖)所占比例较高。
4 Cd的胞内脱毒机理重金属对生物的毒性一部分体现在胞内产生的活性氧(ROS)对细胞造成的氧化胁迫。在正常条件下,生物体内产生的活性氧与其清除系统保持平衡,当细胞处于Cd胁迫时会刺激ROS的过量产生。Cd通过与一些抗氧化酶类和谷胱甘肽(GSH)的巯基基团等活性位点结合而导致生物抗氧化防御系统的失活,从而间接地诱导ROS的产生。藻类的抗氧化系统由抗氧化酶和抗氧化剂组成,在胁迫条件下,抗氧化酶和抗氧化剂的活性提高,抗氧化系统得到增强,从而增加对逆境的抗性。此外,进入到细胞内的Cd离子可以被一些金属螯合物如植物螯合素PCs、金属硫蛋白类似物MTs-like、GSH等所结合形成稳定的金属复合物,或者被进一步运输至亚细胞器如液泡、叶绿体中,降低金属离子对细胞质的毒性。
4.1 抗氧化防御系统藻类的抗氧化系统包括抗氧化酶和抗氧化剂。抗氧化酶主要包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)、谷胱甘肽还原酶(GR)等。SOD是活性氧清除反应过程中第一个发挥作用的抗氧化酶,能将超氧化物阴离子自由基(O2∙-)快速歧化为过氧化氢(H2O2)和分子氧,随后,H2O2在过氧化氢酶(CAT)、各种过氧化物酶和抗坏血酸/谷胱甘肽循环系统的作用下转变为水和分子氧。抗氧化剂主要包括维生素C (抗坏血酸)、还原性谷胱甘肽(GSH)、类胡萝卜素(CAR)、生育酚(维生素E)、脯氨酸等,其中抗坏血酸和谷胱甘肽对清除活性氧有相当重要的作用。Okamoto等[30]发现纤细裸藻在Cd浓度为1.5 mg/L和3.0 mg/L时SOD活性分别提高了41%和107%。Figueira等[31]发现在0.2 mg/L Cd胁迫下硅藻Nitzschia palea的SOD、CAT活性和GSH含量明显增加,表明细胞处于一个高度氧化胁迫水平。Cheng等[22]研究表明随着Cd浓度的增加Chlorella vulgaris中SOD、CAT、GR的活性先增加后降低,当Cd浓度为0.5 mg/L时SOD和CAT的活性达到最大,分别提高了34.18%和38.79%;当Cd浓度为1 mg/L时GR的活性达到最高,提高了92.38%;当Cd浓度增加为7 mg/L时SOD、CAT、GR的活性显著低于对照。本课题组孔祥雪[23]发现高Cd胁迫确实可显著降低绿藻Auxenochlorella protothecoides UTEX 2341胞内SOD和CAT的活性,在224.82 mg/L Cd胁迫120 h时SOD、CAT的活性与对照相比分别降低了38.2%和69.98%,表明微藻的抗氧化酶活性与重金属浓度之间具有一定的剂量相关性。
Belghith等[27]发现100 mg/L Cd胁迫下,杜氏盐藻胞内一些具有抗氧化能力的次级代谢产物如多酚类、黄酮类和类胡萝卜素类含量增加。Haghighi等[32]研究了Cd胁迫下蓝藻的类胡萝卜素含量的变化,发现随着Cd浓度的增加,类胡萝卜素增加,指出类胡萝卜素不仅能够保护光合作用,还能够清除体内的ROS,保护细胞免受重金属的毒害作用。本课题组[23]也发现在224.82 mg/L Cd胁迫Auxenochlorella protothecoides UTEX 2341 96 h时总类胡萝卜素(CAR)含量相比于对照增加了41.67%,进一步证实了绿藻可通过增加胞内抗氧化剂CAR的含量抵抗Cd的毒性。Hasan等[33]发现当抑制番茄胞内GSH合成后,细胞内ROS含量增加,此时,添加外源GSH能够减小Cd造成的毒性。本课题组的孔祥雪[23]也发现Cd胁迫对绿藻Auxenochlorella protothecoides UTEX 2341 GSH含量有显著的影响(P≤0.05),Cd胁迫使GSH含量显著增加,随着Cd浓度的增加,胞内GSH含量持续增加,在337.23 mg/L Cd胁迫120 h时GSH的含量与对照相比增加了479.41%,并通过添加GSH合成关键酶的特异性抑制剂L-丁硫氨酸-亚砜亚胺(BSO)证实了GSH在绿藻抗Cd过程中起着重要作用。
4.2 胞内螯合作用Cd对巯基有较强的亲和力,因此Cd可以被富含巯基的蛋白如PCs (植物螯合素)所结合,从而降低自由Cd离子对细胞的毒害作用[34]。PCs是一种小的金属结合肽(2-10 kD),它以谷胱甘肽为底物由植物螯合素合酶(PCS)催化形成,大部分藻类均能合成PCs。Wang等[35]发现Cd胁迫硅藻Thalassiosira nordenskioldii 15 d后,胞内PC3和PC4的含量增加。Santiago-Martínez等[29]发现纤细裸藻Euglena gracilis为了响应Cd胁迫,其GSH、PCs和Cys含量明显增加,胞内硫化物的含量也增加。Figueira等[31]研究了0.1和0.2 mg/L Cd胁迫下硅藻Nitzschia palea中PC对Cd的螯合效率,发现胞内75.2%-91.2%的Cd被PCs螯合。Morelli等[36]发现三角褐指藻在短期Cd胁迫下几乎50%的谷胱甘肽转化为PC,且将Cd胁迫下的藻转至正常培养基中,PC含量降低、谷胱甘肽含量升高,进一步阐明了金属-PC络合物的降解和释放机制。
金属硫蛋白(MT)分子量较低(6-7 kD),富含半胱氨酸,不含芳香族氨基酸,具有金属结合能力,在1957年由Vallee首次发现。Yoshida等[37]发现Chlorella sorokiniana ANA9在100 mg/L Cd胁迫4 d后胞内出现了MT-like蛋白。Huang等[38]发现当Cd浓度小于9 mg/L时,随着Cd浓度的增加,Chlorella vulgaris中MT-like蛋白含量也增加,在Cd浓度为6.74 mg/L时MT-like蛋白含量达到最大,而杜氏盐藻在100 mg/L Cd胁迫下,胞内总的MT含量增加了29倍[27]。Perales-Vela等[39]发现Cd能够诱导Scenedesmus subspicatus和Thalassiosira weissflogii产生MtⅢ,长链MtⅢ能够结合重金属形成稳定的复合物。Han等[40]将紫羊茅的MT-like基因转化进入莱茵衣藻叶绿体中,发现转基因藻株的Cd结合能力增强,且Cd胁迫3 d下转基因藻株的IC50比对照高55.43%。综上所述,Cd胁迫对MT的产生有一定的剂量诱导效应,但是Cd胁迫对MT的调控机制还有待于进一步研究。
5 Cd胁迫下微藻的组学研究近些年来,随着测序技术的发展,各种组学技术,尤其是转录组学技术被广泛应用于生态毒理学的研究领域。Jamers等[41]研究发现在Cd胁迫条件下,莱茵衣藻中与氧化胁迫相关的基因转录情况发生了不同程度的上调,与谷胱甘肽合成代谢相关的代谢物也发生了较大的变化。Puente-Sánchez等[42]在杜氏盐藻中也发现Cd胁迫下与微藻光合作用相关,与转移酶活性相关,与色素、类囊体膜、细胞壁和液泡膜相关,以及与氧化胁迫、谷胱甘肽合成相关的转录本均得到上调。Brembu等[43]发现Cd胁迫时,硅藻中与金属转运、细胞信号、脱毒有关蛋白的基因发生了明显的转录调控变化,并进一步预测ATPase5-1B能够将Cd运至细胞外,VIT1/CCC1能够将Cd扣押在液泡中。除了采用转录组学分析Cd胁迫下的基因调控变化,Gillet等[44]采用蛋白组学的方法研究了Cd胁迫下莱茵衣藻胞内蛋白水平的变化,发现和光合作用、卡尔文循环、叶绿素合成相关的酶类表达下调,与谷胱甘肽合成、ATP代谢、氧化胁迫响应、蛋白折叠相关的蛋白表达上调。这些研究虽然为阐明微藻抗Cd的机理奠定了一定理论基础,但仍需进一步从基因功能调控和蛋白功能互作方面做深入研究。
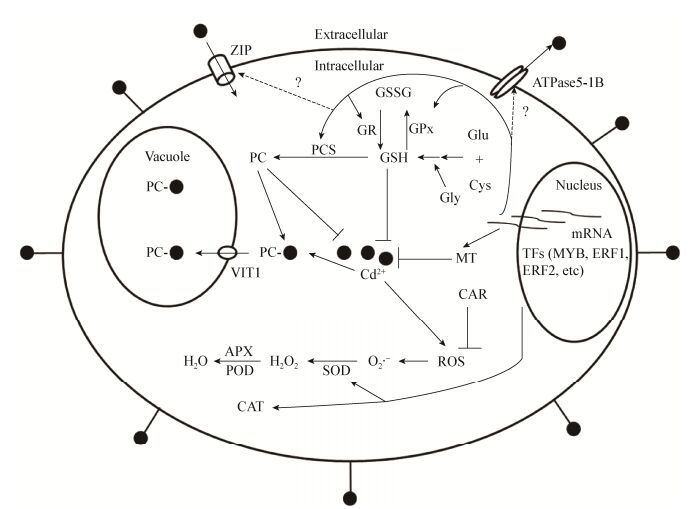
6 小结和展望综上所述,微藻抗Cd的机理可概括如下:(1) 细胞壁上的功能基团如羧基、羟基、氨基、巯基、磷酸根等是微藻抗Cd的第一防线;(2) 微藻胞内的金属螯合物如PCs和MTs是降低胞内游离Cd毒性的重要保障;(3) 微藻胞内的抗氧化酶类如SOD、CAT、APX和抗氧化剂GSH、ASA、CAR是清除胞内Cd的又一保障;(4) 微藻全基因组的整体代谢网络调控是保障藻体活性的关键。基于以上分析我们建立了微藻去除Cd的机理模型(图 1)。
|
图 1 微藻去除镉的机理模型
Figure 1 The model of Cd removal by microalgae
注:ROS:活性氧;SOD:超氧化物歧化酶;APX:抗坏血酸过氧化物酶;POD:过氧化物酶;CAT:过氧化氢酶;MT:金属硫蛋白;PC:植物螯合素;PCS:植物螯合素合酶;GR:谷胱甘肽还原酶;GPx:谷胱甘肽过氧化物酶;GSH:还原型谷胱甘肽;GSSG:氧化型谷胱甘肽;CAR:类胡萝卜素;VIT1,ZIP,ATPase5-1B:金属转运蛋白;TFs:转录因子;●:Cd2+; :细胞表面的功能基团吸附Cd2+.
Note: ROS: Reactive oxygenspecies; SOD: Superoxide dismutase; APX: Ascorbate peroxidase; POD: Peroxidase; CAT: Catalase; MT: Metallothionein; PC: Phytochelatin; PCS: Phytochelatin synthase; GR: Glutathione reductase; GPx: Glutathione peroxidase; GSH: Reduced glutathione; GSSG: Oxidized glutathione; CAR: Carotenoids; VIT1, ZIP, ATPase5-1B: Metal transporters; TFs: Transcription factor; ●: Cd2+; :细胞表面的功能基团吸附Cd2+.
Note: ROS: Reactive oxygenspecies; SOD: Superoxide dismutase; APX: Ascorbate peroxidase; POD: Peroxidase; CAT: Catalase; MT: Metallothionein; PC: Phytochelatin; PCS: Phytochelatin synthase; GR: Glutathione reductase; GPx: Glutathione peroxidase; GSH: Reduced glutathione; GSSG: Oxidized glutathione; CAR: Carotenoids; VIT1, ZIP, ATPase5-1B: Metal transporters; TFs: Transcription factor; ●: Cd2+;  : Cd2+ sorption by the functional groups of cellsurface. : Cd2+ sorption by the functional groups of cellsurface.
|
|
|
虽然目前对微藻抗Cd胁迫的机理研究已经取得了一定的进展,但尚有许多方面需要深入研究:(1) 由于大多数重金属是亲水性的,因此其经过亲脂性的膜进入细胞及亚细胞器的相关转运蛋白仍然没有明确的报道;(2) Cd胁迫下,微藻合成MTs和PCs清除ROS的具体作用机制及Cd-PCs的形成、转运和贮存仍不清楚;(3) 低浓度Cd促进微藻生长,高浓度Cd抑制微藻生长的分子机理仍不清楚;(4) 微藻Cd胁迫下的信号传递通路并不清楚。对以上问题的深入研究,将有助于最终阐明微藻抗Cd分子机理。
| [1] |
Bayramoglu G, Arica MY. Preparation of a composite biosorbent using Scenedesmus quadricauda biomass and alginate/polyvinyl alcohol for removal of Cu(Ⅱ) and Cd(Ⅱ) ions: isotherms, kinetics, and thermodynamic studies[J]. Water, Air, & Soil Pollution, 2011, 221(1/4): 391-403. |
| [2] |
Ahluwalia SS, Goyal D. Microbial and plant derived biomass for removal of heavy metals from wastewater[J]. Bioresource Technology, 2007, 98(12): 2243-2257. DOI:10.1016/j.biortech.2005.12.006 |
| [3] |
Bhattacharya AK, Mandal SN, Das SK. Adsorption of Zn(Ⅱ) from aqueous solution by using different adsorbents[J]. Chemical Engineering Journal, 2006, 123(1/2): 43-51. |
| [4] |
Liang S, Guo XY, Feng NC, et al. Effective removal of heavy metals from aqueous solutions by orange peel xanthate[J]. Transactions of Nonferrous Metals Society of China, 2010, 20(S1): s187-s191. |
| [5] |
Hansda A, Kumar V, Anshumali. A comparative review towards potential of microbial cellsfor heavy metal removal with emphasis on biosorptionand bioaccumulation[J]. World Journal of Microbiology and Biotechnology, 2016, 32: 170. DOI:10.1007/s11274-016-2117-1 |
| [6] |
Singh R, Sinha S. Bioremediation of heavy metals by algae: a review on evaluation of low cost and high performance biosorbents[J]. Indian Journal of Agricultural Biochemistry, 2013, 26(1): 1-9. |
| [7] |
García-García JD, Sánchez-Thomas R, Moreno-Sánchez R. Bio-recovery of non-essential heavy metals by intra-and extracellular mechanisms in free-living microorganisms[J]. Biotechnology Advances, 2016, 34(5): 859-873. DOI:10.1016/j.biotechadv.2016.05.003 |
| [8] |
Yang JS, Cao J, Xing GL, et al. Lipid production combined with biosorption and bioaccumulation of cadmium, copper, manganese and zinc by oleaginous microalgae Chlorella minutissima UTEX 2341[J]. Bioresource Technology, 2015, 175: 537-544. DOI:10.1016/j.biortech.2014.10.124 |
| [9] |
Folgar S, Torres E, Pérez-Rama M, et al. Dunaliella salina as marine microalga highly tolerant to but a poor remover of cadmium[J]. Journal of Hazardous Materials, 2009, 165(1/3): 486-493. |
| [10] |
Irving EC, Baird DJ, Culp JM. Cadmium toxicity and uptake by mats of the freshwater diatom: Navicula pelliculosa (Bréb) Hilse[J]. Archives of Environmental Contamination and Toxicology, 2009, 57(3): 524-530. DOI:10.1007/s00244-009-9299-6 |
| [11] |
Sbihi K, Cherifi O, El Gharmali A, et al. Accumulation and toxicological effects of cadmium, copper and zinc on the growth and photosynthesis of the freshwater diatom Planothidium lanceolatum (Brébisson) Lange-Bertalot: a laboratory study[J]. Journal of Materials and Environmental Science, 2012, 3(3): 497-506. |
| [12] |
Sjahrul M, Arifin. Phytoremediation of Cd2+by marine phytoplanktons, Tetracelmis chuii and Chaetoceros calcitrans[J]. International Journal of Chemistry, 2012, 4(1): 69-74. |
| [13] |
Torres E, Mera R, Herrero C, et al. Isotherm studies for the determination of Cd(Ⅱ) ions removal capacity in living biomass of a microalga with high tolerance to cadmium toxicity[J]. Environmental Science and Pollution Research, 2014, 21(22): 12616-12628. DOI:10.1007/s11356-014-3207-y |
| [14] |
Monteiro CM, Castro PML, Malcata FX. Use of the microalga Scenedesmus obliquus to remove cadmium cations from aqueous solutions[J]. World Journal of Microbiology and Biotechnology, 2009, 25(9): 1573-1578. DOI:10.1007/s11274-009-0046-y |
| [15] |
Monteiro CM, Castro PML, Malcata FX. Cadmium removal by two strains of Desmodesmus pleiomorphus cells[J]. Water, Air, and Soil Pollution, 2010, 208(1/4): 17-27. |
| [16] |
Pérez-Rama M, Torres E, Suárez C, et al. Sorption isotherm studies of Cd(Ⅱ) ions using living cells of the marine microalga Tetraselmis suecica (Kylin) Butch[J]. Journal of Environmental Management, 2010, 91(10): 2045-2050. DOI:10.1016/j.jenvman.2010.05.014 |
| [17] |
Kızılkaya B, Türker G, Akgül R, et al. Comparative study ofbiosorption of heavy metals using living green algae Scenedesmus quadricauda and Neochloris pseudoalveolaris: equilibrium and kinetics[J]. Journal of Dispersion Science and Technology, 2012, 33(3): 410-419. DOI:10.1080/01932691.2011.567181 |
| [18] |
Shanab S, Essa A, Shalaby E. Bioremoval capacity of three heavy metals by some microalgae species (Egyptian Isolates)[J]. Plant Signaling & Behavior, 2012, 7(3): 392-399. |
| [19] |
de Abreu FCP, da Costa PNM, Brondi AM, et al. Effects of cadmium and copper biosorption on Chlorella vulgaris[J]. Bulletin of Environmental Contamination and Toxicology, 2014, 93(4): 405-409. DOI:10.1007/s00128-014-1363-x |
| [20] |
Petrovič A, Simonič M. Removal of heavy metal ions from drinking water by alginate-immobilised Chlorella sorokiniana[J]. International Journal of Environmental Science and Technology, 2016, 13(7): 1761-1780. DOI:10.1007/s13762-016-1015-2 |
| [21] |
Nowicka B, Pluciński B, Kuczyńska P, et al. Physiological characterization of Chlamydomonas reinhardtii acclimated to chronic stress induced by Ag, Cd, Cr, Cu and Hg ions[J]. Ecotoxicology and Environmental Safety, 2016, 130: 133-145. DOI:10.1016/j.ecoenv.2016.04.010 |
| [22] |
Cheng JF, Qiu HC, Chang ZY, et al. The effect of cadmium on the growth and antioxidant response for freshwater algae Chlorella vulgaris[J]. SpringerPlus, 2016, 5: 1290. DOI:10.1186/s40064-016-2963-1 |
| [23] |
Kong XX. Mechanism of cadmium resistance in oil microalgae Auxenochlorella protothecoidesUTEX 2341[D]. Beijing: Master's Thesis of China Agricultural University, 2017(in Chinese) 孔祥雪. 产油微藻Auxenochlorella protothecoides UTEX 2341抗镉机理的初步研究[D]. 北京: 中国农业大学硕士学位论文, 2017 |
| [24] |
Wang SZ, Zhang DY, Pan XL. Effects of cadmium on the activities of photosystems of Chlorella pyrenoidosa and the protective role of cyclic electron flow[J]. Chemosphere, 2013, 93(2): 230-237. DOI:10.1016/j.chemosphere.2013.04.070 |
| [25] |
Moenne A, González A, Sáez CA. Mechanisms of metal tolerance in marine macroalgae, with emphasis on copper tolerance in Chlorophyta and Rhodophyta[J]. Aquatic Toxicology, 2016, 176: 30-37. DOI:10.1016/j.aquatox.2016.04.015 |
| [26] |
Chojnacka K, Chojnacki A, Górecka H. Biosorption of Cr3+, Cd2+ and Cu2+ ions by blue-green algae Spirulina sp.: kinetics, equilibrium and the mechanism of the process[J]. Chemosphere, 2005, 59(1): 75-84. DOI:10.1016/j.chemosphere.2004.10.005 |
| [27] |
Belghith T, Athmouni K, Bellassoued K, et al. Physiological and biochemical response of Dunaliella salina to cadmium pollution[J]. Journal of Applied Phycology, 2016, 28(2): 991-999. DOI:10.1007/s10811-015-0630-5 |
| [28] |
Macfie SM, Welbourn PM. The cell wall as a barrier to uptake of metal ions in the unicellular green alga Chlamydomonas reinhardtii (Chlorophyceae)[J]. Archives of Environmental Contamination and Toxicology, 2000, 39(4): 413-419. DOI:10.1007/s002440010122 |
| [29] |
Santiago-Martínez MG, Lira-Silva E, Encalada R, et al. Cadmium removal by Euglena gracilis is enhanced under anaerobic growth conditions[J]. Journal of Hazardous Materials, 2015, 288: 104-112. DOI:10.1016/j.jhazmat.2015.02.027 |
| [30] |
Okamoto OK, Asano CS, Aidar E, et al. Effects of cadmium on growth and superoxide dismutaseactivity of the marine microalga Tetraselmis gracilis (Prasinophyceae)[J]. Journal of Phycology, 1996, 32(1): 74-79. DOI:10.1111/j.0022-3646.1996.00074.x |
| [31] |
Figueira E, Freitas R, Guasch H, et al. Efficiency of cadmium chelation by phytochelatins in Nitzschia palea (Kützing) W. Smith[J]. Ecotoxicology, 2014, 23(2): 285-292. DOI:10.1007/s10646-013-1172-8 |
| [32] |
Haghighi O, Shahryari S, Ebadi M, et al. Limnothrix sp. KO05: a newly characterized cyanobacterial biosorbent for cadmium removal: the enzymatic and non-enzymatic antioxidant reactions to cadmium toxicity[J]. Environmental Toxicology and Pharmacology, 2017, 51: 142-155. DOI:10.1016/j.etap.2017.03.008 |
| [33] |
Hasan MK, Liu CC, Wang FN, et al. Glutathione-mediated regulation of nitric oxide, S-nitrosothiol and redox homeostasis confers cadmium tolerance by inducing transcription factors and stress response genes in tomato[J]. Chemosphere, 2016, 161: 536-545. DOI:10.1016/j.chemosphere.2016.07.053 |
| [34] |
Lehninger AL. Mitochondria and calcium ion transport[J]. Biochemical Journal, 1970, 119(2): 129-138. DOI:10.1042/bj1190129 |
| [35] |
Wang MJ, Wang WX. Cadmium sensitivity, uptake, subcellular distribution and thiol induction in a marine diatom: exposure to cadmium[J]. Aquatic Toxicology, 2011, 101(2): 377-386. DOI:10.1016/j.aquatox.2010.11.014 |
| [36] |
Morelli E, Scarano G. Synthesis and stability of phytochelatins induced by cadmium and lead in the marine diatom Phaeodactylum tricornutum[J]. Marine Environmental Research, 2001, 52(4): 383-395. DOI:10.1016/S0141-1136(01)00093-9 |
| [37] |
Yoshida N, Ishii K, Okuno T, et al. Purification and characterization of cadmium-binding protein from unicelluar alga Chlorella sorokinian[J]. Current Microbiology, 2006, 52(6): 460-463. DOI:10.1007/s00284-005-0328-z |
| [38] |
Huang ZY, Li LP, Huang GL, et al. Growth-inhibitory and metal-binding proteins in Chlorella vulgaris exposed to cadmium or zinc[J]. Aquatic Toxicology, 2009, 91(1): 54-61. DOI:10.1016/j.aquatox.2008.10.003 |
| [39] |
Perales-Vela HV, Peña-Castro JM, Cañizares-Villanueva RO. Heavy metal detoxification in eukaryotic microalgae[J]. Chemosphere, 2006, 64(1): 1-10. DOI:10.1016/j.chemosphere.2005.11.024 |
| [40] |
Han SH, Hu ZL, Lei AP. Expression and function analysis of the metallothionein-like (MT-like) gene from Festuca rubra in Chlamydomonas reinhardtii chloroplast[J]. Science in China Series C: Life Sciences, 2008, 51(12): 1076-1081. DOI:10.1007/s11427-008-0136-3 |
| [41] |
Jamers A, Blust R, de Coen W, et al. An omics based assessment of cadmium toxicity in the green alga Chlamydomonas reinhardtii[J]. Aquatic Toxicology, 2013, 126: 355-364. DOI:10.1016/j.aquatox.2012.09.007 |
| [42] |
Puente-Sánchez F, Olsson S, Aguilera A. Comparative transcriptomic analysis of the response of Dunaliella acidophila (Chlorophyta) to short-term cadmium and chronic natural metal-rich water exposures[J]. Microbial Ecology, 2016, 72(3): 595-607. DOI:10.1007/s00248-016-0824-7 |
| [43] |
Brembu T, J rstad M, Winge P, et al. Genome-wide profiling of responses to cadmium in the diatom Phaeodactylum tricornutum[J]. Environmental Science & Technology, 2011, 45(18): 7640-7647. |
| [44] |
Gillet S, Decottignies P, Chardonnet S, et al. Cadmium response and redoxin targets in Chlamydomonas reinhardtii: a proteomic approach[J]. Photosynthesis Research, 2006, 89(2/3): 201-211. |
 2017, Vol. 44
2017, Vol. 44