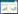扩展功能
文章信息
- 邓梦, 杨正凤, 黄遵锡, 戴利铭, 沈骥冬, 李俊俊, 唐湘华, 慕跃林, 周峻沛, 丁俊美, 韩楠玉, 吴倩, 许波
- DENG Meng, YANG Zheng-Feng, HUANG Zun-Xi, DAI Li-Ming, SHEN Ji-Dong, LI Jun-Jun, TANG Xiang-Hua, MU Yue-Lin, ZHOU Jun-Pei, DING Jun-Mei, HAN Nan-Yu, WU Qian, XU Bo
- 粪便微生物宏基因组来源的热稳定性邻苯二酚1, 2-双加氧酶异源表达及酶学性质
- Expression and characterization of thermostable catechol 1, 2-dioxygenase from a fecal microbial metagenome of Nycticebus pygmaeus
- 微生物学通报, 2017, 44(8): 1947-1957
- Microbiology China, 2017, 44(8): 1947-1957
- DOI: 10.13344/j.microbiol.china.160789
-
文章历史
- 收稿日期: 2016-10-31
- 接受日期: 2017-01-10
- 优先数字出版日期(www.cnki.net): 2017-01-11
2. 生物能源持续开发利用教育部工程研究中心 云南 昆明 650500;
3. 云南省生物质能与环境生物技术重点实验室 云南 昆明 650500;
4. 云南师范大学 酶工程重点实验室 云南 昆明 650500;
5. 云南省热带作物科学研究所 云南 景洪 666100
2. Engineering Research Center of Sustainable Development and Utilization of Biomass Energy, Ministry of Education, Kunming, Yunnan 650500, China;
3. Key Laboratory of Yunnan for Biomass Energy and Biotechnology of Environment, Kunming, Yunnan 650500, China;
4. Key Laboratory of Enzyme Engineering, Yunnan Normal University, Kunming, Yunnan 650500, China;
5. Yunnan Institute of Tropical Crops, Jinghong, Yunnan 666100, China
芳香族化合物普遍存在于自然界中,是煤、石油等化石燃料的天然组成成分,植物体也可产生多种酚类次生代谢产物;此外,工业生产过程中也会产生大量结构复杂的芳香烃类化合物[1]。芳香族化合物化学性质较稳定,难溶于水,因此一般很难消除,而且极低的含量即可对人体造成潜在、甚至强效的危害[2]。目前,微生物降解是沉积环境中多环芳烃去除最主要的途径。芳香族化合物的微生物降解是逐级降解的过程,首先多环芳烃在加氧酶的作用下开环形成单环芳烃,如邻苯二酚、原儿茶酸和龙胆酸等中间代谢物;而单环芳烃又在加氧酶的作用下进一步开环降解;催化单环芳香烃氧化的双加氧酶主要包括邻苯二酚1, 2-双加氧酶、邻苯二酚2, 3-双加氧酶、甲苯双加氧酶、苯甲酸P苯甲酸盐双加氧酶和原儿茶酸双加氧酶等,它们的主要作用是进一步降解苯的衍生物[3]。
邻苯二酚作为其中一种重要的中间代谢产物,其生物降解主要通过邻苯二酚双加氧酶催化[4]。邻苯二酚1, 2-双加氧酶属于内二元醇双加氧酶,它催化邻苯二酚转化为顺, 顺-己二烯二酸,使其在后续酶促反应中可进一步被降解为琥珀酸和乙酰辅酶A,并进入三羧酸循环,最终被降解为H2O和CO2,因此邻苯二酚1, 2-双加氧酶在微生物降解多种芳香族化合物的过程中有着重要作用[5]。此外,邻苯二酚的降解产物顺, 顺-己二烯二酸可作为精细化工原料用于生产特殊性能的工程塑料、树脂、尼龙等,以及合成抗菌素、抗阻胺剂、乳化剂等。目前,顺, 顺-己二烯二酸的商业化生产主要是以芳香族化合物出发,通过有机化学合成获得,对环境会造成污染[6]。可见,邻苯二酚1, 2-双加氧酶的开发利用具有重要意义。热稳定性的邻苯二酚1, 2-双加氧酶在一定温度条件下可长时间保持较高的酶活,在用于多环芳烃的降解及顺, 顺-己二烯二酸的酶法生产方面有其优势。然而,目前利用常规微生物培养法获得的热稳定性好的邻苯二酚1, 2-双加氧酶较少,如来源于Stenotrophomonas maltophilia strain KB2[7]、Candida albicans TL3[8]、Acinetobacter sp. Y64[9]等的邻苯二酚1, 2-双加氧酶。
传统的微生物纯培养技术使得占微生物种类99%以上的不可培养微生物无法分离获得,因此通过分离培养微生物来筛选新型酶的传统方法大大限制了筛选的广泛性和有效性[10-11]。宏基因组学避开了微生物分离培养的问题,极大地扩展了微生物资源的利用空间,为寻找和发现新的功能基因及生物催化剂——酶提供了新的研究策略[12]。前期研究发现,与其他动物相比倭蜂猴粪便微生物宏基因组中存在更高丰度和多样性的芳香化合物代谢系统[13]。本研究中,我们对已构建的宏基因组文库进行高通量测序,从中克隆得到一条邻苯二酚1, 2-双加氧酶基因catPLCgl,成功在大肠杆菌中进行异源表达,并研究其酶学性质。
1 材料与方法 1.1 主要试剂和仪器2×GC bufferⅠ、LA-Taq酶、dNTP mix,宝生物工程有限公司;Ni-NTA Agarose、Large-Construct Kit,Qiagen公司;质粒提取试剂盒,天根生化科技有限公司;Zymo Genomic DNA Clean & Concentration Kit、Zymoclean Gel DNA Recovery KitTM,北京天漠科技开发有限公司;顺, 顺-己二烯二酸标品、邻苯二酚标品,Sigma-Aldrich公司。NEBNext Ultra DNA Library Prep Kit、层析柱,NEB有限公司;HiSeq 2000高通量二代测序仪,Illumina公司;非接触式超声打断仪Biorupter,北京景晟科科技有限公司;Agilent2100生物分析仪,安捷伦科技有限公司;NanoDrop 2000超微量分光光度计、Qubit荧光定量仪、Qubit DNA Quantification Kit,赛默飞世尔科技有限公司;纯水仪,锐思捷科学仪器有限公司;细胞超声破碎仪,宁波新芝生物科技股份有限公司;离心机,Eppendorf公司;PCR仪、核酸电泳仪、蛋白电泳仪及凝胶成像仪,伯乐生命医学产品有限公司;紫外分光光度计,德国耶拿分析仪器股份公司;超高效液相色谱仪,沃特世科技有限公司。
1.2 样品、菌株和载体菌株Escherichia coli EPI300和载体pCC1FOS,EPICENTRE公司;Escherichia coli BL21(DE3),Novagen公司;大肠杆菌表达载体pEASY-E2,北京全式金生物技术有限公司。
1.3 基因克隆利用QIAGEN Large-Construct Kit,按试剂盒说明书步骤提取已构建的宏基因组文库的fosmid混合质粒。用Nanodrop 2000对基因组文库进行质量鉴定,初步检测其浓度及纯度;用Qubit对基因组浓度进行准确定量。将5μg的基因组DNA用非接触式超声打断仪Biorupter进行超声打断,用Zymo Genomic DNA Clean & Concentration Kit对打断的DNA片段进行纯化,纯化后用NEBNext Ultra DNA Library Prep Kit将DNA片段的末端补平;3′端加A碱基;DNA片段末端加接头Adapter;终止反应;对末端加过A碱基和接头的DNA片段进行纯化;用2%的核酸电泳进行检测,并对400–600 bp的DNA片段进行切胶回收,选择片段大小为500 bp左右的DNA片段进行PCR扩增(操作按试剂盒说明书进行)。用Agilent 2100和Qubit对文库片段进行大小和浓度定量,-20℃保存备用。用HiSeq 2000 DNA测序仪对上述制备好的文库进行基因组测序。将基因组测序得到的数据用Seqprep和Sickle软件分别去除接头和质量剪切优化数据,再使用SOAPdenovo 1.05 (Http://soap.genomics.org.cn/ soapdenovo.html)对处理后的优化序列进行拼接组装,获得Contig和Scaffold,组装后的序列经开放读码框预测和本地BLAST比对,将预测得到的结果与NR数据库进行比对得到注释信息,从而可得到邻苯二酚1, 2-双加氧酶基因catPLCgl。
以上述宏基因组fosmid文库混合质粒为模板,使用引物对WFCgl-C12OF (5′-ATGACTACGGGTA CAGACAATC-3′)和WFCgl-C12OR (5′-GTCCTCCT TGTCCAGTGCGAAG-3′)进行Touch-down PCR扩增获得目的基因catPLCgl。PCR反应体系:宏基因组文库的fosmid混合质粒0.5 μL,2×GC bufferⅠ 25.0 μL,2.5 mmol/L dNTP mix 4.0 μL,LA-Taq DNA Polymerase 1 U,10 μmol/L WFCgl-C12OF 1.0 μL,10 μmol/L WFCgl-C12OR 1.0 μL,ddH2O补足50.0 μL。PCR反应条件为:94 ℃ 5 min;94 ℃ 30 s,63 ℃ 30 s (每个循环降0.5 ℃),72 ℃ 1 min,20个循环;94 ℃ 30 s,53 ℃ 30 s,72 ℃ 1 min,10个循环;72℃ 7 min。
1.4 序列分析DNA之间和蛋白质之间的在线比对分别使用Blastn和Blastp (Http://blast.ncbi.nlm.nih.gov/Blast.cgi)。信号肽的预测使用SignalP 4.1 (Http://www.cbs.dtu.dk/services/SignalP/)[14]。蛋白二级结构分析使用NPS@:SOPMA (Https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)[15]。蛋白分子3D同源建模使用SWISS-MODEL (Http://swissmodel.expasy.org/)[16-18]。多序列比对使用MEGA 6.0,多序列比对结果美化使用ESPript 3.0 (Http://espript.ibcp.fr/ESPript/cgi-bin/ESPript.cgi)[19]。
1.5 酶重组表达系统的构建以宏基因组文库fosmid混合质粒DNA为模板进行PCR扩增,将PCR扩增得到的基因catPLCgl与表达载体pEASY-E2连接得到重组质粒pEASY-E2/catPLCgl,然后转化大肠杆菌BL21(DE3) 获得重组大肠杆菌菌株BL21(DE3)/catPLCgl。将获得的重组大肠杆菌菌株BL21(DE3)/catPLCgl送至金唯智基因测序中心测序验证序列。
1.6 蛋白的表达与纯化取含有重组表达载体pEASY-E2/catPLCgl的大肠杆菌菌株BL21(DE3)/catPLCgl,以0.1%的接种量接种于LB (含100 mg/L Amp)培养液中[20],37 ℃、180 r/min培养16 h。然后将活化的菌液以1%接种量接种到新鲜的LB (含100 mg/L Amp)培养液中,37 ℃、180 r/min振荡培养约2–3 h (OD600达到0.6–1.0) 后,加入终浓度0.7 mmol/L的IPTG诱导,于20 ℃、160 r/min继续振荡培养约20 h。9 500 r/min离心5 min,收集菌体。用适量的pH 7.0的Tris-HCl缓冲液悬浮菌体后,于冰浴条件下超声波破碎菌体(300 W,超声5 s,间隔7 s)。经4 ℃、12 000 r/min离心10 min后,吸取上清并用Ni-NTA Agarose纯化含6×His-tag的目的蛋白邻苯二酚1, 2-双加氧酶,将纯化后的蛋白进行12%的SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)分析。
1.7 邻苯二酚的降解产物分析取20 μL 150 mmol/L的邻苯二酚底物溶液和2.93 mL 50 mmol/L缓冲液,加入50μL适当稀释的纯化酶,混匀。以不加酶反应体系作为对照组,间隔5 min扫描反应体系在230 nm–300 nm波长范围内的吸光值,检测反应体系吸光值的变化。
在50 mmol/L pH 8.0的Tris-HCl缓冲液中加入终浓度为10 g/L的邻苯二酚和50 μL纯化的重组酶,总反应体积3 mL,以不加酶相同处理作为对照组。在37 ℃的水浴锅中反应1 h后12 000 r/min离心10 min,取上清,用3 kD的滤膜超滤,去除杂质后进行UPLC分析。UPLC检测条件:色谱柱选用Agilent zorbax SB-C18 (4.6 mm×250 mm,5 μm),流动相:甲醇/水溶液(2/8),进样量2 µL,柱温30 ℃,流速0.4 mL/min,PDA检测器,检测波长270 nm。
1.8 酶学性质分析 1.8.1 酶活性测定方法采用分光光度法[21]: 取10 μL 150 mmol/L邻苯二酚底物溶液(终浓度为0.5 mmol/L)和2.94 mL 50 mmol/L缓冲液在反应温度下预热3 min,加入50 μL适当稀释的酶液反应5 min,立即在260 nm波长下测定OD值。1个酶活单位(U)定义为在给定的条件下每分钟催化底物生成1 μmol相应产物所需的酶量,产物顺, 顺-己二烯二酸在260 nm处的摩尔消光系数为16 800 L/(mol·cm)。 1.8.2 酶最适底物测定: 将纯化的重组酶分别与0.5 mmol/L的邻苯二酚[260 nm,16 800 L/(mol·cm)]、3-甲基邻苯二酚[260 nm,18 000 L/(mol·cm)]、4-甲基邻苯二酚[255 nm,14 300 L/(mol·cm)]、4-氯基邻苯二酚[259 nm,12 500 L/(mol·cm)]、对苯二酚[320 nm,11 000 L/(mol·cm)]进行反应,分别测定不同浓度的底物(5–50 μmol/L)的酶活,计算比活。 1.8.3 酶最适pH及pH稳定性测定: 将纯化的重组酶在30℃下和pH 2.2–10.0的缓冲液中进行酶促反应,测定最适pH。将纯化的酶液置于pH 4.0–10.0的缓冲液中,在30 ℃下处理1 h,然后在pH 7.0及40℃下进行酶促反应,以未处理的酶液作为对照,测定pH稳定性。缓冲液为:50 mmol/L柠檬酸-磷酸氢二钠缓冲液(pH 2.2–8.0);50 mmol/L Tris-HCl (pH 8.0–9.0);50 mmol/L甘氨酸-NaOH (pH 9.0–10.0)。 1.8.4 酶最适温度及热稳定性测定: 在pH 7.0的缓冲液中,于0–60℃下进行酶促反应,测定最适温度。将同样酶量的酶液置于设定的温度(30、40、50或60 ℃)中处理1 h,或置于设定的温度(25℃和40 ℃)中处理210 h后,在pH 7.0及40 ℃下进行酶促反应,以未处理的酶液作为对照,测定热稳定性。 1.8.5 动力学参数测定: 在pH 7.0、温度40 ℃和一级反应时间下以不同浓度的邻苯二酚为底物(5–50 μmol/L)进行测定,根据Lineweaver-Burk法计算出Km、Vmax和kcat值。 1.8.6 酶的金属离子和化学试剂抗性测定: 在酶促反应体系中加入终浓度为1 mmol/L的Ag+、Li+、Ca2+、K+、Fe2+、Zn2+、Mg2+、Na+、Mn2+、Fe3+、Pb2+、Ni2+、Co2+、Cu2+、Hg2+、Al3+、EDTA、SDS、β-Mercaptoethanol和终浓度为0.5% (体积比)的Triton X-100、Tween-80在40 ℃和pH 7.0条件下,测定酶活,以不含金属离子和有机试剂的反应体系作为对照。 1.9 基因登录号catPLCgl收录于GenBank数据库,登录号为KU971297。
2 结果与分析 2.1 基因克隆和序列分析含有重组表达载体pEASY-E2/catPLCgl的大肠杆菌菌株BL21(DE3)/catPLCgl,基因全长852 bp,初始密码子ATG,终止密码子TGA,G+C含量48%,编码283个氨基酸,理论分子量为33.56 kD,理论等电点6.06,不含信号肽,序列分析结果显示与NCBI收录的邻苯二酚1, 2-双加氧酶氨基酸序列(WP_038549328) 最高相似性为95%,但未见其酶学性质报道。氨基酸序列预测显示CatPLCgl中α-螺旋、β-折叠以及无规则卷曲含量分别为21.91%、22.26%和43.46%,与NCBI数据库收录的部分邻苯二酚1, 2-双加氧酶基因进行多序列比对分析(图 1),CatPLCgl含有5个α-螺旋的N-末端结构域和含β-折叠的C-末端结构域的邻苯二酚1, 2-双加氧酶典型结构,以及典型的Fe3+结合位点Tyr-165、Tyr-199、His-223和His-225。
|
| 图 1 catPLCgl的多序列比对分析 Figure 1 Multiple sequence alignment analysis of catPLCgl 注:图中的序列来自于NCBI相似性比对的结果,并使用ClustalW排列,再用ESPript软件输出.其中WP_038549328来自于Corynebacterium glyciniphilum;ABS86780来自于Stenotrophomonas maltophilia strain KB2;AAK14065来自于Streptomyces griseus;AAC33003来自于Rhodococcus rhodochrous NCIMB13259;五角星标记的位置属于Fe3+结合位点. Note: Sequences retrieved from the NCBI server were aligned in ClustalW and rendered using ESPript output. WP_038549328 stem from Corynebacterium glyciniphilum; ABS86780 stem from Stenotrophomonas maltophilia strain KB2; AAK14065 stem from Streptomyces griseus; AAC33003 stem from Rhodococcus rhodochrous NCIMB13259; Five-pointed star indicate amino acid residues belonging to the Fe3+ binding site. |
|
|
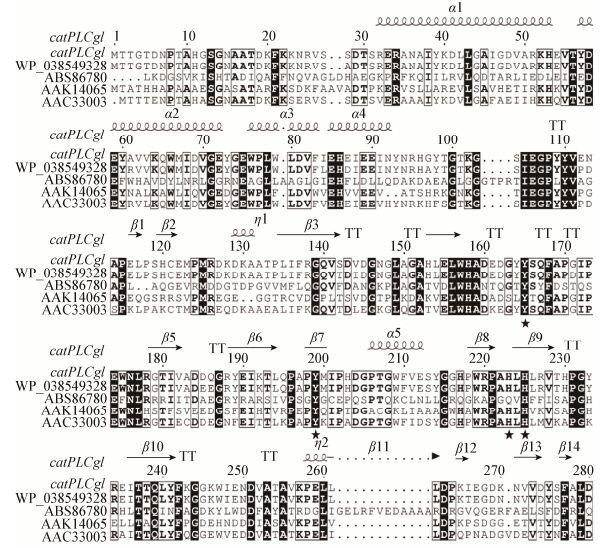
重组质粒pEASY-E2/catPLCgl成功转化大肠杆菌BL21(DE3),阳性克隆子经测序验证正确并在超声波破碎细胞液中得到含有重组CatPLCgl的上清粗酶液。经Ni-NTA Agarose树脂纯化后,纯化的重组CatPLCgl达到SDS-PAGE电泳纯,并具有邻苯二酚1, 2-双加氧酶酶活(图 2),重组CatPLCgl理论分子量为33.56 kD,实际分子量和理论分子量大小相符。
|
| 图 2 大肠杆菌中表达的重组酶的SDS-PAGE分析 Figure 2 SDS-PAGE analysis of recombinant CatPLCgl 注:1:重组CatPLCgl纯化蛋白;M:蛋白Marker;2:重组质粒表达. Note: 1: Recombinant CatPLCgl purified protein; M: Protein molecular weight marker; 2: Total proteins of E. coli BL21(DE3) harboring the recombinant plasmid pEASY-E2/catPLCgl. |
|
|
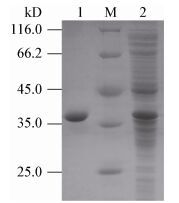
将纯化得到的目的蛋白与含有邻苯二酚的缓冲液混合,在230–300 nm波长范围内进行扫描;随着反应的进行,吸收峰在255–260 nm处不断增加,与理论一致,初步确定邻苯二酚的氧化产物为顺, 顺-己二烯二酸(图 3A)。
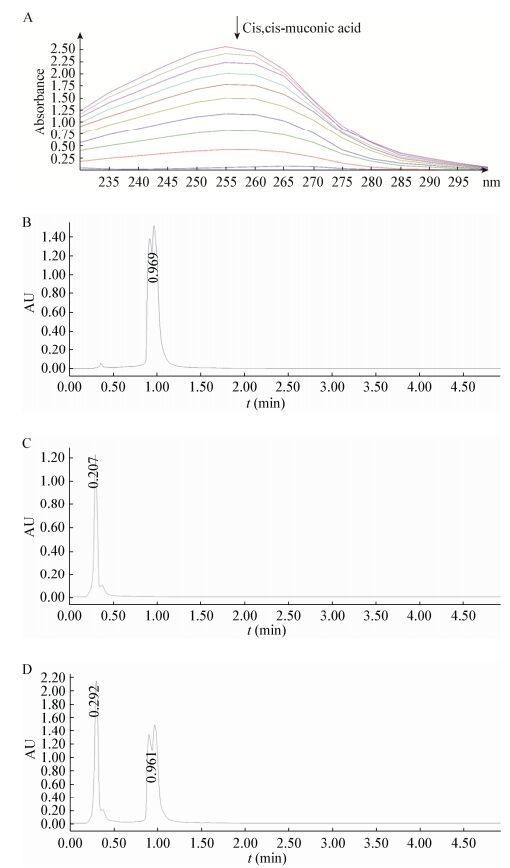
|
| 图 3 重组酶降解产物分析 Figure 3 The analysis of degradation product of recombinant CatPLCgl 注:A:邻苯二酚在重组CatPLCgl作用下转化为顺, 顺-己二烯二酸,每间隔5 min在260 nm处测定一次产物顺, 顺-己二烯二酸的吸光值;B:邻苯二酚标品;C:顺, 顺-己二烯二酸标品;D:邻苯二酚被重组CatPLCgl转化为顺, 顺-己二烯二酸. Note: A: With the effect of recombinant CatPLCgl, catechol was transformed into cis, cis-muconic acid. The reaction was initiated by the addition of 1 mmol/L catechol, followed by measuring the absorbance at 260 nm at time intervals of 5 min (up to 50 min). The black arrows point to the cis, cis-muconic acid; B: The results of UPLC analyses catechol standard sample; C: The results of UPLC analyses cis, cis-muconic acid standard sample; D: The results of catechol was degraded into cis, cis-muconic acid after incubation with recombinant CatPLCgl. |
|
|
UPLC分析结果显示反应体系中有两个明显的峰(图 3D),分别与邻苯二酚标品(图 3B)和顺, 顺-己二烯二酸标品(图 3C)的峰相对应,表明邻苯二酚的氧化产物确为顺, 顺-己二烯二酸。
2.4 重组酶酶学性质 2.4.1 最适底物: 在pH 7.0及40 ℃下,重组CatPLCgl对邻苯二酚的比活为8.3 U/mg,对4-甲基邻苯二酚和3-甲基邻苯二酚的比活分别为1.5 U/mg和6.9 U/mg,对4-氯基邻苯二酚和对苯二酚无酶活。 2.4.2 最适pH及pH稳定性: 以邻苯二酚为底物,重组CatPLCgl的最适pH为7.0,在pH 6.0–9.0之间可以保持58%以上酶活(图 4A);经pH 7.0–10.0的缓冲液处理1 h后,酶活剩余90%以上(图 4C)。

|
| 图 4 重组酶酶学性质分析 Figure 4 Characterization analysis of recombinant CatPLCgl 注:A:最适pH;B:最适温度;C:pH稳定性;D:温度稳定性;E:温度稳定性,重组酶在25 ℃和40 ℃分别耐受210 h. Note: A: Effect of pH on recombinant CatPLCgl; B: Effect of temperature on recombinant CatPLCgl; C: pH stability of recombinant CatPLCgl; D: Thermostability of recombinant CatPLCgl; E: Thermostability of recombinant CatPLCgl. The enzyme was incubated for 210 h at 25 ℃ and 40 ℃. |
|
|
| 离子 Reagent |
相对酶活 Relative activity (%) |
| None | 100.0±3.7 |
| Fe3+ | 118.6±5.7 |
| Mg2+ | 113.0±4.0 |
| Na+ | 112.7±1.9 |
| K+ | 111.8±5.8 |
| Ca2+ | 111.6±4.2 |
| Li+ | 109.7±4.4 |
| Pb2+ | 108.5±6.3 |
| Zn2+ | 107.5±4.5 |
| Co2+ | 105.8±0.3 |
| Al3+ | 103.7±7.5 |
| Ni2+ | 103.1±7.3 |
| Mn2+ | 93.4±1.2 |
| Fe2+ | 32.2±4.7 |
| Hg2+ | 18.4±3.0 |
| Cu2+ | 11.5±5.0 |
| Ag+ | 0.0±0.0 |
| β-Mercaptoethanol | 110.3±1.3 |
| EDTA | 98.4±2.4 |
| Tween-80 (0.5%, V/V) | 81.1±5.0 |
| Triton X-100 (0.5%, V/V) | 9.4±1.3 |
| SDS | 0.0±0.0 |
本研究得到了来自倭蜂猴粪便宏基因组文库的邻苯二酚1, 2-双加氧酶基因catPLCgl,并研究其重组酶酶学性质。获得的重组CatPLCgl对邻苯二酚类污染物表现出了较强活性,并可促使邻苯二酚开环生成顺, 顺-己二烯二酸。序列分析显示,酶具有典型的含5个α-螺旋的N-末端结构域和β-折叠的C末端结构域的邻苯二酚1, 2-双加氧酶结构,NCBI比对结果显示最高序列一致性为95%,但未见酶学性质研究报道。底物动力学参数显示,重组酶对3-甲基邻苯二酚和4-甲基邻苯二酚有较高活性,而对4-氯基邻苯二酚几乎没有活性;已报道的研究显示[12],邻苯二酚1, 2-双加氧酶可分为Ⅰ型和Ⅱ型两种类型,Ⅱ型基因主要出现在氯代芳香族化合物的降解途径中,而Ⅰ型基因几乎对氯代邻苯二酚没有降解能力,因此所获得的重组酶为Ⅰ型邻苯二酚1, 2-双加氧酶。
与其它微生物来源的邻苯二酚1, 2-双加氧酶进行比较(表 2),重组CatPLCgl最适pH为7.0,与已报道的Pseudomonas aeruginosa[22]、Stenotrophomonas maltophilia strain KB2[7]、Candida albicans TL3[8]等来源的邻苯二酚1, 2-双加氧酶最适pH相似;最适温度为40 ℃,与已报道的Stenotrophomonas maltophilia strain KB2和Pseudomonas aeruginosa相似,但比Candida albicans TL3、Rhodococcus sp. NCIM 2891[23]来源的邻苯二酚1, 2-双加氧酶相对较高;在0–60 ℃范围内有酶活,具有中低温酶活性,温度范围与Stenotrophomonas maltophilia strain KB2相似,但比Streptomyces setonii[24]温度范围广。温度稳定性研究发现,重组CatPLCgl表现出了较好的耐热性,在40 ℃条件处理210 h后酶活性几乎不变,与Candida albicans TL3和Rhodococcus sp. NCIM 2891相似,而Stenotrophomonas maltophilia strain KB2在30 ℃半衰期为3 h,Acinetobacter sp. Y64[9]在37 ℃处理2 h酶活损失10%。此外重组CatPLCgl还表现出了较好的耐碱性,在pH 7.0–10.0的碱性条件下处理1 h,酶活剩余90%以上,比来源于Candida albicans TL3和Rhodococcus sp. NCIM 2891的具有温度稳定性的邻苯二酚1, 2-双加氧酶具有更强的耐碱性(表 2)。
| 名称 Name |
来源 Origin |
革兰氏 Gram |
理论分子量 Molecular mass (kD) |
米氏常数 Km (μmol/L) |
最适温度 Optimal temperature (℃) |
最适pH Optimal pH |
温度特性 Temperature characteristic |
pH特性 pH characteristic |
底物特异性 Substrate specificity |
文献 Reference |
| C120 | Stenotrophomo nas maltophilia strain KB2 | G- | 34.50 | 12.8 | 40 (4-60) | 8.0 | Half-life of the enzyme at 40 ℃ was 3 h | - | Catechol 3-Methylcatechol 4-Methylcatechol |
[7] |
| C120 | Candida albicans TL3 | - | 31.00 | 9.3 | 25 | 8.0 | Stable when temperature lower than 40 ℃ after 30 min | Maintaining>85% activity at least 30 min at the pH range of 7.0-9.0 | Catechol 4-Methylcatechol |
[8] |
| C120 | Acinetobacter sp. Y64 | G- | 36.00 | 17.5 | 37 | 7.7 | Stable at 37 ℃ for 5 h and lost 10% activity after 2 h | Stable at pH 7.0 and 8.0 and lost only 18% of its activity after 6 h | Catechol 3-Methylcatechol 4-Methylcatechol 4-Nitrocatechol 1, 2, 4-Benzenetriol |
[9] |
| C120 | Pseudomonas aeruginosa TXU002 | G- | 22.00 | 5.9 | 40 | 7.0 | Stable at 40 ℃ after 1 h and retained 10% after treatment at 50 ℃ | Stable at the pH range of 7.0-9.0 after treatment at 4℃ for 24h | Catechol 3-Methylcatechol 4-Methylcatechol 4-Chlorocatechol Pyrogallol |
[22] |
| C120 | Rhodococcus sp. NCIM 2891 | G+ | 30.00 | 5.0 | 30 | 7.5 | Stable when temperature lower than 40 ℃ | Activity remainsup to>80% for 30 min between pH range of 7.0-9.0 | - | [23] |
| catA | Streptomyces setonii ATCC 39116 | G+ | - | 1.8 | 45 (25-65) |
- | - | - | Catechol 3-Methylcatechol 4-Methylcatechol |
[24] |
| CatPLCgl | Uncultured microorganisms | - | 33.56 | 24.9 | 40 (0-60) |
7.0 | Stable at 25 ℃ and 40 ℃ after 210 h | Activity remains up to>90% for 1 h between pH range of 7.0-10.0 | Catechol 3-Methylcatechol 4-Methylcatechol |
This study |
综上所述,宏基因组来源的重组CatPLCgl兼有温度稳定性和耐碱特性。结合重组CatPLCgl表现出的热稳定性和耐碱性可将其尝试用于芳香烃环境污染物的进一步降解和工业化生产顺, 顺-己二烯二酸,然而目前得到的重组CatPLCgl耐酸性不够好。因此,可通过分子定向进化技术改造出耐受范围更广、可降解底物范围更广、稳定性更好、降解效率更高的邻苯二酚1, 2-双加氧酶,以扩大其实际应用领域。
| [1] |
Zhang J, Xia CG. Studies of structure and function of aromatic hydrocarbon dioxygenases[J]. Progress in Chemistry, 2004, 16(1): 116-122. (in Chinese) 章俭, 夏春谷. 芳香烃双加氧酶的结构与功能研究[J]. 化学进展, 2004, 16(1): 116-122. |
| [2] |
Xu BW, Li SY, Zhang Q, et al. Advance in research on bacterial aromatic extradiol dioxygenase[J]. Chinese Journal of Applied and Environmental Biology, 2012, 18(5): 873-879. (in Chinese) 许炳雯, 李诗阳, 张强, 等. 细菌芳烃外二醇双加氧酶研究进展[J]. 应用与环境生物学报, 2012, 18(5): 873-879. |
| [3] |
Guo CL, Zheng TL. Biodegradation and bioremediation of polycyclic aromatic hydrocarbons[J]. Marine Environmental Science, 2000, 19(3): 24-29. (in Chinese) 郭楚玲, 郑天凌. 多环芳烃的微生物降解与生物修复[J]. 海洋环境科学, 2000, 19(3): 24-29. |
| [4] |
Zhou XM, Chen JJ, Geng LZ, et al. Advances in study on structure and function of catechol 2, 3-dioxygenase[J]. Biotechnology Bulletin, 2007(4): 51-54. (in Chinese) 周鑫淼, 陈洁君, 耿立召, 等. 邻苯二酚2, 3-双加氧酶的结构和功能研究进展[J]. 生物技术通报, 2007(4): 51-54. |
| [5] |
Yoon JH, Kang SS, Cho YG, et al. Rhodococcus pyridinivorans sp. nov., a pyridine-degrading bacterium[J]. International Journal of Systematic and Evolutionary Microbiology, 2000, 50(6): 2173-2180. DOI:10.1099/00207713-50-6-2173 |
| [6] |
Polen T, Spelberg M, Bott M. Toward biotechnological production of adipic acid and precursors from biorenewables[J]. Journal of Biotechnology, 2013, 167(2): 75-84. DOI:10.1016/j.jbiotec.2012.07.008 |
| [7] |
Guzik U, Hupert-Kocurek K, Sitnik M, et al. High activity catechol 1, 2-dioxygenase from Stenotrophomonas maltophilia strain KB2 as a useful tool in cis, cis-muconic acid production[J]. Antonie Van Leeuwenhoek, 2013, 103(6): 1297-1307. DOI:10.1007/s10482-013-9910-8 |
| [8] |
Tsai SC, Li YK. Purification and characterization of a catechol 1, 2-dioxygenase from a phenol degrading Candida albicans TL3[J]. Archives of Microbiology, 2007, 187(3): 199-206. DOI:10.1007/s00203-006-0187-4 |
| [9] |
Lin J, Milase RN. Purification and characterization of catechol 1, 2-dioxygenase from Acinetobacter sp. Y64 strain and Escherichia coli transformants[J]. The Protein Journal, 2015, 34(6): 421-433. DOI:10.1007/s10930-015-9637-7 |
| [10] |
Streit WR, Schmitz RA. Metagenomics——the key to the uncultured microbes[J]. Current Opinion in Microbiology, 2004, 7(5): 492-498. DOI:10.1016/j.mib.2004.08.002 |
| [11] |
Schmeisser C, Steele H, Streit WR. Metagenomics, biotechnology with non-culturable microbes[J]. Applied Microbiology and Biotechnology, 2007, 75(5): 955-962. DOI:10.1007/s00253-007-0945-5 |
| [12] |
Harayama S, Kok M, Neidle EL. Functional and evolutionary relationships among diverse oxygenases[J]. Annual Review of Microbiology, 1992, 46(1): 565-601. DOI:10.1146/annurev.mi.46.100192.003025 |
| [13] |
Xiong CY, Xu B, Dai LM, et al. Analysis gene diversity of phenol hydroxylase and catechol 1, 2-dioxygenase from fecal microbiome of Nycticebus pygmaeus[J]. Microbiology China, 2015, 42(11): 2189-2197. (in Chinese) 熊彩云, 许波, 戴利铭, 等. 倭蜂猴粪便微生物苯酚羟化酶和邻苯二酚1, 2-双加氧酶基因多样性研究[J]. 微生物学通报, 2015, 42(11): 2189-2197. |
| [14] |
Petersen TN, Brunak S, von Heijne G, et al. SignalP 4.0: discriminating signal peptides from transmembrane regions[J]. Nature Methods, 2011, 8(10): 785-786. DOI:10.1038/nmeth.1701 |
| [15] |
Sapay N, Guermeur Y, Deléage G. Prediction of amphipathic in-plane membrane anchors in monotopic proteins using a SVM classifier[J]. BMC Bioinformatics, 2006, 7(1): 255. DOI:10.1186/1471-2105-7-255 |
| [16] |
Berman HM, Westbrook J, Feng ZK, et al. The protein data bank[J]. Nucleic Acids Research, 2000, 28(1): 235-242. DOI:10.1093/nar/28.1.235 |
| [17] |
Guex N, Peitsch MC, Schwede T. Automated comparative protein structure modeling with SWISS-MODEL and Swiss-PdbViewer: a historical perspective[J]. Electrophoresis, 2009, 30(S1): S162-S173. DOI:10.1002/elps.v30.10s |
| [18] |
Biasini M, Bienert S, Waterhouse A, et al. SWISS-MODEL: modelling protein tertiary and quaternary structure using evolutionary information[J]. Nucleic Acids Research, 2014, 42(W1): W252-W258. DOI:10.1093/nar/gku340 |
| [19] |
Robert X, Gouet P. Deciphering key features in protein structures with the new ENDscript server[J]. Nucleic Acids Research, 2014, 42(W1): W320-W324. DOI:10.1093/nar/gku316 |
| [20] |
Sambrook J, Russell DW, Maccallum P, et al. Molecular Cloning: A Laboratory Manual[M]. 3rd Edition. NewYork: Cold Spring Harbor Laboratory Press, 2001.
|
| [21] |
Wojcieszyńska D, Guzik U, Greń I, et al. Induction of aromatic ring: cleavage dioxygenases in Stenotrophomonas maltophilia strain KB2 in cometabolic systems[J]. World Journal of Microbiology and Biotechnology, 2011, 27(4): 805-811. DOI:10.1007/s11274-010-0520-6 |
| [22] |
Wang CL, You SL, Wang SL. Purification and characterization of a novel catechol 1, 2-dioxygenase from Pseudomonas aeruginosa with benzoic acid as a carbon source[J]. Process Biochemistry, 2006, 41(7): 1594-1601. DOI:10.1016/j.procbio.2006.03.008 |
| [23] |
Nadaf NH, Ghosh JS. Purification and characterization of catechol 1, 2-dioxygenase from Rhodococcus sp. NCIM 2891[J]. Research Journal of Environmental and Earth Sciences, 2011, 3(5): 608-613. |
| [24] |
An HR, Park HJ, Kim ES. Cloning and expression of thermophilic catechol 1, 2-dioxygenase gene (catA) from Streptomyces setonii[J]. FEMS Microbiology Letters, 2001, 195(1): 17-22. DOI:10.1111/fml.2001.195.issue-1 |
 2017, Vol. 44
2017, Vol. 44