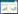扩展功能
文章信息
- 晏文岩, 鲁建飞, 孔善云, 沈兆媛, 杨雨清, 吕利群, 许丹
- YAN Wen-Yan, LU Jian-Fei, KONG Shan-Yun, SHEN Zhao-Yuan, YANG Yu-Qing, LÜ Li-Qun, XU Dan
- Ⅱ型鲤疱疹病毒ORF4的多克隆抗体制备及其组织分布
- Prokaryotic expression, polyclonal antibody preparation and tissue-tropism analysis of cyprinid herpesvirus Ⅱ non-structural protein ORF4
- 微生物学通报, 2017, 44(8): 1938-1946
- Microbiology China, 2017, 44(8): 1938-1946
- DOI: 10.13344/j.microbiol.china.170043
-
文章历史
- 收稿日期: 2017-01-15
- 接受日期: 2017-04-26
- 优先数字出版日期(www.cnki.net): 2017-05-09
2. 上海海洋大学 农业部淡水水产种质资源重点实验室 上海 201306;
3. 上海海洋大学 水产科学国家级实验教学示范中心 上海 201306
2. Shanghai 201306, China;
3. National Experimental Teaching Demonstration Center for Fishery Sciences, Shanghai Ocean University
异育银鲫(Carassius auratus gibelio)是我国主要的淡水养殖鱼类品种之一,其养殖地域广、产量高,在我国淡水养殖中有十分重要的地位[1]。随着异育银鲫养殖规模的持续扩大,集约化程度的不断提高,异育银鲫的病害问题日渐突出,特别是Ⅱ型鲤疱疹病毒感染异育银鲫引起的疱疹病毒性造血器官坏死病(Herpesviral haematopoietic necrosis,HVHN)频发,严重影响了我国异育银鲫养殖业的健康发展[2]。CyHV-2在分类上归属于鱼疱疹病毒科(Alloherpesviridae)鲤疱疹病毒属(Cyprinivirus)[3]。CyHV-2病毒粒子核衣壳为六边形,直径介于100 nm-110 nm之间[4],成熟的病毒粒子有呈椭圆形的囊膜,直径介于175 nm-200 nm之间,CyHV-2属于双链DNA病毒,基因组全长约290 304 bp,共编码156个蛋白[5-6]。CyHV-2与Ⅰ型鲤疱疹病毒(Cyprinid herpesvirus 1,CyHV-1) 和Ⅲ型鲤疱疹病毒(Cyprinid herpesvirus 3,CyHV-3) 同源性最近,与沟鲇疱疹病毒(Ictalurid herpesvirus 1,IcHV-1) 同源性较远[5]。目前,对CyHV-2的研究主要集中在分类鉴定、全基因组测序与注释、快速检测方法的建立等,对CyHV-2重要功能基因的研究和病毒免疫逃避机制的研究较少[7-9]。
肿瘤坏死因子(Tumor necrosis factor,TNF)通过与细胞表面肿瘤坏死因子受体1 (Tumor necrosis factor receptor 1,TNFR1) 和肿瘤坏死因子受体2 (Tumor necrosis factor receptor 2,TNFR2) 结合,可引起免疫反应、炎症反应、细胞增殖和细胞凋亡等[10]。许多大分子DNA病毒都可通过编码vTNFR来调控病毒复制,目前关于病毒编码的vTNFR的研究主要集中在痘病毒。疱疹病毒也能编码vTNFR,人巨细胞病毒编码的UL144含有疱疹病毒侵入介体(HVEM,TNFR superfamily member 14),UL144能通过NF-kB通路促进趋化因子CCL22的表达[11]。基于基因组信息分析表明,CyHV-2编码2个TNFR类似物基因(ORF4和ORF151A),而CyHV-1编码4个TNFR类似物基因(ORF129A、ORF136A、136B和ORF147A),CyHV-3编码2个TNFR类似物基因(ORF4和ORF12),CyHV-3编码的ORF12基因已被证明可能在病毒免疫逃逸机制中起着重要作用,由此我们推测CyHV-2编码的ORF4可能对CyHV-2感染的致病机制发挥重要作用[5]。
本实验针对CyHV-2编码的ORF4基因进行结构分析,在原核系统中表达出了重组GST-ORF4蛋白,并制备出了亲和力好、特异性高的多克隆抗体,通过Western blot等技术检测了ORF4的组织分布特性,且ORF4的组织分布情况与病毒复制水平呈正相关,为CyHV-2编码的ORF4蛋白功能的深入研究奠定基础。
1 材料与方法 1.1 实验材料 1.1.1 基因组DNA、质粒和菌株: CyHV-2病毒基因组DNA样品、PGEX-4T-3质粒由本实验室保存;大肠杆菌DH5α和BL21(DE3) 感受态细胞购自天根生化科技(北京)有限公司。 1.1.2 主要试剂和仪器及培养基: PrimeSTAR Max DNA Polymerase、限制性内切酶、T4连接酶、荧光定量PCR试剂购自TaKaRa公司;HRP标记的羊抗兔IgG多克隆抗体、HRP标记的羊抗鼠IgG多克隆抗体、GST-Tag单克隆抗体购自上海英基生物有限公司;6月龄的纯种新西兰白兔,质量2-3 kg,购自上海实验动物研究中心;异育银鲫购自上海海洋大学水产动物遗传育种中心,于实验室水族箱暂养2周后进行实验;血液/组织/细胞基因组提取试剂盒购自天根生化科技(北京)有限公司。净化工作台,上海博讯实业有限公司;旋涡混合仪,上海琪特分析仪器有限公司;恒温振荡培养床,上海博讯实业有限公司;振荡器,上海贺德试验设备有限公司;琼脂糖凝胶电泳仪、凝胶成像系统、聚丙烯酰胺凝胶电泳仪、免疫印迹电转仪,上海天能科技有限公司;PCR仪、CFX96荧光定量PCR仪,伯乐生命医学产品有限公司。LB培养基、PBS溶液和含5%牛奶的PBST溶液配制方法参照孔善云等[1]。 1.2 生物信息学分析及进化树构建参照GenBank上发表的Ⅱ型鲤疱疹病毒ORF4基因序列,选用在线软件SMART (http://smart.embl-heidelberg.de/)对CyHV-2 ORF4的氨基酸序列进行保守结构域预测。选用在线Blastx (https://www.ncbi.nlm.nih.gov/)软件对CyHV-2 ORF4的核苷酸序列进行同源性搜索;选择其他病毒,如Ⅲ型鲤疱疹病毒ORF4 (YP_001096043.1)、新加坡石斑鱼虹彩病毒(Singapore grouper iridovirus,SIGV ORF50 (AAV91053.1)、黏液瘤病毒(Myxoma virus,MV) T2 (NP_051879.1)、人巨细胞病毒(Human cytomegalovirus,HCMV) UL144 (AAD43177.1) 及Scale drop disease virus SDDV (YP_009163884.1),用DNAMAN软件进行比对,并进行进化树分析。
1.3 ORF4基因片段的扩增利用引物设计软件Primer Premier 5设计其扩增引物(上游:5′-GGATCCGCGATGACACCACCAC CAACAACA-3′;下游:5′-GGAATTCCTTAAAGCT CTTCTGATGGAGTG-3′),在上下游引物序列中分别插入BamH Ⅰ和EcoR Ⅰ酶切位点,CyHV-2病毒基因组DNA为模板,运用PCR技术对ORF4基因进行扩增。PCR反应体系(50 μL):10×Buffer 5 μL,10 mmol/L dNTPs 1 μL,10 μmol/L引物各1 μL,DNA模板0.5 μL,5 U/μL Taq DNA Polymerase 1 μL,加ddH2O至50 μL。PCR反应条件:94 ℃ 5 min;94 ℃ 50 s,59 ℃ 1 min,72 ℃ 1 min,共30个循环;72 ℃ 10 min。PCR产物经1%琼脂糖凝胶电泳检测后,用纯化回收试剂盒回收目的片段。
1.4 PGEX-4T-3-ORF4重组质粒的构建和序列测定将纯化PCR产物和质粒PGEX-4T-3分别用BamH Ⅰ和EcoR Ⅰ在37 ℃进行双酶切处理,酶切1 h,酶切产物经1%琼脂糖凝胶电泳分析后,再用PCR产物纯化回收试剂盒回收。用T4连接酶将ORF4和PGEX-4T-3连接,连接产物转化到大肠杆菌DH5α中,菌落经PCR筛选出阳性克隆,扩增后提取质粒,送至生工生物工程(上海)股份有限公司进行序列测定。测序鉴定成功的质粒命名为PGEX-4T-3-ORF4。
1.5 重组蛋白的表达和纯化将质粒PGEX-4T-3-ORF4转化到BL21(DE3) 大肠杆菌中。挑取单个阳性菌落接种于氨苄西林浓度为100 mg/L的LB液体培养基中,37 ℃、180 r/min培养;培养菌OD600浓度约为0.6时,加入IPTG至其终浓度为1 mmol/L,诱导4 h;8 000 r/min离心10 min收集菌体,用PBS溶液重悬后进行超声破碎处理20 min (6 s/6 s)。超声后,4 ℃、8 000 r/min离心20 min,取上清液过0.22 μm的滤膜,用谷胱甘肽亲和层析法纯化滤液,用SDS-PAGE和Western blot技术对表达和纯化的蛋白进行检测。
1.6 多克隆抗体的制备用纯化的重组蛋白免疫新西兰兔。采用皮下多点注射免疫,抗原与弗氏完全佐剂1:1充分混匀乳化后免疫;第1次免疫10 d后进行第2次免疫,抗原与弗氏不完全佐剂1:1充分混匀乳化后免疫;10 d后进行第3次免疫;第4次免疫为加强免疫,在第3次免疫两周后进行,不加佐剂,注射0.2 mg重组蛋白。第4次免疫7 d后心脏采血,血液37 ℃静置1 h,然后4 ℃过夜,第二天4 ℃、3 000 r/min离心10 min,小心取上清,分装后-80 ℃保存备用。
1.7 血清抗体特异性分析用纯化的GST-ORF4蛋白作为抗原进行SDS-PAGE凝胶电泳,然后采用电转膜法(100 V,75 min)转至PVDF膜,用20 mL含5%牛奶的PBST溶液室温封闭2 h。再用制备的多抗血清作为一抗(稀释度1:3 000) 室温孵育1 h后4 ℃过夜。用PBST溶液清洗3次,每次10 min。再用HRP标记的羊抗兔的IgG抗体作为二抗(稀释度1:5 000) 室温50 r/min振荡孵育2 h,用PBST清洗3次,每次10 min,最后将PVDF膜放入二氨基联苯胺(DAB)显色液中显色,直到目的条带清晰为止,并用双蒸水终止反应。
1.8 荧光定量PCR扩增参照本实验室建立的CyHV-2荧光定量检测方法对各组织中的病毒滴度进行测定[12]。取3条攻毒CyHV-2后的异育银鲫,分别取肌肉、脑、鳃、脾脏、肝胰脏、心脏、肾脏组织20 mg,参照组织基因组提取试剂盒说明书提取总DNA。将DNA模板稀释为50 mg/L,荧光定量PCR反应体系:SYBR Premix ExTaq 12.5 μL,10 μmol/L上下游引物各1μL,DNA模板1μL,双蒸水9.5 μL,总体积为25 μL。每种样品组织均设3个重复,同时设定双蒸水为阴性对照。
1.9 各组织总蛋白的提取及检测分别取肌肉、脑、鳃、脾脏、肝胰脏、心脏、肾脏组织20 mg,使用碧云天RIPA裂解液(中),参照说明书提取上述各组织总蛋白。再利用Western blot技术进行检测,Western blot参照1.7,GAPDH作为内参标定总蛋白的使用量。
2 结果与分析 2.1 ORF4氨基酸序列结构域、同源性和进化分析如图 1所示,通过SMART在线软件对ORF4蛋白的氨基酸进行结构域分析发现,在158-194和259-336氨基酸残基间含有2个保守的TNFR功能结构域——半胱氨酸富集结构域(CRD)。Blastx分析表明,CyHV-2 ORF4与CyHV-3 ORF4、SIGVORF50、MV T2、SDDV ORF123L一致性较高。氨基酸序列比对分析结果表明,半胱氨酸残基较为保守(图 1)。进化树结果表明,CyHV-2 ORF4与CyHV-3 ORF4的亲缘关系最近(图 2)。

|
| 图 1 CyHV-2 ORF4与CyHV-3、HCMV、SDIV等病毒的TNFR氨基酸序列比对 Figure 1 Multiple sequence alignments of CyHV-2 ORF4 homologues in TNFRs of other species 注:在所有物种中完全保守的氨基酸残基用黑色表示;CRD:半胱氨酸富集结构域. Note: The fully conserved amino acid residues in all species are represented in black; CRD: Cysteine rich domain. |
|
|

|
| 图 2 基于CyHV-2 ORF4构建的系统进化树 Figure 2 Phylogenetic tree of CyHV-2 ORF4 amino sequence homologues in TNFRs of other species |
|
|
根据GenBank中Ⅱ型鲤疱疹病毒ORF4的ORF框序列设计引物,并以CyHV-2基因组DNA作为模板,经PCR扩增获得ORF4 ORF框序列。PCR产物经1%琼脂糖凝胶电泳分析,扩增出一条大小约为1 041 bp的特异性条带,大小与预期一致(图 3)。
|
| 图 3 ORF4基因PCR扩增产物电泳图 Figure 3 Electrophoretic profile of PCR products of ORF4 gene Note: M: DL2000 marker; 1: PCR products. |
|
|
将上述PCR产物割胶回收,回收产物和PGEX-4T-3质粒分别进行双酶切,然后进行连接、转化,最后提取质粒,通过PCR扩增、测序等方法鉴定重组质粒,测序结果显示重组质粒PGEX-4T-3-ORF4构建正确,将质粒转化到大肠杆菌后用于诱导表达重组蛋白GST-ORF4。
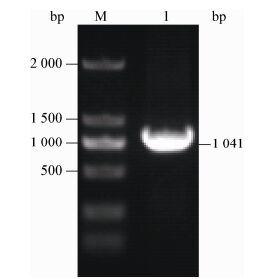
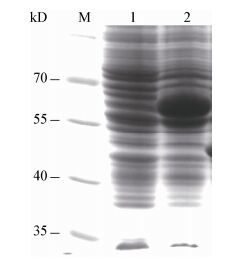
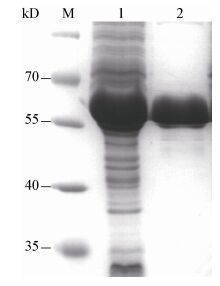
2.4 重组蛋白的表达和纯化将含有质粒PGEX-4T-3-ORF4的大肠杆菌BL21(DE3) 用终浓度为1 mmol/L的IPTG进行诱导,4 h后取总菌体制样进行SDS-PAGE分析。图 4结果表明,与未经IPTG诱导组相比,经IPTG诱导的菌体在65 kD处出现一条明显的目的条带,同时,利用GST-Tag单克隆抗体检测上述蛋白,图 5结果显示,只有诱导组在65 kD处出现条带,与预期相符,说明GST-ORF4蛋白表达成功。将诱导组的菌体超声波破碎,离心后取上清经谷胱甘肽亲和层析柱纯化出重组蛋白,经SDS-PAGE分析,图 6显示在65 kD处出现一条单一条带,说明获得了纯的GST-ORF4重组蛋白,可用于后续实验。
|
| 图 4 表达产物的SDS-PAGE分析 Figure 4 SDS-PAGE of expressed product Note: M: Protein marker; 1: Uninduced bacterial; 2: Induced bacterial. |
|
|
|
| 图 5 表达产物的Western blot检测 Figure 5 Western blot detection of expressed product Note: M: Protein marker; 1: Uninduced bacterial; 2: Induced bacterial. |
|
|
|
| 图 6 纯化的重组ORF4蛋白SDS-PAGE分析 Figure 6 SDS-PAGE of purified product 注:M:蛋白marker;1:未诱导的菌体;2:纯化的GST-ORF4蛋白. Note: M: protein marker; 1: uninduced bacterial; 2: the purified GST-ORF4 protein. |
|
|
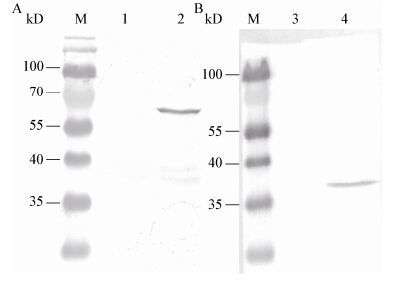
纯化的重组GST-ORF4蛋白免疫新西兰兔后,为了鉴定获得的抗ORF4多克隆抗体是否能特异性识别ORF4,利用制备的抗ORF4的血清为一抗,未诱导的菌体和诱导的菌体为抗原,进行Western blot检测。图 7A结果显示,CyHV-2 ORF4抗血清能检测到一条65 kD的单一蛋白条带,说明所制备的多克隆抗体可以与GST-ORF4蛋白产生特异性免疫反应。为了验证制备的多克隆抗体能否识别体内的ORF4蛋白,利用制备的抗ORF4的血清为一抗,未感染和感染鱼的肾脏为抗原,经Western blot检测,结果如图 7B所示,在未感染组中没有检测到条带,在感染组中检测到一条大小为38 kD的单一条带。
|
| 图 7 利用制备的多抗血清检测重组ORF4蛋白 Figure 7 Detection of rORF4 by the polyclonal antibody 注:M:marker;1:未诱导的菌体;2:诱导的菌体;3:未感染的肾脏;4:感染的肾脏. Note: M: protein marker; 1: uninduced bacterial; 2: induced bacterial; 3: uninfected kidney; 4: infected kidney. |
|
|
利用绝对定量的方法,对CyHV-2在各组织中的分布进行定量分析。图 8结果表明CyHV-2主要在肾脏和脾脏中富集,而脑和肌肉中分布最少。

|
| 图 8 CyHV-2在异育银鲫不同组织中的分布情况 Figure 8 The distribution of CyHV-2 in different tissues of allogynogenetic crucian carp |
|
|
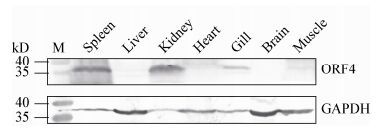
在利用Western blot分析各组织中ORF4蛋白分布的实验中,与内参蛋白GAPDH相比,ORF4蛋白在各组织中分布差异明显,只在肾脏、脾脏和鳃中检测出ORF4蛋白质的分布,肌肉、脑、肝胰脏和心脏组织中未被检测出,并且在肾脏和脾脏中ORF4蛋白条带最粗,而在鳃中ORF4蛋白条带较浅,这很可能预示着ORF4主要在肾脏、脾脏和鳃中行使调控功能(图 9)。
|
| 图 9 ORF4蛋白质在各组织中的分布 Figure 9 The distribution of ORF4 protein in different tissues |
|
|
生物体在受到病毒感染时通过一系列免疫反应来抵抗病毒的侵袭,与此同时病毒也进化出了多种策略促进病毒侵染。疱疹病毒能通过编码宿主蛋白类似物调控细胞的免疫反应来逃避细胞的免疫攻击,如肿瘤坏死因子受体类似物、干扰素受体类似物等[13]。
本文对CyHV-2的ORF4基因的氨基酸序列进行分析,发现其在158-194和259-336位点分别含有一个TNFR结构,与TNFR超家族成员的TNFR1和TNFR2结构相似。CyHV-2 ORF4的TNFR结构与其他病毒的TNFR超家族成员同源性较近,与CyHV-3 ORF4一致性有34%,与其他病毒编码的vTNFR一致性在20%-32%之间。在水生动物病毒中,SGIV通过编码的vTNFR ORF50来调控细胞的TNF和TNFR,达到逃避宿主免疫攻击的目的[14]。与CyHV-2同源性很近的CyHV-3编码了两种vTNFR (ORF4和ORF12),通过Western blot检测感染CyHV-3病毒后的鱼血清和细胞上清,结合质谱分析,只检测出ORF12病毒蛋白[15]。在斑马鱼胚胎中过表达CyHV-3的ORF4和ORF12,会导致胚胎缺陷,甚至死亡,能促进细胞凋亡。CyHV-3 vTNFRs引起的凋亡主要是通过内源性凋亡途径,同时也需要外源性凋亡途径的参与,这预示着CyHV-3 ORF4可能在病毒免疫逃逸机制中起着重要作用[16],也预示着CyHV-2 ORF4很可能是vTNFR,行使着与宿主TNFR相似的功能。
本实验首先从CyHV-2基因组DNA中扩增出了ORF4基因的ORF框序列,并将其插入到表达载体PGEX-4T-3中,再利用原核表达的GST-ORF4蛋白免疫新西兰兔,获得了效价高、特异性好的多克隆抗体。利用该多克隆抗体,我们研究了ORF4的组织分布情况。迄今为止,已有多位学者运用不同技术对CyHV-2的组织分布进行了研究。姚卓凤等[17]研究了急性和慢性感染条件下,异育银鲫鳃、脾脏、肾脏和脑组织的病理损伤情况,在不同感染模型中,脾脏、肾脏、鳃和脑组织的病理损伤都很严重,且以坏死病变为主。林秀秀等[18]利用PCR方法在异育银鲫的体肾、肠道、脾脏、头肾、肝胰脏、鳃中均检测出CyHV-2病毒粒子。同时,林秀秀等[19]利用透射电镜研究患病异育银鲫肾脏、脾脏、头肾、肝胰脏、肠道、鳃各组织细胞超微病理学,在这些组织中均观察到CyHV-2的病毒粒子,其中在肾脏和脾脏中观察到大量的CyHV-2粒子,而肝胰脏、头肾、鳃和肠道中CyHV-2粒子较少。因此,他们推测CyHV-2通过感染体肾、头肾、脾脏的吞噬细胞,引起宿主免疫机能的改变。本实验中我们利用荧光定量PCR技术检测出CyHV-2在肾脏、脾脏、脑、肝胰脏、鳃、肌肉和心脏均有分布,且按照肾脏、脾脏、心脏、肝胰脏、鳃、脑、肌肉的顺序依次减少(图 8),与已报道的研究结果基本一致。在利用Western blot技术检测ORF4的组织分布实验中发现其主要分布在肾脏、脾脏、鳃中,其他组织中没有检测出ORF4蛋白质的分布,可能与ORF4蛋白质在这些组织中表达量少有关。同时,ORF4作为病毒的非结构蛋白,在病毒侵染宿主过程中主要起调控作用,在不同细胞中的表达量会有一定的差异性,已有的研究表明CyHV-2侵染的主要靶器官为肾脏和脾脏,这预示着ORF4可能在病毒与宿主的相互作用中发挥着重要的免疫调控作用。
| [1] |
Kong SY, Jiang YS, Xu D, et al. An immunological method to detect CyHV-2 based on capsid protein 72[J]. Journal of Fishery Sciences of China, 2016, 23(2): 328-335. (in Chinese) 孔善云, 姜有声, 许丹, 等. 一种基于Ⅱ型鲤疱疹病毒衣壳蛋白72的免疫学检测方法[J]. 中国水产科学, 2016, 23(2): 328-335. |
| [2] |
Tian FY, He JQ, Wang L, et al. The research progress of goldfish herpesviral haematopoietic necrosis[J]. Chinese Journal of Animal Quarantine, 2012, 29(4): 78-80. (in Chinese) 田飞焱, 何俊强, 王璐, 等. 金鱼疱疹病毒性造血器官坏死病研究进展[J]. 中国动物检疫, 2012, 29(4): 78-80. |
| [3] |
Waltzek TB, Kelley GO, Stone DM, et al. Koi herpesvirus represents a third cyprinid herpesvirus (CyHV-3) in the family Herpesviridae[J]. Journal of General Virology, 2005, 86(6): 1659-1667. DOI:10.1099/vir.0.80982-0 |
| [4] |
Podok P, Wang H, Xu LJ, et al. Characterization of myeloid-specific peroxidase, keratin 8, and dual specificity phosphatase 1 as innate immune genes involved in the resistance of crucian carp (Carassius auratus gibelio) to Cyprinid herpesvirus 2 infection[J]. Fish & Shellfish Immunology, 2014, 41(2): 531-540. |
| [5] |
Podok P, Xu LJ, Xu D, et al. Different expression profiles of Interleukin 11 (IL-11), Intelectin (ITLN) and Purine nucleoside phosphorylase 5a (PNP 5a) in crucian carp (Carassius auratus gibelio) in response to cyprinid herpesvirus 2 and Aeromonas hydrophila[J]. Fish & Shellfish Immunology, 2014, 38(1): 65-73. |
| [6] |
Davison AJ, Kurobe T, Gatherer D, et al. Comparative genomics of carp herpesviruses[J]. Journal of Virology, 2013, 87(5): 2908-2922. DOI:10.1128/JVI.03206-12 |
| [7] |
He JQ, Shi XJ, Yu L, et al. Development and evaluation of a loop-mediated isothermal amplification assay for diagnosis of cyprinid herpesvirus 2[J]. Journal of Virological Methods, 2013, 194(1/2): 206-210. |
| [8] |
Wu T, Ding ZF, Ren M, et al. The histo-and ultra-pathological studies on a fatal disease of Prussian carp (Carassius gibelio) in mainland China associated with cyprinid herpesvirus 2 (CyHV-2)[J]. Aquaculture, 2013, 412-413: 8-13. DOI:10.1016/j.aquaculture.2013.07.004 |
| [9] |
Ma J, Jiang N, LaPatra SE, et al. Establishment of a novel and highly permissive cell line for the efficient replication of cyprinid herpesvirus 2 (CyHV-2)[J]. Veterinary Microbiology, 2015, 177(3/4): 315-325. |
| [10] |
Grell M, Becke FM, Wajant H, et al. Tumor necrosis factor (TNF) receptor type 2 mediates thymocyte proliferation independently of TNF receptor type 1[J]. European Journal of Immunology, 1998, 28(1): 257-263. DOI:10.1002/(ISSN)1521-4141 |
| [11] |
Poole E, King CA, Sinclair JH, et al. The UL144 gene product of human cytomegalovirus activates NFκB via a TRAF6-dependent mechanism[J]. The EMBO Journal, 2006, 25(18): 4390-4399. DOI:10.1038/sj.emboj.7601287 |
| [12] |
Xu LJ, Podok P, Xie J, et al. Comparative analysis of differential gene expression in kidney tissues of moribund and surviving crucian carp (Carassius auratus gibelio) in response to cyprinid herpesvirus 2 infection[J]. Archives of Virology, 2014, 159(8): 1961-1974. DOI:10.1007/s00705-014-2011-9 |
| [13] |
Rahman MM, McFadden G. Modulation of tumor necrosis factor by microbial pathogens[J]. PLoS Pathogens, 2006, 2(2): e4. DOI:10.1371/journal.ppat.0020004 |
| [14] |
Guan LY, Huang YH, Cai J, et al. Molecular characterization and tentative functional analysis of Singapore grouper iridovirus open reading frame 050 (SGIV ORF050)[J]. Journal of Fisheries of China, 2013, 37(7): 1095-1105. (in Chinese) 关丽雅, 黄友华, 蔡佳, 等. 石斑鱼虹彩病毒ORF050的分子特征和功能初步分析[J]. 水产学报, 2013, 37(7): 1095-1105. |
| [15] |
Kattlun J, Menanteau-Ledouble S, El-Matbouli M. Non-structural protein pORF 12 of cyprinid herpesvirus 3 is recognized by the immune system of the common carp Cyprinus carpio[J]. Diseases of Aquatic Organisms, 2014, 111(3): 269-273. DOI:10.3354/dao02793 |
| [16] |
Yi Y, Qi HM, Yuan JM, et al. Functional characterization of viral tumor necrosis factor receptors encoded by cyprinid herpesvirus 3 (CyHV3) genome[J]. Fish & Shellfish Immunology, 2015, 45(2): 757-770. |
| [17] |
Yao ZF, Huang J, Zhang JM, et al. Investigation of viral load in healthy fish naturally infected with cyprinind herpesvirusⅡ (CyHV-2)[J]. Hubei Agricultural Sciences, 2016, 55(4): 980-983. (in Chinese) 姚卓凤, 黄建, 张俊梅, 等. 自然感染鲤疱疹病毒Ⅱ的病毒载量研究[J]. 湖北农业科学, 2016, 55(4): 980-983. |
| [18] |
Lin XX, Ye YT, Wu P, et al. The injury effect of infection by cyprinid herpesvirus 2 (CyHV-2) on tissues and organs of gibel carp (Carassius auratus gibelio)[J]. Genomics and Applied Biology, 2016, 35(3): 587-594. (in Chinese) 林秀秀, 叶元土, 吴萍, 等. 鲤疱疹Ⅱ型病毒(CyHV-2) 感染对异育银鲫(Carassius auratus gibelio)组织器官的损伤作用[J]. 基因组学与应用生物学, 2016, 35(3): 587-594. |
| [19] |
Lin XX, Ye YT, Wu P, et al. Ultra-pathological observation of cyprinid herpesvirus 2 (CyHV-2) of allogyogenetics silver crucian carp (Carassius auratus gibelio) with hematopoietic necrosis[J]. Chinese Journal of Fisheries, 2016, 29(1): 17-23. (in Chinese) 林秀秀, 叶元土, 吴萍, 等. 异育银鲫造血器官坏死症病鱼体内鲤疱疹病毒Ⅱ型的电镜观察与超微病理学特征[J]. 水产学杂志, 2016, 29(1): 17-23. |
 2017, Vol. 44
2017, Vol. 44