扩展功能
文章信息
- 周洲, 陈建林, 张洪波, 陈丽丽, 李忠玉, 吴移谋
- ZHOU Zhou, CHEN Jian-Lin, ZHANG Hong-Bo, CHEN Li-Li, LI Zhong-Yu, WU Yi-Mou
- 鼠衣原体在不同遗传背景小鼠中病变差异性与炎症细胞动态变化
- Pathological difference and dynamic changes of inflammatory cells in Chlamydia muridarum infected mice with diverse genetic background
- 微生物学通报, 2017, 44(8): 1927-1937
- Microbiology China, 2017, 44(8): 1927-1937
- DOI: 10.13344/j.microbiol.china.160829
-
文章历史
- 收稿日期: 2016-11-15
- 接受日期: 2017-01-18
- 优先数字出版日期(www.cnki.net): 2017-01-18
2. 中南大学湘雅二医院妇产科 湖南 长沙 410011;
3. 中南大学湘雅二医院病理科 湖南 长沙 410011
2. Departments of Obstetrics and Gynecology, Second Xiangya Hospital, Central South University, Changsha, Hunan 410011, China;
3. Departments of Pathology and Endocrinology, Second Xiangya Hospital, Central South University, Changsha, Hunan 410011, China
沙眼衣原体(Chlamydia trachomatis,Ct)引起的泌尿生殖道感染是全球普遍关注的公共健康问题。Ct感染的隐匿性和反复性特点导致患者不能及时接受有效治疗而形成慢性、迁延不愈的病变,在临床上引起男性的附睾炎、前列腺炎,在女性则引起宫颈炎、子宫内膜炎、输卵管炎等,是造成不孕不育、异位妊娠等并发症的重要原因[1]。但Ct不易在常规实验动物体内如小鼠构建衣原体生殖道感染模型,因此,限制了对Ct致病机制及防治策略的进一步研究。鼠衣原体(Chlamydia muridarum,Cm),可以引起小鼠肺炎,与Ct在基因序列上有一定的相似性,在生物学特性及致病性上也比较相近,例如:Cm在小鼠生殖道引起的感染和病理变化与Ct在人体内引起的非常相似,因此,用Cm构建的小鼠生殖道感染模型来研究Ct对人类生殖道的致病作用成为Ct研究的常规手段[2]。
研究表明,宿主的遗传背景影响着衣原体感染的结局[3-4]。我们已经证实,补体C5是宿主体内参与Cm致小鼠生殖道病变、诱发炎症反应的重要因素,C5的活化可促进Cm以阴道接种(Intravaginal inoculation,iv)小鼠后形成典型的生殖道病变——输卵管水肿[5]。但是,在相同C5背景(C5-/-)的不同品系小鼠中(DBA/2J和A/J),以输卵管囊内接种(Intrabursal inoculation,ib)的方式感染Cm,两组小鼠的病变率则出现明显的差异。这提示我们除C5外,宿主存在与感染方式有关的其他遗传因素参与促进生殖道病变的形成。
前期研究发现通过宫颈角接种(Intrauterine inoculation,iu)途径感染时,DBA/2J和A/J小鼠在产生输卵管水肿的病变率上有显著差异[3]。为验证iu接种方式引起病变差异的结果并进一步探讨可能参与Cm致病的机制或因素,也避免iv带来的上行感染及ib接种带来炎症反应的过多干扰,我们以iu方式将等量Cm接种于两组不同品系小鼠体内,在检测感染第60天小鼠生殖道病变率的同时,对两组小鼠在感染过程中生殖道不同部位的衣原体数量、炎症反应程度及病变组织炎症细胞动态变化进行分析,在排除炎症细胞总量不同致病变差异的可能后,对两组小鼠病变组织的炎症细胞种类进行了鉴定,为探寻衣原体致病因子,揭示其致病机制奠定基础。
1 材料与方法 1.1 材料 1.1.1 实验动物: 清洁级5-6 w雌性DBA/2J(000671) 和A/J(000646) 小鼠均购自美国Jackson实验室(Bar Harbor,Maine),喂养于学校动物房。小鼠饲养提供充足的食物和水源,温度长期保持在25 ℃,昼夜交替时间为12 h/12 h。 1.1.2 菌株、试剂和仪器: Cm标准株Nigg株,由本实验室常规传代制备并保存于-80℃。HeLa细胞,美国菌种典藏中心(ATCC,cat#CCL2);胎牛血清和常规细胞培养基DMEM,Gibco BRL公司;宫颈角感染的非手术胚胎移植装置NSET (cat#60010),ParaTechs公司;Depo-Provera,Pharmacia & Upjohn公司;Cy3标记的羊抗鼠IgG (红色)二抗,Jackson ImmunoResearch公司;细胞因子检测试剂盒,sigma-aldrich公司或R & D公司;Triton-100,sigma-aldrich公司。Olympus AX-70荧光显微镜,Olympus公司。 1.2 方法 1.2.1 衣原体细胞感染及动物感染: 体外实验中,先将HeLa细胞用含10%胎牛血清的DMEM在预铺设盖玻片的24孔板中进行培养,使16-20 h后细胞丰度达到80%-90%,然后按常规方案,将待测的处理标本样品(稀释的下生殖道分泌物或上生殖道各段组织匀浆)接种于细胞进行培养,约24 h后弃培养上清,以间接免疫荧光法检测标本中衣原体包涵体数量(详见方法1.2.5)。预备35只/组的DBA/2J和A/J小鼠。感染前5天,每只小鼠腹膜皮下预注射2.5 mg的Depo-Provera,使小鼠发情周期同步,便于衣原体感染。感染当天(0 d),按照NSET装置的使用说明和指示步骤实施iu接种方式,每只小鼠感染2×105衣原体包涵体形成单位(Inclusion forming units,IFUs)的Cm,感染后分别于3、7、14、21、28、35、42、49、56、60 d检测每只小鼠下生殖道分泌物的衣原体带菌量(详见方法1.2.2),于14 d处死5只/组小鼠进行上生殖道衣原体带菌量和细胞因子的检测(详见方法1.2.3),于3、28、35 d不同时间点分别处死5只/组小鼠,制备成病理切片标本并评估输卵管和卵巢组织中的炎症细胞(详见方法1.2.6),在60 d处死15只/组小鼠,进行肉眼及镜下生殖道病变的评估(详见方法1.2.4)。实施iv时,DBA/2J和A/J两组各取15只/组小鼠(A/J组5只小鼠数据用于其他研究),根据2×105 IFUs Cm/只小鼠的接种剂量,将Cm母液稀释并重悬于预冷的衣原体保存液SPG中,调节加样枪以15 μL/只小鼠取样后,将枪头缓慢而轻柔的伸入小鼠阴道内,在加样枪按钮打下第一档遇到阻滞感后继续加压,直至第二档以便将感染液全部打出,保持加样枪档位不变稍稍停滞待感染液被纳入后,轻缓地将枪头从小鼠阴道中退出。实施ib时,DBA/2J和A/J两组各取10只/组小鼠,对小鼠背部肾区对应位置行手术切口,并以无菌注射器将感染液直接接种于暴露出的输卵管囊腔内。
1.2.2 小鼠下生殖道带菌量检测: 小鼠经生殖道感染Cm后,第一周每隔3-4 d (其余每隔7 d)以无菌棉拭子取生殖道(阴道和宫颈体)分泌物重悬于500 μL预备玻璃珠的SPG中,振荡处理并系列稀释标本混合液,取合适稀释度的混合液感染单层HeLa细胞,于CO2培养箱中培养24 h后,进行荧光抗体染色。用荧光显微镜计数包涵体数量。 1.2.3 小鼠上生殖道带菌量及细胞因子检测: 小鼠感染衣原体后14 d每组各处死5只小鼠,无菌条件下分离小鼠生殖道,截取两侧卵巢和输卵管、子宫角、阴道和子宫体三段生殖道组织,无菌条件下分别研磨并以300μL预冷的SPG重悬组织匀浆,玻璃珠振荡处理。取50μL匀浆液进行适当稀释后感染单层HeLa细胞,培养24 h后,间接免疫荧光检测包涵体数量;另取部分输卵管及卵巢匀浆液1 000×g作用10 min分离上清,根据试剂盒操作说明,取适量匀浆上清分别检测小鼠细胞因子。 1.2.4 小鼠生殖道病理检测: 初次感染后60 d处死小鼠,分离生殖道(包括阴道、子宫、输卵管和卵巢),肉眼初步观察、评价并拍照记录小鼠两侧输卵管水肿情况;生殖道标本以10%甲醛固定、石蜡包埋后切片、HE染色,在显微镜下以盲法分别对输卵管进行水肿程度和炎症反应的评分。输卵管水肿的评分标准为:0分,无明显水肿;1分,肉眼可视有轻微水肿且需要显微镜下确认;2分,肉眼明显可见但水肿不超过同侧输卵管直径;3分,与同侧输卵管大小一致的水肿;4分,超过同侧输卵管直径大小的水肿。炎症反应的评分标准(慢性感染阶段主要以观察单核细胞浸润为主,急性感染期主要以中性粒细胞为主):0分,无炎症细胞浸润;1分,有1处轻微炎症细胞浸润;2分,有2-4处炎症细胞浸润;3分,有超过4处炎症细胞浸润;4分,明显的大片炎症细胞浸润。 1.2.5 间接免疫荧光实验: 将感染衣原体的HeLa细胞用4%多聚甲醛进行30 min固定、0.1% triton-100作用10 min对细胞膜透性处理,洗涤封闭后,Hoechst标记细胞核,鼠抗Cm LPS抗体为一抗,Cy3标记的羊抗鼠IgG (红色)为二抗,对不同标本感染细胞后形成的衣原体包涵体进行间接免疫荧光检测。在荧光显微镜下,随机定位每张盖玻片的5个视野,计算每个视野下包涵体的数量,根据对标本稀释倍数及视野面积的转换公式,获得每份标本的总IFUs并转换成Log10的对数值。 1.2.6 小鼠输卵管、卵巢组织炎症细胞观察及分析: 衣原体感染小鼠后,于3、28、35 d各组分别处死5只小鼠,分离小鼠生殖道,并按步骤1.2.4描述对标本进行固定、包埋、切片、HE染色,按间隔5张的规律抽取第1、第6、第11张病理切片标本,在显微镜下观察,鉴别病理切片中输卵管及卵巢组织中浸润的主要炎症细胞种类,取3张病理切片计算均值和标准差并统计。 1.2.7 统计学分析: 用秩和检验Wilcoxon rank sum test分析比较两组间病理评分和下生殖道上皮细胞IFUs含量差异,用Fisher’s exact test对小鼠下生殖道带菌率、病变小鼠百分率以及上生殖道衣原体定殖率进行统计,用t检验(Two-tailed Student’s t test)对各细胞因子水平差异进行两两比较,以The Spearman’s Correlation对小鼠生殖道病变的描述性参数进行分析,P<0.05为差异有显著性。 2 结果与分析 2.1 iu接种方式在DBA/2J小鼠中引起输卵管病变率高于iv和ib的接种方式总结3种不同接种方式在小鼠形成输卵管病变的结局,iv方式在两种感染小鼠中均难以造成明显的输卵管病变,DBA/2J及A/J的病变率分别为20%和10%,且小鼠的输卵管扩张评分仅为0.6±1.4和0.4±1.3;ib方式使DBA/2J小鼠病变率达到60%,但A/J鼠无明显改变,仍为10%,DBA/2J小鼠的输卵管扩张评分为1.3±1.3,略高于A/J小鼠的0.1±0.3;与前两种方法相比,iu接种方式感染Cm后,DBA/2J小鼠输卵管病变率可达100%,而A/J小鼠病变率变化不明显,仅为20%,与A/J鼠0.6±1.5的输卵管扩张评分相比,DBA/2J鼠达到了5.1±1.8,与A/J鼠形成统计学差异(表 1)。
| 小鼠品系 Mouse strains |
阴道接种iv | 输卵管囊内接种ib | 宫颈角接种iu | ||||||||
| 病变率 Incidence (n) |
炎性评分 Severity |
炎性分组 Susceptibility |
病变率 Incidence (n) |
炎性评分 Severity |
炎性分组 Susceptibility |
病变率 Incidence (n) |
炎性评分 Severity |
炎性分组 Susceptibility |
|||
| DBA/2J | 20% (15) | 0.6±1.4 | R | 60% (10) | 1.3±1.3 | S | 100% (15)* | 5.1±1.8** | H | ||
| A/J | 10% (10) | 0.4±1.3 | R | 10% (10) | 0.1±0.3 | R | 20% (15) | 0.6±1.5 | R | ||
| 注:炎性评分≥5属于高度敏感组(H);炎性评分在1-5间属于敏感组(S);炎性评分<1属于抵抗组(R).与iv接种法形成的输卵管病变相比,以iu方式感染DBA/2J鼠形成的输卵管病变显著升高. Note: Inflammatory score ≥5 belong to highly sensitive (H); Inflammatory score 1-5 belong to sensitive (S); Inflammatory score<1 belong to resistance (R). Comparing with intravaginal inoculation, DBA/2J mice with hydrosalpinx has significantly enhanced by intrauterine inoculation. *: P<0.05; **: P<0.01. | |||||||||||
小鼠iu方式感染等量Cm后第60天被处死,分离完整生殖道进行肉眼观察和镜下病理切片的评估。肉眼观察发现,A/J组小鼠感染后输卵管病变不明显,15只小鼠中仅3只出现输卵管水肿,发生比率约20% (图 1B);而15只DBA/2J组小鼠感染后输卵管均出现明显水肿,病变率为100% (图 1A)。同时,DBA/2J小鼠输卵管扩张评分为5.1±1.8,而A/J鼠输卵管扩张均值为0.6±1.5,两者形成统计学差异。组织病理学检测证实两组小鼠在显微镜下输卵管水肿扩张程度确有明显差异,A/J鼠输卵管扩张不明显,扩张评分均值为0.8±1.8,DBA/2J鼠输卵管扩张明显,扩张评分均值达到6.1±1.8;进一步对两组小鼠病变组织中的炎症细胞浸润程度进行评分,结果显示DBA/2J与A/J鼠病变组织中均充斥大量的炎症细胞,DBA/2J鼠的炎症细胞浸润评分均值达到4.1±1.4,而A/J鼠的炎症细胞浸润评分均值达到4.6±1.3,两者没有形成统计学差异,但从绝对值来看,A/J鼠病变组织的炎症细胞浸润评分稍高于DBA/2J组小鼠(图 1C和图 1D)。

|
| 图 1 iu方式接种Cm后60 d小鼠上生殖道输卵管水肿的情况 Figure 1 Hydrosalpinx developed in the upper genital tract of mice on Day 60 after intrauterine infection with C. muridarum 注:A和B:小鼠生殖道外观,病理改变以肉眼可见的输卵管水肿进行标记.左图示每组小鼠具有典型代表的完整生殖道图片,右图示放大的输卵管和卵巢.记录显示具阳性病变(在放大图片中以红色箭头标记)的小鼠数量和阳性病变小鼠的百分率,并根据材料与方法中提到的评分标准评估输卵管水肿的严重程度,以白色数字标记在相应的图片中;C和D:显微镜下HE染色的生殖道组织(物镜放大倍数为10倍或100倍). DBA/2J和A/J两组小鼠的输卵管管腔扩张程度和炎症细胞浸润程度评分用Wilcoxon rank sum进行比较,而输卵管发生率则用Fisher法进行分析. *:P<0.05. Note: A and B: The gross appearance of urogenital tract tissues, the pathologies were recorded as hydrosalpinx observable with naked eye. A representative image from each strain of mice is presented with the whole genital tract in the left and the magnified oviduct and ovary portion in the right. The number of mice with positive hydrosalpinx (as marked with red arrows in the magnified oviduct/ovary images) were counted and recorded as % of hydrosalpinx positive mice. Furthermore, the severity of each hydrosalpinx was scored based on the criteria described in the Materials and Methods and marked with numbers in white in the corresponding images; C and D: The urogenial tract tissues were examined under microscope after H & E staining (10× or 100× objective lens). The luminal dilation of fallopian tubes (the former score in 1B) and hydrosalpinx severity scores (infiltration of inflammatory cells, the later score in 1B) were compared between DBA/2J and A/J mice using wilcoxon rank sum while the hydrosalpinx incidences were compared using Fisher's exact. *: P < 0.05. |
|
|
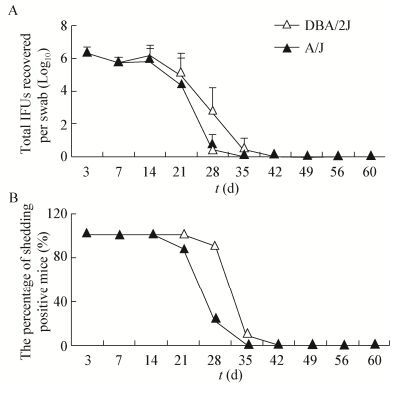
两组小鼠在iu感染Cm后第3天,阴道上皮细胞中衣原体包涵体的检出量均最高,DBA/2J组为6.29±0.24,A/J组为6.27±0.41,且检出率均为100%,说明Cm接种小鼠全部成功。从感染后第7天,小鼠阴道上皮细胞中衣原体包涵体的检出量有所下降,随后感染第14、21、28天衣原体检出量逐步降低,A/J组小鼠在第35天阴道上皮衣原体被全部清除,DBA/2J组小鼠在第42天阴道上皮衣原体被全部清除,两组间无明显差异(图 2A)。两组小鼠带菌率在感染后第3天均为100%,A/J组在感染第21天出现2例小鼠阴道衣原体清零,在感染第35天全部小鼠阴道衣原体被清零,DBA/2J组在感染第28天出现1例小鼠阴道衣原体清零,在感染第42天全部清零,两组间无明显差异(图 2B)。该结果与以往实验数据一致(未显示)。
|
| 图 2 iu方式感染Cm后小鼠下生殖道的衣原体检出量及带菌鼠的阳性检出率 Figure 2 Lower genital tract shedding and the number of mice remaining positive for shedding following intrauterine inoculation with C. muridarum 注:A:从小鼠下生殖道检出的活衣原体数量;B:处死前感染阶段下生殖道能检出活衣原体的阳性小鼠百分率. Note: A: The number of live organism shedding from the lower genital tract; B: Percentage of mice remaining positive for shedding live organisms during the infection course prior to sacrifice. |
|
|
在iu感染后的第14天,每组各取5只小鼠,分离完整生殖道并截取为上段(输卵管和卵巢)、中段(宫颈角)和下段(宫颈体和阴道),各段均研磨成匀浆,感染预铺的HeLa细胞,间接免疫荧光法检测各段生殖道中衣原体的定殖情况。结果如图 3所示,在感染第14天,两组小鼠的生殖道各段中均可检测到衣原体,且总体趋势为下段(宫颈体和阴道)中衣原体的检出量高于中段(宫颈角)和上段(输卵管和卵巢)组织,提示Cm在以iu方式接种后可从上生殖道扩散至小鼠整个生殖道,但A/J鼠与DBA/2J鼠相比在感染过程中各段生殖道的衣原体数量并无显著差异(P>0.05)。该结果与以往实验数据一致(未显示)。

|
| 图 3 iu方式感染Cm后14 d小鼠生殖道各段衣原体的检出量 Figure 3 Live organism recovery from different segments of mouse genital tracts on Day 14 after intrauterine inoculation with C. muridarum 注:阴道和子宫颈(C+V)以及阴道分泌物swab代表下生殖道,子宫角(U)及输卵管和卵巢(OVI+OVA)代表上生殖道. Note: Vagina, cervix (C+V) and swab represent the lower genital tract, and uterine horn (U), oviduct and ovary (OVI+OVA) represent the upper genital tract. |
|
|
根据两组小鼠病变组织镜下炎症细胞浸润程度评分均升高但无差异的结果,于感染后第3、28和35天取每组各5只小鼠,处死后分离完整生殖道,制备的病理切片在放大100倍的油镜下,对小鼠两侧输卵管壁和输卵管腔进行炎症细胞种类和数量的大体评估(如方法1.2.4中炎症反应评分的描述),并进一步对主要炎症细胞(嗜中性粒细胞、嗜酸性粒细胞)进行计数。如图 4所示:在感染第3天,两组小鼠的病变组织中浸润大量的炎症细胞,包括淋巴细胞、巨噬细胞等,以嗜中性粒细胞为主,但根据统计,两组小鼠在嗜中性粒细胞的数量上并无明显差异;在感染第28天,两组小鼠病变组织的炎症细胞数量均有所减少,与A/J小鼠相比,DBA/2J小鼠的病变组织中出现了较多的胞浆红色的嗜酸性粒细胞;在感染第35天,病变组织中炎症细胞以浆细胞和淋巴细胞较为多见,DBA/2J组小鼠病变组织中出现大量的嗜酸性粒细胞,而A/J组小鼠病变组织无明显嗜酸性粒细胞出现(仅个别病变小鼠组织出现少量嗜酸性粒细胞),A/J与DBA/2J小鼠在病变组织的嗜酸性粒细胞的含量上有统计学差异(P<0.05)。

|
| 图 4 iu方式感染Cm后小鼠输卵管组织炎性细胞的动态变化 Figure 4 Dynamic changes of inflammatory cells in oviduct following intrauterine inoculation with C. muridarum 注:A:Cm感染后第3天、第28天、第35天HE染色的输卵管组织.图中标记了中性粒细胞(黄色箭头)或嗜酸性粒细胞(红色箭头)的存在(物镜放大倍数为100倍).在急性感染期(第3天)的输卵管图例中,检测到较多的中性粒细胞,而在慢性感染阶段(第35天),DBA/2J小鼠中检测到较多的嗜酸性粒细胞;B:图中Y轴显示通过计算每只小鼠的中性粒细胞数获得的每组小鼠细胞的均值和标准差;C:图中Y轴显示通过计算每只小鼠的嗜酸性粒细胞数获得的每组小鼠细胞的均值和标准差.注意A/J组和DBA/2J组小鼠在感染第3天均以中性粒细胞为主,第28天DBA/2J鼠输卵管组织中的嗜酸性粒细胞水平升高,在第35天显著高于A/J小鼠. *:P<0.05. Note: A: H & E-stained oviduct tissue on Day 3, 28, 35 after C. muridarum infection. Example images marked with either neutrophils (yellow arrows) or eosinophils (red arrows) are shown (100× objective lens). In the image taken from an oviduct with an acute infection (3 d), more neutrophils were detected, while at the chronic stage (35 d), more eosinophils were detected in DBA/2J mice; B: The number of neutrophils from oviduct of each mouse was used to calculate means and standard deviations for each group as shown along the Y axis; C: The number of eosinophils from oviduct of each mouse was used to calculate means and standard deviations for each group as shown along the Y axis. Note that both A/J (solidbar) and DBA/2J (open bar) mice were dominated by neutrophils in oviduct on Day 3 after infection, then levels of oviduct eosinophils increased on Day 28 in DBA/2J mice, and became significantly higher in DBA/2J mice than A/J mice on Day 35. *: P < 0.05. |
|
|
取两组各5只小鼠的输卵管和卵巢段匀浆组织,离心后收集上清,检测上生殖道输卵管和卵巢段组织的炎症因子水平。如图 5A所示,DBA/2J组小鼠与A/J组小鼠在病变部位的衣原体数量上无明显差异。但除IL-1、TNF-α外(结果未显示),IL-13等细胞因子在DBA/2J小鼠组的检测值明显高于A/J小鼠检测值,具有统计学差异(P<0.05),且检测值的比值(DBA/2J:A/J)>3.0 (图 5B-E)。提示在感染等量Cm后,DBA/2J组小鼠诱发输卵管及卵巢部位的炎症反应要明显强于A/J组小鼠。

|
| 图 5 iu方式感染Cm第14天DBA/2J和A/J小鼠输卵管及卵巢组织细胞因子的比较 Figure 5 Comparison of cytokines from oviduct and ovary tissue in DBA/2J and A/J mice harvested 14 days after intrauterine infection Note: *: P < 0.05. |
|
|
输卵管作为女性生育的重要器官,具有把生殖细胞运送到子宫腔的重要作用,输卵管不通或功能障碍是造成女性不孕症的主要原因。女性常见的衣原体生殖道感染,会使衣原体上行至输卵管,通过炎症反应、炎性细胞浸润,导致输卵管内膜水肿、增厚、上皮细胞脱落,若无及时有效治疗则可能造成输卵管管腔粘黏阻塞,形成输卵管水肿、积液。因此,是否出现输卵管水肿,常作为判断女性衣原体生殖道感染是否导致输卵管阻塞或输卵管性不孕的重要标志[6-8]。而预防因下生殖道衣原体感染导致输卵管病变是维护女性生殖系统正常功能的有效手段。根据衣原体在小鼠模型中的感染特点,把阴道、宫颈、子宫体及分叉部分的子宫角作为小鼠下生殖道组织,而大部分子宫角、输卵管及卵巢则常作为小鼠上生殖道组织来研究衣原体的致病机制[9-11]。
常规的小鼠衣原体生殖道接种方式采用的是iv,即取适量衣原体EB,通过预冷SPG按比例稀释后,经小鼠阴道感染,这种方式最大程度地模拟了衣原体自然情况下侵犯人体生殖道引发病变的过程,涉及了衣原体感染后从下生殖道往上生殖道侵犯的扩散能力、衣原体在上生殖道的增殖以及衣原体在上生殖道引发炎症反应能力的几个因素。ib是将小鼠背部肾区对应位置行手术切口,并直接将衣原体接种于小鼠输卵管囊腔内,其优点为可避开衣原体上行扩散的影响而直接评估衣原体在上生殖道引发病变的能力,但人为手术切口引起的炎症反应可能对衣原体导致的炎性病变造成干扰。而iu技术通过采用非手术性的胚胎移植NSET装置,绕过小鼠阴道和宫颈体的阻碍,将衣原体直接从子宫角感染至上生殖道。这种方式在不造成炎症干扰的前提下,为衣原体致小鼠输卵管水肿的机制提供了一条排除扩散因素而可独立研究衣原体在上生殖道致病能力的研究策略。
在以往研究中,就衣原体感染导致输卵管病变的可能因素已进行了相关讨论[12-14]。但是,任何毒力因子的作用需要借助于调控宿主靶细胞才能完成。我们发现,与正常小鼠(C5+/+,B10.D2) 相比,缺失C5的小鼠(C5-/-,B10.D2) 在感染Cm后不能产生明显的输卵管水肿[5];不同品系小鼠对衣原体的易感性及产生的病变率明显不同[13]。这说明宿主的某些遗传背景可借助于衣原体毒力因子的作用干扰宿主细胞的正常功能,引发机体病变。有趣的是,在相同C5遗传背景(C-/-)的小鼠(DBA/2J和A/J鼠)体内,以常规iv方式接种Cm,DBA/2J和A/J小鼠均属于病变抵抗组,病变率分别为20%和10%,当以ib方式接种Cm时,DBA/2J小鼠的病变率提高到60%,转变为中度敏感组别,而A/J鼠的病变率依然维持在10%。这提示在DBA/2J和A/J小鼠中,存在差异的某种遗传背景因素可能参与Cm调控宿主细胞的病变机制。为此,我们进一步采用了iu接种方式,检测两种小鼠的病变情况。发现DBA/2J组小鼠以iu方式直接在上生殖道感染Cm后,病变率达到100%,进入高度敏感组,而A/J组小鼠依然属于病变抵抗组,病变率仅为22%。据此推测,(1) 通过3种不同接种方式致两种小鼠输卵管病变率的差异,提示除了C5因素外,可能有其他遗传背景相关因素参与导致两组小鼠生殖道病变率的差异;(2) 这种可能参与病变的宿主因素是通过改变接种方式而被激活的。值得注意的是,同样是通过上生殖道接种,ib与iu感染方法在DBA/2J小鼠生殖道病变率上有一定的差距。考虑到ib引起的炎症反应包括Cm感染生殖道引起的局部炎症反应,也包括由手术伤口带来的炎症反应,手术伤口带来的过强炎症反应可以迅速有效清除上生殖道中的衣原体,从而导致DBA/2J小鼠病变率的减少,缩小两组小鼠生殖道病变率的差异。因此iu与ib感染方式致病变率的不同可能与ib方式引起宿主过激的炎症反应有关。
在探究致两组小鼠iu感染Cm后生殖道病变差异性的参与因素时,我们发现,在DBA/2J和A/J小鼠的感染过程中,小鼠下生殖道的衣原体检出量及小鼠带菌率无明显差异,说明引起病变差异的原因与Cm对下生殖道的感染无关;通过对生殖道各段匀浆组织衣原体包涵体的检出,发现小鼠生殖道各段在衣原体数量上也无明显区别,说明病变差异与Cm在生殖道的扩散能力及在上生殖道的数量无关,而可能与其在上生殖道诱发炎症反应的能力相关。在检测感染第60天小鼠输卵管病变时,我们注意到,肉眼观察下DBA/2J和A/J组小鼠的输卵管病变率和输卵管扩张评分形成了统计学差异,而显微镜下的输卵管扩张评分与上述结果一致,但两组小鼠的病变组织炎症细胞浸润评分并无差异,甚至A/J组数值略高于DBA/2J组。这一结果说明,尽管两组小鼠衣原体感染致病变率不同与输卵管和卵巢组织炎症反应有关,但该炎症反应与炎症细胞数量无关,而可能与炎症细胞的种类有关。根据上述推论,我们对病变组织进行动态病理学分析,确认参与病变过程的主要炎症细胞。检测结果显示,在感染早期(第3天),DBA/2J与A/J组在病变组织炎症反应程度以及炎症细胞类型上并无明显区别,病变组织中主要浸润着大量的中性粒细胞。这与以往发现Cm感染小鼠早期以中性粒细胞为主的病变特点一致[4]。至感染中期(第28天),两组小鼠病变组织中炎症细胞的种类及比例有了变化,中性粒细胞的数量明显下降,DBA/2J组小鼠输卵管组织中出现了部分嗜酸性粒细胞,而A/J小鼠病变组织中少有嗜酸性粒细胞出现。感染后期以第35天为例,DBA/2J小鼠组织中浸润大量嗜酸性粒细胞,并与A/J小鼠结果出现显著性差异;而A/J小鼠组织中主要浸润的炎症细胞包括浆细胞、淋巴细胞和巨噬细胞(结果未显示)。这一结果与第60天病理切片的镜下评估(DBA/2J小鼠仅在输卵管组织的扩张程度上与A/J小鼠形成统计学差异,但两者组织的炎症细胞浸润程度评分并无统计学差异)一致。进一步通过病变组织细胞因子检测对上述结论进行验证,结果发现检测的7种细胞因子在DBA/2J小鼠组织中明显高于A/J组别,包括IL-1α、IL-1β、IL-4、IL-13、Eotaxin、GM-CSF和TNF-α,并具有明显差异性(DBA/2J:A/J>3)。IL-1α、IL-1β、TNF-α在炎症反应中被研究的最多,对炎症反应的发生发展具有极其重要的作用,是常规检测的炎症因子,参与机体炎症反应的多种病理过程。Eotaxin (嗜酸性粒细胞细胞趋化因子)是对嗜酸性粒细胞具有选择趋化作用的细胞因子,GM-CSF (粒细胞-巨噬细胞集落刺激因子)是一种调节造血干细胞增殖和分化的细胞因子,对嗜酸性粒细胞的分化也同样重要,而IL-13和IL-4在结构和功能上具有一定相似性,两者均可通过对单核巨噬细胞、嗜酸性粒细胞等细胞的调节作用而参与炎症反应。结合细胞因子的检测结果,我们推测,在DBA/2J及A/J小鼠品系以iu接种Cm导致不同病变率的结果,可能与Cm激活小鼠某种遗传因素,并通过Eotaxin、GM-CSF等细胞因子,促使嗜酸性粒细胞在局部病变组织中聚集、浸润并脱颗粒,通过释放毒性产物,引起组织损伤的能力有关。
衣原体生殖道感染普遍存在,但是据统计,仅有10%-15%的女性在感染未治疗的情况下出现输卵管病变,绝大多数感染者并不患病[15-16]。衣原体感染的发生、发展和结局,不仅与衣原体入侵数量和毒力有关,也受到机体遗传基因和多态性的影响。本实验中,我们希望找到与生物学相关的致病机制,以便阐明临床上不同女性患者抗输卵管病变的可能方式。A/J和DBA/2J小鼠在同种条件下感染Cm致不同病变结果的实验,模拟了临床上女性衣原体生殖道病变的不同情况,提示小鼠Cm感染引起输卵管病变与衣原体在生殖道的扩散能力、繁殖数量无关,而可能与宿主能否诱发嗜酸性粒细胞参与的炎症反应有关。综上所述,小鼠在Cm感染后通过分泌Eotaxin等细胞因子诱发输卵管嗜酸性粒细胞炎症反应可能是某些宿主在衣原体感染后导致输卵管病变的机制之一。
| [1] |
Ahmadi MH, Mirsalehian A, Bahador A. Association of Chlamydia trachomatis with infertility and clinical manifestations: a systematic review and meta-analysis of case-control studies[J]. Infectious Diseases, 2016, 48(7): 517-523. DOI:10.3109/23744235.2016.1160421 |
| [2] |
Bulir DC, Liang S, Lee A, et al. Immunization with chlamydial type Ⅲ secretion antigens reduces vaginal shedding and prevents fallopian tube pathology following live C. muridarum challenge[J]. Vaccine, 2016, 34(34): 3979-3985. DOI:10.1016/j.vaccine.2016.06.046 |
| [3] |
Chen JL, Zhang HB, Zhou Z, et al. Chlamydial induction of hydrosalpinx in 11 strains of mice reveals multiple host mechanisms for preventing upper genital tract pathology[J]. PLoS One, 2014, 9(4): e95076. DOI:10.1371/journal.pone.0095076 |
| [4] |
Zhang HB, Zhou Z, Chen JL, et al. Lack of long-lasting hydrosalpinx in A/J mice correlates with rapid but transient chlamydial ascension and neutrophil recruitment in the oviduct following intravaginal inoculation with Chlamydia muridarum[J]. Infection and Immunity, 2014, 82(7): 2688-2696. DOI:10.1128/IAI.00055-14 |
| [5] |
Yang ZS, Conrad T, Zhou Z, et al. Complement factor C5 but not C3 contributes significantly to hydrosalpinx development in mice infected with Chlamydia muridarum[J]. Infection and Immunity, 2014, 82(8): 3154-3163. DOI:10.1128/IAI.01833-14 |
| [6] |
Shah AA, Schripsema JH, Imtiaz MT, et al. Histopathologic changes related to fibrotic oviduct occlusion after genital tract infection of mice with Chlamydia muridarum[J]. Sexually Transmitted Diseases, 2005, 32(1): 49-56. DOI:10.1097/01.olq.0000148299.14513.11 |
| [7] |
de la Maza LM, Pal S, Khamesipour A, et al. Intravaginal inoculation of mice with the Chlamydia trachomatis mouse pneumonitis biovar results in infertility[J]. Infection and Immunity, 1994, 62(5): 2094-2097. |
| [8] |
Swenson CE, Schachter J. Infertility as a consequence of chlamydial infection of the upper genital tract in female mice[J]. Sexually Transmitted Diseases, 1984, 11(2): 64-67. DOI:10.1097/00007435-198404000-00002 |
| [9] |
Chen LL, Lei L, Zhou Z, et al. Contribution of interleukin-12 p35 (IL-12p35) and IL-12p40 to protective immunity and pathology in mice infected with Chlamydia muridarum[J]. Infection and Immunity, 2013, 81(8): 2962-2971. DOI:10.1128/IAI.00161-13 |
| [10] |
Huang YM, Zhang Q, Yang ZS, et al. Plasmid-encoded Pgp5 is a significant contributor to Chlamydia muridarum induction of hydrosalpinx[J]. PLoS One, 2015, 10(4): e0124840. DOI:10.1371/journal.pone.0124840 |
| [11] |
Zhang Q, Huang YM, Gong SQ, et al. In vivo and ex vivo imaging reveals a long-lasting chlamydial infection in the mouse gastrointestinal tract following genital tract inoculation[J]. Infection and Immunity, 2015, 83(9): 3568-3577. DOI:10.1128/IAI.00673-15 |
| [12] |
Liu YJ, Huang YM, Yang ZS, et al. Plasmid-encoded Pgp3 is a major virulence factor for Chlamydia muridarum to induce hydrosalpinx in mice[J]. Infection and Immunity, 2014, 82(12): 5327-5335. DOI:10.1128/IAI.02576-14 |
| [13] |
Zhou Z, Wu YM, Tan G, et al. Screening of virulence gene and establishment of isogenic Chlamydia muridarum clones with different genotype[J]. Microbiology China, 2015, 42(8): 1561-1568. (in Chinese) 周洲, 吴移谋, 谭钢, 等. 鼠衣原体毒力基因的筛选和基因差异型菌株的建立[J]. 微生物学通报, 2015, 42(8): 1561-1568. |
| [14] |
Chen CQ, Zhou Z, Conrad T, et al. In vitro passage selects for Chlamydia muridarum with enhanced infectivity in cultured cells but attenuated pathogenicity in mouse upper genital tract[J]. Infection and Immunity, 2015, 83(5): 1881-1892. DOI:10.1128/IAI.03158-14 |
| [15] |
Budrys NM, Gong SQ, Rodgers AK, et al. Chlamydia trachomatis antigens recognized in women with tubal factor infertility, normal fertility, and acute infection[J]. Obstetrics & Gynecology, 2012, 119(5): 1009-1016. |
| [16] |
Rodgers AK, Budrys NM, Gong SQ, et al. Genome-wide identification of Chlamydia trachomatis antigens associated with tubal factor infertility[J]. Fertility and Sterility, 2011, 96(3): 715-721. DOI:10.1016/j.fertnstert.2011.06.021 |
 2017, Vol. 44
2017, Vol. 44