扩展功能
文章信息
- 阿尔菲娅·安尼瓦尔, 伊萨克·阿卜杜热合曼, 于斯甫·麦麦提敏, 努尔古丽·热合曼
- Alfira Anwar, Esak Abdurahman, Yusup Mamatemin, Nurgul Rahman
- 吐鲁番传统馕饼酸面团中微生物多样性及挥发性香气成分的分析
- Microbial diversity and volatile component analysis in Turpan traditional sourdough
- 微生物学通报, 2017, 44(8): 1908-1917
- Microbiology China, 2017, 44(8): 1908-1917
- DOI: 10.13344/j.microbiol.china.170187
-
文章历史
- 收稿日期: 2017-03-06
- 接受日期: 2017-05-18
- 优先数字出版日期(www.cnki.net): 2017-05-18
新疆传统发酵食品馕饼是以小麦面、玉米面或高粱面为原料,加少许盐水和酸面团烤制而成的面饼,是维吾尔族的传统主食之一[1]。馕饼发酵面团制作方法有多种,在不同地区居住的维吾尔族家庭都具有不同的面团发酵方法。最近通过调研,发现吐鲁番坎儿井周边有些家庭用坎儿井饮用水发酵面团烘烤馕饼,用这种方法制作的馕饼发酵时间短,拥有独特的味道,香味充裕、面团质地松散、没有一点酸味,显然优于用自来水或其他方法和面发酵的面团及烘烤的馕。
样品采集地点托克逊县常年平均温度比俗称“火洲”的吐鲁番市还高3℃,是全国唯一的海拔零点县城。他们制作面团用的坎儿井饮用水pH在7.3-8.7之间,呈弱碱性质。作为天然弱碱水,坎儿井饮用水对人体有益[2]。在实验室初步研究发现,坎儿井饮用水对天然发酵面团发酵过程具有促进发酵作用。截至目前,对托克逊县坎儿井饮用水制成的发酵面团进行研究的相关文献未见报道。本研究以吐鲁番托克逊县两个地点的发酵面团作为研究对象,评估其中微生物多样性,同时对面团进行风味物质检测[3-4]。初步从馕饼发酵剂——酸面团的微生物菌群组成解释馕饼风味差异的原因。此外,本研究还试图证明水质[5]能影响发酵过程中优势菌及其芳香类物质的组成。这一研究结果为今后传统发酵酸面团微生物组分研究提供重要参考依据。
1 材料与方法 1.1 实验材料酸面团:采集于新疆维吾尔自治区吐鲁番托克逊县夏乡色日克吉勒尕村2号院排孜来提家庭(记作1号样品)、吐鲁番托克逊县郭勒布依乡郭勒布依村7大队1小队克依木家庭(记作2号样品),两地原样品均使用坎儿井弱碱水和面制成。坎儿井弱碱水采自夏乡喀格恰克村阿木尔坎儿井(88°78′02″E、42°70′69″N),水样pH为7.9、温度为22.5℃。装入无菌试样袋密封,将取得的试样保存于4℃。
培养基(g/L):分别采用改良MRS培养基(CaCO3 3.0)、改良YGC培养基(氯霉素0.2) 和PDA培养基[6]。
主要试剂和仪器:TIANGEN细菌、酵母菌基因组DNA提取试剂盒;通用引物由新疆昆泰锐生物技术有限公司合成。LRH-250生化培养箱,上海一恒科技有限公司;光学显微镜,宁波舜宇仪器有限公司;2720 Thermal Cycler PCR扩增仪,美国Applied Biosystems公司;Alphalmager EP凝胶成像系统,美国Proteinsimple公司;振荡培养箱,上海天呈实验仪器制造有限公司;离心机,Eppendorf AG公司;7890A-5975C气相色谱质谱联用仪,美国Agilent公司;DB-WAX毛细管柱(30 m×0.25 mm,0.25 μm),美国J & W公司;SPME 57328-U顶空固相微萃取装置,美国Supeloco公司。
1.2 方法 1.2.1 菌株的分离及染色镜检: 用0.85%的无菌生理盐水将传统发酵酸面团样品按稀释涂布法进行梯度稀释,取10-4、10-5、10-6的稀释度的稀释液分别涂布于加有3%碳酸钙的MRS和YGC平板。MRS平板在37℃培养48 h。YGC平板在28℃培养48 h。分别选取革兰氏阳性和美兰染色[6]的纯培养物采用三划线法进一步纯化培养。最后将纯培养物进行40%甘油保藏,4℃备用[7]。 1.2.2 16S rRNA基因序列分析: 用细菌基因组DNA提取试剂盒提取的DNA用作细菌16S rRNA基因模板进行PCR序列分析。细菌16S rRNA基因是由上游引物27F (5′-AGAGTTTGATCCTGGCT CAG-3′)和下游引物1495r (5′-CTACGGCTACCT TGTTACGA-3′)进行扩增。50 μL PCR反应体系:DNA模板2 μL,2×EasyTaqTM PCR SuperMix 13 μL,10 μmol/L 27F和1495R各0.5 μL,ddH2O 34 μL。PCR反应条件为:94℃ 4 min;94℃ 30 s,58℃ 30 s,72℃ 1 min,30个循环;72℃ 10 min[8]。扩增完成后,以7μL PCR产物和3 μL溴酚蓝混合点样1.0%琼脂糖凝胶电泳来确认PCR产物质量,在1 500 bp左右处出现清晰的条带为准。最后扩增产物送给昆泰锐生物技术有限公司测序。采用Bioedit软件对所待测菌的16S rRNA基因序列进行整理并将得到的有效序列在NCBI进行BLAST分析工具与GenBank数据库中比对,找出同源性最高的已知菌株。采用MEGA 7.07软件构建系统发育树。根据相关软件删除序列匹配排列中的插入和缺失,根据“Kimura双参数”方式,通过序列数据计算进化距离。选择邻近连接法(Neighbour-Joining)对系统进化树进行估算,通过1 000次取样确定[9]。申请Genbank登录号。 1.2.3 26S rRNA基因D1/D2区序列分析[10]: 用酵母菌基因组DNA提取试剂盒,对分离出的酵母菌进行26S rRNA D1/D2区基因序列PCR分析。酵母菌26S rRNA的D1/D2区由上游引物NL1 (5′-GCATATCAATAAGCGGAGGAAAAG-3′)和下游引物NL4 (5′-GGTCCGTGTTTCAAGACGG-3′)进行扩增。50 μL PCR反应体系:DNA模板2 μL,2×EasyTaqTM PCR SuperMix 10 μL,10 μmol/L NL1和NL4各0.5μL,ddH2O 37 μL。PCR反应条件:94℃ 4 min;94℃ 45 s,55℃ 45 s,72℃1 min,30个循环;72℃ 10 min。扩增完成后,以7 μL PCR产物和3 μL溴酚蓝混合点样2.0%琼脂糖凝胶电泳来确认PCR产物质量,在600 bp左右处出现清晰的条带为准。最后扩增产物送给昆泰锐生物技术有限公司测序。采用BioEdit软件对待测菌的26S rRNA基因序列进行整理,将得到的有效序列在NCBI进行BLAST分析并与GenBank数据库比对,找出相似性最高的已知菌株。采用MEGA 7.07软件构建系统发育树。根据相关软件删除序列匹配排列中的插入和缺失,根据“Kimura双参数”方式,通过序列数据计算进化距离。选择邻近连接法(Neighbour-Joining)对系统进化树进行估算,通过1 000次取样确定。申请Genbank登录号。 1.2.4 风味物质的检测: 挥发性风味物质检测技术根据分析目的不同进行选择。研究选用顶空固相微萃取-气质联用法(HS-SPME-GC-MS)检测挥发性风味物质成分从而进行结构上的分析。 1.2.5 顶空固相微萃取(SPME): 将两组原样品分别用阿木尔坎儿井饮用水和乌鲁木齐自来水(对照)进行活化。发酵从起始阶段开始至4 h发酵结束,每2 h (即发酵0、2、4 h)取10 g装入50 mL的样品瓶中,放入75℃的水浴锅中预平衡30 min,然后用经过气相色谱进样口250℃老化1 h的萃取头插入样品瓶的顶空部分,进行顶空萃取30 min,待分析[11]。 1.2.6 GC/MS检测条件: 以不分流进样,氦气作载体,载气流速为1.2 mL/min,进样温度为250℃。MS条件:电子轰击离子源,电子能量70 eV,I=35 μA。升温程序:初温40℃,保持3 min,以5℃/min升温至200℃,再以10℃/min升至230℃,保持3 min。 1.2.7 化合物鉴定方法: 图谱通过计算机和人工检索,把每个峰与NIST Library08提供的标准质谱图对照鉴定化合物,仅当正反匹配度大于90%的鉴定结果才算合格列出。通过系列正构烷烃计算出未知化合物的RI值,并与www.odour.org.uk中报道的化合物RI值进行对比,以RI±50范围内一致的化合物予以列出[12],RI值的计算公式如下所示:
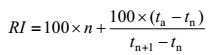
|
其中RI为样品的保留指数;ta为样品a的保留时间(min);tn为正构烷烃Cn的保留时间(min)。
2 结果与分析 2.1 细菌和酵母菌的分离及菌落特征菌落最初基于加有3%碳酸钙的MRS平板,乳酸菌明显带有溶钙圈,上述表型为阳性、过氧化氢酶阴性、革兰氏阳性初步鉴定为乳酸菌[13],对其他没有产生钙圈的革兰氏阳性菌也随机进行了分离纯化。最终得到了26株细菌。用YGC和PDA培养基进行涂布,在2号样品中未分离到任何酵母菌,从1号样品中分离到了菌落形态较大、湿润、乳白色半透明、有酒香味的酵母菌,经纯化后1号样品得到了10株酵母菌。
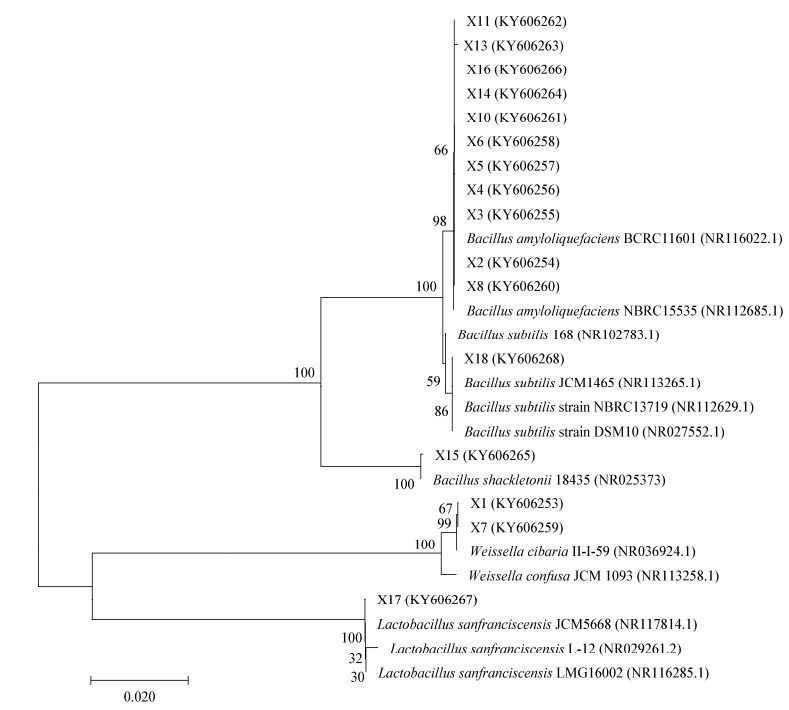
2.2 菌株分子鉴定 2.2.1 细菌16S rRNA基因序列分析: 对26株细菌16S rRNA基因进行扩增鉴定。以用1%琼脂糖凝胶对16S rRNA基因扩增产物进行电泳检测后在1 500 bp左右出现清晰的条带为准。采用BioEdit软件对待测菌的16S rRNA基因序列进行整理,将得到的有效序列在NCBI进行BLAST分析并与GenBank数据库中比对,找出相似性最高的已知菌株。结果表明所测菌株归属于3个属5个种(表 1)。用MEGA 7.07软件绘制系统发育树,见图 1。申请到的登录号为:KY606253-KY606268。| 属名 Genus name |
鉴定结果 Identification result |
代表菌株 Representative strains |
相似性 Similarity rate (%) |
Genbank登录号 Genbank accession No. |
菌株数(株) Strains number |
占种类数比例 Ratio of all species (%) |
| 乳杆菌属 Lactobacillus |
旧金山乳杆菌 L. sanfranciscensis |
X17 | 100 | KY606267 | 9 | 34.6 |
| 魏斯氏菌属 Weissella |
食窦魏斯氏菌 W. cibaria |
X7 | 100 | KY606259 | 4 | 15.4 |
| 芽孢杆菌 Bacillus |
解淀粉芽孢杆菌 B. amyloliquefaciens |
X11 | 100 | KY606262 | 11 | 42.3 |
| 嗜热解淀粉芽孢杆菌 B. shackletonii |
X15 | 100 | KY606265 | 1 | 3.8 | |
| 枯草芽孢杆菌 B. subtills |
X18 | 99 | KY606268 | 1 | 3.8 |
|
| 图 1 酸面团细菌16S rRNA基因序列的系统发育树 Figure 1 Phylogenetic tree of 16S rRNA gene sequences of bacterial in traditional sourdough 注:分支点上的数字表示构建系统树时1 000次计算时形成该节点的百分比;括号内数值为GenBank登录号;标尺或刻度0.020代表 2%的16S rRNA基因序列的进化差异. Note: The bootstrap values (%) presented at the branches were calculated from 1 000 replications. Numbers in parentheses are GenBank accession numbers. The scale bar 0.020 represents 2 nucleotide substitutions pre 100 nucleotides. |
|
|
由表 1可知,代表菌株X7与标准菌株Weissella cibaria strain II-I-59相似性为100%,将其鉴定为Weissella cibaria。菌株X11与标准菌株Bacillus amyloliquefaciens strain BCRC11601聚为一类,相似性为99%,将其鉴定为Bacillus amyloliquefaciens。菌株X15与标准菌株Bacillus shackletonii strain LMG18435相似性为100%,将其鉴定为Bacillus shackletonii。菌株X17与标准菌株Lactobacillus sanfranciscensis strain JCM5668相似性为100%,将其鉴定为Lactobacillus sanfranciscensis。菌株X18与标准菌株Bacillus subtilis strain JCM1465相似性为99%,将其鉴定为Bacillus subtilis。
2.2.2 酵母菌26S rRNA基因D1/D2区序列分析: 对10株酵母菌26S rRNA基因D1/D2区进行扩增鉴定。以用1%琼脂糖凝胶对26S rRNA基因D1/D2区扩增产物进行电泳检测后在600 bp左右出现清晰的条带为准。采用Bioedit软件对所待测菌的26S rRNA基因D1/D2区序列进行整理并将得到的有效序列在NCBI进行BLAST分析并与GenBank数据库中比对,找出相似性最高的已知菌株。结果表明所测菌株均与标准菌株酿酒酵母菌(Saccharomyces cerevisiae)相似率为99%,并均来自1号样品。将J4和J14作为代表菌株用MEGA 7.07绘制系统发育树(图 2),2号样品中没发现酵母菌存在。申请代表菌株的登录号为:KY606269、KY606270。

|
| 图 2 酸面团酵母菌26S rRNA D1/D2区基因序列的系统发育树 Figure 2 Phylogenetic tree of 26S rRNA D1/D2 region gene sequences of yeasts in traditional sourdough 注:分支点上的数字表示构建系统树时1 000次计算时形成该节点的百分比;括号内数值为GenBank登录号;标尺或刻度0.000 2代表 0.02%的26S rRNA D1/D2区基因序列的进化差异. Note: The bootstrap values (%) presented at the branches were calculated from 1 000 replications. Numbers in parentheses are GenBank accession numbers. The scale bar 0.000 2 represents 2 nucleotide substitutions pre 10 000 nucleotides. |
|
|
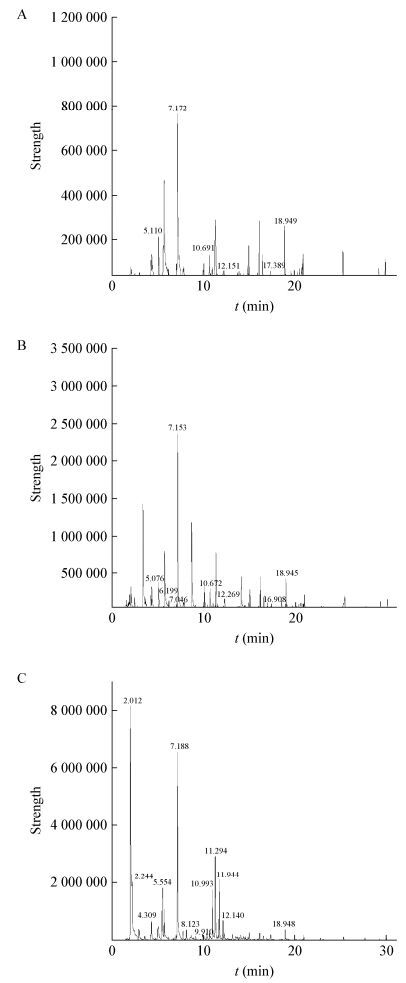
质谱图显示,酸面团经发酵后,酸面团中的挥发性风味物质的种类随着时间的推移而增加,出现多种不同的新峰,而且含量也发生了变化。不同样品发酵起始(A)→中间(B)→停止(C)时的GC-MS总离子流色谱图见图 3、4。

|
| 图 3 1号样品的GC-MS总离子流色谱图(0、2、4 h) Figure 3 GC-MS total ion current chromatogram of No. 1 sample (0, 2, 4 h) 注:总离子流随时间变化的图谱称为总离子流色谱图(TIC);纵坐标表示收集存储离子的电流总强度;横坐标表示离子的生成时间或连续扫描的扫描次数. Note: A map of total ion current change over time is called the total ion current chromatogram (TIC); Ordinate said collect storage ion current overall strength; Horizontal ion generated time or continuous scanning scan times. |
|
|
|
| 图 4 2号样品的GC-MS总离子流色谱图(0、2、4 h) Figure 4 GC-MS total ion current chromatogram of No. 2 sample (0, 2, 4 h) |
|
|
1号和2号样品的总离子色谱图结果见图 3和图 4。用乌鲁木齐自来水分别活化1号、2号样品作对照即1号对照和2号对照。发酵过程中产生的挥发性成分测定结果见表 1。由表 1可知,吐鲁番托克逊县发酵面团产生的挥发性成分大多为酯类,包括乙酸乙酯、乙二醇单甲酸酯、戊酸乙酯、正己酸乙酯、乙酸己酯等,还有醇、醛类如正己醇、1-辛烯-3醇、正己醛等,其中酯类和醇类是主要的呈香物质。这些挥发性香味物质[14]赋予馕饼发酵面团特殊的醇香和脂味的香甜。2号样品产生的各种酯类含量均较高,其特有的呈香物质为戊酸乙酯、正己酸乙酯和乙酸己酯。两组的对照样品即用自来水活化的面团风味物质远不如用阿木尔坎儿井饮用水活化的面团,其表现在芳香物质相对含量少、峰强度低、种类少等方面。
从表 2可知,正己醛、1-辛烯-3醇,随着发酵时间的延长而减少,正己醇随着发酵时间的延长而增加,脂类是从无到有,其中乙酸乙酯>正己酸乙酯>乙二醇单甲酸酯>乙酸己酯>戊酸乙酯。
| Compounds | Sample 1 | Control group 1 | Sample 2 | Control group 2 | RI | Aroma description | |||||||||||
| 0 h | 2 h | 4 h | 0 h | 2 h | 4 h | 0 h | 2 h | 4 h | 0 h | 2h | 4 h | ||||||
| Hexanal | 5.81 | 4.71 | - | 5.18 | 1.83 | 0.84 | 4.83 | 2.55 | - | 3.42 | 1.70 | 0.42 | 798 | Grassy | |||
| 1-Pentanol | 2.49 | 3.96 | 2.36 | 3.90 | 3.28 | 1.43 | 2.43 | 1.31 | 0.92 | 2.31 | 1.11 | 0.56 | 769 | Fusel oil smell | |||
| 1-Hexanol | 11.59 | 16.12 | 17.81 | 18.93 | 22.86 | - | 18.26 | 18.55 | 19.33 | 11.19 | 13.22 | 14.90 | 872 | Fruity | |||
| 1-Octen-3-ol | 2.53 | 2.20 | 0.93 | 2.06 | 1.62 | 1.26 | 3.46 | 1.42 | 0.21 | 1.219 | 0.618 | 0.13 | 984 | Mushroom | |||
| 1-Methyl-4-cyclohexano acetate | 0.29 | - | - | - | - | - | 0.43 | - | - | - | - | - | 1 198 | - | |||
| Dibenzofuran | 1.67 | - | - | - | - | - | - | - | - | - | - | - | 1 040 | - | |||
| Nonanal | - | 0.89 | - | - | - | - | 0.50 | 0.22 | - | 0.33 | 0.17 | - | 1 105 | Sweet smell | |||
| Heptanal | - | - | - | - | - | - | - | 9.61 | - | 2.30 | 0.97 | 0.78 | 869 | Fruity | |||
| Ethyl acetate | - | - | 4.05 | - | - | 2.80 | - | - | 11.49 | - | - | 4.34 | 605 | Winey | |||
| 1, 2-Ethanediol, mo-noformate | - | - | 6.75 | - | - | - | - | - | - | - | - | - | 643 | - | |||
| Dimethoxy acetate | - | - | - | - | - | - | - | - | 6.27 | - | - | - | 766 | - | |||
| Ethyl valerate | - | - | - | - | - | - | - | - | 0.52 | - | - | - | 903 | Fruity | |||
| Hept-2-enal | - | - | - | - | 1.38 | - | - | - | 0.46 | - | - | 0.37 | 960 | Fat fragrance | |||
| 2-Pentylfuran | - | - | - | - | — | 0.94 | - | - | 3.31 | - | - | 1.15 | 993 | Fruity | |||
| Ethyl caproate | - | - | - | - | - | - | - | - | 7.16 | - | - | - | 1 002 | Sweet smell | |||
| Hexyl acetate | - | - | - | - | - | - | - | - | 4.01 | - | - | - | 1 016 | Fruity | |||
| Trans-octenal | - | - | - | - | 1.08 | - | - | - | - | - | 0.34 | 0.26 | 1 061 | Sweet smell | |||
| 2-Ethyl hexanol | - | - | - | - | - | - | - | 1.08 | - | 1.62 | - | - | 1 033 | Clean aroma | |||
| Lauric aldehyde | - | - | - | - | - | - | 0.30 | - | - | - | - | - | 982 | Flowery flavour | |||
| Capraldehyde | - | - | - | - | - | - | 0.13 | - | - | - | - | - | 1 203 | Sweet smell | |||
| 2, 6-Ditertbutylbenzoqu-inone | - | - | - | - | - | - | 0.16 | - | - | - | - | - | 2 002 | - | |||
| 13-Eicosenoic acid | - | - | - | - | - | - | 0.37 | - | - | - | 0.91 | - | 2 052 | - | |||
| n-Pentanal | - | - | - | - | - | - | 0.69 | 0.84 | 1.21 | 0.22 | 0.58 | 0.76 | 757 | Particular scent | |||
| 1, 6-Octadien-3-ol | - | - | - | - | - | - | - | 0.11 | - | - | - | - | 1 087 | - | |||
| 3, 5-Octadien-2-on | - | - | - | - | 0.46 | - | - | - | - | - | - | - | 1 044 | - | |||
| Acetic acid | - | - | - | - | - | 8.28 | - | - | - | - | - | - | 650 | Acidity | |||
由于吐鲁番托克逊馕饼在新疆各类馕饼中占重要地位,所用的坎儿井饮用水来自高山融化的雪水(通过坎儿井暗渠流向村民居住区),其水源矿物质丰富,水质极其特殊,因此制作出的馕饼别具一番风味。为了验证水质引起面团风味物质的差异,本研究将乌鲁木齐自来水作为对照进行面团活化,实验结果证明了水质影响发酵面团风味。对照组最多只有11种芳香类物质产生,而实验组有20余种风味物质产生。通过传统分离培养技术发现坎儿井饮用水所制作的两组面团样品中的解淀粉芽孢杆菌均占优势菌,其次是乳酸杆菌、食窦魏斯氏菌,最后是嗜热解淀粉杆菌和枯草芽孢杆菌。这与中国多地区传统发酵剂细菌菌相组分差距较大。只在样品1中分离到酿酒酵母,在2号样品中未分离出酵母菌,经试验发现没有酵母菌的酸面团的风味物质依然存在,并且种类比别的样品还多出7种,相对百分含量也比较大,这种现象引起了我们的关注。在发酵过程中乳酸杆菌酸化面团产生相应的风味物质[15]。本实验还检测到大量的烃类化合物,比如高级烷烃及一些不饱和烯烃等,因为此类物质具有较大的芳香阈值,不具有风味活性,对发酵面团总体风味贡献较少,因此未列出统计。
在发酵过程中乳酸杆菌酸化面团产生相应的风味物质[16]。经查阅大量文献[10, 17-22],面团中的解淀粉芽孢杆菌和嗜热解淀粉芽孢杆菌也起了重要作用。刘同杰等[10]提出解淀粉芽孢杆菌利用淀粉酶分解淀粉为糖类,给挥发性风味物质奠定了基础。此外Sutyak等[17]从益生菌乳制品中分离得到一株解淀粉芽孢杆菌,发现其细胞的无菌上清液能对单核细胞增生李斯特菌[18-19]、链球菌属及肠道加德菌产生抑菌作用,而对肠道乳酸杆菌不产生作用。因此可以看出解淀粉芽孢杆菌在其生长过程中能够产生多种抑菌物质,具有广泛抑制真菌与细菌的功能,被列入益生菌之中[20-22]。这也对吐鲁番馕饼面团的保质期长,不容易发霉腐败变馊等问题提供了理论依据。对于2号样品中未发现酵母菌存在这一研究结果及酵母菌是否是被解淀粉芽孢杆菌所抑制等科学问题,有待进行进一步研究。
虽然没有酵母菌产醇类物质,但面团中的风味物质没有减少反而增多,2号样品特有的戊酸乙酯、正己酸乙酯和乙酸己酯等挥发性风味物质到底是哪一步代谢或反应所产生,有待进一步研究。
4 结论本研究旨在研究新疆文化资源坎儿井饮用水的水质对维吾尔族经典饮食文化中的重要主食馕饼传统发酵剂发酵过程的影响机制,确定传统馕饼面团发酵过程中的优良微生物种群及其最佳发酵环境。坎儿井和传统馕饼这两者都是目前急需保护的饮食珍稀文化,利用本研究对微生物菌群结构多样性研究的结果,并进一步采集新疆吐鲁番不同坎儿井水(大坎儿井、阿力札阿吉坎儿井、拜什巴拉坎儿井等)制作的传统馕饼酸面团以及新疆各地的优质馕饼酸面团,对其微生物多样性解析并构建传统馕饼发酵面团中微生物菌群数据库,以充分利用及保护天然微生物资源,为传统优质馕饼发酵剂的工业化奠定基础的同时将为保护新疆地区特色传统饮食文化提供重要科学理论依据。
| [1] |
Yusuf R. Special food in the Xinjiang Uygur nationality autonomous region[J]. Journal of Kangding Nationality Teachers College, 2007, 16(2): 17-20. (in Chinese) 热莎拉提·玉苏普. 新疆维吾尔族的特色食品-馕的基本解读[J]. 康定民族师范高等专科学校学报, 2007, 16(2): 17-20. |
| [2] |
Lin Y. Karez natural water quality analysis and evaluation in Turpan Xinjiang[J]. Ground Water, 2010, 32(5): 95-96. (in Chinese) 林亚. 新疆吐鲁番盆地坎儿井的天然水质特征分析及评价[J]. 地下水, 2010, 32(5): 95-96. |
| [3] |
Ding CH, Qi GC, Hou LF, et al. Quality evaluation of steamed bread by traditional fermentation[J]. Journal of the Chinese Cereals and Oils Association, 2007, 22(3): 17-20. (in Chinese) 丁长河, 戚光册, 侯丽芬, 等. 传统老酵头馒头的品质特性[J]. 中国粮油学报, 2007, 22(3): 17-20. |
| [4] |
Ding CH, Qi GC, Zhang JH, et al. Microbial analysis of traditional starter culture (Jiaotou) and its influence on the quality of Chinese steamed bread[J]. Food Science, 2007, 28(4): 69-74. (in Chinese) 丁长河, 戚光册, 张建华, 等. 传统起子(酵头)的微生物分析及其对馒头品质的影响[J]. 食品科学, 2007, 28(4): 69-74. |
| [5] |
Zhu ZQ. Function of water in fermentative dough Products[J]. Cuisine Journal of Yangzhou University, 2001, 18(3): 53-56. (in Chinese) 朱在勤. 水在发酵面团制品中的作用[J]. 扬州大学烹饪学报, 2001, 18(3): 53-56. |
| [6] |
Li J, Shi J, Jia JJ, et al. Isolation and identification of yeasts from Xinjiang sour camel milk and its initial application[J]. Food and Nutrition in China, 2012, 18(1): 22-27. (in Chinese) 李静, 石静, 贾佳佳, 等. 新疆酸驼乳中酵母菌的生理生化鉴定及初步应用[J]. 中国食物与营养, 2012, 18(1): 22-27. |
| [7] |
Yang JY, Liu CH. Industrialization of Chinese traditional Jiaozi[J]. Food Research and Development, 2007, 28(2): 164-166. (in Chinese) 杨敬雨, 刘长虹. 中国传统酵子的工业化[J]. 食品研究与开发, 2007, 28(2): 164-166. |
| [8] |
Hu SL, Liu HX, Yu J, et al. Diversity of lactic acid bacteria associated with traditional fermented milk from Hulun Buir in Inner Mongolia[J]. Microbiology China, 2017, 43(5): 984-990. (in Chinese) 呼斯楞, 刘红新, 于洁, 等. 内蒙古呼伦贝尔地区传统发酵乳中乳酸菌的多样性分析[J]. 微生物学通报, 2017, 43(5): 984-990. |
| [9] |
Ma K, An YH, Wu HJ, et al. Isolation and identification of a dominate lactic acid bacteria strain CGMCC 10624 from a traditional steamed buns Jiaozi[J]. Journal of Food Safety and Quality, 2016, 7(9): 3720-3724. (in Chinese) 马凯, 安云鹤, 武会娟, 等. 传统馒头发酵酵子中一株优势乳酸菌CGMCC 10624的分离与鉴定[J]. 食品安全质量检测学报, 2016, 7(9): 3720-3724. |
| [10] |
Liu TJ, Li Y, Wu SR, et al. Isolation and identification of bacteria and yeast from chinese traditional sourdough[J]. Modern Food Science and Technology, 2014, 30(9): 114-120, 148. (in Chinese) 刘同杰, 李云, 吴诗榕, 等. 传统酸面团中细菌与酵母菌的分离与鉴定[J]. 现代食品科技, 2014, 30(9): 114-120, 148. |
| [11] |
Wang DF, Li TT, Liu N, et al. Analysis of effects of protamine on volatile compounds for grass garpslices by HS-SPME-GC-MS technology combined with electronic nose[J]. Food and Fermentation Industries, 2016, 42(10): 163-170. (in Chinese) 王当丰, 李婷婷, 刘楠, 等. 顶空固相微萃取-气质联用法结合电子鼻分析鱼精蛋白对草鱼片挥发性气味的影响[J]. 食品与发酵工业, 2016, 42(10): 163-170. |
| [12] |
Hansen A, Schieberle P. Generation of aroma compounds during sourdough fermentation: Applied and fundamental aspects[J]. Trends in Food Science & Technology, 2005, 16(1/3): 85-94. |
| [13] |
Zhang LP, Li ZJ, Wang LD. Isolation and identification of fermentation in the rice bran leaven and research of application[J]. China Food Additives, 2006(14): 135-138, 131. (in Chinese) 张丽萍, 李志江, 王立东. 糙米酵素发酵剂筛选分离及应用研究[J]. 中国食品添加剂, 2006(14): 135-138, 131. |
| [14] |
Fu JS, Zhuang SW, Xu DD, et al. Free volatile compounds analysis and molecular identification of different yeast isolate[J]. Food and Fermentation Industries, 2010, 36(2): 44-48. (in Chinese) 付俊淑, 庄世文, 徐丹丹, 等. 酵母分离株分子鉴定及其挥发性香气成分检测分析[J]. 食品与发酵工业, 2010, 36(2): 44-48. |
| [15] |
Zhang J, Zhang X, Zhang L, et al. Potential probiotic characterization of Lactobacillus plantarum strains isolated from Inner Mongolia "Hurood" cheese[J]. Journal of Microbiology and Biotechnology, 2014, 24(2): 225-235. DOI:10.4014/jmb.1308.08075 |
| [16] |
Sun MQ. The comparison of traditional steamed bread and fermentation steamed bread[J]. China Food, 2007(19): 18-19. (in Chinese) 孙美琴. 老面馒头和发酵馒头大比拼[J]. 中国食品, 2007(19): 18-19. DOI:10.3969/j.issn.1000-1085.2007.19.009 |
| [17] |
Sutyak KE, Wirawan RE, Aroutcheva AA, et al. Isolation of the Bacillus subtilis antimicrobial peptide subtilosin from the dairy product-derived Bacillus amyloliquefaciens[J]. Journal of Applied Microbiology, 2008, 104(4): 1067-1074. DOI:10.1111/j.1365-2672.2007.03626.x |
| [18] |
Kaewklom S, Lumlert S, Kraikul W, et al. Control of Listeria monocytogenes on sliced bologna sausage using a novel bacteriocin, amysin, produced by Bacillus amyloliqufaciens isolated from Thai shrimp paste (Kapi)[J]. Food Control, 2013, 32(2): 552-557. DOI:10.1016/j.foodcont.2013.01.012 |
| [19] |
Fan HL, Jiang JP, Wang SY, et al. Optimization of the spore production conditions of strain BN-9 as probiotics to prevent calf diarrhea[J]. Hubei Agricultural Sciences, 2009, 48(2): 405-409. (in Chinese) 范会兰, 姜军坡, 王世英, 等. 抗犊牛腹泻益生菌株BN-9产芽孢条件的优化[J]. 湖北农业科学, 2009, 48(2): 405-409. |
| [20] |
Zhang J, Yang CM, Cao GT, et al. Bacillus amyloliquefaciens and its application as a probiotic[J]. Chinese Journal of Animal Nutrition, 2014, 26(4): 863-867. (in Chinese) 张娟, 杨彩梅, 曹广添, 等. 解淀粉芽孢杆菌及其作为益生菌的应用[J]. 动物营养学报, 2014, 26(4): 863-867. |
| [21] |
Chen C, Cui TB, Yu PR. Identification of an anti-fungal strain of Bacillus amyloliquefaciensand the properties of the antifungal substance[J]. Modern Food Science and Technology, 2011, 27(1): 36-39. (in Chinese) 陈成, 崔堂兵, 于平儒. 一株抗真菌的解淀粉芽孢杆菌的鉴定及其抗菌性研究[J]. 现代食品科技, 2011, 27(1): 36-39. |
| [22] |
Nakamura LK. Bacillus amylolyticus sp. nov., nom. rev. Bacillus lautus sp. nov., norn. rev., Bacillus pabuli sp. nov. norn. rev., and Bacillus validus sp. nov., nom. rev.[J]. International Jornal of Systematic Bacteriology, 1984, 34(2): 224-226. DOI:10.1099/00207713-34-2-224 |
 2017, Vol. 44
2017, Vol. 44