扩展功能
文章信息
- 胡栋, 何欢, 李洪涛, 张翠绵, 贾楠, 王占武, 彭杰丽
- HU Dong, HE Huan, LI Hong-tao, ZHANG Cui-mian, JIA Nan, WANG Zhan-wu, PENG Jie-li
- 亚低温条件下防控番茄南方根结线虫生防菌株的筛选与鉴定
- Screening and identification of biocontrol strains on controling tomato Meloidogyne incognita under sub-low temperature
- 微生物学通报, 2017, 44(8): 1891-1898
- Microbiology China, 2017, 44(8): 1891-1898
- DOI: 10.13344/j.microbiol.china.160747
-
文章历史
- 收稿日期: 2016-10-18
- 接受日期: 2017-01-03
- 优先数字出版日期(www.cnki.net): 2017-01-10
根结线虫(Meloidogyne spp.)是一类分布最广、危害最重的植物根系固定性内寄生物,严重危害世界农业的生产[1]。在我国北方地区,温室大棚以南方根结线虫发生较多,随着保护地栽培面积的逐步增加,复种指数越来越高,特别是节能日光温室的迅速发展,蔬菜根结线虫病的危害日益严重,发生区域也不断扩大。病害发生后,一般减产10%,严重时达到75%以上,甚至绝收[2-3]。生物防治具有无污染、生态环境友好等特点,是目前研究与开发的热点。
目前对优势菌株的筛选大多集中于目的菌株对根结线虫击倒或驱避性能检测方面,缺乏对目的菌株综合特性的研究,如在根际的定殖能力、群体动态变化、对植株生长的影响等[4-5]。此外,在亚低温条件下具有抗虫特性菌株的筛选还很少引起科研工作者的注意[6-7]。在我国北方,冬季设施大棚土壤的平均土温一般在15-20 ℃,而大部分土壤微生物的最适生长温度在25 ℃左右。因此,获得能在亚低温条件下防控根结线虫,并具有促进植物生长的优势菌株显得尤为重要。
本研究以设施蔬菜根结线虫为靶标,从发病蔬菜根际及根围土壤中分离功能微生物。以阿维菌素颗粒制剂为对照,采用室内和温室盆栽试验相结合的方法,筛选出对根结线虫二龄幼虫有较高防控活性,且在亚低温条件下具有促生、提高植物抗性的生防菌株。该研究将为高效、稳定根结线虫防控菌剂的研制奠定菌种资源和技术支持,对其他土传病害、线虫危害等高效生防制剂的研制具有理论和指导意义。
1 材料与方法 1.1 材料 1.1.1 供试线虫和拮抗指示菌: 分别从河北省藁城市、无极县及河北省农林科学院蔬菜试验园区采集根结线虫病发病土壤和黄瓜根结线虫病根,用于功能菌株的分离和根结线虫二龄幼虫的孵化。用于拮抗试验的植物病原菌尖孢镰刀菌黄瓜专化型(Fusarium oxysporium f.sp. cucumerinum) HG-11、立枯丝核菌(Rhizoctonia solani) AG-2、腐霉病菌(Pythium aphanidermatum) MJ-1、甜椒疫病菌(Phytophthora capsici) LJ-3由河北省农林科学院植物保护研究所提供。 1.1.2 培养基: 改良NA培养基(g/L):蛋白胨10.0,牛肉膏3.0,NaCl 5.0,丙酮酸钠0.5,琼脂18.0;改良高氏一号培养基(g/L):可溶性淀粉20.0,KNO3 1.0,K2HPO4 1.0,MgSO4·7H2O 0.5,FeSO4·7H2O 0.01,丙酮酸钠0.2,琼脂18.0。 1.1.3 主要试剂和仪器: 培养基成分相关试剂等均为国产分析纯试剂;细菌基因组提取试剂盒、PCR扩增相关试剂等,生工生物工程(上海)股份有限公司;引物合成和基因测序,上海英俊生物技术有限公司。PCR仪、电泳仪、凝胶成像仪等,美国Bio-Rad公司;超净工作台、恒温培养箱等,上海智城分析仪器制造有限公司。 1.2 菌株的分离取5 g土壤置于45 mL带有玻璃珠的无菌水三角瓶中,充分振荡后梯度稀释,取合适稀释度的100 μL涂布于改良NA培养基和改良高氏一号培养基上,3次重复。放置于28 ℃下恒温倒置培养。根据菌落的颜色、形态、大小等特征挑取不同的菌株进行纯化。纯化培养的菌株于20%甘油中-70 ℃长期保存和于试管斜面4 ℃临时保存。
1.3 菌株的初筛将孵化收集的根结线虫二龄幼虫经420目滤膜过滤后,制成100条/800 μL浓度的二龄幼虫悬浮液备用,仅当天使用。将所有的试验菌株接种到NA和改良高氏一号液体培养基中培养,13 000 r/min离心10 min,取上清的发酵液,稀释5倍后备用。在24孔组织培养板中,每孔接种200 μL 2倍稀释的菌株发酵滤液和800 μL南方根结线虫的悬浮液,常温放置24 h后,观察对线虫的击倒作用,并计数,3个重复。僵直的虫体视为被击倒,以无菌水作为对照。
校正击倒率(%)=100×(处理击倒率–对照击倒率)/(1–对照击倒率)。
1.4 目的菌株的复筛 1.4.1 耐亚低温菌株的筛选: 将校正击倒率大于70%的菌株接种到相应的固体生长培养基上,分别置于4、10、15、20 ℃培养箱中培养,2 d后开始观察固体培养基上菌落生长情况并记录开始生长的时间,将耐低温菌株用于下述试验。 1.4.2 病原真菌拮抗菌株筛选: 采用平板对峙培养法,测定不同菌株对尖孢镰刀菌黄瓜专化型等4种植物病原菌的抑菌率。 1.4.3 盆栽效果比较: 主要比较候选菌株防线虫和促生长特性。将上述试验获得的活性菌株,制成纯的固体菌剂,菌剂浓度为5.0×1010 cfu/g,按菌剂:土=1:300 (体积比)将菌剂均匀混入培养基质,定植两片真叶的番茄幼苗,每处理5个重复。培养基质为正常的有菌土壤复合一定比例的有机肥。定植60 d后,测定番茄植株地上和地下部分的生物量及番茄叶片的相对电导率。同时对每株番茄幼苗接种二龄幼虫1 000头左右,设置清水处理为阴性对照,0.7%的阿维菌素颗粒制剂为阳性对照。每处理5盆重复,控制温室环境温度15-18 ℃,60 d后按Benjumin D的根结分级标准,调查植株受害程度,计算病情指数和防治效果。 1.5 菌株的鉴定 1.5.1 表型特征和生理生化鉴定: 将待鉴定的菌株接种到高氏一号培养基、燕麦琼脂培养基、黄豆粉琼脂培养基、PDA培养基上,28℃培养2-7 d,期间观察并记录菌落、气生菌丝、基内菌丝、可溶性色素等生长特征。将待鉴定的菌株分别进行不同碳氮源利用、硝酸盐还原、淀粉水解等生理生化试验[8]。 1.5.2 16S rRNA基因序列测定与分析: 细菌总DNA的提取参照参考文献[9]的方法,并略作修改,将提取的DNA溶于TE缓冲液备用,用1%琼脂糖电泳检测DNA条带大小与质量。16S rRNA基因PCR扩增的引物为27f (5′-AGAGTTTGATCMTGG CTCAG-3′)和1492r (5′-TACGGYTACCTTGTTAC GACTT-3′)。16S rRNA基因PCR反应体系(50 µL):10×Reaction buffer 5.0 µL,2.5 mmol/L dNTPs 4.0 µL,10 μmol/L 27f 1.0 µL,10 μmol/L 1492r 1.0 µL,2.5 U/µL Taq DNA聚合酶1.0µL,模板DNA (约50 ng) 1.0 µL,ddH2O补至50 µL。PCR反应条件:94 ℃ 5 min;94 ℃ 40 s,56 ℃ 40 s,72 ℃ 90 s,30个循环;72 ℃ 5 min。PCR产物经1.0%琼脂糖凝胶电泳检测后送测序公司测序。序列拼接结果采用DNAMAN 6.0软件进行分析。将拼接成功的核苷酸序列提交至NCBI核苷酸序列库进行比对。再用MEGA 5.0进化树软件采用邻接法(Neighbor-Joining)构建系统发育树,自展值为1 000[10]。 2 结果与分析 2.1 防控根结线虫功能菌株的分离和初筛从发病黄瓜、番茄的根部、根际和根围土壤中共分离获得不同形态菌株297株,其中细菌207株,放线菌90株。经过初筛,得到9株对根结线虫二龄幼虫校正击倒率70%以上的菌株(表 1)。
| 序号 Serial No. |
菌株编号 Strain No. |
平均击倒率 Average mortality (%) |
校正击倒率 Corrected mortality (%) |
| 1 | B167 | 100.00 | 98.22 |
| 2 | S511 | 100.00 | 98.22 |
| 3 | S205 | 94.68 | 92.90 |
| 4 | B244 | 94.44 | 92.66 |
| 5 | S206 | 89.86 | 88.08 |
| 6 | S252 | 85.03 | 83.25 |
| 7 | STU101 | 79.34 | 77.56 |
| 8 | S251 | 78.03 | 76.25 |
| 9 | LK101 | 76.15 | 74.37 |
| 菌株编号 Strain No. |
生长初始时间 the first time to grow (days) |
|||
| 4 ℃ | 10 ℃ | 15 ℃ | 20 ℃ | |
| S205 | 28 | 12 | 8 | 5 |
| STU101 | - | 10 | 8 | 5 |
| B244 | - | 5 | 3 | 1 |
| S252 | - | 15 | 12 | 8 |
| LK101 | - | 5 | 3 | 1 |
| B167 | - | 5 | 3 | 1 |
| S511 | - | - | 20 | 12 |
| 供试菌株 Strains |
拮抗菌株Antagonistic strains | |||
| 腐霉病菌 Pythium aphanidermatum MJ-1 |
立枯丝核菌 Rhizoctonia solani AG-2 |
尖孢镰刀菌黄瓜专化型 Fusarium oxysporium f.sp. cucumerinum HG-11 |
甜椒疫病菌 Phytophthora capsici LJ-3 |
|
| S205 | 46.89 | 51.00 | 51.11 | 49.33 |
| STU101 | 48.56 | 46.67 | 46.56 | 51.67 |
| B244 | 51.22 | 55.44 | 48.44 | 46.44 |
| S252 | 46.33 | 48.78 | 48.56 | 51.22 |
| LK101 | 34.44 | 52.11 | 34.44 | - |
| B167 | 51.11 | 54.44 | 47.44 | 48.33 |
| S511 | - | - | - | - |
| 注:-:无拮抗作用. Note: -: No antagonism. | ||||
| 菌株编号 Strain No. |
病情指数 Disease index |
防治效果 Effect of controlling (%) |
| S205 | 5.34 | 56.82 |
| STU101 | 6.30 | 49.09 |
| 阿维菌素 Abamectin |
7.63 | 38.33 |
| B244 | 9.03 | 27.01 |
| S252 | 10.29 | 16.88 |
| LK101 | 10.93 | 11.69 |
| B167 | 11.40 | 7.88 |
| S511 | 12.32 | 0.46 |
| CK | 12.38 | - |
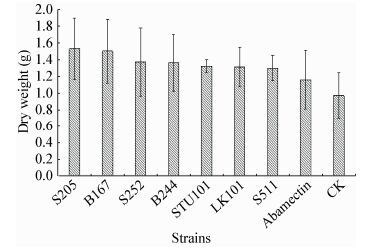
由图 1和图 2结果可见,不同处理均可提高番茄植株的地上鲜重和促进根系发育,其中菌株S205处理的番茄地上鲜重和根系干重与对照相比较差异显著(P<0.05)。

|
| 图 1 不同菌株对番茄地上鲜重的影响 Figure 1 Effect of different strain on the ground fresh weight of tomato |
|
|
|
| 图 2 不同菌株对番茄根系干重的影响 Figure 2 Effect of different strain on the dry weight of tomato root |
|
|
植物组织电导率是反映植株水分状况以及抗逆性的重要指标。相对电导率与植物抗性包括抗(耐)寒性、耐热性、耐盐性、抗病性等相关,相对电导率越低,说明细胞质电解液外渗的越少,细胞膜受到破坏的程度越低,细胞受到的伤害越小[11]。菌株S205、STU101和B244处理叶片的相对电导率均低于对照(表 5),说明采用3株菌处理后,植物细胞的系统抗性得到了显著改善。
| 菌株编号 Strain No. |
相对电导率 Relatively conductivity (%) |
| CK | 14.44a |
| S205 | 10.14b |
| STU101 | 10.45b |
| B244 | 12.78b |
| B167 | 14.55a |
| 阿维菌素Abamectin | 14.62a |
| S252 | 23.64c |
| S511 | 27.50c |
| LK101 | 57.42c |
| 注:小写字母不同表示数据差异达到显著水平(P<0.05). Note: Different letters in the control and treated stand for the significant difference at the 0.05 level. | |
通过初筛和系统复筛,筛选出一株综合性能优良的菌株S205。
2.3.1 表型特征及生理生化特性: 菌株S205在高氏一号培养基上生长良好,菌落圆形,表面干燥,菌落边缘整齐,凸起,菌落最初为白色,然后逐渐变成浅灰色或灰色,且与培养基结合较紧密。气生菌丝浅灰至深灰色,基内菌丝黄色,有可溶性色素产生。革兰氏染色阳性,菌丝无隔,不断裂,孢子丝呈链状直丝,孢子长椭圆形。生理生化试验结果如表 6所示。| 项目 Items |
结果 Results |
|
| 唯一碳源利用试验 Sole sugar utilization test |
D-木糖D-xylose | - |
| D-甘露糖D-mannose | + | |
| 葡萄糖Glucose | + | |
| D-半乳糖D-galactose | + | |
| 鼠李糖Rhamnose | +++ | |
| 棉籽糖Cottonseed sugar | + | |
| D-甘露醇D-mannitol | +++ | |
| L-阿拉伯糖L-arabinose | + | |
| 乳糖Lactose | - | |
| 麦芽糖Maltose | - | |
| 海藻糖Trehalose | + | |
| D-果糖D-fructose | + | |
| 蔗糖Sucrose | ++ | |
| 淀粉Starch | +++ | |
| 肌醇Inositol | ++ | |
| 唯一氮源利用试验 Sole nitrogen utilization test |
L-缬氨酸L-Valine | + |
| L-组氨酸L-Histidine | ++ | |
| L-苯丙氨酸L-Phenylalanine | +/- | |
| L-精氨酸L-Arginine | + | |
| L-丝氨酸L-Serine | + | |
| L-色氨酸L-Tryptophan | + | |
| L-赖氨酸L-Lysine | + | |
| L-羟脯氨酸L-Hydroxyproline | +/- | |
| L-半胱氨酸L-Cystine | + | |
| 不同盐浓度下生长情况 Grow and development under different salt concentration |
1% | +++ |
| 2% | ++ | |
| 3% | ++ | |
| 4% | + | |
| 5% | + | |
| 6% | - | |
| 生长温度试验 Grow and development under different temperature |
45 ℃ | - |
| 37 ℃ | +++ | |
| 28 ℃ | +++ | |
| 15 ℃ | + | |
| 10 ℃ | + | |
| 4 ℃ | + | |
| 不同pH生长试验 Grow and development under different pH |
pH 5.0 | - |
| pH 6.0 | + | |
| pH 7.0-8.0 | +++ | |
| pH 9.0 | + | |
| pH 10.0 | + | |
| pH 11.0 | - | |
| 硝酸盐还原试验Nitrate reduction test | + | |
| 明胶液化Gelatin liquefaction | + | |
| H2S的产生H2S production | - | |
| 淀粉水解Starch hydrolysis test | + | |
| 卵磷脂酶测定Lecithin enzyme assay | + | |
| 纤维素水解Cellulose hydrolysis test | + | |
| 注:+:阳性结果;-:阴性结果. Note: +: Positive results; -: Negative results. | ||

|
| 图 3 菌株S205的16S rRNA基因序列系统发育树 Figure 3 Phylogenetic tree constructed based on the 16S rRNA gene sequence of S205 注:分支点上的数字表示构建系统树时1 000次计算时形成该节点的百分比;括号内数值为Genbank登录号;标尺或刻度0.001代表 0.1%的16S rRNA基因序列的进化差异. Note: The bootstrap values presented at the branches were calculated from 1 000 replications; Numbers in parentheses are GenBank accession no.; The scale bar 0.001 represents 1 nucleotide substitutions per 1 000 nucleotide. |
|
|
根结线虫病害是我国农业特别是设施蔬菜产业多发且难以防治的主要病害之一,传统的化学和物理防治方法存在污染环境、成本高等问题。因此,利用功能微生物进行生物防治具有安全、高效、生态友好等特点,具有广阔的应用前景。由于我国北方设施大棚在冬季的地温为15-20 ℃,而大部分土壤微生物的最适生长温度在25 ℃左右,因此,将耐低温特性作为关键评价指标,是获得高效防控菌株的重要前提。此外,为了提高应用效果及其稳定性,综合评价目的菌株的拮抗病原真菌、促进根系发育等特性也非常必要。本研究将筛选亚低温下抗线虫特性和亚低温下促进植物生长发育相结合,筛选得到的菌株S205在室内耐低温测试中表现出很强的耐低温特性,可在4 ℃下生长。在15-18 ℃温室环境下,菌株S205处理的植株明显优于对照,说明菌株S205可在亚低温下发挥其生物功能。
对S511、B167、S205、B244、STU101、S252和LK101这7株菌的根结线虫拮抗的功能进行了盆栽试验验证,初步明确S205具有较好的抗虫和促生功能,有进一步开发和研究的价值。在盆栽试验过程中,由于7株菌的使用浓度都一致,这使得有些菌株在本次试验中表现一般的原因有可能有如下几点:(1) 不同菌株在土壤或根际或根内的“生态位”不一样,使用的浓度不一定相同;(2) 菌株不同,可能需要的增效物或配套措施也不同。另外,在前期的平皿实验中,菌株B167和S511对线虫的击倒率最高,但在盆栽试验中却没有表现出较好的防控效果,可能与土壤环境、宿主专一性有关。
在盆栽试验中,只用了有菌的培养基质来检验S205的抗线虫和促生功能,然而番茄根际微生物与S205是如何互相影响和作用的却不清楚,因此有必要在进一步的研究中验证S205在无菌培养基质中的抗线虫和促生功能。
研究采用的是经典的平板分离方法,由于该方法具有高度选择性,分离出来的菌株仅占土壤细菌群落的很小一部分,另外培养环境与土壤环境相差很远,因此对目的菌株的获得具有很大局限。据报道,在土壤、植物根际、植物组织中都存在数量庞大的微生物群落,其中迄今不可培养的占90%-99%[12],这些难培养的细菌很可能在土壤系统的“生态位”起着重要作用。近年来,国内外学者开始利用以分子生物学为核心的微生物非培养技术研究土壤或其他环境中的微生物,并取得了重要进展,这将为根际线虫拮抗菌株的“定向分离”提供理论和技术支持。
目前已报道的各种链霉菌在次级代谢产物上研究较多[13],但关于抗生素链霉菌(Streptomyces antibioticus)的报道还很少,尤其是抗生素链霉菌在亚低温条件下抗南方根结线虫功能上未见有报道,本研究发现的抗生素链霉菌菌株除具有抗根结线虫和拮抗病原真菌外,还有一定的促生和提高植株系统抗性的功能,其田间应用效果还需做深入试验予以证明。
| [1] |
Mai WF, Abawi GS. Interactions among root-knot nematodes and fusarium wilt fungi on host plants[J]. Annual Review of Phytopathology, 1987, 25(1): 317-338. DOI:10.1146/annurev.py.25.090187.001533 |
| [2] |
Lei JC, Huang HQ. Research advance on biological control of the meloidogyne incognita[J]. Chinese Journal of Biological Control, 2007, 23(S1): 76-81. (in Chinese) 雷敬超, 黄惠琴. 南方根结线虫生物防治研究进展[J]. 中国生物防治, 2007, 23(S1): 76-81. |
| [3] |
Fang Z, Peng DL, Li JH. Control effect of three fungal strains fermentation liquid to tomato root-knot nematode[J]. Journal of Huazhong Agricultural University, 2010, 29(4): 440-443. (in Chinese) 方治, 彭德良, 李建洪. 3株真菌发酵液对番茄根结线虫的防治效果[J]. 华中农业大学学报, 2010, 29(4): 440-443. |
| [4] |
Wei H, Liu M, Bao SX, et al. Screening and characterization of anti-root-knot nematode actinomycetes strain from mud under mangrove (Rhizophora) forest[J]. Journal of Microbiology, 2012, 32(4): 13-16. (in Chinese) 魏华, 刘敏, 鲍时翔, 等. 1株抗根结线虫红树林放线菌的筛选与鉴定[J]. 微生物学杂志, 2012, 32(4): 13-16. |
| [5] |
Huang HQ, Yuan WD, Wei H, et al. Screening and identification of an actinomycete strain with nematicidal activity[J]. Biotechnology Bulletin, 2013(11): 175-179. (in Chinese) 黄惠琴, 袁维道, 魏华, 等. 一株抗根结线虫放线菌的筛选与鉴定[J]. 生物技术通报, 2013(11): 175-179. |
| [6] |
de Araujo FF, Marchesi GVP. Use of Bacillus subtilis in the control of root-knot nematode and the growth promotion in tomato[J]. Ciência Rural, 2009, 39(5): 1558-1561. DOI:10.1590/S0103-84782009000500039 |
| [7] |
Singh P, Siddiqui ZA. Biocontrol of root-knot nematode Meloidogyne incognita by the isolates of Bacillus on tomato[J]. Archives of Phytopathology and Plant Protection, 2010, 43(14): 1423-1434. DOI:10.1080/03235400802536857 |
| [8] |
K mpfer P, Busse HJ, Scholz HC. Chromobacterium piscinae sp. nov. and Chromobacterium pseudoviolaceum sp. nov., from environmental samples[J]. International Journal of Systematic and Evolutionary Microbiology, 2009, 59(10): 2486-2490. DOI:10.1099/ijs.0.008888-0 |
| [9] |
Rainey FA, Ward-Rainey N, Kroppenstedt RM, et al. The genus Nocardiopsis represents a phylogenetically coherent taxon and a distinct actinomycete lineage: proposal of Nocardiopsaceae fam. nov.[J]. International Journal of Systematic and Evolutionary Microbiology, 1996, 46(6): 1088-1092. |
| [10] |
Xiao C, Huang HQ, Ye JJ, et al. Ornithinibacter aureus gen. nov., sp. nov., a novel member of the family Intrasporangiaceae[J]. International Journal of Systematic and Evolutionary Microbiology, 2011, 61(3): 659-664. DOI:10.1099/ijs.0.022806-0 |
| [11] |
Cornelissen JHC, Lavorel S, Garnier E, et al. A handbook of protocols for standardised and easy measurement of plant functional traits worldwide[J]. Australian Journal of Botany, 2003, 51(4): 335-380. DOI:10.1071/BT02124 |
| [12] |
Cristinzio G, Scala F. Electrolyte leakage as a potential method for measuring of eggplant resistance and Verticillium dahliae virulence[J]. Phytopathology, 1994, 29(4): 184-190. |
| [13] |
Dai FP, Li SW. Progress on the secondary metabolites and applications of Streptomyces[J]. Biotechnology Bulletin, 2014(3): 30-35. (in Chinese) 代芳平, 李师翁. 链霉菌次级代谢物及其应用研究进展[J]. 生物技术通报, 2014(3): 30-35. |
 2017, Vol. 44
2017, Vol. 44