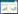扩展功能
文章信息
- 李炫莹, 沈文丽, 张旭旺, 裴晓芳, 李亚飞, 殷庆鑫, 由胜男, 王经伟, 曲媛媛
- LI Xuan-Ying, SHEN Wen-Li, ZHANG Xu-Wang, PEI Xiao-Fang, LI Ya-Fei, YIN Qing-Xin, YOU Sheng-Nan, WANG Jing-Wei, QU Yuan-Yuan
- Trichosporon montevideense WIN合成纳米金的催化特性
- Catalytic characteristics of gold nanoparticles biosynthesized by Trichosporon montevideense WIN
- 微生物学通报, 2017, 44(8): 1858-1865
- Microbiology China, 2017, 44(8): 1858-1865
- DOI: 10.13344/j.microbiol.china.170074
-
文章历史
- 收稿日期: 2017-01-26
- 接受日期: 2017-04-24
- 优先数字出版日期(www.cnki.net): 2017-05-25
2. 工业生态与环境工程教育部重点实验室 大连理工大学食品与环境学院 辽宁 盘锦 124221
2. Key Laboratory of Industrial Ecology and Environmental Engineering (Ministry of Education), School of Food and Environmental Science and Technology, Dalian University of Technology, Panjin, Liaoning 124221, China
纳米金颗粒一般指粒径为1 nm-100 nm的金颗粒[1],由于其特殊的结构和表面性能及良好的稳定性,被广泛应用于化学催化[2]、生物传感器[3]、生物医药[4]等领域。目前合成纳米金的方法有物理法[5]、化学法[6]和生物法[7]。相比物理法和化学法,生物法合成纳米金绿色环保无污染,且合成的纳米金分散性较好、生物相容性高、产率高、成本低,近年来受到广泛关注[8]。生物法合成纳米金常用的生物资源有细菌[9]、放线菌[10]、真菌[11-12]及植物提取液[13]等,其中真菌能够分泌大量蛋白酶及次级代谢产物等,合成的纳米金产量大、分散性好、易于分离[14],因此在生物合成纳米金中具有更大的优势和潜力。
本实验室前期从活性污泥中分离得到一株丝孢酵母菌Trichosporon montevideense WIN,证明其具有纳米金合成能力[15]。本文在前期实验的基础上,进一步考察不同浓度氯金酸对菌株WIN合成纳米金的影响,以及活性和灭活WIN菌两种反应体系合成纳米金的能力及其合成的纳米金对硝基芳烃污染物催化还原的特性。酵母菌作为简单的单细胞真核生物,易于培养且生长迅速,探究其合成纳米金的特性有助于酵母菌在商业应用方面的推广。
1 材料与方法 1.1 实验材料 1.1.1 菌株: Trichosporon montevideense WIN为本实验室前期从活性污泥中筛选分离得到[15],保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏号为CGMCC 10368。菌株WIN的26S rRNA基因序列(550 bp)已提交到GenBank数据库,登录号为KP676895。 1.1.2 主要试剂和仪器: 氯金酸(HAuCl4),百灵威科技有限公司;硝基类化合物,国药集团化学试剂有限公司;所有化学试剂均为分析纯及以上。V-560紫外-可见分光光度计,日本分光株式会社;JY92-IIN超声破碎仪,宁波新芝生物科技股份有限公司;Perkin-Elmer Optima 2000DV电感耦合等离子体光谱仪,珀金埃尔默股份有限公司;Tecnai G220 S-Twin透射电子显微镜,美国FEI公司。 1.1.3 培养基: 改良马丁培养基(g/L):KH2PO4 1.0,(NH4)2SO4 1.0,MgSO4·7H2O 0.5,葡萄糖5.0,pH 7.0。6.76×104Pa灭菌15 min。 1.2 实验方法 1.2.1 菌株WIN生长曲线: 改良马丁培养基灭菌后接种菌株WIN,接菌量为10% (体积比),置于30 ℃、150 r/min振荡培养。以660 nm波长处的吸光度值(OD660)表示WIN菌液浓度,每12 h测一次WIN菌液的OD660值,以OD660值的变化趋势表示菌株WIN的生长趋势。 1.2.2 不同浓度氯金酸对菌株WIN合成纳米金的影响: 取稳定期WIN菌液(OD660为1.0),分别取6 mL于3个小管中,加入HAuCl4使其终浓度分别为1、2和4 mmol/L,30 ℃、150 r/min下避光培养。 1.2.3 活性WIN菌合成纳米金: 取稳定期菌液(OD660为0.47) 7 mL至小管中,加入HAuCl4使其终浓度为1 mmol/L,30 ℃、150 r/min下避光培养。 1.2.4 灭活WIN菌合成纳米金: 稳定期菌液(OD660为0.47) 湿热灭菌(6.76×104 Pa,15 min),取7 mL至小管中,加入HAuCl4使其终浓度为1 mmol/L,30 ℃、150 r/min下避光培养。 1.2.5 金颗粒的分离、鉴定及表征: (1) 紫外-可见分光光度计分析法(UV-vis)。超声破碎仪破碎细胞30 min,低转速(3 000 r/min)离心5 min后收集上清液,于400-800 nm波长范围进行全波扫描。(2) 电感耦合等离子体光谱仪分析法(ICP)。取0.4 mL反应体系溶液于2 mL小管中,20 ℃、10 000×g离心20 min,得到样品的上清液用电感耦合等离子体光谱仪在波长267.595 nm处测定反应液中剩余金元素含量。将反应体系菌液超声30 min后,取0.2 mL于2 mL小管中,用1 mL王水(HCl:HNO3=3:1,体积比)溶解后定容至2 mL,利用ICP测定金元素含量。(3) 透射电子显微镜分析法(TEM)。取适量纳米金溶液,超声波振荡10 min,取适量纳米金溶液滴在铜网上,晾干,重复5-6次后获得样品。在透射电子显微镜下观察纳米金的形貌及尺寸。 1.2.6 纳米金对硝基芳烃化合物的催化还原: 选择4-硝基苯酚作为目标底物,考察菌株WIN合成纳米金的催化活性。取100 μL 4-硝基苯酚(2 mmol/L)与400 μL NaBH4 (50 mmol/L)溶液混合,然后加入100 μL合成的纳米金样品以及1 400 μL超纯水,充分混合。使用紫外-可见分光光度计监测反应过程,定时全波扫描,检测范围为250-500 nm,扫描间隔为1 nm。以不加入纳米金的实验组作为空白对照。 2 结果与分析 2.1 菌株WIN生长曲线菌株WIN的生长曲线见图 1。菌株WIN在0-60 h期间生长迅速,60 h后其生长量(OD660值)基本趋于稳定。因此,选择培养60 h的菌株WIN用于纳米金的合成。
|
| 图 1 菌株WIN生长曲线 Figure 1 The growth curve of strain WIN |
|
|
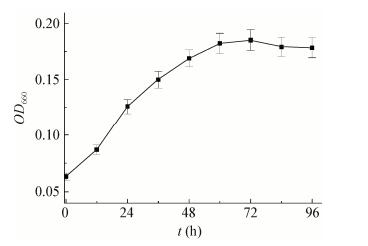
考察1、2和4 mmol/L 3种浓度HAuCl4对菌株WIN合成纳米金的影响,3种HAuCl4浓度的反应体系颜色分别为紫色、浅棕色和黄色(图 2)。通过颜色观察发现,加入1 mmol/L HAuCl4的管壁附着有紫黑色物质,加入2 mmol/L和4 mmol/L HAuCl4的管壁附着有金颗粒。在400-800 nm波长范围内对3组反应体系进行全波扫描,并与空白对照组进行对比发现,HAuCl4浓度为1 mmol/L的反应体系在600 nm出现特征吸收峰,而HAuCl4浓度为2 mmol/L和4 mmol/L的两组体系未出现明显特征吸收峰。
|
| 图 2 菌株WIN作用不同浓度氯金酸全波图以及还原产物图片 Figure 2 UV-vis spectra of strain WIN with different concentration of HAuCl4 and the photos of reduzate 注:a:菌株WIN作用不同浓度氯金酸的全波图,插图为反应体系的颜色图;B:菌株WIN作用不同浓度氯金酸的还原产物图片. Note: A: UV-vis spectra of strain WIN with different concentration of HAuCl4, and the insets show the color change of reaction system with different concentration of HAuCl4; B: The appearance photos of reduzate from different reaction system. |
|
|
由于尺寸差异,纳米金的表面等离子体共振效应不同,反应体系呈现出的颜色也不同,而全波图中的最大吸收波长与纳米金粒径大小有着直接关联[7]。根据颜色观察及全波图分析,HAuCl4浓度为1 mmol/L时,菌株WIN合成了纳米金;HAuCl4浓度为2 mmol/L和4 mmol/L时,菌株WIN合成了粒径较大的金颗粒,这些金颗粒在反应液中沉淀析出。
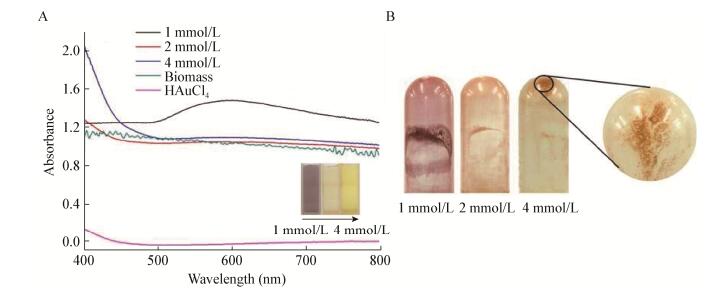
2.3 活性WIN菌合成纳米金活性WIN菌作用HAuCl4反应12 h后,观察到粉色物质生成。随着反应进行,颜色逐渐加深,并由粉色逐渐变为紫色,管壁上也附着少量大尺寸金颗粒。取反应9 d后的产物,利用紫外可见分光光度计在450-650 nm波长范围进行全波扫描。结果如图 3A所示,在544 nm处出现特征吸收峰,与AuNPs的特征吸收峰相吻合,证明合成了纳米金[16]。经ICP分析,AuNPs浓度为418.9 μmol/L,该体系24 h后Au3+转化率为98.87%。Au3+转化率计算公式如下:
|
| 图 3 活性WIN菌合成纳米金表征图 Figure 3 The characterization of AuNPs synthesized by active cells of WIN 注:A:活性WIN菌合成纳米金全波图,插图为管壁金颗粒照片;B:活性WIN菌合成纳米金粒径分析图,插图为纳米金的TEM照片. Note: A: The UV-vis spectra of AuNPs synthesized by active cells of strain WIN, and the insert represents the photo of gold particles on tube wall; B: The particle size analysis of AuNPs synthesized by active cells of strain WIN, and the insert represents the TEM image of AuNPs. |
|
|
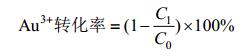
|
式中:C0:反应起始时刻Au3+浓度,mg/L;C1:反应1 d后反应体系上清液中剩余的Au3+浓度,mg/L。
利用TEM对合成的纳米金进行观察,如图 3B所示,有三角形、四边形、六边形、球形等形貌,以球形纳米金为主。用Nano Measurer 1.2.5粒径分析软件对TEM照片中的纳米金粒径进行分析,发现活性WIN菌合成的纳米金粒径范围是3 nm-252 nm,平均粒径是45.2 nm,粒径 < 10 nm的纳米金占5%,粒径处于3 nm-88 nm范围内的纳米金占90.4%,也有少量 > 200 nm的金颗粒形成。
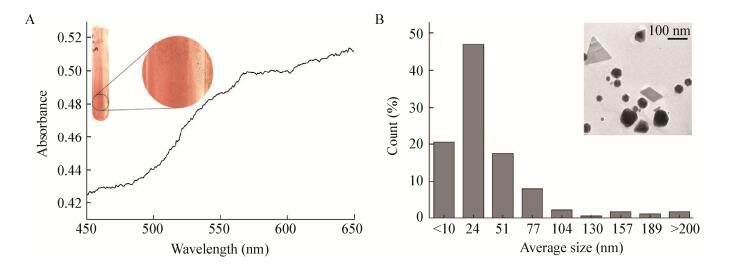
2.4 灭活WIN菌合成纳米金灭活WIN菌作用HAuCl4反应12 h后,观察到粉色物质生成。随着反应进行,颜色逐渐加深,并由浅粉色逐渐变为浅粉紫色,管壁上同样有少量大尺寸金颗粒生成。取反应9 d后的样品进行分析,利用紫外可见分光光度计在450-650 nm波长范围内进行全波扫描。结果如图 4A所示,其特征吸收峰出现在570 nm处,与AuNPs的特征吸收峰相吻合,证明合成了纳米金[16]。经ICP分析,AuNPs浓度为516.5 μmol/L,该体系24 h后Au3+转化率为95.81% (转化率公式同2.3)。
|
| 图 4 灭活WIN菌合成纳米金表征图 Figure 4 The characterization of AuNPs synthesized by inactive cells of strain WIN 注:A:灭活WIN菌合成纳米金全波图,插图为管壁金颗粒照片;B:灭活WIN菌合成纳米金粒径分析图,插图为灭活WIN菌液合成纳米金的TEM照片. Note: A: The UV-vis spectra of AuNPs synthesized by inactive cells of strain WIN, and the insert represents the photo of gold particles on tube wall; B: The particle size analysis of AuNPs synthesized by inactive cells of strain WIN, and the insert represents the TEM image of AuNPs. |
|
|
利用TEM对合成的纳米金颗粒进行观察,如图 4B所示,有三角形、四边形、六边形、球形等纳米金,以球形纳米金为主。粒径分析发现灭活WIN菌合成的纳米金粒径范围是1 nm-271 nm,平均粒径是38.3 nm,粒径 < 10 nm的纳米金占20%,粒径处于1 nm-88 nm范围内的纳米金颗粒占93.0%,也有少量 > 200 nm的金颗粒形成。
对比灭活WIN菌,活性WIN菌对Au3+还原率高出3.1%,说明活性WIN菌对Au3+还原能力更强。但灭活WIN菌合成的纳米金平均粒径更小,粒径小于10 nm的金颗粒也更多。
2.5 纳米金对硝基芳烃化合物的催化还原为了考察菌株WIN合成纳米金的催化特性,将活性和灭活WIN菌株合成的纳米金各取100 μL用于4-硝基苯酚的催化还原。4-硝基苯酚溶液呈淡黄色,在320 nm处有特征吸收峰。向4-硝基苯酚溶液中加入NaBH4会迅速产生4-硝基苯酚钠,溶液由淡黄色变为深黄色,同时特征吸收峰由320 nm转移到402 nm。向混合物中加入少量纳米金,溶液颜色逐渐由深黄色变为无色,同时402 nm处的吸收峰强度逐渐减弱,297 nm处出现新的特征吸收峰,表明产生了新的物质——4-氨基苯酚。
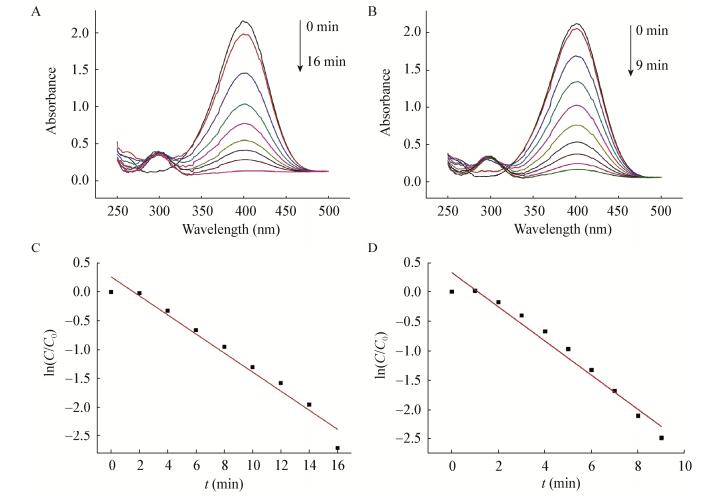
如图 5所示,活性和灭活WIN菌合成的纳米金对4-硝基苯酚的催化还原过程中,4-硝基苯酚的去除率达到90%需要的时间分别为16 min和9 min。由于反应体系中NaBH4的浓度要远高于4-硝基苯酚的浓度,可以认为NaBH4的量在整个反应过程中保持不变,该反应遵循假一级反应。根据动力学方程计算可知活性和灭活WIN菌液合成纳米金催化4-硝基苯酚降解的反应速率常数(k)分别为2.76×10-3 s-1和4.84×10-3 s-1。
|
| 图 5 纳米金催化还原4-硝基苯酚的UV-vis光谱图及ln(C/C0)随反应时间变化对纳米金的线性关系 Figure 5 UV-vis spectra of nitroaromatics reduction catalyzed by AuNPs and linear correlation of ln(C/C0) with time for AuNPs 注:A:活性WIN菌合成的纳米金催化还原4-硝基苯酚的UV-vis光谱图;B:灭活WIN菌合成的纳米金催化还原4-硝基苯酚的UV-vis光谱图;C:ln(C/C0)随反应时间变化对活性WIN菌合成的纳米金的线性关系;D:ln(C/C0)随反应时间变化对灭活WIN菌合成的纳米金的线性关系. Note: A: UV-vis spectra of nitroaromatics reduction catalyzed by AuNPs synthesized with active cells of strain WIN; B: UV-vis spectra of nitroaromatics reduction catalyzed by AuNPs synthesized with inactive cells of strain WIN; C: Linear correlation of ln(C/C0) with time using AuNPs synthesized by active cells of strain WIN; D: Linear correlation of ln(C/C0) with time using AuNPs synthesized by inactive cells of strain WIN. |
|
|
本实验采用Trichosporon montevideense WIN合成纳米金,考察了不同浓度HAuCl4对菌株WIN合成纳米金的影响。HAuCl4浓度为1 mmol/L时合成了纳米金;当HAuCl4浓度为2 mmol/L和4 mmol/L时,合成了较大尺寸的金颗粒,从反应液中沉淀析出。UV-vis分析表明活性和灭活WIN菌均能合成纳米金。ICP分析发现活性和灭活WIN菌对Au3+的还原率分别为98.87%和95.81%,活性和灭活WIN菌两组反应体系中AuNPs的含量分别为418.9 μmol/L和516.5 μmol/L,说明活性WIN菌对Au3+的还原能力更强,但灭活WIN菌反应体系中合成了更多的纳米金。TEM图像显示活性和灭活WIN菌合成的纳米金形貌以球形为主,也有少量三角形、平行四边形和六边形。
活性和灭活WIN菌合成纳米金的平均粒径分别为45.2 nm和38.3 nm,同时发现灭活WIN菌株合成的尺寸在10 nm左右的纳米金占所有纳米金的20%以上。微生物合成纳米金被视作微生物应对重金属的脱毒作用,细胞会将重金属还原为毒性较小的零价态金属颗粒[17]。小粒径纳米金比表面积大,容易团聚形成大粒径金颗粒,而生物分子能够作为封端剂使小粒径纳米金稳定[18]。推测WIN菌灭活后可能释放出更多的生物小分子,从而有利于形成小尺寸纳米金颗粒。
活性和灭活WIN菌合成的纳米金催化还原4-硝基苯酚的催化速率分别为2.76×10-3 s-1和4.84×10-3 s-1。一般认为,粒径在10 nm以下的纳米金粒子才具有较高的催化活性。Valden等[19]研究表明,具有非金属特性尺寸(约3.5 nm)的纳米金粒子具有最高的催化活性,将纳米金粒子的特殊催化效应归结于量子尺寸效应。结合粒径分析,灭活WIN菌合成了更多10 nm以下的纳米金粒子,比活性WIN菌合成的纳米金对4-硝基苯酚的催化速率高,说明灭活WIN菌合成的纳米金对4-硝基苯酚具有更好的催化能力,在硝基芳烃污染物降解方面具有潜在的应用价值。
本研究首次报道丝孢酵母菌可以同时合成三角形、平行四边形、六边形、球形纳米金,该现象的发现为调控微生物定向合成特定形貌的纳米金提供了可操作的空间,下一步工作可以就定向调控微生物合成特定形貌的纳米金展开研究。此外,微生物合成纳米金是复杂的生物化学过程,其机理尚不明晰,下一步研究工作主要是解析并分离参与合成纳米金还原与稳定的物质成分,探索微生物合成纳米金的分子生物学机制。
| [1] |
Zhang JC, Liu K, Cao WL. Property, preparation and application of nanoparticle[J]. Journal of Petrochemical Universities, 2001, 14(2): 21-26. (in Chinese) 张敬畅, 刘慷, 曹维良. 纳米粒子的特性、应用及制备方法[J]. 石油化工高等学校学报, 2001, 14(2): 21-26. |
| [2] |
Larsson EM, Langhammer C, Zorić I, et al. Nanoplasmonic probes of catalytic reactions[J]. Science, 2009, 326(5956): 1091-1094. DOI:10.1126/science.1176593 |
| [3] |
Zhang FX, Han L, Israel LB, et al. Colorimetric detection of thiol-containing amino acids using gold nanoparticles[J]. Analyst, 2002, 127(4): 462-465. DOI:10.1039/b200007e |
| [4] |
Farokhzad OC, Langer R. Impact of nanotechnology on drug delivery[J]. ACS Nano, 2009, 3(1): 16-20. DOI:10.1021/nn900002m |
| [5] |
Das M, Shim KH, An SSA, et al. Review on gold nanoparticles and their applications[J]. Toxicology and Environmental Health Sciences, 2011, 3(4): 193-205. DOI:10.1007/s13530-011-0109-y |
| [6] |
Turkevich J, Stevenson PC, Hillier J. A study of the nucleation and growth processes in the synthesis of colloidal gold[J]. Discussions of the Faraday Society, 1951, 11: 55-75. DOI:10.1039/df9511100055 |
| [7] |
Liu ZY, Zhou H, Shen E, et al. Recent advances in microbes-mediated biosynthesis of gold nanoparticles[J]. Microbiology China, 2015, 42(8): 1584-1592. (in Chinese) 刘紫嫣, 周豪, 沈娥, 等. 微生物介导的金纳米颗粒合成[J]. 微生物学通报, 2015, 42(8): 1584-1592. |
| [8] |
Suresh AK, Pelletier DA, Wang W, et al. Biofabrication of discrete spherical gold nanoparticles using the metal-reducing bacterium Shewanella oneidensis[J]. Acta Biomaterialia, 2011, 7(5): 2148-2152. DOI:10.1016/j.actbio.2011.01.023 |
| [9] |
Gericke M, Pinches A. Biological synthesis of metal nanoparticles[J]. Hydrometallurgy, 2006, 83(1/4): 132-140. |
| [10] |
Ahmad A, Senapati S, Khan MI, et al. Extracellular biosynthesis of monodisperse gold nanoparticles by a novel extremophilic actinomycete, Thermomonospora sp[J]. Langmuir, 2003, 19(8): 3550-3553. DOI:10.1021/la026772l |
| [11] |
Mishra AN, Bhadauria S, Gaur MS, et al. Extracellular microbial synthesis of gold nanoparticles using fungus Hormoconis resinae[J]. JOM, 2010, 62(11): 45-48. DOI:10.1007/s11837-010-0168-6 |
| [12] |
Du LW, Xian L, Feng JX. Rapid extra-/intracellular biosynthesis of gold nanoparticles by the fungus Penicillium sp[J]. Journal of Nanoparticle Research, 2011, 13(3): 921-930. DOI:10.1007/s11051-010-0165-2 |
| [13] |
Song JY, Jang HK, Kim BS. Biological synthesis of gold nanoparticles using Magnolia kobus and Diopyros kaki leaf extracts[J]. Process Biochemistry, 2009, 44(10): 1133-1138. DOI:10.1016/j.procbio.2009.06.005 |
| [14] |
Castro-Longoria E, Vilchis-Nestor AR, Avalos-Borja M. Biosynthesis of silver, gold and bimetallic nanoparticles using the filamentous fungus Neurospora crassa[J]. Colloids and Surfaces B: Biointerfaces, 2011, 83(1): 42-48. DOI:10.1016/j.colsurfb.2010.10.035 |
| [15] |
Shen WL, Qu YY, Pei XF, et al. Green synthesis of gold nanoparticles by a newly isolated strain Trichosporon montevideense for catalytic hydrogenation of nitroaromatics[J]. Biotechnology Letters, 2016, 38(9): 1503-1508. DOI:10.1007/s10529-016-2120-5 |
| [16] |
Shankar SS, Ahmad A, Pasricha R, et al. Bioreduction of chloroaurate ions by geranium leaves and its endophytic fungus yields gold nanoparticles of different shapes[J]. Journal of Materials Chemistry, 2003, 13(7): 1822-1826. DOI:10.1039/b303808b |
| [17] |
Nair B, Pradeep T. Coalescence of nanoclusters and formation of submicron crystallites assisted by Lactobacillus strains[J]. Crystal Growth & Design, 2002, 2(4): 293-298. |
| [18] |
Hulkoti NI, Taranath TC. Biosynthesis of nanoparticles using microbes—a review[J]. Colloids and Surfaces B: Biointerfaces, 2014, 121: 474-483. DOI:10.1016/j.colsurfb.2014.05.027 |
| [19] |
Valden M, Lai X, Goodman DW. Onset of catalytic activity of gold clusters on Titania with the appearance of nonmetallic properties[J]. Science, 1998, 281(5383): 1647-1650. DOI:10.1126/science.281.5383.1647 |
 2017, Vol. 44
2017, Vol. 44