扩展功能
文章信息
- 许艳婷, 李祎, 赵国威, 王海磊, 郑天凌
- XU Yan-Ting, LI Yi, ZHAO Guo-Wei, WANG Hai-Lei, ZHENG Tian-Ling
- 絮凝菌株Shinella sp. xn-1对铜绿微囊藻的絮凝效果
- Flocculation effect of Shinella sp. xn-1 on Microcystis aeruginosa
- 微生物学通报, 2017, 44(8): 1808-1816
- Microbiology China, 2017, 44(8): 1808-1816
- DOI: 10.13344/j.microbiol.china.160882
-
文章历史
- 收稿日期: 2016-12-01
- 接受日期: 2017-02-13
- 优先数字出版日期(www.cnki.net): 2017-02-28
2. 厦门大学生命科学学院 福建 厦门 361102
2. School of Life Sciences, Xiamen University, Xiamen, Fujian 361102, China
随着工业化步伐的大力推进,包含大量氮、磷物质的工业及生活废物被排放入水体后,造成水体中营养过剩,引起藻类及其他浮游生物迅速繁殖,即“水体富营养化”[1]。在水体富营养化出现后,蓝藻由于其自身繁殖迅速和竞争性强,往往可以抑制其他藻类的生长而成为水体富营养化的优势种,从而形成“水华”[2]。蓝藻形成水华后会引起水质恶化,造成其他水生生物的死亡[3]。特别是某些蓝藻如铜绿微囊藻(Microcystis aeruginosa)会散发刺鼻的气味,还会产生微囊藻毒素(Microcystins),对人体健康造成严重的影响[4]。如何有效缓解及治理蓝藻水华成为淡水环境研究的热点和焦点。
目前国内外对水华的治理方法主要包括物理、化学、生物等方法[5]。有研究者采用投加化学试剂来达到絮凝藻的效果,但是这些化学药品会对水体环境造成二次伤害,不具有生态安全性。超声絮凝和电絮凝等物理方法成本较高、不易操作,并不能很好地应用于水华的治理[6]。近年来,不少研究者发现微生物可以与蓝藻进行相互作用,或者可以分泌絮凝物质,从而有效缓解蓝藻水华的危害[7],并且微生物具有生态安全性,也是我们主要的研究方向。
本论文主要研究菌株Shinella sp. xn-1对铜绿微囊藻的絮凝作用,以蓝藻水华藻——铜绿微囊藻(Microcystis aeruginosa 7820) 为研究目标,从蓝藻藻际环境中筛选到一株有明显絮凝功能的菌株xn-1,对其进行了形态鉴定和进化地位确定,并对其絮凝作用来源、絮凝物质添加量及不同pH和不同金属离子对其絮凝效果的影响等进行初步探究,以期为应用絮凝微生物治理蓝藻水华奠定理论基础。
1 材料与方法 1.1 供试菌种、藻种及其培养絮凝菌株xn-1分离于铜绿微囊藻7820藻际,采用LB培养基(胰蛋白胨10.0 g,酵母粉5.0 g,氯化钠30.0 g,pH 7.2,1.0 L蒸馏水),于28 ℃、150 r/min振荡培养。供试藻种为铜绿微囊藻(Microcystis aeruginosa 7820) 购于中国科学院野生生物种质库,采用BG11培养基,于光强50 μE/(m2·s),温度25±1 ℃,昼夜比L:D=12 h:12 h的条件下培养。BG11培养基(g/L):NaNO31.500,K2HPO4 0.040,MgSO4·7H2O 0.075,CaCl2·7H2O 0.036,Na2CO30.020,柠檬酸0.006,柠檬酸铁0.006,微量元素溶液A5 1.0 mL,EDTA 0.001,蒸馏水1.0 L,用于铜绿微囊藻的培养。微量元素混合溶液A5 (g/L):H3BO4 2.860,MnCl2·4H2O 1.810,ZnSO4 0.222,Na2MoO4 0.390,CuSO4·5H2O 0.079,Co(NO3)2·6H2O 0.490。絮凝培养基(g/L):NaCl 24.0,NH4Cl 1.0,MgSO4·7H2O 0.5,K2HPO4·3H2O 6.5,KH2PO42.0,葡萄糖10.0,酵母粉0.6,pH调至7.0,用于菌的培养。
1.2 主要试剂和仪器细菌基因组DNA提取试剂盒,TaKaRa公司。超净工作台,苏州智净净化设备有限公司;酶标仪,郑州金友宁仪器有限公司;光照培养箱,宁波莱福科技有限公司;离心机,美国贝克曼库尔特公司;光学显微镜BX63,日本奥林巴斯有限公司。
1.3 实验方法 1.3.1 絮凝菌株xn-1的分离: 取铜绿微囊藻7820的藻液20 mL,通过0.2 μm的聚碳酸膜过滤,获得游离和粘附的细菌样品[8]。采取逐级稀释法将样品分别涂布在LB固体培养基表面,置于28 ℃培养2-3 d。挑取不同类型单菌落划线于LB固体平板,置于28 ℃温度下培养2-3 d,重复该步骤直到得到纯培养。分别将0.5 mL不同纯培养的发酵产物接种于10 mL铜绿微囊藻培养液中,于室温120 r/min、振摇5 min后,再在25±1 ℃、昼夜比L:D=12 h:12 h的条件下培养7 d,0.5 mL灭菌的BG11培养基加入藻液作为对照组,处理组和对照组分别设置3个平行;观察处理组中对7820藻有絮凝作用的菌株,从而筛选出絮凝菌株。用20%甘油将其保存在-80 ℃,待用。 1.3.2 菌株xn-1的菌落形态观察及简单染色: 将菌株xn-1接种到LB固体平板上,于28 ℃恒温培养24-48 h,观察细菌菌落形态,并通过简单染色后,在油镜下观察细菌细胞形态。 1.3.3 菌株xn-1的16S rRNA基因序列测定: 菌株xn-1的基因组DNA是用细菌基因组DNA提取试剂盒提取,以提取的基因组DNA为模板,用16S rRNA基因扩增的通用引物27F (5′-AGAGTTTGATCC TGGCTCAG-3′)和1492R (5′-GGTTACCTTGTTACG ACTT-3′)进行PCR。PCR反应体系:27F (10 μmol/L) 1 μL,1492R (10 μmol/L) 1 μL,DNA (50 ng/μL) 10 μL,Taq DNA聚合酶(5 U/μL) 0.5 μL,10×Buffer 5 μL,dNTPs (2.5 mmol/L) 1 μL,加ddH2O补足至50 μL。反应条件:94℃5 min;94℃ 1 min,55℃ 1 min,72 ℃2 min,循环30次;72℃ 8 min。PCR扩增后发现有目的条带,送公司测序。将测序结果与NCBI的GenBank数据库以及EzTaxon数据库[9]进行比对,选取与所测序列相似性较高的种或属。应用clustalx和MEGA 4.0生物软件[10],采用Neighbor-Joining法构建系统发育树。 1.3.4 菌株xn-1对藻细胞的絮凝效果: 将培养至对数期的菌株xn-1的发酵液均按照5.0% (体积比)的添加量加入到铜绿微囊藻的培养液中作为实验组,添加同样体积无菌的絮凝培养基的藻液作为对照组。实验分成两组进行:(1) 实验组和对照组均不加氯化钙;(2) 实验组和对照组均加终浓度为5 mmol/L的氯化钙。以上处理组与对照组分别设置3个平行,将其同时置于25±1℃,12 h光照,12 h黑暗,50 μE/(m2·s)光照强度条件下培养,6 h后取藻培养液表层(从上至下藻液的1/3高度)样品,然后用酶标仪测定处理组与对照组藻细胞在OD680条件下的吸光度值,并按照公式(1) 计算絮凝率。
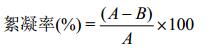
|
(1) |
其中,A为对照组中藻细胞在OD680条件下的吸光度值,B为处理组中藻细胞在OD680条件下的吸光度值。
1.3.5 絮凝培养基的pH对菌株xn-1絮凝效果的影响以及絮凝效果来源的探究: 将菌株xn-1接种于pH分别为6.0、7.0、8.0的絮凝培养基中进行培养,将培养至对数期的菌株xn-1的发酵液均按照5.0% (体积比)的添加量加入到铜绿微囊藻的藻液中作为处理组,添加同样体积的无菌絮凝培养基的铜绿微囊藻藻液为对照组。处理组与对照组均加终浓度为5 mmol/L的CaCl2溶液,放摇床于室温摇匀后(120 r/min,5 min),放入光照培养箱,6 h后用移液器分别吸取表层藻液,用酶标仪测定吸光度值(OD680)并按照公式(1) 计算絮凝效率,以上处理组与对照组分别设置3个平行。菌株xn-1培养48 h后分别进行处理得到3种样品:(1) 细菌发酵液,即直接收集对数期菌株的发酵液;(2) 无菌上清,即将菌株xn-1的发酵液10 000×g离心15 min后,收集上清经过0.22 μm滤膜过滤,得到无菌上清;(3) 细菌菌体,即将菌株xn-1的发酵液按照上述条件离心后,去除上清后得到菌体,将菌体用无菌BG11培养基重悬洗涤2-3次后,重悬于等体积BG11中,得到细菌菌体。将上述得到的细菌发酵液、无菌上清和细菌菌体分别按照体积比5.0%的添加量加入到铜绿微囊藻7820藻液中,同时以添加相同体积的无菌絮凝培养基作为对照组,处理组与对照组均设置3个平行,并连续测定藻细胞在OD680条件下的吸光度值。
1.3.6 菌株xn-1不同添加量的上清及处理时间对絮凝效果的影响: 将菌株xn-1的无菌上清按照0.5%、1.0%、2.0%、3.0%、4.0%和5.0%的添加量分别加入到铜绿微囊藻7820藻液中作为处理组,同时以添加相同体积的无菌絮凝培养基作为对照组,处理组与对照组均加终浓度为5 mmol/L的CaCl2溶液,放摇床于室温摇匀后(120 r/min,5 min),放入光照培养箱。分别放置20、40、60、80、100、120、360 min后,从光照培养箱中轻轻拿出处理组和对照组,用移液器分别吸取表层藻液,用酶标仪测定吸光度值(OD680)并按照公式(1) 计算絮凝效率,以上处理组与对照组分别设置3个平行。 1.3.7 不同金属离子对菌株xn-1絮凝效果的影响: 配制NaCl、KCl、MgCl2、CuCl2、FeCl3终浓度为500 mmol/L的母液,1×105 Pa灭菌待用;处理组为5.0%的菌株xn-1无菌上清分别添加终浓度为5 mmol/L的NaCl、KCl、MgCl2、CuCl2和FeCl3溶液,相同体积无菌絮凝培养基藻液分别添加不同金属离子作为对照组,放摇床于室温摇匀后(120 r/min,5 min),放入光照培养箱。30 min后用移液器分别吸取表层藻液,用酶标仪测定吸光度值(OD680)并按照公式(1) 计算絮凝效率,以上处理组与对照组分别设置3个平行。 1.3.8 絮凝物质的提取及其对铜绿微囊藻的絮凝效果: 絮凝物质提取方法[11]:取菌株xn-1培养48 h后的发酵液,6 000×g离心20 min后收集上清;加入二倍体积预冷的无水乙醇,4 ℃放置24 h后在6 000×g离心30 min收集沉淀;用预冷的丙酮洗2次沉淀,每次均6 000×g离心10 min;然后冷冻干燥后称重。将以上得到的絮凝物质,按照0.05、0.15、0.30、0.50、1.00 g/L的添加量将絮凝物质加入到铜绿微囊藻7820藻液中作为处理组,正常生长的铜绿微囊藻7820藻液作为对照组。处理组与对照组均加终浓度为5 mmol/L的CaCl2溶液,放摇床摇匀后(120 r/min,5 min),放入光照培养箱,2 h后用移液器分别吸取表层藻液,用酶标仪测定吸光度值(OD680)并按照公式(1) 计算絮凝效率,以上处理组与对照组分别设置3个平行。 1.3.9 光学显微镜下观察絮凝过程: 将絮凝物质按照0.5 g/L的添加量添加到铜绿微囊藻7820藻液中,同时添加终浓度为5 mmol/L的CaCl2,放摇床摇匀后(120 r/min,5 min),放入光照培养箱,分别在5、10、20 min不同的絮凝时间取样,并在光学显微镜下观察絮凝过程。 1.3.10 数据分析: 显著性分析采用Origin 8.5进行分析,其中“*”代表p < 0.05,“**”代表p < 0.01。 2 结果与分析 2.1 菌株xn-1的形态特征菌株xn-1在盐度为3.0%的LB固体培养基上生长48 h后,可以观察到菌株xn-1菌落为白色,呈圆形,边缘不齐整,菌落湿润,不透明(图 1a)。将细菌细胞进行简单染色后在光学显微镜下观察到细菌细胞呈短小杆状,细胞长约2 μm,直径约为0.4 μm-0.6 μm (图 1b)。

|
| 图 1 菌株xn-1的菌落形态(A)及细胞形态(B) Figure 1 Colony morphology (A) and cell morphology (B) of strain xn-1 |
|
|
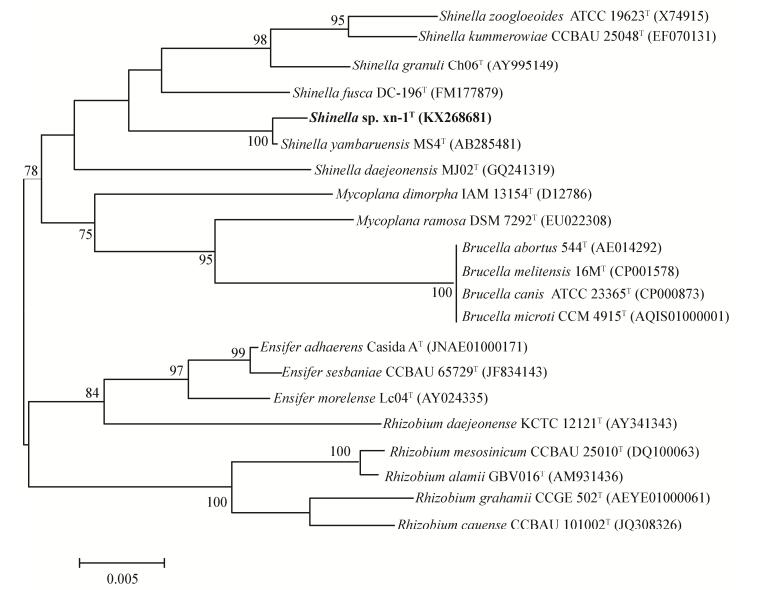
测序后获得1 485 bp的几乎完整的16S rRNA基因序列,将该序列提交至NCBI的GenBank数据库以及EzTaxon数据库进行比对,结果表明菌株xn-1与申氏杆菌属Shinella yambaruensis MS4T最高相似性为99.79%。通过clustalx和MEGA 4.0生物软件,采用Neighbor-Joining法构建系统发育树(图 2),在进化树中与Shinella yambaruensis MS4T在同一分支。因此,确定该菌株应该为申氏杆菌属的一株细菌,命名为Shinella sp. xn-1。
|
| 图 2 菌株xn-1的16S rRNA基因序列的系统进化树 Figure 2 Neighbour-Joining tree showing the phylogenetic positions of strain xn-1 based on 16S rRNA gene sequences 注:步长值通过1 000次重复运算在各分支点显示出来;只保留步长值大于70%;标尺=0.005 Knuc. Note: Bootstrap values (expressed as percentages of 1 000 replications) are shown at branch points; Only bootstrap values > 70% are showed; Bar, 0.005 nucleotide substitution rate (Knuc) units. |
|
|
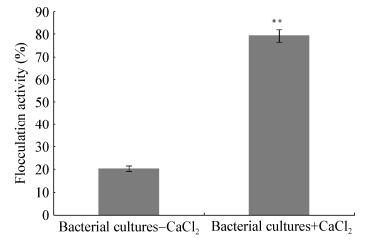
将菌株xn-1的发酵产物按照体积比5.0%的添加量加入到铜绿微囊藻7820藻培养液中进行絮凝实验。菌株xn-1的发酵液对铜绿微囊藻细胞有絮凝效果,但是在不添加氯化钙作为促凝剂的第一处理组的絮凝效率较低,仅为20.67%;而添加了氯化钙的处理组对藻细胞的絮凝率显著高于(p < 0.01) 未加氯化钙的处理组,达到79.30% (图 3)。
|
| 图 3 菌株xn-1有无加氯化钙的絮凝效果 Figure 3 Flocculation activity of strain xn-1 with or without adding CaCl2 Note: ** were presented as means ± standard error of the mean and were evaluated using one-way analysis of variance followed by the least significant difference test with P < 0.01. The same below. |
|
|
由图 4结果可知,pH值为6.0时,絮凝效率偏低,为65.14%;而在絮凝培养基的pH值为7.0或8.0时,絮凝效率均达到较高水平且差别不大,分别为84.17%、83.86% (图 4)。该结果表明,絮凝培养基在中性偏弱碱性条件下菌株xn-1的絮凝率显著高于(P < 0.01) 其在酸性条件下,即培养基的pH在中性偏碱性时絮凝率较高,絮凝效果好。
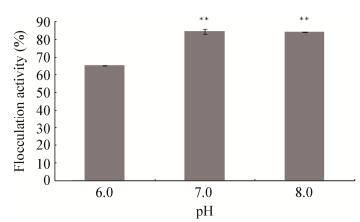
|
| 图 4 培养基不同pH对菌株xn-1絮凝效果的影响 Figure 4 Effect of different pH on flocculation activity of strain xn-1 |
|
|
由图 5结果可知,添加了无菌上清的处理组较添加了相同体积无菌絮凝培养基的对照组表现出明显的絮凝效果,且絮凝率较添加了发酵产物和细菌细胞的处理组最高,达86.66%;添加了发酵产物的处理组也表现出了明显的絮凝效果,虽然没有添加无菌上清处理组的絮凝率高,但与其差别不大,为86.58%;而添加了细菌细胞的处理组,不但没有表现出明显的絮凝效果,且絮凝率显著低于(P < 0.01) 添加了无菌上清和发酵产物的处理组。
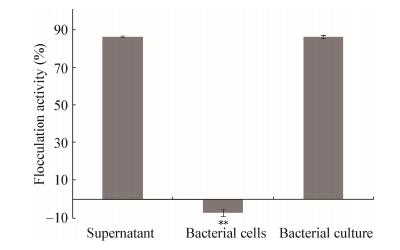
|
| 图 5 菌株xn-1的絮凝效果来源 Figure 5 The flocculation source of strain xn-1 |
|
|
由图 6结果可知,在整个处理过程中,添加量为0.5%和1.0%的处理组的絮凝效果与对照组相比,几乎无明显的区别,其絮凝率在各测定阶段均保持较低水平;2.0%处理组的絮凝率明显高于0.5%和1.0%处理组,其絮凝率逐渐升高后趋于稳定,整个处理过程中最高絮凝率为59.96%,絮凝效果较明显;而3.0%处理组的絮凝率明显高于2.0%处理组,仅在20 min的处理时间内就可达到75.98%,并且随着处理时间的延长,絮凝率逐渐增大为84.29%,絮凝效果明显;4.0%和5.0%处理组的絮凝率明显高于0.5%、1.0%和2.0%处理组,但与3.0%处理组差别不大,絮凝率均能在20 min内达到较高水平,絮凝效果明显。该结果表明,菌株xn-1无菌上清添加量为3.0%以上的处理组中絮凝效果明显。
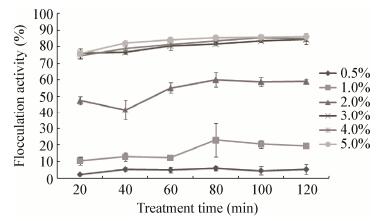
|
| 图 6 菌株xn-1不同添加量的上清及处理时间的絮凝效果 Figure 6 Effects of different dosages of supernatant and treatment times on flocculation activity of strain xn-1 |
|
|
由图 7结果可知,添加MgCl2、NaCl、KCl溶液的处理组中有絮凝效果,但效果不明显,絮凝率分别为16.75%、31.97%、36.89%,均在较低水平;而添加FeCl3和CuCl2溶液的处理组中,絮凝率分别达到80.79%和83.22%,絮凝效果比较明显。该结果表明Na+、K+等一价金属离子虽然对微藻絮凝有促进效果,但没有Cu2+和Fe3+等二价或者三价金属离子对微藻絮凝的促进效果显著。
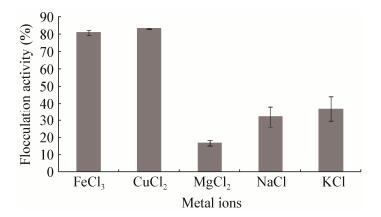
|
| 图 7 不同金属离子对菌株xn-1絮凝效果的影响 Figure 7 Effects of different metal ions on the flocculation activity of strain xn-1 |
|
|
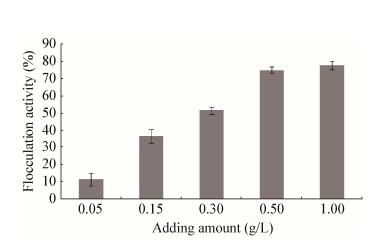
絮凝物质不同添加量对铜绿微囊藻7820絮凝效果影响的结果如图 8所示,絮凝物质添加量为0.5 g/L和1.0 g/L时,絮凝率均达到较高水平且相差不大,分别为74.81%和77.58%;而絮凝物质添加量为0.05 g/L和0.15 g/L时,絮凝率明显低于絮凝物质添加量为0.5 g/L和1.0 g/L时的絮凝率,分别为11.05%和36.36%。该结果表明,絮凝物质添加量为0.5 g/L时,絮凝效果明显。
|
| 图 8 絮凝物质不同添加量对絮凝效果的影响 Figure 8 Effects of different dosages of bioflocculant on flocculation efficiency |
|
|
将絮凝物质添加量为0.5 g/L时的处理组在不同时间进行取样,在显微镜下更直观地观察菌株xn-1絮凝铜绿微囊藻7820的整个絮凝过程,结果如图 9所示。图 9A为没有加絮凝物质的对照组铜绿微囊藻7820的藻细胞;图 9B、C、D分别为添加絮凝物质后在5、10、20 min观察到的藻细胞絮凝结果。在处理5 min时絮凝处理组与对照组相比有少量藻细胞聚集,形成较小絮凝团;而处理10 min时可以看到大量藻细胞聚集成团,处理20 min时看到更明显的大片絮凝团形成。该结果表明,随着絮凝时间的延长,絮凝团逐渐增大,进而絮凝沉降,絮凝物质可以被用来进行藻细胞的收集。

|
| 图 9 菌株xn-1所分泌胞外絮凝物质对铜绿微囊藻细胞的絮凝过程 Figure 9 High flocculation activity of Shinella sp. xn-1 on M. aeruginosa through secreting extracellular bioflocculant 注:A:对照组藻细胞;B:处理时间5 min的絮凝团;C:处理时间10 min形成的絮凝团;D:处理时间20 min的絮凝团;标尺=5 μm. Note: A: Algal cells in control; B: the formed flocs after 5 min treatment time; C: The formed flocs after 10 min treatment time; D: The formed flocs after 20 min treatment time; Bar=5 μm. |
|
|
铜绿微囊藻是一种蓝藻,常在淡水水体引发水华,由于该藻可以产生微囊藻毒素,对淡水水资源、水生生物生存及人类健康造成严重威胁[12]。如何安全、高效地控制淡水水华是目前淡水资源研究的热点问题。环境中的微生物能够与藻细胞通过复杂的相互作用杀死、抑制或者絮凝藻细胞[13]。因此,目前有报道已开展用微生物来治理有害藻华,但是相关研究主要集中在利用微生物治理海洋藻类所引发的赤潮中,而细菌与淡水藻类之间相互作用的研究并不多,特别是利用絮凝细菌通过絮凝蓝藻细胞从而治理蓝藻水华的关注很少。
本研究从蓝藻藻际中筛选到一株有高效絮凝功能的菌株xn-1,首先对该菌株进行了形态特征观察和分子鉴定,最终确定菌株xn-1为申氏杆菌(Shinella)属,与菌株Shinella yambaruensis MS4T有最高相似性为99.79%。菌株xn-1在进化树中与Shinella yambaruensis MS4T在同一分支。因此,确定该菌株应该为申氏杆菌属的一株细菌,命名为Shinella sp. xn-1。申氏杆菌属最早是由An等提出[14]。申氏杆菌属的细菌主要是从污泥、土壤、堆肥中分离得到,广泛参与硝酸盐还原等[15],但是很少有关于Shinella属菌株和藻类相互关系的报道。我们前期研究发现Shinella sp. xn-1对能源微藻——小球藻的生物质有高效的絮凝作用,可以用于能源微藻生物质的获取[16],但菌株xn-1对于水华藻——铜绿微囊藻的絮凝作用还不清楚。因此,我们着重开展了该部分的研究。
将菌株xn-1的发酵液添加入铜绿微囊藻培养液中进行絮凝实验,发现添加氯化钙处理组的絮凝效果比较明显,且明显好于不添加氯化钙的处理组,该结果表明絮凝过程需要Ca2+协助[17]。絮凝微生物对微藻的絮凝作用往往需要有金属离子参与,金属离子可以作为促凝剂促进微生物对微藻的絮凝。有报道称,微藻的絮凝机制一般包括电荷中和理论和离子桥联理论,其中电荷中和理论认为藻细胞表面的负电荷被带正电荷的颗粒中和,从而消除了电荷斥力而沉降下来;而离子桥联理论则证实微藻絮凝过程需要有金属离子参与,金属离子可以同时结合在藻细胞和微生物细胞表面,并在不同颗粒间架桥,从而将微藻细胞沉降[18]。在本研究中,菌株xn-1的絮凝作用需要钙离子参与,没有添加钙离子的处理组其絮凝率显著低于钙离子添加组。因此,钙离子桥联可能是菌株xn-1絮凝铜绿微囊藻的主要机理。
细菌与微藻之间的絮凝关系最早是由Rodolfi等在培养微拟球藻的时候发现的[19-20]。细菌对藻细胞絮凝的作用方式主要有两种:一种是带阳离子的絮凝菌与带阴离子的藻细胞接触通过电荷中和进行直接絮凝[21];另一种是通过絮凝菌分泌一些絮凝物质,通过絮凝物质与藻细胞进行间接絮凝[7]。本实验中菌株xn-1的发酵产物和无菌上清均有较高的絮凝能力,且无菌上清絮凝率最高为86.66%;而细菌菌体无絮凝效果。实验结果证明菌株xn-1通过分泌一些絮凝物质对铜绿微囊藻7820进行间接絮凝,该絮凝物质的活性成分为非蛋白和多糖及含三键和累积双键的小分子物质,其作用机制为电荷中和[16, 22]。
从金属离子絮凝效果的实验结果可以看出,添加FeCl3和CuCl2溶液的处理组较添加MgCl2、NaCl、KCl溶液的处理组有明显的絮凝效果。有报道称,二价或者三价金属离子对微藻絮凝的促进效果显著高于一价金属离子,如Lei等研究MBF-L03絮凝小球藻时发现Ca2+、Al3+和Fe3+有明显的絮凝效果,而K+、Na+无明显絮凝效果[23]。但是也有研究发现有的微生物絮凝微藻的过程中并不需要添加金属离子作用促凝剂[24]。在本研究中Ca2+、Cu2+和Fe3+与菌株xn-1一同加入藻液中都显著提高了菌株xn-1对藻细胞的絮凝能力,因此菌株xn-1需要添加金属离子作用促凝剂。然而,由于Cu2+和Fe3+对环境有一定的危害性,所以一般通过添加Ca2+作为促凝剂来进行絮凝实验[25]。
菌株xn-1的絮凝物质产量明显高于之前报道过的絮凝物质的产量[21, 26]。当絮凝物质添加量为0.05和0.15 g/L时的处理组中絮凝效果不明显,但当絮凝物质添加量为0.5 g/L时絮凝效果明显,絮凝率为74.81%。但是絮凝物质的絮凝效率没有FLC-xn-1絮凝小球藻的絮凝率高,在FLC-xn-1添加量为30 mg/L时,对小球藻的絮凝率可以达到82.8%,这可能跟藻的种类有关[16]。为了直观地看到这一絮凝现象,将絮凝物质添加量为0.5 g/L的处理组在不同时间进行显微镜观察,可以看到藻细胞由少变多进行聚集进而絮凝的整个过程。藻细胞随着处理时间的增加,逐渐聚集在一起,形成较大体积的絮凝团,而絮凝团使得藻细胞沉降下来,从而达到絮凝藻细胞的目的。在菌株xn-1的絮凝作用下,藻细胞被聚集在一起,但不会破坏藻细胞而释放藻毒素,有利于环境的保护,从而达到安全、高效地治理水华。
4 结论菌株xn-1对水华藻——铜绿微囊藻7820有高效的絮凝效果,通过形态学观察和分子鉴定,确定菌株xn-1属于申氏杆菌属(Shinella),并命名为Shinella sp. xn-1。菌株xn-1通过分泌胞外絮凝物质从而表现出絮凝能力,在添加终浓度为5 mmol/L氯化钙的条件下,添加为3.0%以上的无菌上清对藻细胞有很高的絮凝率。菌株xn-1的絮凝物质产量较高,并在絮凝物质添加量为0.5 g/L时有较高的絮凝率,在显微镜下观察到在絮凝物质作用下铜绿微囊藻7820逐渐被絮凝在一起,随着处理时间增加形成越来越大的絮凝团。我们的研究对于有害水华藻的治理有一定的帮助,微生物絮凝水华藻是一种安全、高效的生物防治方法,为水华治理提供了新思路和新选择。
| [1] |
Schindler DW, Hecky RE, Findlay DL, et al. Eutrophication of lakes cannot be controlled by reducing nitrogen input: results of a 37-year whole-ecosystem experiment[J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(32): 11254-11258. DOI:10.1073/pnas.0805108105 |
| [2] |
Li Y, Liu L, Xu YT, et al. Stress of algicidal substances from a bacterium Exiguobacterium sp. h10 on Microcystis aeruginosa[J]. Letters in Applied Microbiology, 2016, 64(1): 57-65. |
| [3] |
Reynolds CS. Cyanobacterial water-blooms[J]. Advances in Botanical Research, 1987, 13: 67-143. DOI:10.1016/S0065-2296(08)60341-9 |
| [4] |
Li D, Li Y, Zheng TL. Advance in the research of marine algicidal functional bacteria and their algicidal mechanism[J]. Advances in Earth Science, 2013, 28(2): 243-252. (in Chinese) 李东, 李祎, 郑天凌. 海洋溶藻功能菌作用机理研究的若干进展[J]. 地球科学进展, 2013, 28(2): 243-252. DOI:10.11867/j.issn.1001-8166.2013.02.0243 |
| [5] |
Makower AK, Schuurmans JM, Groth DT, et al. Transcriptomics-aided dissection of the intracellular and extracellular roles of microcystin in Microcystis aeruginosa PCC 7806[J]. Applied and Environmental Microbiology, 2015, 81(2): 544-554. DOI:10.1128/AEM.02601-14 |
| [6] |
Wan C, Zhang XY, Zhao XQ, et al. Harvesting microalgae via flocculation: a review[J]. Chinese Journal of Biotechnology, 2015, 31(2): 161-171. (in Chinese) 万春, 张晓月, 赵心清, 等. 利用絮凝进行微藻采收的研究进展[J]. 生物工程学报, 2015, 31(2): 161-171. |
| [7] |
Sun PF, Cai H, Bai NL, et al. Revealing the characteristics of a novel bioflocculant and its flocculation performance in Microcystis aeruginosa removal[J]. Scientific Reports, 2015, 5: 17465. DOI:10.1038/srep17465 |
| [8] |
Miao Z, Du ZJ, Li HR, et al. Analysis of bacterial diversity in the phycosphere of five Arctic microalgae[J]. Acta Ecologica Sinica, 2015, 35(5): 1587-1600. (in Chinese) 苗祯, 杜宗军, 李会荣, 等. 5株北极微藻藻际环境的细菌多样性[J]. 生态学报, 2015, 35(5): 1587-1600. |
| [9] |
Chun J, Lee JH, Jung Y, et al. EzTaxon: a web-based tool for the identification of prokaryotes based on 16S ribosomal RNA gene sequences[J]. International Journal of Systematic and Evolutionary Microbiology, 2007, 57(10): 2259-2261. DOI:10.1099/ijs.0.64915-0 |
| [10] |
Tamura K, Dudley J, Nei M, et al. MEGA4: molecular evolutionary genetics analysis (MEGA) software version 4.0[J]. Molecular Biology and Evolution, 2007, 24(8): 1596-1599. DOI:10.1093/molbev/msm092 |
| [11] |
Wan C, Zhao XQ, Guo SL, et al. Bioflocculant production from Solibacillus silvestris W01 and its application in cost-effective harvest of marine microalga Nannochloropsis oceanic by flocculation[J]. Bioresource Technology, 2013, 135: 207-212. DOI:10.1016/j.biortech.2012.10.004 |
| [12] |
Yuan YT, Zhang HG, Pan G. Flocculation of cyanobacterial cells using coal fly ash modified chitosan[J]. Water Research, 2015, 97: 11-18. |
| [13] |
Wang XX, Jiang CC, Zhu J, et al. Research on the application of microbial techniques to algae removal[J]. Industrial Water Treatment, 2011, 31(2): 1-4. (in Chinese) 汪小雄, 姜成春, 朱佳, 等. 微生物在除藻方面的应用研究[J]. 工业水处理, 2011, 31(2): 1-4. DOI:10.11894/1005-829x.2011.31(2).1 |
| [14] |
An DS, Im WT, Yang HC, et al. Shinella granuli gen. nov., sp. nov., and proposal of the reclassification of Zoogloea ramigera ATCC 19623 as Shinella zoogloeoides sp. nov[J]. International Journal of Systematic and Evolutionary Microbiology, 2006, 56(2): 443-448. DOI:10.1099/ijs.0.63942-0 |
| [15] |
Lee M, Woo SG, Ten LN. Shinella daejeonensis sp. nov., a nitrate-reducing bacterium isolated from sludge of a leachate treatment plant[J]. International Journal of Systematic and Evolutionary Microbiology, 2011, 61(9): 2123-2128. DOI:10.1099/ijs.0.026435-0 |
| [16] |
Li Y, Xu YT, Liu L, et al. First evidence of bioflocculant from Shinella albus with flocculation activity on harvesting of Chlorella vulgaris biomass[J]. Bioresource Technology, 2016, 218: 807-815. DOI:10.1016/j.biortech.2016.07.034 |
| [17] |
Powell RJ, Hill RT. Rapid aggregation of biofuel-producing algae by the bacterium Bacillus sp. strain RP1137[J]. Applied and Environmental Microbiology, 2013, 79(19): 6093-6101. DOI:10.1128/AEM.01496-13 |
| [18] |
Qin PY, Zhang T, Chen CX. Flocculating mechanism of microbial flocculant MBFTRJ21[J]. Environmental Science, 2004, 25(3): 69-72. (in Chinese) 秦培勇, 张通, 陈翠仙. 微生物絮凝剂MBFTRJ21的絮凝机理[J]. 环境科学, 2004, 25(3): 69-72. |
| [19] |
Amin SA, Parker MS, Armbrust EV. Interactions between diatoms and bacteria[J]. Microbiology and Molecular Biology Reviews, 2012, 76(3): 667-684. DOI:10.1128/MMBR.00007-12 |
| [20] |
Rodolfi L, Zittelli GC, Barsanti L, et al. Growth medium recycling in Nannochloropsis, sp. mass cultivation[J]. Biomolecular Engineering, 2003, 20(4/6): 243-248. |
| [21] |
Vandamme D, Foubert I, Muylaert K. Flocculation as a low-cost method for harvesting microalgae for bulk biomass production[J]. Trends in Biotechnology, 2013, 31(4): 233-239. DOI:10.1016/j.tibtech.2012.12.005 |
| [22] |
Li Y, Zhu H, Lei XQ, et al. The first evidence of deinoxanthin from Deinococcus sp. Y35 with strong algicidal effect on the toxic dinoflagellate Alexandrium tamarense[J]. Journal of Hazardous Materials, 2015, 290: 87-95. DOI:10.1016/j.jhazmat.2015.02.070 |
| [23] |
Lei XQ, Chen Y, Shao ZZ, et al. Effective harvesting of the microalgae Chlorella vulgaris via flocculation-flotation with bioflocculant[J]. Bioresource Technology, 2015, 198: 922-925. DOI:10.1016/j.biortech.2015.08.095 |
| [24] |
Kim DG, La HJ, Ahn CY, et al. Harvest of Scenedesmus sp. with bioflocculant and reuse of culture medium for subsequent high-density cultures[J]. Bioresource Technology, 2011, 102(3): 3163-3168. DOI:10.1016/j.biortech.2010.10.108 |
| [25] |
Pu SY, Qin LL, Che JP, et al. Preparation and application of a novel bioflocculant by two strains of Rhizopus sp. using potato starch wastewater as nutrilite[J]. Bioresource Technology, 2014, 162: 184-191. DOI:10.1016/j.biortech.2014.03.124 |
| [26] |
Deng SB, Gang Y, Ting YP. Production of a bioflocculant by Aspergillus parasiticus and its application in dye removal[J]. Colloids and Surfaces B: Biointerfaces, 2005, 44(4): 179-186. DOI:10.1016/j.colsurfb.2005.06.011 |
 2017, Vol. 44
2017, Vol. 44