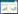扩展功能
文章信息
- 王冰, 何新宇, 周洋洋, 潘迎捷, 赵勇
- WANG Bing, HE Xin-Yu, ZHOU Yang-Yang, PAN Ying-Jie, ZHAO Yong
- 外源化学物质对副溶血性弧菌药物敏感性的影响
- Effect of additional chemicals on antimicrobial susceptibility of Vibrio parahaemolyticus
- 微生物学通报, 2017, 44(8): 1785-1792
- Microbiology China, 2017, 44(8): 1785-1792
- DOI: 10.13344/j.microbiol.china.160843
-
文章历史
- 收稿日期: 2016-11-20
- 接受日期: 2017-02-17
- 优先数字出版日期(www.cnki.net): 2017-04-19
2. 上海水产品加工及贮藏工程技术研究中心 上海 201306;
3. 农业部水产品贮藏保鲜质量安全风险评估实验室 上海 201306
2. Shanghai Engineering Research Centre of Aquatic-Product Processing & Preservation, Shanghai 201306, China;
3. Laboratory of Quality & Safety Risk Assessment for Aquatic Product on Storage and Preservation (Shanghai), Ministry of Agriculture, Shanghai 201306, China
我国是抗菌药物生产和使用大国。抗生素广泛应用于医疗卫生和农业养殖领域,在治疗感染性疾病挽救患者生命、防治动物疫病提高养殖效益以及保障公共卫生安全中发挥了重要作用。但是,由于新型抗菌药物研发能力不足、医疗和养殖领域不合理应用抗菌药物、群众合理用药意识不高等多种因素,导致细菌耐药问题日益突出。近年来,令人闻之色变的“超级细菌”[对多种抗生素具抗药性(Multi-drug resistant,MDR)的病原体]更是大量涌现。世界卫生组织发表声明称,细菌广泛地耐药已经明显成为威胁人类生命与健康的全球性问题[1]。近年来,有学者提出通过调节菌体细胞代谢状态能显著影响抗生素对细菌的杀菌效力[2]。小分子代谢物如吲哚、硫化氢、一氧化氮、气态氨可通过改变细胞内代谢微环境来影响大肠杆菌耐药性[3-6]。碳代谢抑制蛋白Crc、碳氮源代谢的全局调控因子CbrA-CbrB是铜绿假单胞菌中两类重要的功能代谢调控蛋白,可调节该菌对多种临床抗菌药物的敏感性[7-8]。醌氧化还原酶Nqr及硝酸还原酶Nar作为呼吸链酶复合体的重要组成部分,分别对溶藻弧菌和大肠杆菌耐药性的调控有着至关重要的影响[9-10]。有研究表明氨基酸代谢在调控细菌胞内代谢能量或还原力、增强菌体细胞对环境胁迫等方面具有重要作用[11]。
副溶血性弧菌(Vibrio parahaemolyticus)是一种革兰氏阴性嗜盐细菌,它广泛分布在水生环境——包括河水、海水以及海水沉积物,能感染鱼、虾、蟹类以及甲壳类等多种水产动物,给海水养殖业带来危害[12]。同时也是沿海地区由海产品引发急性肠胃炎的主要致病菌。随着抗菌药物大量使用导致该菌的耐药株不断增加,给临床以及水产动物疾病的控制带来挑战,因此对副溶血性弧菌耐药谱的研究以及对其耐药水平的控制显得十分重要[13-14]。彭宣宪等发现外源性添加低浓度果糖可有效提高耐药迟钝爱德华氏菌对亚抑菌浓度抗生素的敏感性,并通过实验证明果糖可通过促进细胞能量代谢提高外源抗生素跨膜运输,导致菌体裂解死亡[15-16]。
副溶血性弧菌是一类需氧的海洋弧菌,糖、氨基酸、脂代谢是细菌产能的主要途径,同时也是中心碳代谢调控的重要组成成分[17]。因此本实验在彭宣宪等研究的基础上进一步探究了外源物质的种类、不同耐药程度的副溶血性弧菌以及不同亚抑菌浓度抗生素种类对添加外源物质条件下抗生素杀菌实验效果的影响,以期为深入研究相关代谢活动提供基础资料,并为食源性疾病的防控及抗生素的合理使用提供依据。
1 材料与方法 1.1 材料 1.1.1 菌株: 实验中所用的14株副溶血性弧菌(编号分别为VP8、VP14、VP18、VP31、VP33、VP34、VP41、VP57、VP58、VP61、VP103、VP105、VP107、VP108) 均分离自上海市的水产品,两株副溶血性弧菌标准菌株ATCC33847、ATCC17802购自中国科学院微生物研究所,经过PCR鉴定均携带致病基因tdh或trh。以上菌株均由上海海洋大学农业部水产品贮藏保鲜质量安全风险评估实验室菌种库保藏。 1.1.2 培养基: 胰蛋白胨大豆肉汤培养基(TSB)、胰蛋白胨大豆琼脂培养基(TSA)购自北京陆桥技术股份有限公司;M9培养基购自青岛日水生物技术有限公司;葡萄糖、丙氨酸、无水氯化钙、硫酸镁均购自Sigma公司;甘油、甲醇、无水乙醇等均为国产分析纯,购自生工生物工程(上海)股份有限公司。 1.1.3 抗生素: 药敏试验纸片购自英国Oxoid公司;卡那霉素、链霉素、庆大霉素、哌拉西林、氨苄西林均购自上海汉尼生物技术有限公司。 1.1.4 主要仪器: 恒温摇床购自上海智城分析仪器制造公司;酶标仪购自美国Bio-Rad公司;台式冷冻离心机购自美国Thermo公司;纯水仪Milli-Q century购自Millipore公司。 1.2 方法 1.2.1 培养条件: 将实验所需的副溶血性弧菌菌株从-80 ℃保存的甘油管中划线至TCBS平板,37 ℃培养24 h,挑取单菌落于9 mL TSB (3% NaCl)的试管中,在37℃、180 r/min培养16 h,连续活化2次,作为种子液(约109 CFU/mL)备用。 1.2.2 副溶血性弧菌耐药水平测定: 采用改良K-B纸片扩散法,将上海市水产品中分离的14株野生副溶血性菌以及标准菌株ATCC33847和ATCC17802对18种常见抗生素(氨苄西林、哌拉西林、阿莫西林-克拉维酸、头孢噻肟、头孢他啶、头孢西丁、头孢唑林、亚胺培南、美罗培南、阿米卡星、庆大霉素、卡那霉素、链霉素、四环素、环丙沙星、左氧氟沙星、氯霉素、复方新诺明)耐药情况进行普查。药敏性测定标准质控菌株采用Escherichia coli ATCC25922,筛选相关耐药菌株进行液体微量稀释试验(Broth microdilution test)测定其对氨苄西林、链霉素、卡那霉素、庆大霉素、哌拉西林的最小抑菌浓度(Minimal inhibitory concentration,MIC)。根据美国临床实验室标准委员会(CLSI/NCCLS) 2010版执行标准判定结果[18]。将菌液接种到9 mL TSB液体培养基中,37℃、180 r/min培养16 h后离心,用生理盐水漂洗并调OD600至0.330±0.025。用TSB稀释菌液至OD600为0.025±0.005备用。在96孔板内每孔加入100 μL TSB液体培养基,将100 μL浓度为512 mg/L的抗生素加入到第一排孔板中并依次对抗生素进行二倍稀释。将10 μL稀释好的菌液分别加入孔中,37℃培养过夜,测定菌体600 nm的吸光度值,确定细菌的最小抑菌浓度。 1.2.3 添加外源代谢物的抗生素杀菌实验: 将活化后的菌体接种至液体培养基,在37℃条件下好氧培养(180 r/min) 16 h,8 000×g离心8 min收集菌体,用无菌生理盐水清洗菌体颗粒3次,重悬于M9培养基中并调整菌液浓度至OD600为0.20±0.02,实验组分别添加10 mmol/L葡萄糖、丙氨酸、甘油以及8 mg/L (1/8 MIC)卡那霉素,按照不同的时间梯度(0、2、4、6、8 h)分别胁迫受试菌株,反应结束后,立即离心(25℃,8 000×g,5 min),将沉淀物用生理盐水洗涤两次以去除残余的卡那霉素。随后,将菌体重悬于1 mL生理盐水中,取100 μL菌液在TSA培养基平板上测定单位体积菌落数(Colony forming per unit,CFU)。将平板放置在37℃培养18-22 h,对平板上的菌落进行计数。设3个平行样。用Excel软件计算平均值和标准偏差。 2 结果与分析 2.1 不同耐药程度副溶血性弧菌菌株筛选K-B纸片药敏试验结果见表 1,16株副溶血性弧菌总耐药率为100%,所有菌株对氨苄西林和链霉素耐药,其次对卡那霉素和哌拉西林的耐药率分别达到64.3%和37.5%。少数菌株对头孢西丁和头孢唑林出现耐受性。有25%分离株出现对4种以上药物耐药的多重耐药现象。筛选以下3株副溶血性弧菌进行后续实验,其中VP61为5重耐药菌株,分别对氨苄西林、链霉素、卡那霉素、庆大霉素、哌拉西林耐药;ATCC33847为3重耐药菌株,对氨苄西林、链霉素、卡那霉素耐药;ATCC17802为较敏感菌株,对氨苄西林、链霉素耐药。
| 菌株 Strains | 来源 Source | 致病基因 Virulence genes | 耐药情况 Antibiotic resistance |
| ATCC33847 | 中国科学院微生物研究所 | tdh+/trh- | AMP,S,K |
| VP61 | 日本沼虾 | tdh+/trh- | AMP,S,K,GM,PRL |
| VP18 | 日本沼虾 | tdh+/trh- | AMP,S,PRL,SXT |
| VP8 | 日本沼虾 | tdh+/trh- | AMP,S,PRL |
| VP33 | 日本沼虾 | tdh+/trh- | AMP,S,K,KZ |
| VP14 | 日本沼虾 | tdh+/trh- | AMP,S,K |
| VP31 | 日本沼虾 | tdh+/trh- | AMP,S,K |
| VP34 | 太平洋牡蛎 | tdh+/trh- | AMP,S,FOX,K |
| VP57 | 日本沼虾 | tdh+/trh- | AMP,S,K |
| VP58 | 南美白对虾 | tdh+/trh- | AMP,S,FOX |
| VP41 | 南美白对虾 | tdh+/trh- | AMP,S,K |
| ATCC17802 | 中国科学院微生物研究所 | tdh-/trh+ | AMP,S |
| VP103 | 日本沼虾 | tdh-/trh+ | AMP,S,PRL |
| VP105 | 日本沼虾 | tdh-/trh+ | AMP,S |
| VP107 | 日本沼虾 | tdh-/trh+ | AMP,S |
| VP108 | 日本沼虾 | tdh-/trh+ | AMP,S |
| 注:AMP:氨苄西林;PRL:哌拉西林;KZ:头孢唑林;CIP:环丙沙星;LEV:左氧氟沙星;AK:阿米卡星;GM:庆大霉素;K:卡那霉素;S:链霉素;FOX:头孢西丁. Note: AMP: Ampicillin; PRL: Piperacillin; KZ: Cephazolin; CIP: Ciprofloxacin; LEV: Levofloxacin; AK: Amikacin; GM: Gentamincin; K: Kanamycin; S: Streptomycin; FOX: Cefoxitin. | |||
采用微量肉汤稀释法(Broth microdilution test)对筛选出的3株不同耐药程度副溶血性弧菌菌株VP61、ATCC33847、ATCC17802对氨苄西林、链霉素、卡那霉素、庆大霉素、哌拉西林5种抗生素进行最小抑菌浓度测定。结果见表 2,与以往副溶血性弧菌耐药谱相比,发现此次分离株对氨基糖苷类链霉素、卡那霉素耐药能力也较强,其中VP61对卡那霉素的MIC高达64 mg/L,说明其卡那霉素耐受能力极强。所以,后续研究选取5重耐药菌株VP61以及卡那霉素进行添加外源代谢物的抗生素杀菌实验。
| 抗生素Antibiotics | VP61 | ATCC33847 | ATCC17802 |
| 氨苄西林Ampicillin | 32.00 | 32.00 | 32.00 |
| 链霉素Streptomycin | 32.00 | 16.00 | 16.00 |
| 卡那霉素Kanamycin | 64.00 | 32.00 | 8.00 |
| 庆大霉素Gentamincin | 16.00 | 4.00 | 0.25 |
| 哌拉西林Piperacillin | 32.00 | 1.00 | 0.50 |
|
| 图 1 3种外源物质对促进耐药副溶血性弧菌61细胞生长情况的比较 Figure 1 Metabolite ability to induce growth in V. parahemolyticus 61 注:A:10 mmol/L葡萄糖;B:10 mmol/L丙氨酸;C:10 mmol/L甘油.数据表示为均数±标准差(n=3). Note: A: 10 mmol/L Glucose; B: 10 mmol/L Alanine; C: 10 mmol/L Glycerol. The data were expressed as mean ± standard deviation (n=3). |
|
|
|
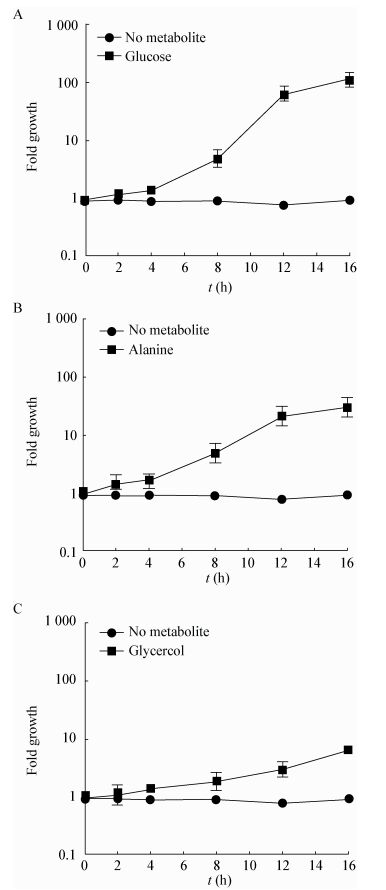
| 图 2 添加3种外源物质及8 mg/L卡那霉素对副溶血性弧菌61存活率的影响 Figure 2 Percent survival of V. parahemolyticus 61 in the presence of three types of metabolites and 8 mg/L kanamycin 注:A:10 mmol/L葡萄糖;B:10 mmol/L丙氨酸;C:10 mmol/L甘油.数据表示为均数±标准差(n=3). Note: A: 10 mmol/L Glucose; B: 10 mmol/L Alanine; C: 10 mmol/L Glycerol. The data were expressed as mean ± standard deviation (n=3). |
|
|
|
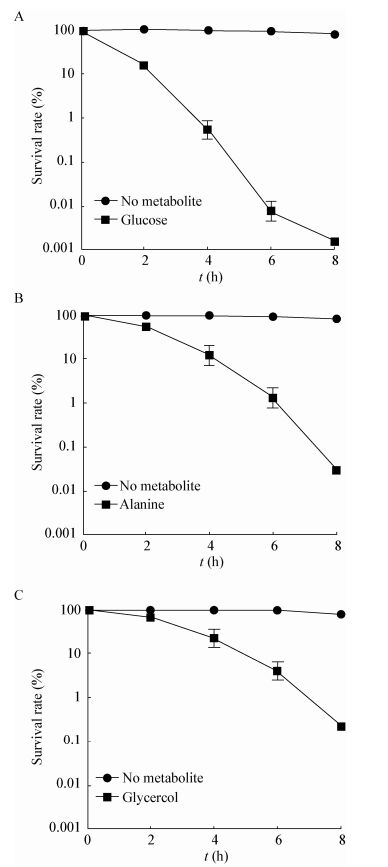
| 图 3 外源添加10 mmol/L葡萄糖以及亚抑菌浓度卡那霉素对不同耐药程度副溶血性弧菌存活率的影响 Figure 3 Percentage survival of different V. parahemolyticus strains after treatment with glucose and sub-inhibit concentration kanamycin 注:数据表示为均数±标准差(n=3). Note: The data were expressed as mean ± standard deviation (n=3). |
|
|
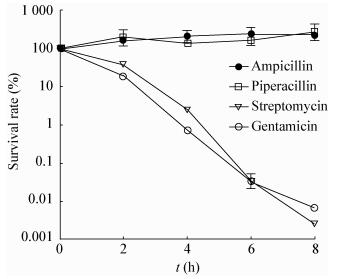
|
| 图 4 添加不同种类亚抑菌浓度抗生素及10 mmol/L葡萄糖对耐药副溶血性弧菌61存活率的影响 Figure 4 Percentage survival of V. parahemolyticus 61 after treatment with glucose and different classes of sub-inhibit concentration antibiotics 注:数据表示为均数±标准差(n=3). Note: The data were expressed as mean ± standard deviation (n=3). |
|
|
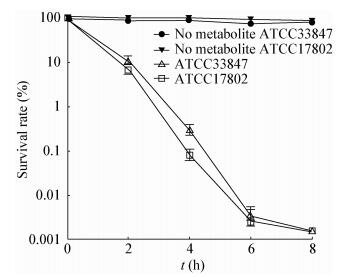
图 5为在抗生素杀菌试验中加入终浓度100 μmol/L氧化磷酸化解偶联剂羰基氰化物间氯苯腙(CCCP)作用条件下细菌存活率随时间的变化。从实验结果可以看出,实验组在添加CCCP后副溶血性弧菌存活率与对照组相比显著提高,菌株对抗生素敏感性增强能力明显降低。从图 5可知,添加相同浓度葡萄糖、丙氨酸、甘油时,葡萄糖产生质子浓度梯度的能力最强,丙氨酸次之,甘油影响最弱。消除跨膜电化学梯度后,外源代谢物的添加失去作用。
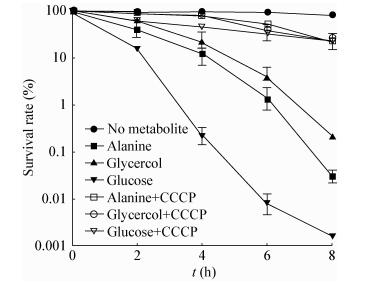
|
| 图 5 外源添加3种类型代谢物及8 mg/L卡那霉素在终浓度100 μmol/L CCCP作用下对副溶血性弧菌61存活率的影响 Figure 5 Percentage survival of V. parahemolyticus 61 in the presence or absence of 100 μmol/L CCCP with three types of metabolites and 8 mg/L kanamycin 注:数据表示为均数±标准差(n=3). Note: The data were expressed as mean ± standard deviation (n=3). |
|
|
此次副溶血性弧菌药敏实验结果与以往国外报道的文献有所不同,与以往副溶血性弧菌耐药谱相比[19],发现分离株对氨基糖苷类抗生素耐受能力明显增强。16株副溶血性弧菌对氨苄西林、链霉素完全耐药。64.3%菌株对卡那霉素耐药,25%菌株出现对4种以上药物耐药的多重耐药现象。从这些结果可以推测,养殖环境极可能是副溶血性弧菌耐药性的主要来源,间接反应了我国水产养殖业滥用抗生素现象普遍。同时,环境中亚抑菌浓度抗生素选择下来的耐药基因往往会通过垂直和水平传播等方式在环境微生物种内和种间进行传递,这些基因可以导致微生物对绝大多数抗生素产生耐药[20-21]。因此,加强水产品副溶血性弧菌耐药性的监控以及进一步提高耐药副溶血性弧菌对亚致死浓度抗生素的敏感性显得尤为重要。
在外源性的果糖可恢复耐药迟缓爱德华氏菌对卡那霉素杀伤敏感性研究的基础上,我们近一步比较了3种外源代谢物对副溶血性弧菌杀菌作用效果的影响。结果发现单纯添加终浓度为10 mmol/L葡萄糖、丙氨酸、甘油3种代谢物均可以显著促进VP61的生长,其中葡萄糖对菌体生长的促进作用最明显,这可能是由于糖类、氨基酸、脂质丰富了细胞生长的碳源、氮源供应,从而提高了菌体细胞生长代谢水平。在亚抑菌浓度抗生素存在条件下,外源添加这3种代谢物均显著增强了亚抑菌浓度氨基糖苷类抗生素对不同耐药程度副溶血性弧菌杀菌能力,而对其他种类抗生素杀菌能力则无明显增强作用。其中葡萄糖对提高亚抑菌浓度卡那霉素的杀菌作用效果最为显著。有研究表明,细菌对氨基糖苷类抗生素的吸收需要质子动力势[22]。实验组采用氧化磷酸化解偶联剂CCCP对实验结果进行了进一步验证,结果表明外源代谢物通过提高质子驱动力(PMF)促进了氨基糖苷类抗生素摄入,进而增强亚抑菌浓度抗生素杀菌效力。以上研究结果初步表明,通过调节细菌细胞代谢水平可提高耐药副溶血性弧菌对氨基糖苷类抗生素的敏感性,具有一定的实际应用意义。后续进一步的作用机制将在蛋白网络水平上对细菌细胞代谢状态水平的变化进行阐释和验证。
| [1] |
Lima TB, Pinto MFS, Ribeiro SM, et al. Bacterial resistance mechanism: what proteomics can elucidate[J]. The FASEB Journal, 2013, 27(4): 1291-1303. DOI:10.1096/fj.12-221127 |
| [2] |
Bhargava P, Collins JJ. Boosting bacterial metabolism to combat antibiotic resistance[J]. Cell Metabolism, 2015, 21(2): 154-155. DOI:10.1016/j.cmet.2015.01.012 |
| [3] |
Lee HH, Molla MN, Cantor CR, et al. Bacterial charity work leads to population-wide resistance[J]. Nature, 2010, 467(7311): 82-85. DOI:10.1038/nature09354 |
| [4] |
Gusarov I, Shatalin K, Starodubtseva M, et al. Endogenous nitric oxide protects bacteria against a wide spectrum of antibiotics[J]. Science, 2009, 325(5946): 1380-1384. DOI:10.1126/science.1175439 |
| [5] |
Bernier SP, Létoffé S, Delepierre M, et al. Biogenic ammonia modifies antibiotic resistance at a distance in physically separated bacteria[J]. Molecular Microbiology, 2011, 81(3): 705-716. DOI:10.1111/mmi.2011.81.issue-3 |
| [6] |
Shatalin K, Shatalina E, Mironov A, et al. H2S: a universal defense against antibiotics in bacteria[J]. Science, 2011, 334(6058): 986-990. DOI:10.1126/science.1209855 |
| [7] |
Linares JF, Moreno R, Fajardo A, et al. The global regulator Crc modulates metabolism, susceptibility to antibiotics and virulence in Pseudomonas aeruginosa[J]. Environmental Microbiology, 2010, 12(12): 3196-3212. DOI:10.1111/emi.2010.12.issue-12 |
| [8] |
Yeung ATY, Bains M, Hancock RE. The sensor kinase CbrA is a global regulator that modulates metabolism, virulence, and antibiotic resistance in Pseudomonas aeruginosa[J]. Journal of Bacteriology, 2011, 193(4): 918-931. DOI:10.1128/JB.00911-10 |
| [9] |
Li PP, Liu XJ, Li H, et al. Downregulation of Na(+)-NQR complex is essential for Vibrio alginolyticus in resistance to balofloxacin[J]. Journal of Proteomics, 2012, 75(9): 2638-2648. DOI:10.1016/j.jprot.2012.03.006 |
| [10] |
Ma Y, Guo C, Li H, et al. Low abundance of respiratory nitrate reductase is essential for Escherichia coli in resistance to aminoglycoside and cephalosporin[J]. Journal of Proteomics, 2013, 87: 78-88. DOI:10.1016/j.jprot.2013.05.019 |
| [11] |
Fernández M, Zú iga M. Amino acid catabolic pathways of lactic acid bacteria[J]. Critical Reviews in Microbiology, 2006, 32(3): 155-183. DOI:10.1080/10408410600880643 |
| [12] |
Ma YJ, Sun XH, Zhao Y, et al. REP-PCR and ERIC-PCR analysis for the typing of Vibrio parahaemolyticus isolated from sea products marketed in Shanghai[J]. Food Science, 2013, 34(10): 263-267. (in Chinese) 马月姣, 孙晓红, 赵勇, 等. REP-PCR及ERIC-PCR法对分离自海产品副溶血性弧菌分型分析[J]. 食品科学, 2013, 34(10): 263-267. DOI:10.7506/spkx1002-6630-201310058 |
| [13] |
Jiang YH, Yao L, Li FL, et al. Research progress on antibiotic resistance of Vibrio parahaemolyticus and its mechanism[J]. Chinese Fishery Quality and Standards, 2013, 3(4): 96-102. (in Chinese) 江艳华, 姚琳, 李风铃, 等. 副溶血性弧菌的耐药状况及耐药机制研究进展[J]. 中国渔业质量与标准, 2013, 3(4): 96-102. |
| [14] |
Liu XM, Chen Y, Guo YC, et al. Foodborne diseases outbreaks in 2005-report of national foodborne diseases surveillance network in China[J]. Chinese Journal of Food Hygiene, 2008, 20(6): 506-509. (in Chinese) 刘秀梅, 陈艳, 郭云昌, 等. 2005年中国食源性疾病暴发事件监测资料分析[J]. 中国食品卫生杂志, 2008, 20(6): 506-509. |
| [15] |
Su YB, Peng B, Han Y, et al. Fructose restores susceptibility of multidrug-resistant Edwardsiella tarda to kanamycin[J]. Journal of Proteome Research, 2015, 14(3): 1612-1620. DOI:10.1021/pr501285f |
| [16] |
Andersson DI, Hughes D. Microbiological effects of sublethal levels of antibiotics[J]. Nature Reviews Microbiology, 2014, 12(7): 465-478. DOI:10.1038/nrmicro3270 |
| [17] |
Cui P, Xu T, Zhang WH, et al. Molecular mechanisms of bacterial persistence and phenotypic antibiotic resistance[J]. Hereditas, 2016, 38(10): 859-871. (in Chinese) 崔鹏, 许涛, 张文宏, 等. 细菌持留与抗生素表型耐药机制[J]. 遗传, 2016, 38(10): 859-871. |
| [18] |
Pfaller MA, Diekema DJ. Progress in antifungal susceptibility testing of Candida spp. by use of clinical and laboratory standards institute broth microdilution methods, 2010 to 2012[J]. Journal of Clinical Microbiology, 2012, 50(9): 2846-2856. DOI:10.1128/JCM.00937-12 |
| [19] |
Ma C, Hao XH, Ma XB, et al. Antibiotic sensitivity analysis of China marine bacteria[J]. Chinese Journal of Antibiotics, 2013, 38(1): 53-58. (in Chinese) 马聪, 郝秀红, 马学斌, 等. 中国海域海洋细菌抗生素敏感性分析[J]. 中国抗生素杂志, 2013, 38(1): 53-58. |
| [20] |
Baker-Austin C, McArthur JV, Tuckfield RC, et al. Antibiotic resistance in the shellfish pathogen vibrio parahaemolyticus isolated from the coastal water and sediment of georgia and South Carolina, USA[J]. Journal of Food Protection, 2008, 71(12): 2552-2558. DOI:10.4315/0362-028X-71.12.2552 |
| [21] |
Lu X. Mechanism study of resistence gene horizental transfer under stimulation of sub-inhibit concentration antibiotics[D]. Guangzhou: Doctoral Dissertation of South China University of Technology, 2012(in Chinese). 鲁曦. 低剂量抗生素刺激条件下耐药基因水平传播的机制研究[D]. 广州: 华南理工大学博士学位论文, 2012 http://cdmd.cnki.com.cn/Article/CDMD-10561-1012452834.htm |
| [22] |
Denamur S, Boland L, Beyaert M, et al. Subcellular mechanisms involved in apoptosis induced by aminoglycoside antibiotics: Insights on p53, proteasome and endoplasmic reticulum[J]. Toxicology and Applied Pharmacology, 2016, 309: 24-36. DOI:10.1016/j.taap.2016.08.020 |
 2017, Vol. 44
2017, Vol. 44