扩展功能
文章信息
- 熊君燕, 李小东, 谢圣凯, 余培斌, 陈建新
- XIONG Jun-Yan, LI Xiao-Dong, XIE Sheng-Kai, YU Pei-Bin, CHEN Jian-Xin
- 清香型白酒中乳酸菌和酵母菌的相互作用
- Interaction between lactic acid bacteria and yeasts in light-aroma liquor
- 微生物学通报, 2017, 44(8): 1767-1776
- Microbiology China, 2017, 44(8): 1767-1776
- DOI: 10.13344/j.microbiol.china.160917
-
文章历史
- 收稿日期: 2016-12-14
- 接受日期: 2017-02-21
- 优先数字出版日期(www.cnki.net): 2017-02-24
传统白酒发酵具有复杂的微生物体系和生物转化机制,不同的菌株之间的物理缔合和分子相互作用可以导致多种不同结果,如共生、竞争、抑制等[1]。酿酒酵母与异常毕赤酵母的混合发酵能够形成更多的酯类物质[2],芽孢杆菌能促进酵母菌产己酸和庚酸[3],而酿酒酵母能产生的某些大分子蛋白类物质对地衣芽孢杆菌的生长具有抑制作用[4]。由此可见微生物间的相互作用是十分复杂的。
在清香型白酒发酵过程中,酵母菌和乳酸菌是最为庞大的两个群体[5],两者共同作用形成复杂的菌系。酵母菌利用原料中的还原糖进行生长繁殖和发酵产乙醇的同时,其代谢产物还为乳酸菌提供生长所需的营养物质如氨基酸、维生素等[6],而乳酸菌的作用又会促进酸类、乙醛和醇类等风味化合物的代谢[7]。但是不同的乳酸菌和酵母菌共培养时相互作用不同,某些酵母菌和乳酸菌共培养时会产生愉悦的香味,而另一些则会产生一些异味[8-9]。因此认识乳酸菌和酵母菌的相互作用,将有利于更加清晰地了解清香型白酒发酵机理,对白酒发酵过程可控性的实现提供一定的微生物学基础。
目前,对白酒微生物相互作用的研究多运用液态培养和恒温发酵,如张艳等[10]利用高梁汁培养基研究乳酸菌对酿造微生物群体的影响,发现适当比例的乳酸菌对维持酿造微生物区系平衡有重要作用。颜兵等[11]利用米酒液体发酵培养基研究酿酒酵母和异常汉逊酵母在酿酒过程中的相互作用。而固态发酵是清香型白酒发酵的重要特征。固态和液态发酵相比,固体颗粒比例和传质传热速度相差悬殊,这些因素将影响微生物的代谢和化学反应速度,进而还会影响风味物质的代谢[12-13]。在固体培养中细胞表现出更好的生长传代性能,挥发性代谢产物也明显高于液态发酵条件[14]。白酒独特的固态发酵酿造环境,驯化出微生物独特的生理性能,而这种性能的发挥需要一个适宜的温度催化。发酵温度的高低直接影响着酵母、乳酸菌和其他微生物的生命活动,若起始发酵温度高,杂菌迅速生产繁殖,有益微生物如酵母等在不良环境下,生长繁殖受到抑制并迅速衰老[15]。陈丙友等[16]发现实际生产中地缸内温度不均匀,存在温度场,而温度变化模式对酒醅微生物群落的生长和代谢产生显著影响。
本文在清香型白酒发酵过程温度调控机理研究的基础上[16],首次利用程序控温和固态发酵模拟清香型白酒发酵工艺[17],研究发酵过程中微生物之间的消长规律,探讨乳酸菌和酵母菌之间的相互作用,为提高工艺控制水平提供一定的理论基础。
1 材料与方法 1.1 材料 1.1.1 实验材料: 高粱、大曲等原料由山西汾酒股份有限公司提供。 1.1.2 菌株来源: 酵母菌Pichia kudriavzevii MJ14、Saccharomyces cerevisiae YJ1、Candida aaseri MJ7,乳酸菌Pediococcus sp. JYA1、Lactobacillus plantarum MRS4、Leuconostoc lactis JMRS1-2,均分离自山西汾酒厂白酒车间的发酵酒醅中。 1.1.3 培养基: 酵母菌筛选为WL培养基[18],并添加1 g/L的青霉素,酵母菌培养为YPD培养基[18];乳酸菌筛选与培养为MRS培养基[19],筛选培养基中添加1 g/L的制霉菌素。 1.2 主要试剂和仪器乙酸正戊酯(色谱纯),谱析科技有限公司;乙酸(色谱纯),上海阿拉丁生化科技股份有限公司;青霉素、制霉菌素、万古霉素,生工生物工程(上海)股份有限公司;葡萄糖、乳酸(分析纯),国药集团化学试剂有限公司。
气相色谱-质谱联用仪(Trace 1300-ISQ QD)、离心机(Pico 17),Thermo Fisher Scientific公司;液相色谱仪(1260 infinity),Agilent科技有限公司;顶空固相微萃取(57328U),Supelco公司;生化培养箱(BSP-250),上海博讯实业有限公司;电子天平(AL204),METTLER TOLEDO;恒温水浴锅(W201D),上海申顺生物技术有限公司;分光光度计(UV mini),SHIMADZU公司;酒精计(No6812),浙江余姚黄家埠玻璃仪器表厂。
1.3 方法 1.3.1 菌株筛选: (1) 酵母菌的分离纯化:取10 g发酵第7天的酒醅于90 mL无菌生理盐水中,振荡混匀后取上清液进行梯度稀释,取10-3-10-5稀释液涂布于添加了青霉素的WL平板中,30 ℃培养至菌落长出,挑选平板上的菌落在WL平板上进行两次划线获得单菌落。(2) 乳酸菌的分离纯化:方法同酵母菌的分离纯化,取10-3-10-5稀释液涂布于添加了制霉菌素的MRS平板中,30 ℃培养至菌落长出,挑选平板上的菌落在MRS平板上进行两次划线获得单菌落。 1.3.2 菌种鉴定: (1) 基因组的提取:采用CTAB法提取基因组[5]。(2) PCR扩增:反应体系:10×Buffer 5 μL,2.5 mmol/L dNTPs 4 μL,模板1 μL,100 μmol/L正反向引物各3 μL,Taq酶0.5 μL,双蒸水33.5 μL。反应程序:94 ℃ 5 min;94 ℃ 30 s,50 ℃ 30 s (酵母菌),56 ℃ 30 s (乳酸菌),72 ℃ 90 s;72 ℃ 10 min。乳酸菌引物序列参考文献[5];酵母菌引物序列参考文献[20]。PCR扩增纯化后测序,得到的测序结果在NCBI进行比对,鉴定为乳酸菌和酵母菌后进行菌株编号。 1.3.3 菌株形态和生理生化研究: (1) 形态观察:菌株外观形态观察采用平板划线法,细胞形态观察采用显微镜观察。(2) 对菌株进行生理生化实验[21-22]。 1.3.4 菌株模拟固态发酵: 在灭菌完成的高粱培养基中加入与工厂实际发酵用酶等活力单位的大曲浸出液,搅拌混匀后分装至平皿中,每个平皿分装量按照工厂实际生产中酒醅空隙率换算得来。按500-1 000 CFU/mL的菌体接种量分别将酵母菌、乳酸菌接入到高粱培养基中,同一处理的样品做3组平行,最终的测定结果求平均值。放置于厌氧罐中进行氮气置换,培养温度为模拟实际生产程序控温培养,培养周期为12 d,每隔48 h取出测定其理化指标、活菌数和挥发性成分。 1.3.5 生长曲线的测定: (1) 液态培养:接种500-1 000 CFU/mL的酵母菌于YPD液体培养基中,置于25 ℃厌氧培养器内,每隔2 h取样测定其活菌数。取1 mL菌液梯度稀释,取不同的梯度稀释液涂布于YPD平板上,28 ℃培养至菌落长出,选取菌落数为30-300个的平板计数。(2) 固态培养:依照1.3.1方法进行固态培养。称取10 g样品于90 mL无菌水中,振荡混匀后取1 mL上清进行梯度稀释,取不同的梯度稀释液涂布于平板上,细菌涂布MRS培养基,酵母涂布YPD培养基,30 ℃培养至菌落长出,选取菌落数为30-300个的平板计数。 1.3.6 理化指标的测定: 发酵样品中还原糖、酸度依据固体发酵酒醅分析方法[23]。酒精度的测定:取50 g固体样品和100 mL水加入250 mL烧瓶中,蒸出的馏出液50 mL,蒸馏水定容到100 mL,用酒精计测定。 1.3.7 乳酸和乙酸含量测定: 采用HPLC测定。前处理:取10 g发酵样品,加入20 mL超纯水,混合均匀后4 ℃、8 000 r/min离心5 min取5 mL上清,分别加入0.5 mL亚铁氰化钾(10.6%)和0.5 mL硫酸锌(30%),4 ℃静置沉淀后用0.22 μm微孔滤膜过滤[24],取滤液测定其乳酸和乙酸峰面积,并根据峰面积分别计算出其中乳酸和乙酸的浓度。
HPLC条件:流动相为pH 2.5的30 mmol/L磷酸二氢钠溶液,流速1 mL/min,检测波长210 nm,柱温30 ℃,进样体积20 μL。乳酸标准曲线:y=511x+20.348,R2=0.999 5;乙酸标准曲线:y=678.59x+15.782,R2=0.999 4。
1.3.8 挥发性成分测定: 采用顶空固相微萃取和气质联用测定。前处理:取2 g酒醅和3 g氯化钠于10 mL顶空瓶中,加入1 mL内标乙酸正戊酯(1 g/L)和7 mL超纯水。
顶空固相微萃取条件:样品50 ℃预热15 min,插入针头距离液面1 cm处,吸附30 min,进样口解析5 min。
色谱条件:起始温度40 ℃,保留2 min,以2 ℃/min升温至80 ℃,保留1 min,再以5 ℃/min升温至230 ℃,保持5 min,进样口温度为250 ℃。
质谱条件:离子源温度230 ℃,质子扫描范围20-550。
2 结果与讨论 2.1 菌株的筛选与鉴定 2.1.1 菌株筛选: 经过筛选纯化、分子鉴定和NCBI比对筛选得到22株酵母菌和15株乳酸菌,如表 1所示。| 属名 Genus name | 菌株数 Number of strains |
| Saccharomyces | 11 |
| Pichia | 9 |
| Candida | 2 |
| Lactobacillus | 8 |
| Pediococcus | 6 |
| Leuconostoc | 1 |

|
| 图 1 酵母菌和乳酸菌在培养基上菌落及微观形态比较 Figure 1 Comparation of colonies morphology and micromorphologies of yeast and lactic acid bacteria 注:A、C、E分别为P. kudriavzevii MJ14、S. cerevisiae YJ1、C. aaseri MJ7的菌落形态;B、D、F分别为P.kudriavzevii MJ14、S. cerevisiae YJ1、C. aaseri MJ7的显微镜形态;G、I、K分别为P. sp. JYA1、L. plantarum JMRS4、L. lactis JMRS1-2菌落形态;H、J、L分别为P. sp. JYA1、L. plantarum JMRS4、L. lactis JMRS1-2显微镜形态. Note: A, C and E stand for the colony morphology of P. kudriavzevii MJ14, S. cerevisiae YJ1 and C. aaseri MJ7 respectively; B, D and F stand for the micromorphologies of P. kudriavzevii MJ14, S. cerevisiae YJ1 and C. aaseri MJ7 respectively; G, I and K stand for the colony morphology of P. sp. JYA1, L. plantarum JMRS4 and L. lactis JMRS1-2 respectively; H, J and L stand for the micromorphologies of P. sp. JYA1, L. plantarum JMRS4 and L. lactis JMRS1-2 respectively. |
|
|
| 菌株 Strains | 菌落形态 Colonies morphology | 微观形态 Micromorphology | 发酵实验 Fermentation test | |||||
| 乳糖 Lactose | 麦芽糖 Maltose | 蔗糖 Sucrose | 葡萄糖 Glucose | 淀粉 Starch | 乙醇 ethanol | |||
| P.kudriavzevii MJ14 | 中间深绿色凸起,边缘不整齐白色绒毛状,菌落较大,液体培养形成菌膜 | 椭圆形,球形,有明显的细胞核 | - | + | - | + | - | + |
| S.cerevisiae YJ1 | 边缘整齐乳白色,表面湿润光滑,菌落凸起中间呈浅绿色 | 椭圆球形,有明显的细胞核 | - | + | + | + | - | + |
| C.aaseri MJ7 | 灰绿色,平伏,表面光滑粘稠,长时间培养菌落表面有颗粒状凸起出现 | 椭圆形,形态较小 | - | - | - | - | - | + |
| 注:+:阳性;-:阴性. Note: +: positive; -: negative. | ||||||||
| 菌株 Strains | 菌落形态 Colonies morphology | 微观形态 Micromorphology | 耐万古霉素 Vancomycin tolerance | 发酵产酸 Acid production | |||||||
| 柠檬酸盐 Citrate | 果糖 Fructose | 麦芽糖 Maltose | 乳糖 Lactose | 蔗糖 Sucrose | 葡萄糖 Glucose | 淀粉 Starch | |||||
| P. sp. JYA1 | 乳白色,边缘整齐,表面光滑,菌落偏小 | 细胞圆球状,四联状或成对排列 | - | d | + | + | - | - | + | - | |
| L.plantarum JMRS4 | 乳白色,边缘整齐,凸起 | 长杆状 | - | d | + | + | + | + | + | d | |
| L.lactis JMRS1-2 | 灰白色,边缘整齐,表面光滑 | 细胞球形呈长链状排列 | + | + | + | + | + | + | + | d | |
| 注:+:阳性;-:阴性;d:未实验. Note: +: positive; -: negative; d: Not tested. | |||||||||||

|
| 图 2 S. cerevisiae YJ1在液体和固体培养中的活菌数变化 Figure 2 Viable count of S. cerevisiae YJ1 in liquid culture medium and solid culture medium |
|
|
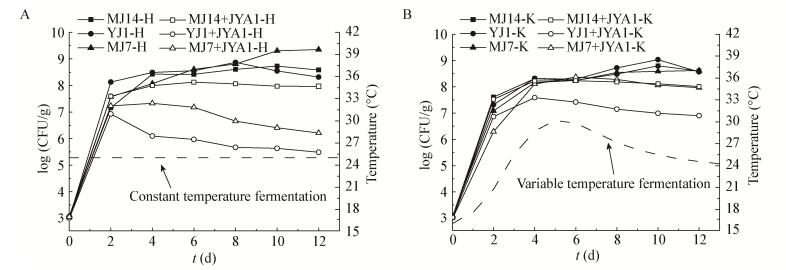
|
| 图 3 酵母菌在恒温和控温培养条件下活菌数的变化情况 Figure 3 Viable count of yeast during constant temperature fermentation and variable temperature fermentation 注:MJ14:P. kudriavzevii MJ14;YJ1:S.cerevisiae YJ1;MJ7:C. aaseri MJ7;MJ14+JYA1:P.kudriavzevii MJ14和P. sp. JYA1共培养;YJ1+JYA1:S.cerevisiae YJ1和P. sp. JYA1共培养;MJ7+JYA1:C. aaseri MJ7和P. sp. JYA1共培养;H:25 ℃恒温培养;K:程序控温培养. Note: MJ14: P. kudriavzevii MJ14; YJ1: S. cerevisiae YJ1; MJ7: C. aaseri MJ7; MJ14+JYA1: Co-culture of P. kudriavzevii MJ14 with P. sp. JYA1; YJ1+JYA1: Co-culture of S. cerevisiae YJ1 with P. sp. JYA1; MJ7+JYA1: Co-culture of C. aaseri MJ7 with P. sp. JYA1; H: 25 ℃ constant temperature fermentation; K: variable temperature fermentation. |
|
|
如图 4A所示,通过考察酵母菌代谢糖速率快慢发现,不同菌株间差异较大,S. cerevisiae YJ1代谢速度快,其次分别是P. kudriavzevii MJ14、C. aaseri MJ7。而这恰好与3株酵母产酒精能力正相关,S. cerevisiae YJ1在第12天产生的酒精度高达6.3% vol,还原糖消耗最慢的C. aaseri MJ7产生的酒精度仅为0.9% vol。分析可能是由于菌株发酵产酒精过程中生命活动更加旺盛,对还原糖需求更大。结合图 3B和4A发现,3种酵母菌生长没有明显差异,但耗糖速率和产乙醇速率却存在明显差异,因为菌体生长属同化作用,而还原糖转化为乙醇属异化作用,菌体生长和耗糖速率之间没有直接的相关性;而糖化和发酵是一个协同的过程,在发酵中,糖化酶持续作用,并且直到发酵后期,仍然存在后糖化,糖被酵母利用转化为酒精,因此乙醇产率和耗糖速率呈现一定的相关性;当糖化速度变慢,发酵前期体现出酵母耗糖快,但是后期糖化完成后,酒精对酵母存在产物抑制,酵母发酵能力衰弱,从而导致样品的残还原糖偏高。如图 4B所示,考察乳酸菌发酵中还原糖含量与酸度变化情况,从发酵起始到第8天培养基中还原糖含量逐渐增多,菌株消耗还原糖速度越来越慢,到发酵第8天后培养基中还原糖含量基本不变。就不同的乳酸菌而言,L. plantarum JMRS4消耗糖速度快产酸多,其酸度远高于P. sp. JYA1和L. actis JMRS1-2,发酵结束酸度可达到12.4 mg/100 g。
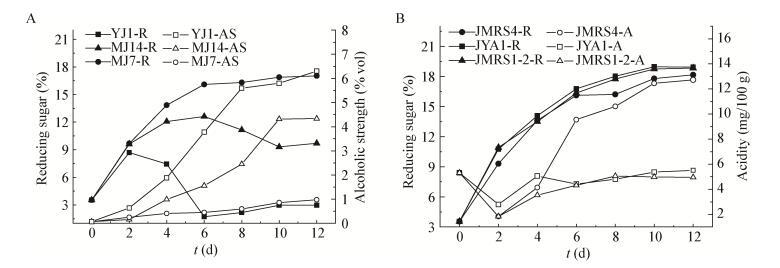
|
| 图 4 酵母菌和乳酸菌单菌发酵理化指标变化 Figure 4 Physicochemical indexes during single cultures of yeast and lactic acid bacteria 注:A:酵母菌发酵过程还原糖和酒精度变化;B:乳酸菌发酵过程还原糖和酸度变化;JMRS4:L. plantarum JMRS4;JYA1:P. sp. JYA1;JMRS1-2:L. actis JMRS1-2;R:还原糖;AS:酒精度;AC:酸度. Note: A: Reducing sugar and alcohol strength in the fermentation process of yeast; B: Reducing sugar and acidity in the fermentation process of lactic acid bacteria; JMRS4: L. plantarum JMRS4; JYA1: P. sp. JYA1; JMRS1-2: L. actis JMRS1-2; R: reducing sugar; AS: alcohol degree; AC: acidity. |
|
|
考察纯菌和混菌发酵至第12天酒精度差异情况(图 5),相比于酵母纯菌发酵,S. cerevisiae YJ1、P. kudriavzevii MJ14与细菌混合发酵过程中酒精度降低,而C. aaseri MJ7与细菌混合发酵乙醇产率未受到影响。结合图 3B在程序控温培养条件下P. sp. JYA1对酵母菌生长的抑制情况来看,酵母单菌发酵活菌数呈现增长趋势,前期增长快后期增长慢;与P. sp. JYA1混合培养,酵母菌的活菌数均低于单菌发酵时的活菌数,分析可能为乳酸菌发酵产酸,在这种酸度较高的环境中酵母菌的生长受到一定的抑制[25],并且共培养还存在对营养物质的竞争。比较不同酵母菌之间的差异可以看出,相比于S. cerevisiae YJ1,P. kudriavzevii MJ14的菌落数和产乙醇量受乳酸菌影响相对较小,分析可能由于毕赤酵母是一类产酯酵母,对低pH、高渗透压等不利环境下的适应能力较强[17]。C. aaseri MJ7在混合培养中乙醇产量未受影响。
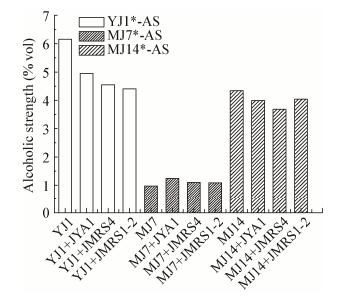
|
| 图 5 酒精度含量 Figure 5 Content of alcoholic strength 注:YJ1*-AS:S. cerevisiae YJ1纯培养和共培养条件下酒精度;MJ7*-AS:C. aaseri MJ7纯培养和共培养条件下酒精度;MJ14*-AS:P. kudriavzevii MJ14纯培养和共培养条件下酒精度. Note: YJ1*-AS: Alcoholic strength of S. cerevisiae YJ1 during single culture and co-culture conditions; MJ7*-AS: Alcoholic strength of C. aaseri MJ7 during single cultures and co-culture conditions; MJ14*-AS: Alcoholic strength of P. kudriavzevii MJ14 during single cultures and co-culture conditions. |
|
|
如图 6A所示,不同的乳酸菌产乳酸量差异较大,L. plantarum JMRS4单菌发酵至12 d乳酸含量达到7.63 g/L,明显高于P. sp. JYA1和L. lactis JMRS1-2。在共培养方式中,P. kudriavzevii MJ14可以抑制乳酸菌产乳酸。图 6B中可以看出,L. lactis JMRS1-2乙酸产量最高,为0.54 g/L,其次依次是L. plantarum JMRS4、P. sp. JYA1。分析可能L. lactis JMRS1-2为异型乳酸发酵菌,能产生乳酸、乙酸等多种代谢产物[26],因此产乙酸量明显高于同型乳酸发酵菌株。从不同的酵母菌与乳酸菌共培养产乙酸量差异可以看出,P. kudriavzevii MJ14对乳酸菌产乙酸有促进作用,乙酸量明显高于其他共培养条件下的产量。就L. lactis JMRS1-2在不同培养方式下产乙酸量来看,该菌株与酵母菌共培养时乙酸量有所减少,可能为酵母菌对其存在某种抑制作用,其机理还需要进一步研究。

|
| 图 6 乳酸和乙酸含量 Figure 6 The concentration of lactic acid and acetic acid 注:JYA1-L:P. sp. JYA1在纯培养和共培养条件下乳酸含量;JMRS4-L:L. plantarum JMRS4在纯培养和共培养条件下乳酸含量;JMRS1-2-L:L. lactis JMRS1-2在纯培养和共培养条件下乳酸含量;JYA1-A:P. sp. JYA1在纯培养和共培养条件下乙酸含量;JMRS4-A:L. plantarum JMRS4在纯培养和共培养条件下乙酸含量;JMRS1-2-A:L. lactis JMRS1-2在纯培养和共培养条件下乙酸含量. Note: JYA1-L: Lactic acid content of P. sp. JYA1 during single cultures and co-culture conditions; JMRS4-L: Lactic acid content of L. plantarum JMRS4 during single cultures and co-culture conditions; JMRS1-2-L: Lactic acid content of L. lactis JMRS1-2 during single cultures and co-culture conditions; JYA1-A: Acetic acid content of P. sp. JYA1 during single cultures and co-culture conditions; JMRS4-A: Acetic acid content of L. plantarum JMRS4 during single cultures and co-culture conditions; JMRS1-2-A: Acetic acid content of L. lactis JMRS1-2 during single cultures and co-culture conditions. |
|
|
微生物通过一系列的酶促反应产生了多种微量化合物,正是这些微量成分决定着白酒的口感和品质。而白酒发酵是一个多种微生物共同参与的过程,把某种特定微生物独立出来考察其发酵产物,将更直观地了解该微生物在整个代谢产物体系中的作用。由图 7可知,就不同的酵母菌而言,S. cerevisiae YJ1和P. kudriavzevii MJ14产生的代谢产物丰度较C. aaseri MJ7更高,一些特征香味物质如乙酸乙酯、丁酸乙酯和苯乙醇的含量明显高于C. aaseri MJ7,而C. aaseri MJ7产愈创木酚、油酸乙酯、亚油酸乙酯含量高于S. cerevisiae YJ1。从产生的物质来看,白酒中多种风味成分均有产生,酵母菌不仅能发酵产乙醇,同时也能产生多种香味成分,这也促进研究者对酵母菌的代谢产物有着更加全面的认识。比较纯培养和共培养两种方式下微生物代谢组分的差异,S. cerevisiae YJ1与L. plantarum JMRS4共培养产异戊醇和苯乙醇含量增多,酵母菌和L. lactis JMRS1-2共培养产乙酸乙酯、异丁酸、正戊醇和乙酸苯乙酯均受到抑制。这说明乳酸菌与酵母菌共培养会对代谢产物的组成产生影响。

|
| 图 7 纯培养和共培养条件下特征代谢产物热图 Figure 7 Heat map of main metabolites during single cultures and co-culture conditions |
|
|
双边发酵是白酒固态发酵的一大特点,固态发酵中微生物传质传热相对较慢,这种方式更加接近于传统发酵工艺。适宜的发酵温度是各种酶进行催化反应的基础,相比于恒温发酵,程序控温发酵较大程度地还原了实际发酵状态。还原糖消耗速度可以作为酵母菌产乙醇和乳酸菌产有机酸的主要指标。共培养中,乳酸菌对3株酵母菌生长均存在抑制,对P. kudriavzevii MJ14的生长抑制相对较小;对P. kudriavzevii MJ14和C. aaseri MJ7产乙醇影响不大,而对S. cerevisiae YJ1产乙醇抑制作用最大。对乳酸菌而言,P. kudriavzevii MJ14对乳酸菌产乳酸有抑制作用,对P. sp. JYA1和L. plantarum JMRS4产乙酸则存在促进作用。从代谢产物来看,L. plantarum JMRS4和L. lactis JMRS1-2分别是产乳酸和乙酸的优势菌株。酵母菌能产生多种风味物质,P. kudriavzevii MJ14和S. cerevisiae YJ1产生的酯类物质含量明显高于C. aaseri MJ7。
传统白酒发酵过程中的微生物种类繁多,不同的微生物之间的相互作用机理各异,而本研究只针对其中的部分乳酸菌和酵母菌,想要更透彻更深入地了解白酒发酵机理,还需进行更深入的研究,包括分子生物学、代谢组学、微生态系统等。
| [1] |
Frey-Klett P, Burlinson P, Deveau A, et al. Bacterial-fungal interactions: hyphens between agricultural, clinical, environmental, and food microbiologists[J]. Microbiology and Molecular Biology Reviews, 2011, 75(4): 583-609. DOI:10.1128/MMBR.00020-11 |
| [2] |
Tang J, Wang HY, Xu Y. Effect of mixed culture of Saccharomyces cerevisiae and Pichia anomala on fermentation efficiency and flavor compounds in Chinese Liquor[J]. Microbiology China, 2012, 39(7): 921-930. (in Chinese) 唐洁, 王海燕, 徐岩. 酿酒酵母和异常毕赤酵母混菌发酵对白酒液态发酵效率和风味物质的影响[J]. 微生物学通报, 2012, 39(7): 921-930. |
| [3] |
Xiong XM, Liu TT, Yang TY, et al. Liquid fermentation characteristics of Baijiu (Liquor) with mixed strains of yeast and bacillus[J]. Liquor-Making Science & Technology, 2015(2): 17-20. (in Chinese) 熊小毛, 刘婷婷, 杨团元, 等. 不同酵母菌及芽孢杆菌混合菌株液态白酒发酵特征分析[J]. 酿酒科技, 2015(2): 17-20. |
| [4] |
Ling J, Wu Q, Xu Y, et al. Interactions between Bacillus licheniformis and Saccharomyces cerevisiae in the fermentation of soy-sauce flavor liquor[J]. Microbiology China, 2013, 40(11): 2014-2021. (in Chinese) 凌杰, 吴群, 徐岩, 等. 酱香型白酒发酵中地衣芽孢杆菌与酿酒酵母的相互作用[J]. 微生物学通报, 2013, 40(11): 2014-2021. |
| [5] |
Li XR, Ma EB, Yan LZ, et al. Bacterial and fungal diversity in the traditional Chinese liquor fermentation process[J]. International Journal of Food Microbiology, 2011, 146(1): 31-37. DOI:10.1016/j.ijfoodmicro.2011.01.030 |
| [6] |
Roostita R, Fleet GH. The occurrence and growth of yeasts in Camembert and blue-veined cheeses[J]. International Journal of Food Microbiology, 1990, 28(3): 293-404. |
| [7] |
Welthagen JJ, Viljoen BC. Yeast profile in Gouda cheese during processing and ripening[J]. International Journal of Food Microbiology, 1998, 41(3): 185-194. DOI:10.1016/S0168-1605(98)00042-7 |
| [8] |
Gadaga TH, Mutukumira AN, Narvhus JA. The growth and interaction of yeasts and lactic acid bacteria isolated from Zimbabwean naturally fermented milk in UHT milk[J]. International Journal of Food Microbiology, 2001, 68(1/2): 21-32. |
| [9] |
lvarez-Martín P, Belén Flórez A, Hernández-Barranco A, et al. Interaction between dairy yeasts and lactic acid bacteria strains during milk fermentation[J]. Food Control, 2008, 19(1): 62-70. DOI:10.1016/j.foodcont.2007.02.003 |
| [10] |
Zhang Y, Du H, Wu Q, et al. Impacts of two main lactic acid bacteria on microbial communities during Chinese Maotai-flavor liquor fermentation[J]. Microbiology China, 2015, 42(11): 2087-2097. (in Chinese) 张艳, 杜海, 吴群, 等. 酱香型白酒发酵中两株主要乳酸菌对酿造微生物群体的影响[J]. 微生物学通报, 2015, 42(11): 2087-2097. |
| [11] |
Yan B, Jiang Y, Liang RN, et al. Interaction between Saccharomyces cerevisiae and Hansenula anomala during Brewing[J]. Journal of Anhui Agricultural Sciences, 2016, 44(2): 107-109. (in Chinese) 颜兵, 江月, 梁若楠, 等. 酿酒酵母和异常汉逊酵母在酿酒过程中的相互作用[J]. 安徽农业科学, 2016, 44(2): 107-109. |
| [12] |
Hu BG. To investigate the liquid fermentation and solid fermentation of vinegar flavor difference[J]. The Food Industry, 2004(5): 27-28. (in Chinese) 胡本高. 液态深层发酵与固态发酵食醋风味差别探讨[J]. 食品工业, 2004(5): 27-28. |
| [13] |
Zhao HM, Guo XN, Zhu KX. Impact of solid state fermentation on nutritional, physical and flavor properties of wheat bran[J]. Food Chemistry, 2017, 217: 28-36. DOI:10.1016/j.foodchem.2016.08.062 |
| [14] |
Zhang R. The influence of lichenysin and aroma-active compounds by Bacillus licheniformis in solid-state fermentation on quality of Chinese liquor[D]. Wuxi: Doctoral Dissertation of Jiangnan University, 2014(in Chinese). 张荣. 地衣芽孢杆菌固态发酵产地衣素及风味活性物质对白酒品质的影响[D]. 无锡: 江南大学博士学位论文, 2014 http://cdmd.cnki.com.cn/Article/CDMD-10295-1015523879.htm |
| [15] |
Ren QM, Liu S, Zhen P. The experience of shallow view on fen liquor brewing process operation[J]. Liquor Making, 2014, 41(5): 83-85. (in Chinese) 任全明, 刘帅, 甄攀. 汾酒酿造工艺操作经验之浅见[J]. 酿酒, 2014, 41(5): 83-85. |
| [16] |
Chen BY, Han Y, Zhang X, et al. The effect of temperature control on the fermentation process of Fen-flavor liquor[J]. Food and Fermentation Industries, 2016, 42(6): 44-49. (in Chinese) 陈丙友, 韩英, 张鑫, 等. 酒醅温度调控对清香型白酒发酵过程的影响[J]. 食品与发酵工业, 2016, 42(6): 44-49. |
| [17] |
Wang YT. Brewing Technology of Fen-Flavor Liquor[M]. Beijing: China Light Industry Press, 2009, 113-167. (in Chinese) 王元太. 清香型白酒酿造技术[M]. 北京: 中国轻工业出版社, 2009, 113-167.
|
| [18] |
Xue JX, Xu YW, Yang Y, et al. Screening and identification of Saccharomyces cerevisiae with WL medium[J]. China Brewing, 2007, 174(9): 36-39. (in Chinese) 薛军侠, 徐艳文, 杨莹, 等. WL培养基在酿酒酵母筛选中的应用[J]. 酿酒, 2007, 174(9): 36-39. |
| [19] |
Feng H, Mao J, Huang GD, et al. Study on isolation, identification and biological properties oflactic acid bacteria from the fermentation of Chinese rice wine[J]. Science and Technology of Food Industry, 2013, 34(16): 224-244. (in Chinese) 冯浩, 毛健, 黄桂东, 等. 黄酒发酵过程中乳酸菌的分离、鉴定及生物学特性研究[J]. 食品工业科技, 2013, 34(16): 224-244. |
| [20] |
Zheng XW, Zheng Y, Han BZ, et al. Complex microbiota of a Chinese "Fen" liquor fermentation starter (Fen-Daqu), revealed by culture-dependent and culture-independent methods[J]. Food Microbiology, 2012, 31(2): 293-300. DOI:10.1016/j.fm.2012.03.008 |
| [21] |
Yang JB, Guo XH, Ling DW, et al. Lactic Acid Bacteria: Biological Baseand Application[M]. Beijing: China Light Industry Press, 1996. (in Chinese) 杨洁彬, 郭兴华, 凌代文, 等. 乳酸菌:生物学基础及应用[M]. 北京: 中国轻工业出版社, 1996.
|
| [22] |
Barnett JA. Yeasts: Characteristics and Identification[M]. Translated by Hu RQ. Qingdao: Qingdao Ocean University Press, 1991: 60-150 (in Chinese). Barnett JA. 酵母菌的特征与鉴定手册[M]. 胡瑞卿, 译. 青岛: 青岛海洋大学出版社, 1991: 60-150 |
| [23] |
Wang FR. Brewing Analysis and Detection[M]. 2nd Edition. Beijing: Chemical Industry Press, 2012, 32-34. (in Chinese) 王福荣. 酿酒分析与检测[M]. 第2版. 北京: 化学工业出版社, 2012, 32-34.
|
| [24] |
Yu YJ. Organic acids analysis and enhanced lactic acid synthesis of zhenjiang aromatic vinegar[D]. Wuxi: Doctoral Dissertation of Jiangnan University, 2014(in Chinese). 余永建. 镇江香醋有机酸组成及乳酸合成的生物强化[D]. 无锡: 江南大学博士学位论文, 2014 http://cdmd.cnki.com.cn/Article/CDMD-10295-1014370493.htm |
| [25] |
Passoth V, Fredlund E, Druvefors U, et al. Biotechnology, physiology and genetics of the yeast Pichia anomala[J]. FEMS Yeast Research, 2006, 6(1): 3-13. DOI:10.1111/fyr.2006.6.issue-1 |
| [26] |
Meng XC. Lactic Acid Bacteria and Dairy Starter Culture[M]. Beijing: Science Press, 2009, 89-111. (in Chinese) 孟祥晨. 乳酸菌与乳品发酵剂[M]. 北京: 科学出版社, 2009, 89-111.
|
 2017, Vol. 44
2017, Vol. 44