扩展功能
文章信息
- 林先贵, 吴宇澄, 曾军, 李烜桢, 张晶, 尹睿
- LIN Xian-Gui, WU Yu-Cheng, ZENG Jun, LI Xuan -Zhen, ZHANG Jing, YIN Rui
- 多环芳烃的真菌漆酶转化及污染土壤修复技术
- Transformation of polycyclic aromatic hydrocarbon by fungal laccases and potential application in soil remediation
- 微生物学通报, 2017, 44(7): 1720-1727
- Microbiology China, 2017, 44(7): 1720-1727
- DOI: 10.13344/j.microbiol.china.170036
-
文章历史
- 收稿日期: 2017-01-13
- 接受日期: 2017-03-29
- 优先数字出版日期(www.cnki.net): 2017-04-20
2. 河南农业大学林学院 河南 郑州 450002;
3. 中国科学院东北地理与农业生态研究所 吉林 长春 130102
2. College of Forestry, Henan Agricultural University, Zhengzhou, Henan 450002, China;
3. Northeast Institute of Geography and Agroecology, Chinese Academy of Sciences, Changchun, Jilin 130102, China
多环芳烃(polycyclic aromatic hydrocarbons,PAHs)主要由不完全燃烧过程产生,是一类具有潜在健康风险的有机污染物。据统计,我国16种优先控制多环芳烃的年排放量约为11.4万t[1],局部地区土壤受到污染[2]。
生物修复是利用微生物、植物及其联合作用清除土壤中污染物的环境污染治理技术[3]。细菌、真菌、植物都能一定程度转化多环芳烃,其中真菌因其独特的漆酶氧化机制而在PAHs污染土壤修复中具有广阔的应用前景[4]。近二十年来,通过多学科的综合研究,真菌漆酶转化PAHs的机制与特征逐渐被揭示,对漆酶转化后污染物在土壤中消减机制的认识不断深入,同时,有关污染土壤修复技术蓬勃发展。本文将结合本领域的新进展、新认识对漆酶转化机制与修复技术进行综合介绍,并对若干涉及基础及应用研究方向的重要问题进行评述。
1 真菌漆酶转化多环芳烃的机制与特征由于漆酶以及锰过氧化物酶、木质素过氧化物酶等在真菌木质素转化中的重要作用,它们常被统称为木质素分解酶(Ligninolytic enzymes)。植物、真菌、细菌、昆虫均可产生漆酶,其中真菌漆酶研究最为深入。已知真菌普遍具有胞外漆酶活性,可能在木质素降解、真菌毒力(Virulence)、形态发生等过程中发挥作用[5]。漆酶作用底物广泛,可氧化多氯联苯、抗生素、酚类等多种有机污染物,在环境保护领域具有应用潜力。自Collins等[6]首次发现白腐真菌云芝栓孔菌(Trametes versicolor)漆酶可以氧化PAHs后,相关研究不断深入,在漆酶氧化机制、转化特征等多个方面取得了显著进展。
1.1 漆酶氧化的一般作用机制漆酶(Laccase,EC 1.10.3.2) 是一类活性中心含有4个铜原子的氧化还原酶,催化芳香族化合物的单电子氧化,同时伴随着氧分子的一步四电子反应(图 1)[7]。漆酶活性中心4个铜原子可分为三类,Ⅰ型铜原子(T1 Cu)单核位点是底物结合场所,接受电子后通过保守的组氨酸-半胱氨酸-组氨酸三肽传递至三核铜簇位点(包括两个Ⅱ型铜原子和一个Ⅲ型铜原子),分子氧在此被还原为水。T1 Cu是漆酶从底物获得电子的关键位点,漆酶对芳香化合物的催化效率取决于T1 Cu的氧化还原势(E°)。植物和细菌漆酶的E°相对较低( < +500 mV),真菌中子囊菌漆酶具有适中的E° (可达+700 mV),而担子菌漆酶的E°约为+790 mV。E°的差异可能与T1 Cu配体的疏水性有关[8]。
除了氧化还原势,活性中心的空间构型也是影响催化效率的重要因素。某些取代酚和芳香胺类,尽管其氧化还原势满足催化条件,实际上却难以被漆酶氧化,这可能是因为酶活性中心位点入口具有空间阈值(11-12 ),限制了底物和催化中心的结合。同时,结合口袋(Binding pocket)底部氨基酸与酚类物质间的氢键结合有助于驱动底物进入酶活性中心[8]。
1.2 漆酶转化多环芳烃的特征漆酶对不同PAHs的氧化能力存在明显差异。Li等[9]发现,富含漆酶的双孢菇和杏鲍菇培养液可以转化多种PAHs,以对蒽和苯并[a]芘的作用最为突出,但对萘、菲、荧蒽等缺乏效果。对蒽和苯并[a]芘的优先转化可能是漆酶的共同特征,如细菌漆酶大肠杆菌CueO[10]、枯草芽孢杆菌CotA[11]1[a]芘的转化能力相对较低[12]。这种偏好与PAHs的电离电位(Ionization potential,又称电离能,原子或分子失去一个电子所需要的能量)及氧化还原势存在一定联系。蒽和苯并[a]芘的电离电位分别为7.43 eV和7.12 eV,在16种优控PAHs中处于最低[13](图 2);真菌漆酶的氧化还原势较低(E°=+500-+800 mV),限制了其对较高E°底物的直接作用。

|
| 图 2 双孢菇培养液PAHs转化与电离电位的关系[13] Figure 2 Relation between PAHs transformation with crude extracts of A. bisporus and the ionization potentials[13] 注:连接线两端代表同一种污染物在加入氧化还原介体ABTS (○)或不加介体(●)的转化. Note: The line links the transformation of a single PAH in the presence (○) or absence (●) of redox mediator (ABTS). |
|
|
漆酶铜活性中心包埋于分子内部,可能阻碍底物与活性位点的电子传递。氧化还原介体(Redox mediator)起到电子梭(Electron shuttle)的作用,可以有效改善漆酶对多环芳烃的氧化。其原理是,漆酶作用下形成的氧化态介体从酶活性中心逸出后,通过自由基反应或离子化途径转化底物[14]。这种漆酶-介体系统(Laccase-mediator system,LMS)通常可以明显改善漆酶的氧化效果并扩展底物范围[13](图 2)。开发高效、廉价的氧化还原介体是提高漆酶转化效率的重要方向,而土壤中存在小分子酚类,可以充当天然介体促进底物的转化[15]。
1.3 漆酶转化多环芳烃的产物漆酶氧化多环芳烃一般产生对应的醌类。例如,蒽被漆酶氧化生成9, 10-蒽醌,苯并[a]蒽易被氧化为苯并[a]蒽-7, 12-二酮,苯并[a]芘被氧化产生不同取代位置的醌类等。醌类较其母体化合物极性增加,化学反应活性提高。漆酶氧化产生的醌自由基中间产物,可自发偶联生成多聚体[5];在铁离子存在下,发生醌氧化还原循环(Quinone redox cycling),产生更强的氧化剂——羟基自由基[16]。许多真菌具有醌氧化还原循环潜力,其对多环芳烃真菌转化的意义值得深入探讨[17]。
醌较其母体化合物水溶性增加、分配系数Kow降低,在环境中可能有更高的生物有效性,这对于PAHs的生物降解具有重要意义(表 1)。早期认为醌类等物质难以降解[18],但近期研究表明这些所谓的Dead-end产物仍能被微生物继续转化[19]。例如,云芝栓孔菌漆酶氧化苯并[a]芘产生的醌类,可以被分枝杆菌转化为苯并[a]芘甲氧基衍生物[20]。土壤微生物的多样性使其具有多样的降解能力,可能导致多环芳烃氧化物的进一步降解。最近我们采用同位素示踪技术,发现漆酶作用后土壤中来自苯并[a]芘的CO2释放量显著增加,提示漆酶转化有助于提高PAHs的矿化率(未发表数据)。
| PAHs | 分子量 Molecular weight |
水溶性 Water solubility (mg/L) |
分配系数 logKow |
亨利常数 Henry’s constant (atm-m3/mol) |
| 芴Fluorene | 166 | 1.690 0 | 4.18 | 9.62E-05 |
| 芴酮9-Fluorenone | 180 | 25.300 0 | 3.58 | 6.77E-07 |
| 蒽Anthracene | 178 | 0.043 4 | 4.45 | 5.56E-05 |
| 蒽醌Anthracene-9, 10-quinone | 208 | 1.350 0 | 3.39 | 2.35E-08 |
| 苯并[a]蒽Benzo(a)anthracene | 228 | 0.009 4 | 5.76 | 1.20E-05 |
| 苯并[a]蒽醌Benzo(a)anthracene-7, 11-dione | 258 | 0.289 0 | 4.40 | 3.10E-10 |
| 注:数据来源于https://chem.nlm.nih.gov/chemidplus/. Note: Data retrieved from https://chem.nlm.nih.gov/chemidplus/. | ||||
许多氧化PAHs (Oxygenated PAHs,Oxy-PAHs)对动、植物具有明显的毒害作用。一般而言,Oxy-PAHs要比母体毒性更强[21]。但由于Oxy-PAHs反应活性的增加,与土壤有机质可能发生复杂的物理和化学作用,形成所谓的不可提取残留(Nonextractable residue,NER)[22]。借助同位素示踪,我们发现苯并[a]芘经漆酶转化后的产物,除矿化增加的部分,更多的具有向土壤腐植酸和胡敏素迁移的趋势。NER的形成可能是漆酶作用于PAHs导致解毒的另一重要机制。
1.4 漆酶作用下土壤多环芳烃的归趋综合上述研究,可以归纳出真菌漆酶作用下土壤PAHs的去向(图 3),即与自然降解过程相比,土壤中部分PAHs被酶氧化后矿化增加、微生物同化增加、结合残留态增多,而可提取部分减少。这一变化对于苯并[a]芘、苯并[a]蒽等高分子量、高风险但易被漆酶作用的PAHs具有重要意义。苯并[a]芘高度疏水,微生物难以降解,是最受关注的PAHs类污染物之一。正因为漆酶对苯并[a]芘的特殊作用,基于真菌转化能力的生物修复方法正成为PAHs污染土壤修复技术的重要发展方向。
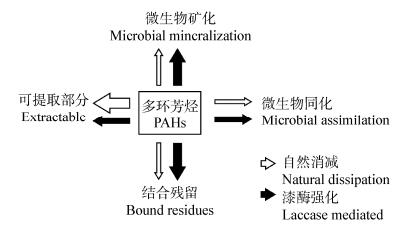
|
| 图 3 土壤中漆酶作用下PAHs的归趋 Figure 3 Laccase-mediated changes in soil PAHs fate 注:箭头的粗细代表污染物通量的大小. Note: The arrows are proportional to the PAHs flux. |
|
|
真菌漆酶在土壤中可表现出与液相体系类似的PAHs转化特征。将云芝栓孔菌漆酶加入老化的PAHs污染土壤,培养10 d后,蒽和苯并[a]芘的转化率分别达到52.7%和40.8%,氧化还原介体ABTS可以进一步提高包括苯并[a]蒽在内的其他PAHs的转化[13],体现出一定的土壤修复潜力。分子改造提高漆酶的催化效率[23],改变适用条件[24]、增加底物范围[25],是提高漆酶处理污染土壤可行性的另一方向。但一般来说,漆酶的直接应用成本较高,尽管漆酶的重组表达有助于大量发酵生产[10-11],但出于成本考虑以及酶催化所需的特殊条件,纯酶在土壤修复中的实际应用受到严重的限制。开发经济、有效、安全的修复方法,成为多环芳烃污染土壤生物修复技术的重要发展方向。
2.2 真菌生物刺激方法生物强化方法是向土壤中接种产漆酶真菌,使其发挥产酶能力以达到转化土壤中污染物的目的[26]。但是,生物强化在实际应用中有其固有的缺陷。首先,农田土壤无法为白腐真菌类漆酶高产菌提供适宜的环境,导致其与土著菌竞争时处于劣势。其次,许多子囊菌是植物病原菌,大量接种产漆酶子囊菌会产生一定的生态风险。根据真菌的营养需求,向土壤中添加适合其营养需求的底物,尤其是富含木质纤维素的农业废弃物,是具有应用潜力的真菌生物刺激修复方法。
食用菌栽培料是富含纤维素、木质素的混合物,价廉易得,将其加入土壤能刺激真菌的生长。Li等[27]将主要成分为玉米芯、麸皮的食用菌栽培料混入长期PAHs污染的土壤,经60 d培养后土壤中蒽、苯并[a]芘、苯并[a]蒽转化率均高于60%,符合漆酶对PAHs的作用特征。接种白腐真菌P. ostreatus可以进一步强化PAHs的转化。食用菌栽培料显著提高了土壤真菌、细菌的数量,导致子囊菌门粪壳菌纲(Sordariomycetes)类真菌的富集。
木屑、木片等可以刺激木质素降解菌并改善土壤通风,因而也可作为土壤修复的生物刺激材料。加入木屑后,土壤中真菌丰度增加,粪壳菌纲真菌富集[28],可能有利于PAHs的转化。同位素示踪研究证实,木质素可以显著提高土壤中多环芳烃的矿化(未发表结果)。但由于这类材料并非专一影响土壤真菌,木质素对多环芳烃降解的强化机理还有待更深入的研究。
2.3 生物刺激与其他措施联合真菌生物刺激与其他措施如植物修复、表面活性剂联用,可以更好地促进土壤中PAHs的转化。张晶等[29]通过盆栽试验评价了菇渣和鼠李糖脂联合强化苜蓿修复PAHs污染土壤的效果,结果显示,单独使用苜蓿或鼠李糖脂时土壤修复效果不明显,但双孢菇菇渣的加入能明显提高苯并[a]芘等高环PAHs的转化,PAHs总量也有一定降低。菇渣、鼠李糖脂和种植苜蓿,较三种措施单独使用能够更好地提高土壤中苯并[a]芘的转化率(图 4)。我们近期对木质素修复潜力的研究也发现,当木质素与黑麦草、鼠李糖脂等联合使用,能获得更好的PAHs转化效果。这可能是因为,鼠李糖脂改善了污染物的生物有效性,植物的根系能刺激土壤微生物的活性,多种因素联合有效促进土壤中PAHs的消减。
需要注意的是,真菌生物刺激可能存在一定副作用。例如,单一施用木质素降低黑麦草的生物量,同时导致子囊菌在土壤中的富集。尽管施肥等措施可以有效提高作物产量,在实际应用中仍应重视对真菌修复的综合效益进行评估。
3 对漆酶转化多环芳烃及其土壤修复研究中若干问题的思考土壤污染修复正成为我国环保产业发展的新兴方向,新的修复技术不断出现。在走向实际应用之前,应对技术的基本原理进行系统、深入的研究,一方面揭示其作用机制,另一方面应全面掌握其使用条件、适用范围和综合效益,才能保障土壤修复的有效性和安全性。在漆酶作用及其相关修复技术的研发中,以下问题值得注意。
3.1 真菌转化多环芳烃的机制研究 3.1.1 过氧化物酶的作用:目前,对真菌木质素分解酶转化PAHs的研究大多关注漆酶,对过氧化物酶的研究较少。真菌木质素过氧化物酶和锰过氧化物酶的氧化还原电位较高,体外转化研究表明它们均可氧化PAHs[30],但它们在真菌污染物转化中发挥何种作用,受到什么因素调控,是值得深入探讨的科学问题。
3.1.2 漆酶分子定向进化:真菌漆酶虽能高效转化PAHs,但在土壤中稳定性相对较差,同时,真菌菌剂或酶制剂的固态发酵方式,产能及产量远低于细菌液体深层发酵,不利于大规模工业化生产。细菌漆酶突出的抗逆优势和可大规模量产的特性,恰好弥补了真菌漆酶大规模实际应用的缺陷,或许在未来大面积污染土壤修复中更具发展前景。然而,目前细菌漆酶较低的催化活性是限制其实际应用的最大瓶颈。分子定向进化技术通过“突变+定向选择”的方式对现有酶类进行改造,可有效改善漆酶的催化性能,提高漆酶活性,是漆酶生物技术的重要研究方向[31]。
3.1.3 转化中间产物的毒性评价及其转化:真菌产生多种氧化多环芳烃,但一般并不导致污染物的矿化。尽管目前的研究主要关注16种优控PAHs,但土壤中广泛存在Oxy-PAHs,其中相当一部分是蒽醌、苯并[a]蒽二酮等真菌氧化产物[21]。这些Oxy-PAHs极性较其母体化合物增加,带来潜在的风险。但是,对真菌所产生Oxy-PAHs的毒理学性质尚缺乏了解,其生态风险不明。此外,Oxy-PAHs的降解途径也是重要的研究课题。有研究发现,同一土壤中同化蒽和蒽醌的细菌存在明显差异[19],提示微生物对二者的降解途径存在基本差异。揭示Oxy-PAHs的微生物转化规律,对于阐明真菌-细菌协同降解PAHs的机制具有重要的科学意义。
3.1.4 污染物在土壤中的迁移和转化规律:有机污染物进入土壤后,除可提取部分外,可能被微生物同化或矿化形成CO2,还有部分被土壤吸附固定。微生物同化、矿化及吸附对于污染土壤修复均具有积极的意义。近年来,以放射性同位素示踪、稳定性同位素探针为代表的同位素技术快速发展,为定量、定性解析土壤中污染物的去向提供了可靠的方法,有助于深入了解修复的机制。
3.1.5 木质素分解酶和细胞色素P450酶的相对贡献:有观点认为,由于农业土壤中木质素含量一般较少,P450酶系氧化可能是真菌转化PAHs的主要途径[32]。区分真菌木质素分解酶和细胞色素P450酶在PAHs转化中的相对贡献,揭示其降解特征,是真菌PAHs修复机制的重要内容[33]。
3.2 修复技术的发展 3.2.1 针对特定污染土壤的修复试验:我国土壤类型多样,气候条件不同,可能导致同一修复措施的效果产生重大差异。此外,由于土壤的异质性、气象条件及外界干扰,实验室内获得的修复结果很少能在田间获得简单重复。因此,在开展田间修复时,不应照搬他处的成功经验,而要就当地土壤类型、土地利用方式开展温室盆栽、中宇宙(mesocosm)模拟和小区试验等不同规模的探索(图 5),取得适用于大田推广的最佳应用参数。近年来,我们在污染土壤修复方面开展了多个尺度的实验,对真菌修复田间应用进行了有益的尝试。例如,针对南京郊区某污染农田,采用食用菌-农作物套种的方式,可以取得明显的修复效果。

|
| 图 5 不同尺度的污染土壤修复试验 Figure 5 Bioremediation tests at different levels 注:A:盆栽;B:土壤中宇宙;C:田间小区;D:大田修复. Note: A: A pot experiment; B: A mesocosm experiment; C: Plot test; D: Field remediation. |
|
|
我国耕地资源有限,中、低污染农田仍应秉持“边生产、边修复”的原则。因此,应对修复的综合效益,诸如农田生产力、作物病虫害、作物体内污染物积累、土壤生态系统稳定性及功能等进行评价,确定修复措施的综合成本和最优修复方案,最终将有助于污染土壤生物修复技术的安全、高效应用。
历经20年的研究,漆酶转化PAHs的研究正从最初的现象描述走向机制探讨,从酶学反应走向土壤生态过程,从理论探讨走向实际应用。随着研究的持续深入,面向我国土壤污染修复的现实需求,漆酶转化及其相关的真菌修复技术有望获得更大的突破和更广泛的应用。
| [1] | Zhang YX, Tao S. Global atmospheric emission inventory of polycyclic aromatic hydrocarbons (PAHs) for 2004[J]. Atmospheric Environment, 2009, 43(4) : 812–819. DOI:10.1016/j.atmosenv.2008.10.050 |
| [2] | Cao YZ, Liu XJ, Xie YF, et al. Patterns of PAHs concentrations and components in surface soils of main areas in China[J]. Acta Scientiae Circumstantiae, 2012, 32(1) : 197–203. (in Chinese) 曹云者, 柳晓娟, 谢云峰, 等. 我国主要地区表层土壤中多环芳烃组成及含量特征分析[J]. 环境科学学报, 2012, 32(1) : 197–203. |
| [3] | Teng Y, Li XF, Pang C, et al. Technology development and applications of bioremediation for persistent organic pollutants contaminated soil and sites[J]. The Administration and Technique of Environmental Monitoring, 2011, 23(3) : 43–46. (in Chinese) 滕应, 李秀芬, 潘澄, 等. 土壤及场地持久性有机污染的生物修复技术发展及应用[J]. 环境监测管理与技术, 2011, 23(3) : 43–46. |
| [4] | Wu YC, Lin XG. Fungal remediation of polycyclic aromatic hydrocarbons-contaminated soil: a review[J]. Acta Pedologica Sinica, 2013, 50(6) : 1191–1199. (in Chinese) 吴宇澄, 林先贵. 多环芳烃污染土壤真菌修复进展[J]. 土壤学报, 2013, 50(6) : 1191–1199. |
| [5] | Monti D, Ottolina G, Carrea G, et al. Redox reactions catalyzed by isolated enzymes[J]. Chemical Reviews, 2011, 111(7) : 4111–4140. DOI:10.1021/cr100334x |
| [6] | Collins PJ, Kotterman M, Field JA, et al. Oxidation of anthracene and benzo[J]. Applied and Environmental Microbiology, 1996, 62(12) : 4563–4567. |
| [7] | Baldrian P. Fungal laccases-occurrence and properties[J]. FEMS Microbiology Reviews, 2006, 30(2) : 215–242. DOI:10.1111/j.1574-4976.2005.00010.x |
| [8] | Prado I, Camarero S. Laccase engineering by rational and evolutionary design[J]. Cellular and Molecular Life Sciences, 2015, 72(5) : 897–910. DOI:10.1007/s00018-014-1824-8 |
| [9] | Li XZ, Lin XG, Zhang J, et al. Degradation of polycyclic aromatic hydrocarbons by crude extracts from spent mushroom substrate and its possible mechanisms[J]. Current Microbiology, 2010, 60(5) : 336–342. DOI:10.1007/s00284-009-9546-0 |
| [10] | Zeng J, Lin XG, Zhang J, et al. Oxidation of polycyclic aromatic hydrocarbons by the bacterial laccase CueO from E. coli[J]. Applied Microbiology and Biotechnology, 2011, 89(6) : 1841–1849. DOI:10.1007/s00253-010-3009-1 |
| [11] | Zeng J, Zhu QH, Wu YC, et al. Oxidation of polycyclic aromatic hydrocarbons using Bacillus subtilis CotA with high laccase activity and copper independence[J]. Chemosphere, 2016, 148 : 1–7. DOI:10.1016/j.chemosphere.2016.01.019 |
| [12] | Jouanneau Y, Meyer C, Duraffourg N. Dihydroxylation of four-and five-ring aromatic hydrocarbons by the naphthalene dioxygenase from Sphingomonas CHY-1[J]. Applied Microbiology and Biotechnology, 2016, 100(3) : 1253–1263. DOI:10.1007/s00253-015-7050-y |
| [13] | Li XZ, Lin XG, Yin R, et al. Optimization of laccase-mediated benzo[J]. Journal of Health Science, 2010, 56(5) : 534–540. DOI:10.1248/jhs.56.534 |
| [14] | Fabbrini M, Galli C, Gentili P. Comparing the catalytic efficiency of some mediators of laccase[J]. Journal of Molecular Catalysis B: Enzymatic, 2002, 16(5/6) : 231–240. |
| [15] | Cañas AI, Alcalde M, Plou F, et al. Transformation of polycyclic aromatic hydrocarbons by laccase is strongly enhanced by phenolic compounds present in soil[J]. Environmental Science & Technology, 2007, 41(8) : 2964–2971. |
| [16] | Varela E, Tien M. Effect of pH and oxalate on hydroquinone-derived hydroxyl radical formation during brown rot wood degradation[J]. Applied and Environmental Microbiology, 2003, 69(10) : 6025–6031. DOI:10.1128/AEM.69.10.6025-6031.2003 |
| [17] | Krueger MC, Bergmann M, Schlosser D. Widespread ability of fungi to drive quinone redox cycling for biodegradation[J]. FEMS Microbiology Letters, 2016, 363(11) : fnw105. DOI:10.1093/femsle/fnw105 |
| [18] | Andersson BE, Henrysson T. Accumulation and degradation of dead-end metabolites during treatment of soil contaminated with polycyclic aromatic hydrocarbons with five strains of white-rot fungi[J]. Applied Microbiology and Biotechnology, 1996, 46(5/6) : 647–652. |
| [19] | Rodgers-Vieira EA, Zhang ZF, Adrion AC, et al. Identification of anthraquinone-degrading bacteria in soil contaminated with polycyclic aromatic hydrocarbons[J]. Applied and Environmental Microbiology, 2015, 81(11) : 3775–3781. DOI:10.1128/AEM.00033-15 |
| [20] | Zeng J, Lin XG, Zhang j, et al. Successive transformation of benzo[a]pyrene by laccase of Trametes versicolor and pyrene-degrading Mycobacterium strains[J]. Applied Microbiology and Biotechnology, 2013, 97(7) : 3183–3194. DOI:10.1007/s00253-012-4120-2 |
| [21] | Lundstedt S, White PA, Lemieux CL, et al. Sources, fate, and toxic hazards of oxygenated polycyclic aromatic hydrocarbons (PAHs) at PAH-contaminated sites[J]. AMBIO: A Journal of the Human Environment, 2007, 36(6) : 475–485. DOI:10.1579/0044-7447(2007)36[475:SFATHO]2.0.CO;2 |
| [22] | Kästner M, Nowak KM, Miltner A, et al. Classification and modelling of nonextractable residue (NER) formation of xenobiotics in soil — a synthesis[J]. Critical Reviews in Environmental Science and Technology, 2014, 44(19) : 2107–2171. DOI:10.1080/10643389.2013.828270 |
| [23] | Brissos V, Ferreira M, Grass G, et al. Turning a hyperthermostable metallo-oxidase into a laccase by directed evolution[J]. ACS Catalysis, 2015, 5(8) : 4932–4941. DOI:10.1021/acscatal.5b00771 |
| [24] | Xu F, Berka RM, Wahleithner JA, et al. Site-directed mutations in fungal laccase: effect on redox potential, activity and pH profile[J]. Biochemical Journal, 1998, 334(1) : 63–70. DOI:10.1042/bj3340063 |
| [25] | Gupta N, Lee FS, Farinas ET. Laboratory evolution of laccase for substrate specificity[J]. Journal of Molecular Catalysis B: Enzymatic, 2010, 62(3/4) : 230–234. |
| [26] | Wu YC, Teng Y, Li ZG, et al. Potential role of polycyclic aromatic hydrocarbons (PAHs) oxidation by fungal laccase in the remediation of an aged contaminated soil[J]. Soil Biology and Biochemistry, 2008, 40(3) : 789–796. DOI:10.1016/j.soilbio.2007.10.013 |
| [27] | Li XZ, Wu YC, Lin XG, et al. Dissipation of polycyclic aromatic hydrocarbons (PAHs) in soil microcosms amended with mushroom cultivation substrate[J]. Soil Biology and Biochemistry, 2012, 47 : 191–197. DOI:10.1016/j.soilbio.2012.01.001 |
| [28] | Cébron A, Beguiristain T, Bongoua-Devisme J, et al. Impact of clay mineral, wood sawdust or root organic matter on the bacterial and fungal community structures in two aged PAH-contaminated soils[J]. Environmental Science and Pollution Research, 2015, 22(18) : 13724–13738. DOI:10.1007/s11356-015-4117-3 |
| [29] | Zhang J, Lin XG, Li XZ, et al. Interactive effect of spent mushroom compost and rhamnolipids to enhance the effeciency of alfalfa remediation of aged PAHs contaminated soil[J]. Environmental Science, 2010, 31(10) : 2431–2438. (in Chinese) 张晶, 林先贵, 李烜桢, 等. 菇渣和鼠李糖脂联合强化苜蓿修复多环芳烃污染土壤[J]. 环境科学, 2010, 31(10) : 2431–2438. |
| [30] | Zhang H, Zhang S, He F, et al. Characterization of a manganese peroxidase from white-rot fungus Trametes sp. 48424 with strong ability of degrading different types of dyes and polycyclic aromatic hydrocarbons[J]. Journal of Hazardous Materials, 2016, 320 : 265–277. DOI:10.1016/j.jhazmat.2016.07.065 |
| [31] | Monza E, Lucas MF, Camarero S, et al. Insights into laccase engineering from molecular simulations: toward a binding-focused strategy[J]. Journal of Physical Chemistry Letters, 2015, 6(8) : 1447–1453. DOI:10.1021/acs.jpclett.5b00225 |
| [32] | Aranda E. Promising approaches towards biotransformation of polycyclic aromatic hydrocarbons with Ascomycota fungi[J]. Current Opinion in Biotechnology, 2016, 38 : 1–8. DOI:10.1016/j.copbio.2015.12.002 |
| [33] | Zhang SM, Ning YX, Zhang XL, et al. Contrasting characteristics of anthracene and pyrene degradation by wood rot fungus Pycnoporus sanguineus H1[J]. International Biodeterioration & Biodegradation, 2015, 105 : 228–232. |
 2017, Vol. 44
2017, Vol. 44






