扩展功能
文章信息
- 黄烨, 刘双江, 姜成英
- HUANG Ye, LIU Shuang-Jiang, JIANG Cheng-Ying
- 微生物腐蚀及腐蚀机理研究进展
- Microbiologically influenced corrosion and mechanisms
- 微生物学通报, 2017, 44(7): 1699-1713
- Microbiology China, 2017, 44(7): 1699-1713
- DOI: 10.13344/j.microbiol.china.170197
-
文章历史
- 收稿日期: 2017-03-09
- 接受日期: 2017-06-05
- 优先数字出版日期(www.cnki.net): 2017-06-07
2. 中国科学院大学 北京 100049;
3. 环境微生物技术联合实验室 北京 100101
2. University of Chinese academy of sciences, Beijing 100049, China;
3. IMCAS-RCEECAS Joint-Lab of Microbial Technology for Environmental Science, Beijing 100101, China
微生物腐蚀(Microbiologically influenced corrosion,MIC)是指附着在材料(包括金属及非金属)表面的生物膜中微生物的生命活动导致或促进材料的腐蚀或破坏。环境中微生物的存在是发生微生物腐蚀的先决条件。若其生命活动要对材料有进一步的影响,环境中必须具备微生物生长所需的能源、碳源、电子供体、电子受体以及水。以往,人们总是用非生物的腐蚀机制来解释观察到的腐蚀现象,微生物对腐蚀的影响往往被忽略。近年来,由于检测手段日益发展,微生物在腐蚀过程中的作用越来越受到重视。目前理解的微生物腐蚀的本质依然是电化学腐蚀,只是在非生物的过程中引入了生物的影响。但是有很多现象已无法仅用电化学模型来解释,所以微生物直接作用于材料的机制亟待阐明。
微生物腐蚀作用几乎能使所有现用的材料都受到严重影响,使材料的结构及性能发生很大的变化。微生物能造成金属局部腐蚀,如孔蚀、缝隙腐蚀、沉积层下腐蚀,脱合金腐蚀,还能增强电偶腐蚀、环境敏感断裂和腐蚀及磨蚀。微生物腐蚀涉及面广,渗透于石油、化工、建筑、道路桥梁、矿山及舰船等工业部门,已造成巨大的经济损失。我国2014年重大咨询项目“中国腐蚀状况及控制战略研究”的结果显示[1],全国腐蚀总成本约占当年GDP的3.34%,总额超过2.1万亿元人民币,相当于每个中国人承担1 555多元的腐蚀成本。据美国腐蚀工程师协会NACE最近的调查结果显示,2013年美国的腐蚀成本已经达到2.5万亿美元,超过GDP的3.4%[2]。而其中由微生物腐蚀造成的损失约占20%。因此,为减少腐蚀造成的损失,对微生物腐蚀的研究刻不容缓。
1 腐蚀微生物及特性早在1895年,Beijerinck[3]就描述了“在缺乏氧气的土壤中营严格厌氧的一种微生物,能生成H2S和金属硫化物”,并把它命名为Spirillum desulfuricans。1934年,von Wolzogen Kühr等[4]认为硫酸盐还原菌(sulfate-reducing bacteria,SRB)是硫酸盐富集土壤中管道腐蚀的主要原因,他们总结了微生物腐蚀的重要生理特征,即“阴极氢作为SRB的单一电子供体”,并衍生出了经典的“阴极去极化”理论。20世纪80年代中期,随着表面分析技术的发展,使得精确确定微生物和腐蚀材料之间的空间关系成为可能[5-7]。由于有了得力的技术支持,关于金属和非金属材料在各种环境下的MIC研究报道不断增加。
腐蚀与碳、氮、铁、硫等元素循环息息相关。腐蚀微生物多是环境中铁硫循环的参与者。根据细菌种类及作用的不同可以分为硫酸盐还原菌SRB、硫氧化菌SOB、产酸菌APB、铁氧化细菌IOB、铁还原细菌IRB、硝酸盐还原菌NRB以及产粘液细菌SFB等(表 1)。
| 类型 Type |
特征 Trait |
影响 Effect |
参考文献 References |
|
| Sulfate-reducing bacteria Desulfovibrio Desulfobacterium Desulfotomaculum |
Anaerobic | Use H2 to reduce SO42- to S2-; producing of H2S and FeS | Cathodic depolarization by hydrogen uptake; anodic depolarization by corrosive iron sulfides; direct iron uptake | [9-11] |
| Sulfur-oxidizing bacteria Thiobacillus Sulfurospirillum |
Aerobic | Oxidize S2- and SO32-to H2SO4 |
Acids corrode metal | [12] |
| Nitrate-reducing bacteria Klebsiellamobilis |
Anaerobic | Reduce NO3- to NH4+; Oxidize Fe2+ to Fe3+ | Dissolve metal | [13] |
| Iron-oxidizing/reducing bacteria Acidithiobacillus ferrooxidans Leptothrix Crenothrix Sphaerotilus |
Aerobic and anaerobic | Oxidize Fe2+to Fe3+ Reduce Fe3+ to Fe2+ manganese or iron oxide/reduction | Oxidation/Reduction of iron and manganese (oxides) | [14-15] |
| Acid-producing bacteria and fungi Thiobacillus Acetobacter |
Aerobic and anaerobic | Production acids, e.g., nitric acid, sulfuric acid, and organic acids | Dissolve iron, chelate copper, zinc and iron | [16-17] |
| Slime-forming bacteria Clostridium Flavobacterium Bacillus Pseudomonas |
Aerobic and anaerobic | Production of extracellular polymeric substances (biofilm) | Exopolymers capable of binding metal ions | [18] |
在厌氧环境下占腐蚀主导地位的为SRB。SRB是一类在生理和形态上互不相同,通过氧化有机化合物或分子氢,将硫酸盐、亚硫酸盐、硫代硫酸盐甚至是单质硫(作为其电子传递链的最终电子受体)还原为H2S,从而获得能量的原核微生物的总称。SRB是古老的微生物,当生命在地球上孕育的同时,就参与到了原始的硫素地球化学循环中。目前已经发现了超过60个属220个种的SRB。按照系统发育以及生理生化特性分类,大多数SRB主要归类为:(1) 广古菌门(Euryarchaeota),如古生球菌属(Archaeoglobus);(2) 常温δ变形菌,主要包括:脱硫弧菌属(Desulfovibrio)和脱硫杆菌属(Desulfobacterium);(3) 热脱硫菌科(Thermodesulfobiaceae);(4) 嗜热革兰氏阴性菌,如热脱硫弧菌属(Thermodesulfovibrio);(5) 革兰氏阳性菌,代表菌主要为脱硫弧菌属(Desulfovibrio)[18]和脱硫肠状菌属(Desulfotomaculum)。虽然大多数的SRB严格厌氧,但是有的属能耐受一定浓度的O2,并能在低浓度的O2中生长[19]。SRB能利用上百种化合物如糖类、氨基酸类、醇类、羧酸、芳香族化合物等作为电子供体,同时还原多种价态的含硫或金属化合物。因此,SRB被认为可用于芳香族化合物及有毒有害金属(如铬、锶等)污染土壤的微生物修复、废水中贵金属(铂、金、钯等)的提炼以及烟气的脱硫处理。Smith等[20]利用乳糖作为SRB的碳源及能源,利用SRB生物膜处理浓度为500 µmol/L的含铬溶液,经过48 h处理,溶液中铬的去除率达到88%;Zhang等[21]利用固定化SRB处理含Fe 469 mg/L、Cu 88 mg/L、Cd 92 mg/L和Zn 128mg/L的酸性矿山废水时,SRB对含多种金属离子的酸性矿山废水耐受性好,重金属去除率高达99.9%。同时,对废水中SO42-离子的去除率最高也达到了88%。
由于具有可利用电子供体范围广,金属还原酶的底物非特异性等特点,SRB在环境生物修复中有着潜在的利用价值。但SRB在生长代谢的过程中会产生H2S、金属硫化物等化合物,在厌氧的情况下会导致并加速材料的腐蚀。Sungur等[5, 22]发现SRB在冷却塔中的数量可以最高达到104cells/mL;SRB能贴附在镀锌钢的表面并形成生物膜,对这种本来有较好耐腐蚀性能的冷却塔常用材料造成腐蚀。Yuan等[23]探究了在海水培养基中SRB以及SRB代谢产物与无机硫化物对304不锈钢的腐蚀对照,发现SRB所产生的硫化物对304不锈钢有更明显的腐蚀现象,而且SRB所产生的生物膜不仅没有对不锈钢的表面起到钝化膜保护作用,反而会促进腐蚀。Liu等[24]发现SRB会对海洋沉积层的Al-Zn-In-Sn牺牲阴极造成点蚀。材料的腐蚀速率随SRB的生长过程而加速。由于阴极氢的消耗导致阴极去极化,从而会加速腐蚀产物与金属材料的电偶腐蚀。对于耐腐蚀性能好的2205双相不锈钢,SRB也会造成其表面明显的点蚀并形成Cr2O3、FeS、FeS2、Fe(OH)2和FeO等腐蚀产物。SRB普遍出现在工业冷却水、海洋沉积层、油井、热泉喷口、污水处理及海中运输系统中,会引起水质酸化、工业及运输设备被腐蚀,造成严重的环境危害及经济损失。
硫氧化细菌(Sulfur-oxidizing bacteria,SOB)与SRB作用刚好相反,是将各种还原态的硫化物(如H2S,硫代硫酸盐等)或单质硫在较低的pH条件下氧化成H2SO4的一类细菌,主要包括脂环酸芽孢杆菌属(Alicyclobacillus)[25-27]、丝硫细菌属(Thiothrix)、嗜酸菌属(Acidiphilium)[28]、盐硫杆状菌属(Halothiobacillus)以及硫杆菌属(Thiobacillus,Acidithiobacillus)等。Bielefeldt等[29]将中性的那不勒斯硫杆菌Thiobacillus neapolitanus C2和排硫硫杆菌Thiobacillus thioparus H1以及嗜酸的氧化硫硫杆菌Acidithiobacillus thiooxidans和隐性嗜酸杆菌Acidiphilium cryptum LHET2混合培养,发现SOB能造成混凝土失重13 mg/g,生成47 mg硫酸盐/g混凝土。SOB与SRB的协同作用能造成严重的混凝土腐蚀。Okabe等[30]发现SOB能通过氧化SRB代谢生成的H2S生成H2SO4,在102 d之后使混凝土表面的pH值从12.0降到1.6。1年之后混凝土的失重率为37%,腐蚀达到3-4 mm/y。
1.2 硝酸盐还原菌NRB硝酸盐是植物生长最主要的氮源,但同时也是环境中的污染源。石油生产过程中会注入水到油井中,以保持油井的压力从而将石油冲入生产井中。在大部分海上油田和一些中东的陆上油田生产石油过程中,会注入海水作为补给水与之前的采出水混合保证生产的连贯进行,这样海水中所含的硫酸盐也因此会被引入整套石油开采设备中,导致SRB在管道中生长代谢,生成一系列的硫化物造成油藏酸化,为了防止或减少酸化的发生,会在引入的海水中加入硝酸盐[31]。硝酸盐的注入会促进水中异养硝酸盐还原菌(Nitrate-reducing bacteria,NRB)和硫氧化菌SOB的生长,前者会与SRB竞争底物(石油有机物);而后者会直接氧化SRB产生的硫化物。SRB的生长也会受到NRB的产物亚硝酸盐的抑制。NRB是分类学上广泛的统称,是指可以将硝酸盐还原为亚硝酸盐,并通过脱硝作用将亚硝酸盐还原为气态氮化合物或异化转化为NH4+的一类细菌。然而最近的研究表明,NRB的硝酸盐还原会造成微生物腐蚀的发生。Etique等[13]发现克雷伯氏菌(Klebsiella mobilis)有在硝酸盐与Fe2+存在的情况下产生绿锈(Fe2+与Fe3+的氢氧化物)的能力,该菌可以利用有机碳源还原硝酸盐,虽然该菌中未发现与Fe2+氧化相关的酶。但实验结果发现,K. mobilis可以通过耦合硝酸盐的还原将Fe2+氧化成Fe3+,硝酸盐还原导致的金属氧化是热力学可行的,NRB能有效地促进这类反应的发生。Xu等[32]发现NRB可以形成生物膜,在一周的腐蚀试验中,在C1018碳钢表面可形成14.5 μm深的腐蚀坑,失重能达到0.89 mg/cm2。
1.3 铁氧化菌IOB铁在水圈、大气圈、岩石圈以及生物圈中无处不在,是地壳中含量第四丰富的元素,也是生命必需的物质元素。由于具有富铁矿床、易于加工以及良好的机械性能等特性,铁同时也是应用最为广泛的金属。由于Fe在生命活动中的重要性,自然界中铁的氧化还原反应,包括溶解和沉淀以及继而发生的移动和再分布,都很大程度上依赖于细菌来完成。Fe2+可以作为厌氧或好氧条件下无机营养微生物的电子供体;而Fe3+则可以作为厌氧条件下铁还原微生物的电子受体。在微生物的作用下,地球环境中的铁元素得以在氧化还原状态之间相互转换,实现铁元素的有效循环。
铁氧化菌(Iron-oxidizing bacteria,IOB)广泛存在于环境中[14-15]。各种各样不同生理特性的微生物进化出了不同形式的氧化Fe的能力。Fe2+在pH值较低的情况下较为稳定。而当pH达到中性及以上之后,Fe2+极易被O2所氧化,只有在厌氧条件下,铁氧化细菌才能有效利用Fe2+进行能量代谢过程。因此铁细菌大多为兼性、专性厌氧的,可以在中性、温和甚至是极酸的环境中生长。
嗜酸性IOB的代表菌为氧化亚铁硫杆菌(Acidithiobacillus ferrooxidans,原为Thiobacillus ferrooxidans)[33-34]。该菌具有很强的Fe2+氧化能力,可以氧化硫化矿生成硫酸[35-36]。Li等[37]发现A. ferrooxidans能提高金属的腐蚀电位,增加腐蚀电流密度,在A3钢上形成明显的点蚀坑。Wang等[38]探究了C1010碳钢在A. ferrooxidans存在下的腐蚀行为,发现A. ferrooxidans对于C1010碳钢的腐蚀速率是没有细菌存在下的酸水腐蚀速率的3–6倍。
中性铁氧化细菌一般为厌氧菌,包括光能厌氧铁氧化细菌、厌氧硝酸盐依赖性铁氧化菌和微好氧型铁氧化菌[39]。比如光能厌氧铁氧化细菌,能利用光能将Fe2+氧化成Fe3+并固定CO2,代表菌有氧化亚铁绿硫菌(Chlorobium ferrooxidans)、铁锈小红卵菌(Rhodovulum robiginosum)、万尼氏红微菌(Rhodomicrobium vannielii)、网硫菌属Thiodictyon sp.等;厌氧硝酸盐依赖型铁氧化菌广泛存在于水环境中,包括稻田、海洋沉积物、热泉、池塘、溪流、咸水湖等,代表菌有化能自养的脱氮硫杆菌(Thiobacillus denitrificans)。这类菌利用硝酸盐作为电子受体耦合Fe2+氧化,从而造成金属腐蚀[40];微好氧型铁氧化菌主要分布在近海水域、河口以及深海热泉喷口处,能在中性环境中造成金属矿化,主要产物包括α-FeOOH和Fe2O3[41]。Zeta变形菌门(Proteobacteria)中的Leptothrix、Crenothrix和Sphaerotilus属可能是分布最为广泛,在腐蚀过程中起最重要作用的微好氧中性IOB[15, 39],它们对亚铁的氧化可能是各种生物源矿物如水铁矿、赤铁矿、针铁矿、磁铁矿以及绿锈等矿物的形成原因。
IOB铁氧化所产生的能量很少,并且氧化Fe2+的速率远大于化学氧化过程。因此IOB在生长过程中会氧化大量的二价铁离子,引起的腐蚀会加速金属的分解并造成严重的局部腐蚀[42-43];同时氧化形成的大量Fe3+与Cl-形成具有更高腐蚀性的FeCl3溶液,而形成的铁氧化物或铁氢氧化物沉淀结壳堆积,形成非常明显的锈瘤(即普遍熟识的铁锈),所以发生在管道中的IOB腐蚀会影响管道中溶液的质量并会造成管道的严重堵塞[44-45]。Sung等[46]探究了IOB对不锈钢和镀锌钢的影响,发现IOB不仅会引起镀锌钢和不锈钢的腐蚀,还会加速锌/铁沉淀的形成。Li等[47]发现在再生水中,IOB会吸附在碳钢表面并加速碳钢的点蚀,系统的腐蚀电位负移23%-36%。本研究组利用从热泉中分离获得的铁、硫氧化细菌及古菌进行不锈钢腐蚀研究,发现中温IOB Leptospirillum ferriphilum、中度嗜热菌Sulfobacillus thermotolerance[48]及嗜酸热古菌Metallosphaera cuprina[49]和Metallosphaera tengchongenes[50]均具有较强的金属腐蚀能力。
1.4 产酸细菌APB产酸细菌(Acid-producing bacteria,APB)的代谢产物包括多种有机酸和无机酸,这些酸使周围环境pH值下降,使金属受到侵蚀并溶解,造成严重的孔蚀和孔隙渗漏[51]。比如氨氧化细菌及亚硝酸盐氧化菌代谢产生的HNO2和HNO3能造成混凝土表面的腐蚀[52];硫杆菌属(Thiobacillus)能氧化还原态硫化物如单质硫、亚硫酸盐和硫代硫酸盐等,产生代谢产物H2SO3或H2SO4侵蚀金属。
醋酸杆菌属(Acetobacter)能将乙醇转化为乙酸。不论是水溶条件的乙酸还是乙酸蒸气都能对材料造成腐蚀。Sowards等[53]模拟地下储油罐环境利用A. aceti对110铜和1018合金钢进行腐蚀,发现1018合金钢出现明显的点腐蚀,而110铜则出现了点蚀和晶间腐蚀,实验估算乙酸对1018合金钢和110铜的腐蚀速率分别为2.85-4.7 mm/y和0.402-0.876 mm/y。典型的工业级铜管具有1.24 mm和1.65 mm之间的壁厚,乙酸可以相当迅速地使其穿孔;Heyer等[54]将海洋压载舱常用涂层暴露于产酸细菌中,表面产生了深度为0.2 μm-0.9 μm,宽度为4 μm-9 μm的腐蚀孔,因此产酸菌造成的腐蚀不可忽视。近年,APB已经越来越多地被发现在环境中处于腐蚀主导地位。微生物腐蚀研究重点正逐渐向APB转移[16]。
1.5 产黏液菌SFB产黏液菌(Slime-forming bacteria,SFB)是一类产大量胞外多聚物(Extracellular polymeric substances,EPS)的细菌。EPS是细菌分泌的多糖、脂质、腐殖质、蛋白以及核酸的混合物[55],是金属表面形成的生物膜的基质结构。在腐蚀过程中,生物膜的形成最初是由浮游细菌借助微弱的范德华力接触金属表面,快速但可逆[56];然后形成微菌落,造成持久牢固的附着;接着细菌开始分泌生物膜基质,随着基质上不断黏附上微生物的代谢物、金属离子、腐蚀产物以及其他生物等,最终形成成熟的生物膜。
常见的SFB包括梭菌属(Clostridium)、黄杆菌属(Flavobacterium)、芽孢杆菌属(Bacillus)、脱硫弧菌属(Desulfovibrio)、脱硫肠状菌属(Desulfotomaculum)以及假单胞菌属(Pseudomonas)等。SFB在MIC中有着不可或缺的作用,能使周围环境在有氧与无氧之间转换,形成适宜SRB、IOB、APB等其他微生物生长的微环境[18]。
SFB中的铜绿假单胞菌(Pseudomonas aeruginosa,PA)在海洋环境中大量存在,会分泌酸性的EPS,主要为胞外多糖海藻酸[57],海藻酸能与金属络合,与金属离子反应[58];PA在金属表面形成的生物膜不均匀,使得金属表面产生各种浓差电池,对金属材料造成严重的局部腐蚀。PA还能通过自身产生的铁载体蛋白Pyochelin和Pyoverdin,将三价铁固体溶解,再将Fe3+还原为Fe2+,使金属腐蚀更加严重[59]。
1.6 铁还原细菌IRB铁还原细菌(Iron-reducing bacteria,IRB)是一类营严格厌氧或兼性厌氧的古菌或细菌[60]。其中铁还原古菌主要包括泉古菌门(Crenarchaeota)和广古菌门(Euryarchaeota)成员。铁还原细菌包括菌种较多,包括地杆菌属(Geobacter)、希瓦氏菌属(shewanella)、暗杆菌属(pelobacter)、地弧菌属(Geovibrio)、地发菌属(Geospirillum)、脱硫单胞菌属(desulfuromonas)等。IRB利用有机物或H2作为电子供体,Fe3+ (或者Mn4+)等作为电子受体,从而获得能量。IRB因为其多样化的电子传递系统,在还原Fe3+或其他铁氧化物的同时,能驱动有机碳矿化,降解苯、苯酚等芳香有机物。受到广泛研究的IRB包括:铁还原地杆菌(Geobacter metallireducens)、硫还原地杆菌(Geobacter sulfurreducens)、希瓦氏菌Shewanella oneidensis MR-1和Shewanella putrefaciens。这些菌一直被作为电子传递研究的模式菌,研究发现,地杆菌属能直接从金属表面获取电子[61-62],胞外的纳米导线以及外表面的细胞色素C均对地杆菌的胞外电子传递(Extracellular electron transfer,EET)起到重要作用[63-64]。最早的研究认为希瓦氏菌是通过一种可溶的电子通道介质——核黄素将电子传递到阳极,而Pirbadian等[65]观察到Shewanella oneidensis MR-1具有由外膜和周质衍生出的纳米通道,参与细菌种间的电子传递[66]。
对IRB腐蚀性能的研究有多种观点,有人认为IRB能增加具有腐蚀性的铁硫化物的浓度,从而加强腐蚀;IRB或能溶解金属表面的抗腐蚀金属氧化膜进而腐蚀金属[67-69];也有人认为IRB溶解金属氧化膜后会形成Fe2+,Fe2+氧化消耗掉了环境中的氧气,从而阻断了氧气与金属表面的接触,阻碍了腐蚀的进行[70-71]。同时,金属表面还可能生产铁磷化合物等保护性膜,抑制金属的腐蚀[72]。
1.7 其他腐蚀微生物产甲烷菌能利用金属表面的阴极氢或者有机碳源如乙酸作为电子供体,还原CO2的同时释放甲烷。常见的与腐蚀相关的产甲烷菌包括:甲烷八叠球菌Methanosarcina barkeri、嗜热甲烷球菌Methanococcus thermolithotrophicus、甲烷丝菌Methanosaeta、甲烷杆菌Methanobacteriaceae等[73]。厌氧环境中的产甲烷菌越来越多地被发现与微生物腐蚀相关[74-75],产甲烷菌可能是某些环境中金属腐蚀的重要原因[76-77]。
真菌在生物圈有非常重要的生物地球化学作用,与元素的循环和无机物/有机物相互转化密切相关。真菌独特的生长习性以及生存策略使得真菌广泛存在于各类陆生环境中。真菌会释放一些有机酸如草酸和柠檬酸等强金属螯合剂,促进金属的溶解,造成材料的局部腐蚀及开裂。Dai等[17]和Qu等[78]发现黑曲霉的主要代谢产物草酸是造成金属点腐蚀的主要原因。
2 微生物腐蚀机理腐蚀是一种在自然界极其普遍的现象。人们根据观察到的现象进行研究,并基于实验结果得出各自的理论。腐蚀是一种电化学过程,目前对于微生物腐蚀的研究都是从宏观层面上分析和解释,通过分析微生物所产生的生物膜以及代谢产物,腐蚀后金属表面成分及结构性能的变化,得到金属表面图像以及电化学数据,从而推测腐蚀机理。
微生物附着在金属表面形成生物膜后,可通过多种方式影响金属的腐蚀过程:(1) 影响电化学腐蚀的阳极或阴极反应,分泌能够促进阴极还原的酶;(2) 改变了腐蚀反应类型,由均匀腐蚀可能转变为局部腐蚀;(3) 微生物新陈代谢过程产生促进或抑制金属腐蚀的化合物;(4) 生成生物膜结构,创造了生物膜内的腐蚀环境,改变金属表面状态。
然而微生物腐蚀的过程中并不一定只有某种机理,也不可能出现统一的机理。由于不同的微生物在不同环境中生长代谢不同,以及环境中多种微生物相互作用的复杂性,导致即使是同一种微生物也会出现对于同种金属不同的腐蚀行为。而实际情况中往往是几种机理以不同的方式在腐蚀过程中共同起作用。因此根据腐蚀现象想要弄清楚微生物的腐蚀机理非常困难。我们仅能根据实际情况的不同,判断是哪种机理在起主要作用(图 1)。
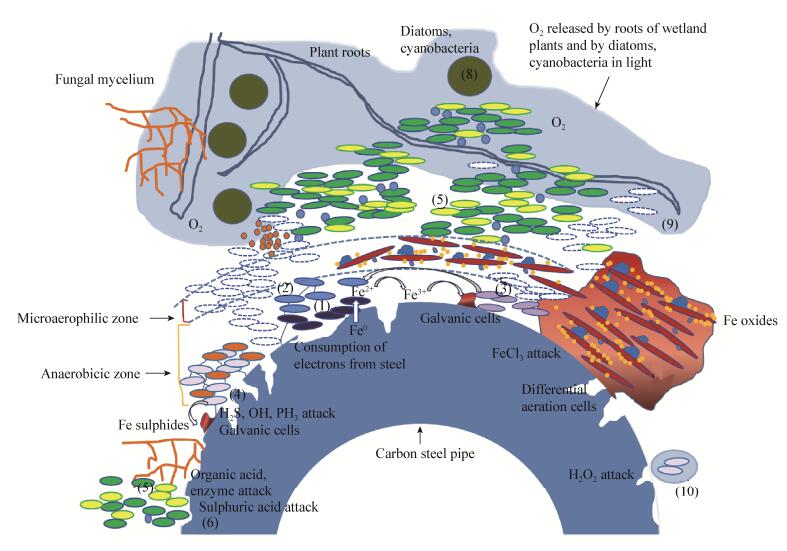
|
| 图 1 微生物腐蚀机理总述图[79] Figure 1 Microbial corrosion mechanism summary[79] 注:(1) 厌氧甲烷菌和硫酸还原微生物从金属中直接摄取电子,产生Fe2+;(2) 厌氧铁氧化微生物利用硝酸盐作为电子受体氧化Fe2+,产生铁氧化物;(3) 厌氧异养微生物利用不溶性Fe氧化物,产生Fe2+;(4) 厌氧硫酸盐还原微生物利用硫酸盐作为末端电子受体,产生可以增加腐蚀速率的OH-、PH3、H2S、FeS.连接线为纳米线;(5) 异养微生物产生某些有机酸和酶侵蚀钢铁,消耗其他微生物产生的营养物质.在生物膜内产生氧气梯度;(6) 硫氧化微生物产生硫酸;(7) 中性铁氧化细菌产生Fe氧化物,在金属表面形成不同的浓差电池;(8) 硅藻和蓝细菌在土壤表面产生氧气,产生不同的氧浓差池.一些植物根部在土壤中释放氧气;(9) 其他微生物;(10) 好氧土壤微生物产生的过氧化氢侵蚀钢铁. Note: (1) Anaerobic methanogens and sulphate reducing microorganisms uptake electrons directly from the metal surface, producing Fe2+; (2) Anaerobic iron oxidising microorganisms use nitrate as an electron acceptor oxidise Fe2+; (3) Anaerobic heterotrophic microorganisms utilize insoluble Fe oxides to produce Fe2+; (4) Anaerobic sulphate reducing microorganisms use sulphates as terminal electron acceptors to produce OH-, PH3, H2S, FeS that can increase the corrosion rate. The connecting lines indicate nanowires; (5) Heterotrophic microorganisms produce organic acids and enzymes that erode iron and steel. They also consume nutrients produced by other microorganisms; (6) Sulfur-oxidising microorganisms produce sulphuric acid; (7) Neutrophilic iron oxidising bacteria produce Fe oxide forming differential aeration cells and the galvanic cells; (8) Diatoms and cyanobacteria produce oxygen atthe surface of soil, creating differential aeration cells. Some plant roots release oxygen in soil; (9) Other microorganisms; (10) Hydrogen peroxide produced by aerobic microorganisms erode steel. |
|
|
铁的腐蚀必定伴随着金属铁的溶解,这是所有腐蚀机理中的阳极反应:Fe↔Fe2++2e–,E=-0.47 V。
在有氧条件下(E=+0.82 V),反应很容易发生。会生成铁的氧化物或氢氧化物。
在厌氧条件下,电子会传递给水电解出的H+:2e–+H+→H2,E=-0.41 V。
总反应为:Fe+2H2O→Fe2++H2+2OH–。
H+的形成是整个反应的限速步骤。所以在缺氧的实际情况中铁的腐蚀速率理论上应该非常低。但是微生物的生长代谢过程中,能通过各种途径、不同方式改变阴极反应的动力学,提高上述反应的速率,促进了整个反应的发生[80]。
2.1 氢化酶阴极去极化理论早期研究者推测,在没有微生物的情况下,水中的氢会夺取金属表面的电子形成H2,在金属表面形成“氢膜”,最终阻碍金属的溶解反应。这种阻碍通常被称为“极化”。腐蚀是一个能量释放的反应过程,微生物通过腐蚀金属得到维持其生命所必需的能量。阴极去极化理论认为SRB吸附在金属表面,利用体内的氢化酶,在把SO42-还原成H2S的同时,将金属表面电化学意义的阴极上生成的氢除去,其有效清除H2被认为降低局部分压,并且通过这种“去极化”使得铁溶解进行,因此厌氧SRB腐蚀起到了阴极去极化剂的作用。阴极氢促进了SRB的生长,从而加速金属的腐蚀[81]。SRB的作用是将氢原子从金属表面除去,有利于铁转变成二价铁离子进入溶液中,然后二价铁离子分别与二价硫离子和氢氧根离子反应生成二次腐蚀产物FeS和Fe(OH)2,二次腐蚀产物可在铁表面形成松软的腐蚀瘤,致使其内外形成浓差电池,从而加速腐蚀。
相关反应如下:
8H2O→8H·+8OH阳极反应;
4Fe+8H→4Fe·+8H阳极反应;
H2SO4+8H→H2S+H2O氢化酶的阴极去极化;
3Fe·+6OH→3Fe(OH)2腐蚀产物;
总反应式为:4Fe+H2SO4+2H2O→3Fe(OH)2+FeS。
阴极去极化理论是SRB最为经典的腐蚀机理,得到了众多学者的支持。Keresztes等[82]研究发现,粘附在金属材料表面的SRB在有可溶性介质分子存在的情况下极易发生阴极反应,金属电极的腐蚀电位与SRB中氢化酶的氧化还原电位一致,微生物能直接消耗金属表面的阴极氢。还有学者认为,金属表面的电子可以直接转移到氢化酶表面,同时形成活性氢[83],氢化酶还能直接从金属表面摄取电子。这种直接摄取氢造成金属腐蚀的现象常见于脱硫弧菌属(Desulfovibrio)。
Xu等[84]在2016年提出了一种新的SRB腐蚀机理——BCSR (Biocatalytic cathodic sulfate reduction)理论,该理论认为:金属表面附着具有腐蚀能力的生物膜,在生物催化剂(指生物膜中SRB分泌的生物活性酶)的作用下,阴极硫酸盐的还原直接消耗了阳极金属材料溶解释放的电子,从而加速金属的腐蚀。与传统的阴极去极化理论不同,这种观点认为整个阴极反应发生在SRB的细胞膜内(生物阴极),这样的认识颠覆了微生物腐蚀领域中一直认为的“物理阴极”的传统看法。阴极与阳极的反应如下:
阳极:4Fe→4Fe2++8e– (金属溶解);
阴极:SO42–+8H++8e–→HS–+OH–+3H2O。
阴极去极化理论存在着一定缺陷:按照电化学理论,阴极去极化中腐蚀的底物金属Fe与反应生成的FeS的比值理论上应为4。但是Spruit等[85]在SRB异养条件下测得该值在0.9-1.5之间,自养条件下则为5-9。同时,之前在SRB腐蚀实验中测定H2对腐蚀的影响时,由于培养基中加入了乙酸,乙酸作为SRB的电子供体会竞争阴极氢,使SRB生成更多的硫化物,造成了严重的化学腐蚀;而不加乙酸盐并以金属作为SRB的唯一电子供体时,SRB并没有造成金属的阴极去极化,腐蚀加速的现象也没有发生[8]。因此用阴极去极化理论解释SRB的腐蚀机理并不完善。
2.2 代谢产物腐蚀机理 2.2.1 H2S腐蚀机理:SRB的代谢产物H2S可以以较高的速率与金属铁反应形成FeS产物,因此可以作为有效的阴极或阳极反应物,加速腐蚀的发生[9]。H2S微溶于水,形成氢硫酸(HS-)。研究发现,H2S溶于水的比例与金属的腐蚀速率密切相关[86]。在以金属材料作为唯一的电子供体时,SRB的代谢产物H2S是导致金属腐蚀加速的原因;同时H2S溶于水之后会产生H2,H2也会造成金属的氢渗透和裂纹腐蚀,被称之为“氢脆”[87-88]。
2.2.2 FeS腐蚀机理:SRB腐蚀金属过程中,由电极过程产生的亚铁离子(Fe2+)能够与细菌代谢的硫化物反应,形成铁硫化物(FeSx)的复合物[89],在硫化物膜刚形成时,或者周围硫化物浓度很高时,该层膜结构紧密,会对金属起到很好的保护作用,但是当硫化物浓度从很低变为很高时,随之会形成较为疏松的结构,FeS可以传递金属表面的电子,并被SRB消除,从而加速金属的腐蚀[90-91](图 2);硫化物膜的生长也会导致金属表面的开裂,因而硫化物膜也可能是SRB腐蚀最主要的原因。
SRB和其他异养的腐蚀微生物能利用有机化合物如乙醇、乳酸、丙酮酸等生成CO2或者乙酸。乙酸和CO2均会对金属造成严重的腐蚀。尤其当这些产物酸在菌落或者沉积物下聚集时,会变得极具侵蚀性;如SRB和SOB协同作用生成H2SO4,造成混凝土腐蚀;产酸细菌如硝酸盐及亚硝酸盐氧化菌、硫杆菌属、醋酸杆菌能够代谢产生乙酸、甲酸、H2NO3和H2SO4等。这些酸使周围环境pH值下降,并能有效侵蚀金属,使金属溶解,造成严重的孔蚀和孔隙渗漏。
2.3 浓差电池机理微生物可以通过生长代谢建立起几种浓差电池,从而造成局部腐蚀。主要包括氧浓差电池、金属离子浓差电池以及活化钝化电池。
氧浓差电池是引起局部腐蚀最为主要的因素之一。由于金属表面的微生物膜结构、分布不均匀导致氧的扩散不均匀;产生的腐蚀产物局部堆积引起氧扩散到金属表面的量减少,或是不同位置的好氧细菌如IOB和SOB呼吸对氧气的消耗有差异,在金属表面不同区域形成氧气差从而形成了氧浓差电池,进而产生电位差。富氧区电极电位较正,为金属阴极;而贫氧区电极电位较负,为金属阳极,电位差造成了电子从阴极到阳极的流动,因而引起严重的孔蚀和缝隙腐蚀[59]。
2.4 直接与间接电子传递最近的研究表明,即使SRB造成了金属的阴极去极化,消耗了金属表面的H也不能显著地提高金属的腐蚀速率。相反,微生物能直接从金属表面获取电子,加速金属的溶解。Dinh等[92]通过富集培养的方法,利用金属离子作为唯一的电子供体,从海洋中分离到了一株能直接利用金属获得电子还原硫酸盐的SRB,它们似乎直接跳过了利用化学形成的H2作为电子供体,而选择直接利用金属表面的电子生存。因此,经典的阴极去极化理论明显不能解释这类细菌的腐蚀行为。据此,Enning等[93]2012年提出了化学微生物腐蚀(Chemical microbially influenced corrosion,CMIC)和电微生物腐蚀(Electrical microbially influenced corrosion,EMIC)的概念。电微生物腐蚀认为细菌与金属之间存在相应的电子传递机制,细菌利用金属表面的电子生长代谢,从而造成了金属腐蚀。微生物获取腐蚀金属释放的电子主要是通过细胞膜表面的细胞色素C蛋白以及生物纳米导线(pili)进行传递(图 3)。Reguera等[95]在2005年首次提出纳米导线(pili)的概念,通过导电原子力显微镜发现硫还原地杆菌Geobacter sulfurreducens的“菌毛蛋白” (geopili),在细菌与金属的电子传递中起到重要的作用。

|
| 图 3 G. sulfurreducens的电子传递机制[94] Figure 3 G. sulfurreducens electron transfer mechanism[94] 注:(由膜内到金属阳极)有机物氧化产生的电子首先由NADH脱氢酶传递给醌池,再由醌池传递至MacA蛋白,后者将电子释放给周质空间的色素蛋白PpcA等,然后周质腔色素蛋白扩散至外膜将电子转移至OmcB、OmcZ等,最后经OmcS、OmcZ或菌毛传递给胞外受体(如金属阳极).对应的电势差如图右所示. Note: (from film to metal anode) The electrons produced by oxidation of organics are first transferred from the NADH dehydrogenase to the quinone pool and then transferred from the quinone pool to the MacA protein, which releases the electrons into the perinuclear space. Periplasmic pigment protein PpcA in the outer membrane diffuses electron to OmcB, OmcZ. Electrons are ultimately delivered to extracellular receptors (such as metal anodes) via OmcS, OmcZ or fimbriae. The corresponding potential differences are shown at right. |
|
|
相比于需要微生物功能蛋白与电极接触才能发生的直接电子传递,间接电子传递可通过具有可逆氧化还原活性的电子中介体(Electron transfer mediators,ETMs)实现电子的传递,从而有效提高微生物胞外电子传递效率。在间接电子转移过程中,ETMs起着中间电子受体和中间电子供体的作用,即被还原后可将电子传递给最终电子受体并被重新还原。微生物的内生ETMs主要包括Pseudomonas属菌的吩嗪类物质和Shewanella属菌分泌的黄素类物质。Hernandez等[96]发现从根际分离的P. chlororaphis能合成1-甲酰胺吩嗪(phenazine-1-carboxamide,PCN),实现晶体氧化铁的还原。缺失PCN合成能力时,晶体氧化铁的还原能力随之减弱,并且发现少量的PCN就能够还原大量的金属氧化物。Zhang等[97]发现在培养基中加入没有腐蚀性的黄素类电子载体会增强SRB的电子传递并加速金属试片的失重及点蚀。
2.5 微生物群落协同与抑制腐蚀自然环境中的材料表面经常附着具有腐蚀能力的微生物并形成生物膜结构。腐蚀生物膜往往由各种各样的微生物组成,包括细菌、真菌、古生菌和真核生物。不同的微生物拥有不同的代谢能力,在自然环境中微生物群落能释放多种信号分子以相互“沟通”,形成协同或竞争代谢,导致腐蚀微生物群落能发挥出单一菌群无法发挥的功能。例如,Yang等[98]发现来自不同循环水通路(地表水或地下水)的铁管道中,在不同采样点、不同腐蚀阶段、不同流入水源的条件下,腐蚀微生物的种类数量以及腐蚀产物的类和量各不相同。Valencia-Cantero等[99]将来自温泉的细菌分离混合物进行培养,并与来自纯培养生长的相同菌株的腐蚀速率相比,前者对碳钢的腐蚀速率更高。Wang等[100]探讨了再生水配水系统中铁腐蚀过程的不同时间段内腐蚀产物形态结构及腐蚀微生物群落组成。腐蚀初期(56 d以前),存在铁氧化细菌IOB Sediminibacterium sp.、铁还原细菌IRB Shewanella sp.、硫氧化细菌SOB Limnobacterthioxidans以及其他异养细菌,其中IOB的生物量大于IRB。菌群中SOB能将腐蚀产物FeS氧化成H2SO4,从而释放Fe2+,并被IOB所利用。因此腐蚀初期,通过SRB/SOB与IRB/IOB的生长代谢、细菌与代谢产物、生物与非生物腐蚀之间的相互协同作用,促进金属的腐蚀;而腐蚀后期(76 d之后),随着钝化膜的形成,生物质以及细菌多样性随之减少,此时厌氧的IRB成为主要功能菌。IRB代谢生成Fe2+,阻止了氧气的扩散,通过与IOB的协同作用,抑制了腐蚀的进一步发生。宗月等[101]认为脱氮硫杆菌、硫化细菌、光和细菌、短芽孢杆菌以及假单胞菌等与SRB存在或共生或拮抗或竞争的关系,阻碍其对金属材料的腐蚀。许萍等[102]综述了微生物防腐蚀的研究,认为利用某些微生物所产的生物膜能够抑制腐蚀、保护金属的现象可以开发环境友好的可再生防腐技术。
许多学者从生物能量学和生物电子传递方面着手,发现微生物能利用电子、通过氧化还原中间体传递电子或者通过纳米导线(Pili)吸收电子进行代谢活动,从而腐蚀金属,维持自己的生命活动。而这种电子传递也可以在不同物种之间进行。Kato等[103]发现硫还原地杆菌与脱氮硫杆菌可以通过导电磁纳米颗粒作为中间体实现菌间的电子传递,完成醋酸盐氧化耦合硝酸盐还原的过程。氢、硫酸盐、甲酸盐以及一些不溶的物质如磁铁矿等也可以作为电子穿梭介体实现菌种之间的电子传递[104]。因此,材料的微生物腐蚀往往是微生物群落的综合作用。
3 生物膜与腐蚀点蚀是常见的微生物腐蚀,往往出现在有致密生物膜覆盖的区域而不是邻近分散的微生物附着的地方。生物膜的主要组成成分胞外多糖EPS在腐蚀过程中作用复杂,与其浓度、pH以及温度都有关系[105]。有研究表明低浓度的EPS (比如10 ng/cm2)可以在碳钢表面吸附成膜抑制阴极反应过程,进而抑制碳钢的腐蚀[106];而高浓度的EPS对Fe2+具有很强的络合作用(EPS中的化学物质含有大量负电荷基团如糖醛酸、氨基酸和核苷酸可以结合多价阳离子,导致金属离子的沉淀、螯合、吸附和络合,以及局部环境的pH变化),能够促进基体材料的阳极溶解,进而促进碳钢的腐蚀[105]。微生物往往在金属表面形成不均匀的附着。好氧微生物附着时,会形成氧浓差电池。菌层厚(耗氧更多,氧浓度更低)的区域会作为阳极,而附着的菌少且薄(耗氧少,氧浓度更高)的区域会作为阴极,由此加速金属的腐蚀[59]。同时生物膜的异相不均匀性会导致金属表面产生氧气的浓度梯度,使金属表面所处的环境不同,造成金属阳极曲线的不一致,从而发生“自催化效应”,造成小孔腐蚀。然而,从另一方面来说,细菌分泌的生物膜基质其实是腐蚀中的传递屏障,阻止了能造成腐蚀的代谢产物与金属的接触,从而减少腐蚀的发生[8, 107],此外,生物膜具有催化效应,能增大阴极电流密度,从而促进金属表面自钝化。在特定环境下(如恰当的pH值),原本对金属有腐蚀作用的细菌如SRB会产生对金属具有保护作用的生物膜,而原本没有作用的细菌会产生具有腐蚀作用的生物膜[108]。在油田实际工况条件下,生物膜形成过程中会引起腐蚀电位和腐蚀电流的不均匀性,呈先增加后减小的变化趋势。另外,在完整的生物膜下,腐蚀减弱,当生物膜局部脱落后,基体材料的腐蚀倾向加剧[109]。
4 总结与展望腐蚀是一种常见的自然现象。大多数的腐蚀都是微生物参与下的电化学过程。不同的微生物对于不同环境中的不同材料有不同的腐蚀机理。由于不同的微生物在不同环境中生长代谢不同,以及环境中多种微生物相互作用的复杂性,导致即使是同一种微生物也会出现对于同种金属不同的腐蚀行为。
了解腐蚀微生物的组成对于了解微生物的腐蚀过程是非常必要的。自然环境中的材料表面经常附着具有腐蚀能力的微生物并形成生物膜结构,腐蚀生物膜往往由各种各样的微生物组成。微生物群落能释放多种信号分子得以相互“沟通”,形成协同或竞争代谢,共同造成材料的腐蚀现象,因此实际情况中往往是已知的多种机理以不同的方式在腐蚀过程中共同起作用。
在对腐蚀微生物的生长习性以及腐蚀机制有所了解的基础之上,针对性地利用其他微生物进行腐蚀抑制已被证明具有巨大的潜力[8]。没有腐蚀活性的微生物可以通过消耗具有腐蚀性的物质,如呼吸消耗氧气进而减少腐蚀;可以抑制腐蚀微生物的生长,阻止腐蚀进一步发生;微生物形成的保护性生物膜可对金属材料提供保护;某些微生物还能生成化合物沉淀,保护材料免受腐蚀。
2016年5月,美国白宫启动了又一重大的国家科研计划——“国家微生物组计划”,“微生物组”这一概念也应运而生。对微生物群落或“微生物组”的研究,有助于解决不同生态系统微生物的基本问题,全面分析微生物群落的多样性和功能。地球上的每一个地方,每一种生态系统,如土壤、海洋、空气、矿藏等生态系统均有微生物的身影,微生物作为自然的分解者和还原者,在生物地球化学循环中成为不可或缺的重要角色。
鉴于此,作为影响生产生活安全及国家经济的重要领域,腐蚀微生物组也将成为其中不可缺少的重要组成部分。我们应该结合多领域多学科的研究背景与基础知识,拓展对原位微生物腐蚀现象的研究,收集微生物腐蚀信息,全面了解腐蚀微生物活动,对微生物腐蚀机制不拘泥于先前的总结与决断,着力改进或开发新型精确的研究微生物腐蚀的技术,在整体掌握腐蚀微生物组的基础上,增强对微生物腐蚀的发生与抑制的了解,为微生物腐蚀的防控提供有效的数据及指导。
| [1] | Institute of Oceanology, Chinese Academy of Sciences. Chinas corrosion costs in 2014 were more than 2 trillion. (2016-06-05). http://www.qdio.cas.cn/xwzx/tpxw/201606/t20160605_4616224.html 中国科学院海洋研究所. 我国2014年腐蚀成本超过2万亿约占GDP 3. 34%. (2016-06-05). http://www.qdio.cas.cn/xwzx/tpxw/201606/t20160605_4616224.html |
| [2] | National Association of Corrosion Engineers. National Association of Corrosion Engineers international IMPACT study. (2017-04-13). http://impact.nace.org/executive-summary.aspx |
| [3] | Beijerinck MW. Ueber Spirillumde sulfuricans als Ursache von sulfatreduction[J]. Zentralbl Bakteriol, 1895(1) : 49–59. |
| [4] | von Wolzogen Kühr C, van der Vlugt L. De grafiteering van gietijzeralselectro biochemichproces in anaerobe Gronden[J]. Water, 1934, 18 : 147–165. |
| [5] | Sungur EI, Ozuolmez D, Çotuk A, et al. Isolation of a sulfide-producing bacterial consortium from cooling-tower water: evaluation of corrosive effects on galvanized steel[J]. Anaerobe, 2017, 43 : 27–34. DOI:10.1016/j.anaerobe.2016.11.005 |
| [6] | Kiran MG, Pakshirajan K, Das G. Heavy metal removal from multicomponent system by sulfate reducing bacteria: mechanism and cell surface characterization[J]. Journal of Hazardous Materials, 2017, 324 : 62–70. DOI:10.1016/j.jhazmat.2015.12.042 |
| [7] | Zhao JL, Xu DK, Shahzad MB, et al. Effect of surface passivation on corrosion resistance and antibacterial properties of Cu-bearing 316L stainless steel[J]. Applied Surface Science, 2016, 386 : 371–380. DOI:10.1016/j.apsusc.2016.06.036 |
| [8] | Kip N, van Veen JA. The dual role of microbes in corrosion[J]. The ISME Journal, 2015, 9(3) : 542–551. DOI:10.1038/ismej.2014.169 |
| [9] | Li DP, Zhang L, Yang JW, et al. Effect of H2S concentration on the corrosion behavior of pipeline steel under the coexistence of H2S and CO2[J]. International Journal of Minerals, Metallurgy, and Materials, 2014, 21(4) : 388–394. DOI:10.1007/s12613-014-0920-y |
| [10] | Venzlaff H, Enning D, Srinivasan J, et al. Accelerated cathodic reaction in microbial corrosion of iron due to direct electron uptake by sulfate-reducing bacteria[J]. Corrosion Science, 2013, 66 : 88–96. DOI:10.1016/j.corsci.2012.09.006 |
| [11] | Enning D, Garrelfs J. Corrosion of iron by sulfate-reducing bacteria: new views of an old problem[J]. Applied and Environmental Microbiology, 2014, 80(4) : 1226–1236. DOI:10.1128/AEM.02848-13 |
| [12] | Pokorna D, Zabranska J. Sulfur-oxidizing bacteria in environmental technology[J]. Biotechnology Advances, 2015, 33(6) : 1246–1259. DOI:10.1016/j.biotechadv.2015.02.007 |
| [13] | Etique M, Jorand FPA, Zegeye A, et al. Abiotic process for Fe(II) oxidation and green rust mineralization driven by a heterotrophic nitrate reducing bacteria (Klebsiella mobilis)[J]. Environmental Science & Technology, 2014, 48(7) : 3742–3751. |
| [14] | Emerson D, Fleming EJ, McBeth JM. Iron-oxidizing bacteria: an environmental and genomic perspective[J]. Annual Review of Microbiology, 2010, 64(1) : 561–583. DOI:10.1146/annurev.micro.112408.134208 |
| [15] | McBeth JM, Emerson D. In situ microbial community succession on mild steel in estuarine and marine environments: exploring the role of iron-oxidizing bacteria[J]. Frontiers in Microbiology, 2016, 7 : 767. |
| [16] | Machuca LL, Jeffrey R, Melchers RE. Microorganisms associated with corrosion of structural steel in diverse atmospheres[J]. International Biodeterioration & Biodegradation, 2016, 114 : 234–243. |
| [17] | Dai XY, Wang H, Ju LK, et al. Corrosion of aluminum alloy 2024 caused by Aspergillus niger[J]. International Biodeterioration & Biodegradation, 2016, 115 : 1–10. |
| [18] | Vigneron A, Alsop EB, Chambers B, et al. Complementary microorganisms in highly corrosive biofilms from an offshore oil production facility[J]. Applied and Environmental Microbiology, 2016, 82(8) : 2545–2554. DOI:10.1128/AEM.03842-15 |
| [19] | Brioukhanov AL, Netrusov AI. Aerotolerance of strictly anaerobic microorganisms and factors of defense against oxidative stress: a review[J]. Applied Biochemistry and Microbiology, 2007, 43(6) : 567–582. DOI:10.1134/S0003683807060014 |
| [20] | Smith WL, Gadd GM. Reduction and precipitation of chromate by mixed culture sulphate-reducing bacterial biofilms[J]. Journal of Applied Microbiology, 2000, 88(6) : 983–991. DOI:10.1046/j.1365-2672.2000.01066.x |
| [21] | Zhang ML, Wang HX, Han XM. Preparation of metal-resistant immobilized sulfate reducing bacteria beads for acid mine drainage treatment[J]. Chemosphere, 2016, 154 : 215–223. DOI:10.1016/j.chemosphere.2016.03.103 |
| [22] | Sungur EI, Cotuk A. Characterization of sulfate reducing bacteria isolated from cooling towers[J]. Environmental Monitoring and Assessment, 2005, 104(1/3) : 211–219. |
| [23] | Yuan SJ, Liang B, Zhao Y, et al. Surface chemistry and corrosion behaviour of 304 stainless steel in simulated seawater containing inorganic sulphide and sulphate-reducing bacteria[J]. Corrosion Science, 2013, 74 : 353–366. DOI:10.1016/j.corsci.2013.04.058 |
| [24] | Liu F, Zhang J, Zhang S, et al. Effect of sulphate reducing bacteria on corrosion of Al-Zn-In-Sn sacrificial anodes in marine sediment[J]. Materials and Corrosion, 2012, 63(5) : 431–437. DOI:10.1002/maco.v63.5 |
| [25] | Zhang B, Wu YF, Song JL, et al. Alicyclobacillus fodiniaquatilis sp. nov., isolated from acid mine water[J]. International Journal of Systematic and Evolutionary Microbiology, 2015, 65(12) : 4915–4920. DOI:10.1099/ijsem.0.000695 |
| [26] | Guo X, You XY, Liu LJ, et al. Alicyclobacillus aeris sp. nov., a novel ferrous and sulfur-oxidizing bacterium isolated from a copper mine[J]. International Journal of Systematic and Evolutionary Microbiology, 2009, 59(10) : 2415–2420. DOI:10.1099/ijs.0.008870-0 |
| [27] | Jiang CY, Liu Y, Liu YY, et al. Alicyclobacillus ferrooxydans sp. nov., a ferrous-oxidizing bacterium from solfataric soil[J]. International Journal of Systematic and Evolutionary Microbiology, 2008, 58(12) : 2898–2903. DOI:10.1099/ijs.0.2008/000562-0 |
| [28] | Liu YY, Chen ZW, Jiang CY, et al. Isolation and characterization of Acidiphilium strain Teng-A and its metabolism of Fe(Ⅲ) during pure-and mixed cultivation[J]. Acta Microbiologica Sinica, 2007, 47(2) : 350–354. (in Chinese) 刘艳阳, 陈志伟, 姜成英, 等. 一株嗜酸化能异养菌Acidiphilium sp.的分离鉴定及其对Fe(Ⅲ)代谢的研究[J]. 微生物学报, 2007, 47(2) : 350–354. |
| [29] | Bielefeldt A, Gutierrez-Padilla MGD, Ovtchinnikov S, et al. Bacterial kinetics of sulfur oxidizing bacteria and their biodeterioration rates of concrete sewer pipe samples[J]. Journal of Environmental Engineering, 2009, 136(7) : 731–738. |
| [30] | Okabe S, Odagiri M, Ito T, et al. Succession of sulfur-oxidizing bacteria in the microbial community on corroding concrete in sewer systems[J]. Applied and Environmental Microbiology, 2007, 73(3) : 971–980. DOI:10.1128/AEM.02054-06 |
| [31] | Voordouw G. Impact of nitrate on the sulfur cycle in oil fields[A]//Dahl C, Friedrich CG. Microbial Sulfur Metabolism[M]. Berlin, Heidelberg: Springer, 2008: 296-302 |
| [32] | Xu DK, Li YC, Song FM, et al. Laboratory investigation of microbiologically influenced corrosion of C1018 carbon steel by nitrate reducing bacterium Bacillus licheniformis[J]. Corrosion Science, 2013, 77 : 385–390. DOI:10.1016/j.corsci.2013.07.044 |
| [33] | Mustin C, Berthelin J, Marion P, et al. Corrosion and electrochemical oxidation of a pyrite by Thiobacillus ferrooxidans[J]. Applied and Environmental Microbiology, 1992, 58(4) : 1175–1182. |
| [34] | Konhauser KO, Kappler A, Roden EE. Iron in microbial metabolisms[J]. Elements, 2011, 7(2) : 89–93. DOI:10.2113/gselements.7.2.89 |
| [35] | Nguyen VK, Lee MH, Park HJ, et al. Bioleaching of arsenic and heavy metals from mine tailings by pure and mixed cultures of Acidithiobacillus spp[J]. Journal of Industrial and Engineering Chemistry, 2015, 21 : 451–458. DOI:10.1016/j.jiec.2014.03.004 |
| [36] | Chen S, Qiu GZ, Qin WQ, et al. Bioleaching of sphalerite by Acidithiobacillus ferrooxidans and Acidithiobacillus thiooxidans cultured in 9K medium modified with pyrrhotite[J]. Journal of Central South University of Technology, 2008, 15(4) : 503–507. DOI:10.1007/s11771-008-0095-7 |
| [37] | Li SM, Zhang YY, Liu JH, et al. Corrosion behavior of steel A3 influenced by Thiobacillus ferrooxidans[J]. Acta Physico-Chimica Sinica, 2008, 24(9) : 1553–1557. DOI:10.1016/S1872-1508(08)60063-7 |
| [38] | Wang H, Ju LK, Castaneda H, et al. Corrosion of carbon steel C1010 in the presence of iron-oxidizing bacteria Acidithiobacillus ferrooxidans[J]. Corrosion Science, 2014, 89 : 250–257. DOI:10.1016/j.corsci.2014.09.005 |
| [39] | Weber KA, Achenbach LA, Coates JD. Microorganisms pumping iron: anaerobic microbial iron oxidation and reduction[J]. Nature Review Microbiology, 2006, 4(10) : 752–764. DOI:10.1038/nrmicro1490 |
| [40] | Baker BJ, Banfield JF. Microbial communities in acid mine drainage[J]. FEMS Microbiology Ecology, 2003, 44(2) : 139–152. DOI:10.1016/S0168-6496(03)00028-X |
| [41] | Chan CS, Fakra SC, Emerson D, et al. Lithotrophic iron-oxidizing bacteria produce organic stalks to control mineral growth: implications for biosignature formation[J]. The ISME Journal, 2011, 5(4) : 717–727. DOI:10.1038/ismej.2010.173 |
| [42] | Starosvetsky D, Armon R, Yahalom J, et al. Pitting corrosion of carbon steel caused by iron bacteria[J]. International Biodeterioration & Biodegradation, 2001, 47(2) : 79–87. |
| [43] | Starosvetsky J, Starosvetsky D, Pokroy B, et al. Electrochemical behaviour of stainless steels in media containing iron-oxidizing bacteria (IOB) by corrosion process modeling[J]. Corrosion Science, 2008, 50(2) : 540–547. DOI:10.1016/j.corsci.2007.07.008 |
| [44] | Ray RI, Lee JS, Little BJ. Iron-oxidizing bacteria: a review of corrosion mechanisms in fresh water and marine environments[C]. Proceedings of the 2010 National Association of Corrosion Engineers International Corrosion Conference. San Antonio, Texas: NACE International, 2010 |
| [45] | Maeda T, Negishi A, Komoto H, et al. Isolation of iron-oxidizing bacteria from corroded concretes of sewage treatment plants[J]. Journal of Bioscience and Bioengineering, 1999, 88(3) : 300–305. DOI:10.1016/S1389-1723(00)80013-4 |
| [46] | Sung EH, Han JS, Ahn CM, et al. Biological metal corrosion in saline systems by sulfur-reducing and iron-oxidizing bacteria[J]. Water Quality Research Journal of Canada, 2011, 46(4) : 321–331. DOI:10.2166/wqrjc.2011.009 |
| [47] | Li D, Li Z, Yu JW, et al. Characterization of bacterial community structure in a drinking water distribution system during an occurrence of red water[J]. Applied and Environmental Microbiology, 2010, 76(21) : 7171–7180. DOI:10.1128/AEM.00832-10 |
| [48] | Peng TJ, Zhong SP, Chen CR, et al. Isolation and identification of Sulfobacillus sp. strains and their application in pyrite bioleaching[J]. Acta Microbiologica Sinica, 2013, 53(12) : 1318–1325. (in Chinese) 彭堂见, 衷水平, 陈超然, 等. 嗜酸硫化杆菌(Sulfobacillus sp.)的分离鉴定及其在黄铁矿浸取中的应用[J]. 微生物学报, 2013, 53(12) : 1318–1325. |
| [49] | Liu LJ, You XY, Guo X, et al. Metallosphaera cuprina sp. nov., an acidothermophilic, metal-mobilizing archaeon[J]. International Journal of Systematic and Evolutionary Microbiology, 2011, 61(10) : 2395–2400. DOI:10.1099/ijs.0.026591-0 |
| [50] | Peng TJ, Liu LJ, Liu C, et al. Metallosphaera tengchongensis sp. nov., an acidothermophilic archaeon isolated from a hot spring[J]. International Journal of Systematic and Evolutionary Microbiology, 2015, 65(2) : 537–542. |
| [51] | Gu T, Galicia B. Can acid producing bacteria be responsible for very fast MIC pitting?[C]. Proceedings of the 2012 National Association of Corrosion Engineers International Corrosion Conference. Salt Lake City, Utah: NACE International, 2012 |
| [52] | Diercks M, Sand W, Bock E. Microbial corrosion of concrete[J]. Experientia, 1991, 47(6) : 514–516. DOI:10.1007/BF01949869 |
| [53] | Sowards JW, Mansfield E. Corrosion of copper and steel alloys in a simulated underground storage-tank sump environment containing acid-producing bacteria[J]. Corrosion Science, 2014, 87 : 460–471. DOI:10.1016/j.corsci.2014.07.009 |
| [54] | Heyer A, D'souza F, Zhang X, et al. Biodegradation of ballast tank coating investigated by impedance spectroscopy and microscopy[J]. Biodegradation, 2014, 25(1) : 67–83. DOI:10.1007/s10532-013-9641-6 |
| [55] | Beech IB, Sunner JA, Hiraoka K. Microbe-surface interactions in biofouling and biocorrosion processes[J]. International Microbiology, 2005, 8(3) : 157–168. |
| [56] | Palmer J, Flint S, Brooks J. Bacterial cell attachment, the beginning of a biofilm[J]. Journal of Industrial Microbiology & Biotechnology, 2007, 34(9) : 577–588. |
| [57] | Morales J, Esparza P, González S, et al. The role of Pseudomonas aeruginosa on the localized corrosion of 304 stainless steel[J]. Corrosion Science, 1993, 34(9) : 1531–1540. DOI:10.1016/0010-938X(93)90246-D |
| [58] | Li HB, Zhou EZ, Zhang DW, et al. Microbiologically influenced corrosion of 2707 hyper-duplex stainless steel by marine Pseudomonas aeruginosa biofilm[J]. Scientific Reports, 2016, 6 : 20190. DOI:10.1038/srep20190 |
| [59] | Abdolahi A, Hamzah E, Ibrahim Z, et al. Microbially influenced corrosion of steels by Pseudomonas aeruginosa[J]. Corrosion Reviews, 2016, 32(3/4) : 129–141. |
| [60] | Hedrich S, Schlömann M, Johnson DB. The iron-oxidizing proteobacteria[J]. Microbiology, 2011, 157(6) : 1551–1564. DOI:10.1099/mic.0.045344-0 |
| [61] | Mehanna M, Basséguy R, Délia ML, et al. Effect of Geobacter sulfurreducens on the microbial corrosion of mild steel, ferritic and austenitic stainless steels[J]. Corrosion Science, 2009, 51(11) : 2596–2604. DOI:10.1016/j.corsci.2009.06.041 |
| [62] | Luef B, Fakra SC, Csencsits R, et al. Iron-reducing bacteria accumulate ferric oxyhydroxide nanoparticle aggregates that may support planktonic growth[J]. The ISME Journal, 2013, 7(2) : 338–350. DOI:10.1038/ismej.2012.103 |
| [63] | Strycharz SM, Glaven RH, Coppi MV, et al. Gene expression and deletion analysis of mechanisms for electron transfer from electrodes to Geobacter sulfurreducens[J]. Bioelectrochemistry, 2011, 80(2) : 142–150. DOI:10.1016/j.bioelechem.2010.07.005 |
| [64] | Snider RM, Strycharz-Glaven SM, Tsoi SD, et al. Long-range electron transport in Geobacter sulfurreducens biofilms is redox gradient-driven[J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(38) : 15467–15472. DOI:10.1073/pnas.1209829109 |
| [65] | Pirbadian S, Barchinger SE, Leung KM, et al. Shewanella oneidensis MR-1 nanowires are outer membrane and periplasmic extensions of the extracellular electron transport components[J]. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(35) : 12883–12888. DOI:10.1073/pnas.1410551111 |
| [66] | Lovley DR. Happy together: microbial communities that hook up to swap electrons[J]. The ISME Journal, 2017, 11(2) : 327–336. DOI:10.1038/ismej.2016.136 |
| [67] | Schütz MK, Libert M, Schlegel ML, et al. Dissimilatory iron reduction in the presence of hydrogen: a case study of microbial activity and nuclear waste disposal[A]//Hellmann R, Pitsch H. Procedia Earth and Planetary Science[M]. Amsterdam: Elsevier, 2013: 409-412 |
| [68] | Valencia-Cantero E, Peña-Cabriales JJ. Effects of iron-reducing bacteria on carbon steel corrosion induced by thermophilic sulfate-reducing consortia[J]. Journal of Microbiology and Biotechnology, 2014, 24(2) : 280–286. DOI:10.4014/jmb.1310.10002 |
| [69] | Schütz MK, Schlegel ML, Libert M, et al. Impact of iron-reducing bacteria on the corrosion rate of carbon steel under simulated geological disposal conditions[J]. Environmental Science & Technology, 2015, 49(12) : 7483–7490. |
| [70] | Potekhina JS, Sherisheva NG, Povetkina LP, et al. Role of microorganisms in corrosion inhibition of metals in aquatic habitats[J]. Applied Microbiology and Biotechnology, 1999, 52(5) : 639–646. DOI:10.1007/s002530051571 |
| [71] | Dubiel M, Hsu CH, Chien CC, et al. Microbial iron respiration can protect steel from corrosion[J]. Applied and Environmental Microbiology, 2002, 68(3) : 1440–1445. DOI:10.1128/AEM.68.3.1440-1445.2002 |
| [72] | Du XQ, Duan JZ, Zhai XF, et al. Corrosion behavior of 316L stainless steel influenced by iron-reducing bacteria shewanella algae biofilms[J]. Journal of Chinese Society for Corrosion and Protection, 2013, 33(5) : 363–370. (in Chinese) 杜向前, 段继周, 翟晓凡, 等. 铁还原细菌Shewanella algae生物膜对316L不锈钢腐蚀行为的影响[J]. 中国腐蚀与防护学报, 2013, 33(5) : 363–370. |
| [73] | Zhu XY, Lubeck J, Kilbane JJ. Characterization of microbial communities in gas industry pipelines[J]. Applied and Environmental Microbiology, 2003, 69(9) : 5354–5363. DOI:10.1128/AEM.69.9.5354-5363.2003 |
| [74] | Zhang T, Fang HHP, Ko BCB. Methanogen population in a marine biofilm corrosive to mild steel[J]. Applied Microbiology and Biotechnology, 2003, 63(1) : 101–106. DOI:10.1007/s00253-003-1396-2 |
| [75] | Usher KM, Kaksonen AH, MacLeod ID. Marine rust tubercles harbour iron corroding archaea and sulphate reducing bacteria[J]. Corrosion Science, 2014, 83 : 189–197. DOI:10.1016/j.corsci.2014.02.014 |
| [76] | Mori K, Tsurumaru H, Harayama S. Iron corrosion activity of anaerobic hydrogen-consuming microorganisms isolated from oil facilities[J]. Journal of Bioscience and Bioengineering, 2010, 110(4) : 426–430. DOI:10.1016/j.jbiosc.2010.04.012 |
| [77] | Uchiyama T, Ito K, Mori K, et al. Iron-corroding methanogen isolated from a crude-oil storage tank[J]. Applied and Environmental Microbiology, 2010, 76(6) : 1783–1788. DOI:10.1128/AEM.00668-09 |
| [78] | Qu Q, Wang L, Li L, et al. Effect of the fungus, Aspergillus niger, on the corrosion behaviour of AZ31B magnesium alloy in artificial seawater[J]. Corrosion Science, 2015, 98 : 249–259. DOI:10.1016/j.corsci.2015.05.038 |
| [79] | Usher KM, Kaksonen AH, Cole I, et al. Critical review: microbially influenced corrosion of buried carbon steel pipes[J]. International Biodeterioration & Biodegradation, 2014, 93 : 84–106. |
| [80] | Beech IB, Gaylarde CC. Recent advances in the study of biocorrosion-an overview[J]. Revista De Microbiologia, 1999, 30(3) : 117–190. DOI:10.1590/S0001-37141999000300001 |
| [81] | von Wolzogen Kuehr CAH, van der Vlugt LS. The graphitization of cast iron as an electrobiochemical process in anaerobic soil[J]. Water, 1964 : AD0617552. |
| [82] | Keresztes Z, Felhősi I, Kálmán E. Role of redox properties of biofilms in corrosion processes[J]. Electrochimica Acta, 2001, 46(24/25) : 3841–3849. |
| [83] | Da Silva S, Basséguy R, Bergel A. Electron transfer between hydrogenase and 316L stainless steel: identification of a hydrogenase-catalyzed cathodic reaction in anaerobic mic[J]. Journal of Electroanalytical Chemistry, 2004, 561 : 93–102. DOI:10.1016/j.jelechem.2003.07.005 |
| [84] | Xu DK, Li YC, Gu TY. Mechanistic modeling of biocorrosion caused by biofilms of sulfate reducing bacteria and acid producing bacteria[J]. Bioelectrochemistry, 2016, 110 : 52–58. DOI:10.1016/j.bioelechem.2016.03.003 |
| [85] | Spruit CJP, Wanklyn JN. Iron/sulphide ratios in corrosion by sulphate-reducing bacteria[J]. Nature, 1951, 168(4283) : 951–952. DOI:10.1038/168951a0 |
| [86] | Dall'agnol LT, Cordas CM, Moura JJG. Influence of respiratory substrate in carbon steel corrosion by a sulphate reducing prokaryote model organism[J]. Bioelectrochemistry, 2014, 97 : 43–51. DOI:10.1016/j.bioelechem.2013.10.006 |
| [87] | Raman RKS, Javaherdashti R, Panter C, et al. Hydrogen embrittlement of a low carbon steel during slow strain testing in chloride solutions containing sulphate reducing bacteria[J]. Materials Science and Technology, 2005, 21(9) : 1094–1098. DOI:10.1179/174328405X51811 |
| [88] | Biezma MV. The role of hydrogen in microbiologically influenced corrosion and stress corrosion cracking[J]. International Journal of Hydrogen Energy, 2001, 26(5) : 515–520. DOI:10.1016/S0360-3199(00)00091-4 |
| [89] | Liu T, Liu H, Hu Y, et al. Growth characteristics of thermophile sulfate-reducing bacteria and its effect on carbon steel[J]. Materials and Corrosion, 2009, 60(3) : 218–224. DOI:10.1002/maco.v60:3 |
| [90] | King RA, Miller JDA. Corrosion by the sulphate-reducing Bacteria[J]. Nature, 1971, 233(5320) : 491–492. DOI:10.1038/233491a0 |
| [91] | Gu TY. New understandings of biocorrosion mechanisms and their classifications[J]. Journal of Microbial & Biochemical Technology, 2012, 4(4) : 3–6. |
| [92] | Dinh HT, Kuever J, Muẞmann M, et al. Iron corrosion by novel anaerobic microorganisms[J]. Nature, 2004, 427(6977) : 829–832. DOI:10.1038/nature02321 |
| [93] | Enning D, Venzlaff H, Garrelfs J, et al. Marine sulfate-reducing bacteria cause serious corrosion of iron under electroconductive biogenic mineral crust[J]. Environmental Microbiology, 2012, 14(7) : 1772–1787. DOI:10.1111/j.1462-2920.2012.02778.x |
| [94] | Bonanni PS, Schrott GD, Busalmen JP. A long way to the electrode: how do Geobacter cells transport their electrons?[J]. Biochemical Society Transactions, 2012, 40(6) : 1274–1279. DOI:10.1042/BST20120046 |
| [95] | Reguera G, Mccarthy KD, Mehta T, et al. Extracellular electron transfer via microbial nanowires[J]. Nature, 2005, 435(7045) : 1098–1101. DOI:10.1038/nature03661 |
| [96] | Hernandez ME, Kappler A, Newman DK. Phenazines and other redox-active antibiotics promote microbial mineral reduction[J]. Applied and Environmental Microbiology, 2004, 70(2) : 921–928. DOI:10.1128/AEM.70.2.921-928.2004 |
| [97] | Zhang PY, Xu DK, Li YC, et al. Electron mediators accelerate the microbiologically influenced corrosion of 304 stainless steel by the Desulfovibrio vulgaris biofilm[J]. Bioelectrochemistry, 2015, 101 : 14–21. DOI:10.1016/j.bioelechem.2014.06.010 |
| [98] | Yang F, Shi BY, Bai YH, et al. Effect of sulfate on the transformation of corrosion scale composition and bacterial community in cast iron water distribution pipes[J]. Water Research, 2014, 59 : 46–57. DOI:10.1016/j.watres.2014.04.003 |
| [99] | Valencia-Cantero E, Peña-Cabriales JJ, Martínez-Romero E. The corrosion effects of sulfate and ferric-reducing bacterial consortia on steel[J]. Geomicrobiology Journal, 2003, 20(2) : 157–169. DOI:10.1080/01490450303885 |
| [100] | Wang HB, Hu C, Hu XX, et al. Effects of disinfectant and biofilm on the corrosion of cast iron pipes in a reclaimed water distribution system[J]. Water Research, 2012, 46(4) : 1070–1078. DOI:10.1016/j.watres.2011.12.001 |
| [101] | Zong Y, Xie F, Wu M, et al. Research progress in influencing factors of corrosion by sulfate-reducing bacteria and corresponding antisepsis techniques[J]. Surface Technology, 2016, 45(3) : 24–30, 95. (in Chinese) 宗月, 谢飞, 吴明, 等. 硫酸盐还原菌腐蚀影响因素及防腐技术的研究进展[J]. 表面技术, 2016, 45(3) : 24–30, 95. |
| [102] | Xu P, Zhai YJ, Wang J, et al. Understanding biofilm in a new prespective — research progress on microbial anti-corrosion[J]. Corrosion Science and Protection Technology, 2016, 28(4) : 356–360. (in Chinese) 许萍, 翟羽佳, 王婧, 等. 从新的视角理解生物膜——微生物防腐蚀研究进展[J]. 腐蚀科学与防护技术, 2016, 28(4) : 356–360. DOI:10.11903/1002.6495.2015.293 |
| [103] | Kato S, Hashimoto K, Watanabe K. Microbial interspecies electron transfer via electric currents through conductive minerals[J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(25) : 10042–10046. DOI:10.1073/pnas.1117592109 |
| [104] | Stams AJM, de Bok FAM, Plugge CM, et al. Exocellular electron transfer in anaerobic microbial communities[J]. Environmental Microbiology, 2006, 8(3) : 371–382. DOI:10.1111/emi.2006.8.issue-3 |
| [105] | Dong ZH, Liu T, Liu HF. Influence of EPS isolated from thermophilic sulphate-reducing bacteria on carbon steel corrosion[J]. Biofouling, 2011, 27(5) : 487–495. DOI:10.1080/08927014.2011.584369 |
| [106] | Jin JT, Wu GX, Zhang ZH, et al. Effect of extracellular polymeric substances on corrosion of cast iron in the reclaimed wastewater[J]. Bioresource Technology, 2014, 165 : 162–165. DOI:10.1016/j.biortech.2014.01.117 |
| [107] | Li K, Whitfield K, van Vliet KJ, et al. Beating the bugs: roles of microbial biofilms in corrosion[J]. Corrosion Reviews, 2014, 31(3/6) : 73–84. |
| [108] | O'toole G, Kaplan HB, Kolter R. Biofilm formation as microbial development[J]. Annual Review of Microbiology, 2000, 54(1) : 49–79. DOI:10.1146/annurev.micro.54.1.49 |
| [109] | Videla HA, Herrera LK. Microbiologically influenced corrosion: looking to the future[J]. International Microbiology, 2005, 8(3) : 169–180. |
 2017, Vol. 44
2017, Vol. 44





