扩展功能
文章信息
- 牛永艳, 陈正军, 赵帅, 李祥锴
- Niu Yong-yan, Chen Zheng-jun, Zhao Shuai, Li Xiang-kai
- 铬还原菌的分离筛选及其在微生物燃料电池生物阴极中的应用
- Isolation of chromium reducing bacteria for application in biological cathode of microbial fuel cell
- 微生物学通报, 2017, 44(7): 1631-1638
- Microbiology China, 2017, 44(7): 1631-1638
- DOI: 10.13344/j.microbiol.china.170104
-
文章历史
- 收稿日期: 2017-02-10
- 接受日期: 2017-05-25
- 优先数字出版日期(www.cnki.net): 2017-06-05
铬(Cr)在电镀、制革、染料生产及木材防腐等工业生产中被广泛使用。由于铬在水体中不能被自然降解,只能发生各种形态的转化,因此会对环境造成持续污染。在自然界中,重金属铬主要以Cr(Ⅵ)或Cr(Ⅲ)的形式存在[1]。Cr(Ⅵ)极易溶于水,具有高毒性、致癌性和致突变性,同时铬的积累还会增加患肺癌的风险[2]。Cr(Ⅲ)则会形成稳定的氧化物或氢氧化物沉淀,不易溶于水,毒性小,在污染物中占的比例也小[3],因此,通常将Cr(Ⅵ)转化成Cr(Ⅲ)来减轻Cr(Ⅵ)的危害。传统的化学修复技术成本较高,效果也不明显,还容易破坏生态环境,造成二次污染。因此,低成本、高效率的微生物修复技术倍受世界各国科学工作者的关注。许多文献报道微生物可以将Cr(Ⅵ)还原成Cr(Ⅲ)[4],因此分离筛选具有Cr(Ⅵ)还原能力的功能菌株是生物处理铬污染首先要解决的问题。
微生物燃料电池(MFC)是一种新型的,利用产电微生物作为催化剂,能够同时从底物获得电能并且对污染物进行生物修复的技术[5-6]。一般的双室MFC由阳极室、阴极室和质子交换膜(PEM)组成。在厌氧的阳极室中产电微生物氧化底物释放电子并将电子传递到阳极电极,然后电子通过闭合电路被阴极电子受体接受,从而产生电流[7]。研究表明,在污水处理方面MFC因为高效性和产能被认为是最有前途的应用。过去用MFC处理废水时,废水是在阳极室作为电子供体,而阴极还未受到关注[8]。通常在阴极使用氧气[9]、铁氰化钾[8]或者锰酸盐[10]作电子受体发生还原反应,这也称为化学阴极。生物阴极MFCs是指阴极室中也有功能微生物,它们能够附着在电极表面形成生物膜,电子由电极传递给微生物并发生相应的生物电化学反应[11]。如二氧化锰(MnO2)作为电子受体被还原成Mn(Ⅱ)后,锰氧化细菌(MOB)将Mn(Ⅱ)的两个电子传递给氧,并实现MnO2的再生[12]。López-López等研究表明铁氧化硫杆菌是将Fe(Ⅱ)氧化成Fe(Ⅲ)的主要铁氧化细菌,阴极室Thiobacillus ferrooxidans氧化Fe(Ⅱ),实现Fe(Ⅲ)的再生,证实了铁化合物参与生物阴极反应的可行性[13]。生物阴极克服了化学药剂再生困难、需要铂等贵金属催化及成本高等缺陷[14],还利用微生物参与阴极反应将有机物去除和生物修复联系在一起[15]。
兰州市西固区位于黄河兰州段上游,是我国西北主要的工业基地之一,该区常年受各种重金属和有机物的污染[16-18],当地微生物群落有很强的重金属和有机物抗性[5, 19]。本研究希望通过筛选Cr(Ⅵ)还原优势菌株,并将其应用在微生物燃料电池中,在产能的同时加速阴极液中Cr(Ⅵ)的还原,为含Cr(Ⅵ)工业废水处理提供一种高效节能的方法。
1 材料与方法 1.1 材料 1.1.1 样品收集:采样点位于黄河兰州段西固工业园区的一条排污渠(N36°8′,E103°38′)。沿着排污口分别设定了上游、中游和下游3个采样点,按15 cm和30 cm的深度分别取3份土样。采样时分别记录采样点的温度和pH,样品采集后立即装入封口袋,运抵实验室后于-20 ℃保存备用。
1.1.2 主要试剂和仪器:磷酸氢二钾、磷酸二氢钾购自天津市致远化学试剂有限公司;葡萄糖、氯化铵、氨基三乙酸、硫酸锰、氯化钠、硫酸亚铁、氯化钴、氯化钙、硫酸锌、硫酸铜、硫酸铝钾、硼酸和钼酸钠购自天津市巴斯夫化工有限公司;重铬酸钾购自天津市大茂化学试剂厂;硫酸镁购自烟台双双化工有限公司;酵母提取物和胰蛋白胨购自英国OXOID公司。ExTaq、细菌DNA提取试剂盒(MiniBEST Bacterial Genomic DNA Extraction Kit 3.0) 购自日本TaKaRa公司,质子膜购自美国DuPont公司。
恒温培养振荡器,上海智城公司;洁净工作台,苏州苏洁净化设备有限公司;V-5100可见光分光光度计,上海元析仪器有限公司;PCR仪,日本TaKaRa公司;DYY-60型电泳仪电源,北京市六一仪器厂;LDZX型立式压力蒸汽灭菌器,上海申安医疗器械厂;3K15离心机,德国Sigma公司;控温磁力搅拌器,金坛市迅生仪器厂;JPB-607A便携式溶解氧测定仪,上海仪电科学仪器股份有限公司。
1.2 铬还原菌株的分离筛选及鉴定 1.2.1 分离筛选方法:将18份土壤样品按等质量混匀后称取1 g加入9 mL无菌蒸馏水,制成10-1的土壤悬液。吸取0.1 mL土壤悬液涂布于制备好的含有不同浓度Cr(Ⅵ)的SC固体平板[20]上,28 ℃倒置培养1-2周,待分离平板上的菌落长好后,挑取单菌落用划线法在SC固体平板上进行纯化。纯化后的菌株保藏在25%的甘油中,-80 ℃保藏。为了筛选具有Cr(Ⅵ)还原能力的菌株,将21株Cr(Ⅵ)抗性菌株分别在不含Cr(Ⅵ)的SC液体培养基中培养48 h后按照10% (体积比)的接种量接种在含有0.4 mmol/L Cr(Ⅵ)的SC液体培养基中,通过测定菌生长来确定菌株在液体培养基中对Cr(Ⅵ)的抗性,再通过测定培养基中剩余的Cr(Ⅵ)含量来确定对Cr(Ⅵ)还原能力最强的菌株。
1.2.2 菌株的初步鉴定和系统进化分析:提取21株菌基因组DNA,用PCR扩增16S rRNA基因[20]并测序。将测序结果通过Blast程序提交到GenBank数据库中进行相似性比对搜索,下载相关属、种近缘菌株的16S rRNA基因序列,用MEGA 5.0软件中的Clustal程序进行多序列比对,确定菌种所在的种属。
1.2.3 Cr(Ⅵ)测定方法:采用1, 5-Diphenylcarbazide (DPC)显色法来测定Cr(Ⅵ)含量[20]。
1.3 MFC运行实验采用双室微生物燃料电池装置[8],使用的电池隔膜材料为质子交换膜。在使用前,依次用3% H2O2、0.5 mol/l H2SO4和去离子水分别煮30 min,最后在灭菌的去离子水中保存备用。MFC的阳极液为含有1%葡萄糖的MS培养基[8]。为了增加溶液的导电性,1 L MS培养基加入12.5 mL微量矿物盐[8]。微量矿物盐(g/L):氨基三乙酸1.50,MgSO4·7H2O 3.00,MnSO4·2H2O 0.50,NaCl 1.00,FeSO4·7H2O 0.10,CoCl2.6H2O 0.10,CaCl·2H2O 0.10,ZnSO4 0.10,CuSO4·5H2O 0.01,KAl(SO4)2 0.01,H3BO3 0.01,Na2MoO4·2H2O 0.01。碳毡电极的几何表面积为16 cm2,使用前在1 mol/L HCl和1 mol/L NaOH中浸泡以清除可能的金属和杂质,然后用蒸馏水冲洗直到pH为7.0[21]。LZU-26菌株按1:100接种在LB培养基[8]中37 ℃、180 r/min过夜培养,5 000 r/min离心5 min收集,并用MS培养基洗涤3次,最后用MS培养基悬浮调节OD600为1.2作为MFC接种物备用。生物阴极电池组中阳极和阴极都按10% (体积比)的比例接种LZU-26,即225 mL MS培养基中加入25 mL菌液。除了实验组,还设置了3个控制对照组。对照1:评估可能通过PEM由阴极迁移或扩散进入阳极室的任何Cr(Ⅵ),此对照组为阳极室填充MS培养基,阴极填充含有0.5 mmol/L Cr(Ⅵ)的MS培养基的MFC,连续搅拌并监测两个室中Cr(Ⅵ)的浓度一周。对照2:与实验组MFC相同的设置,但用非生物阴极室(无生物量)以研究任何非生物减少的Cr(Ⅵ)。对照3:开路状态下的生物阴极,主要说明细菌对Cr(Ⅵ)还原的贡献。所有电池阳极电极和阴极电极由铜芯导线连接,接入1 kΩ的外电阻。微生物燃料电池放置在定制的控温磁力搅拌器上,转速为180 r/min,温度控制在30 ℃,所有接口边缘全部用硅橡胶密封,并检测实验组阴极溶解氧。在阳极室和阴极室插入Ag/AgCl参比电极(3 mol/L KCl),检测MFC阳极和阴极电势。MFC组装好后由接入计算机的8通道电压采集卡记录MFC电压,记录间隔设置为1 min。根据欧姆定律I=V/R进行电化学分析[22],这里I表示电流,V表示电压,R表示电阻。
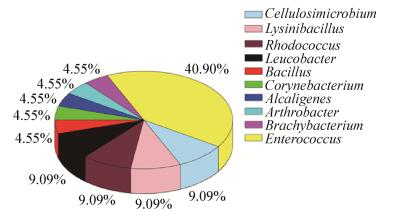
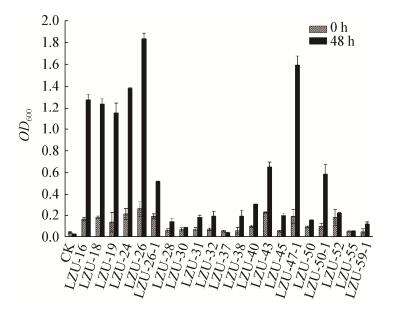
2 结果与讨论 2.1 Cr(Ⅵ)还原菌株的分离筛选共分离到21株Cr(Ⅵ)还原菌株,测序结果表明这些菌株主要属于肠球菌属(Enterococcus)、乳杆菌属(Lysinibacillus)、红球菌属(Rhodococcus)、纤维微菌属(Cellulosimicrobium)、白色杆菌属(Leucobacter)、芽孢杆菌属(Bacillus)、棒状杆菌属(Corynebacterium)、产碱杆菌属(Alcaligenes)、节细菌属(Arthrobacter)、短状杆菌属(Brachybacterium)。其中肠球菌属占40.91%,是该地区的优势菌群(图 1)。从图 2可以看出,21株Cr(Ⅵ)抗性菌中有14株可以在含有0.4 mmol/L Cr(Ⅵ)的SC液体培养基中很好地生长,其中LZU-26和LZU-47-1长势较好。如图 3所示,LZU-16、LZU-26、LZU-43、LZU-47这4株菌的Cr(Ⅵ)还原能力较强,其中菌株LZU-26生长最好,对Cr(Ⅵ)的还原力也最强。LZU-26菌株与Cellulosimicrobium cellilans (KT262970) 的16S rRNA基因序列相似性为99.6%,推测LZU-26可能属于纤维化纤维菌,其在初始Cr(Ⅵ)浓度为0.4 mmol/L的胁迫下48 h时OD600约为1.8,铬还原率达到99.97%,因此将其应用在微生物燃料电池生物阴极。
|
| 图 1 21株Cr(Ⅵ)抗性菌株的种属分布图 Figure 1 Distribution of 21 species of Cr(Ⅵ) resistant strains |
|
|
|
| 图 2 21株Cr(Ⅵ)还原菌株的生长情况 Figure 2 Cell growth of 21 isolates for Cr(Ⅵ) reduction 注:CK:空白对照;条件:30 ℃,180 r/min,0.4 mmol/L Cr(Ⅵ);实验重复3次分别计算平均值和标准差. Note: CK was uninoculated control; Conditions: 30 ℃, 180 r/min and 0.4 mmol/L Cr(Ⅵ); Experiments were replicated three times and standard deviations were presented. |
|
|

|
| 图 3 21株Cr(Ⅵ)还原菌株的Cr(Ⅵ)还原率 Figure 3 Cr(Ⅵ) reduction rates of 21 isolates 注:CK;空白对照;条件:30 ℃,180 r/min,0.4 mmol/L Cr(Ⅵ);实验重复3次分别计算平均值和标准差. Note: CK was uninoculated control; Conditions: 30 ℃, 180 rpm/min and 0.4 mmol/L Cr(Ⅵ); Experiments were replicated three times and standard deviations were presented. |
|
|
LZU-26在分类地位上属于放线菌门(Actinobacteria)普通单孢菌科(Promicromonosporaceae)纤维菌属(Cellulosimicrobium)。1977年第一个具有Cr(Ⅵ)还原能力的假单胞菌被分离得到[23],随后的研究中,不断有铬还原菌被分离纯化,如节细菌属(Arthrobacter)[24]、红球菌属(Rhodococcus)[25]等。细菌的Cr(Ⅵ)还原途径分为直接还原和间接还原。Cr(Ⅵ)直接还原是指细菌通过酶的催化作用和功能蛋白的电子传递作用等将Cr(Ⅵ)直接还原成Cr(Ⅲ)[26]。以研究较多并具有代表性的YieF为例,在有氧气存在的情况下YieF催化Cr(Ⅵ)直接还原成Cr(Ⅲ),这个过程涉及4个电子的传递,其中3个在Cr(Ⅵ)还原中被消耗,另外1个传递给了氧,属于好氧直接还原[27]。厌氧直接还原是指在无氧环境中电子通过呼吸链传递过程中,部分电子被Cr(Ⅵ)获得从而被还原,从而降低Cr(Ⅵ)毒性[26]。厌氧条件下,Shewanella oneidensis MR-1利用细胞膜C型细胞色素,使内膜电子穿过周质和外膜,最终将电子转移到细胞外的电子受体如Cr(Ⅵ)。这些C型细胞色素包括CymA、MtrA、MtrB、MtrC和OmcA,其中定位在外膜上的MtrC和OmcA负责电子转移到细胞外电子受体[28]。此研究还通过比较蛋白组织学的方法证明OmcA和MtrC的缺失不仅加剧了Cr(Ⅵ)对Shewanella oneidensis MR-1外膜的毒性,而且扰乱了Cr(Ⅵ)处理下Shewanella oneidensis MR-1的转录和翻译过程,同时影响了Shewanella oneidensis MR-1响应Cr(Ⅵ)的代谢途径和细胞膜中电子传递相关蛋白的表达[29]。间接还原主要是指厌氧环境下细菌产生还原性代谢产物还原Cr(Ⅵ)。在厌氧条件下硫酸盐还原菌中硫酸盐代谢生成S2-,S2-再与Cr(Ⅵ)发生氧化还原反应,从而实现Cr(Ⅵ)的间接还原[26]。目前已经有文献报道,纤维菌具有较强Cr(Ⅵ)抗性和还原能力[30],但是还没有研究纤维菌对Cr(Ⅵ)还原的分子机理,因此在后续的研究中将研究这株菌对Cr(Ⅵ)还原的特性及机理。
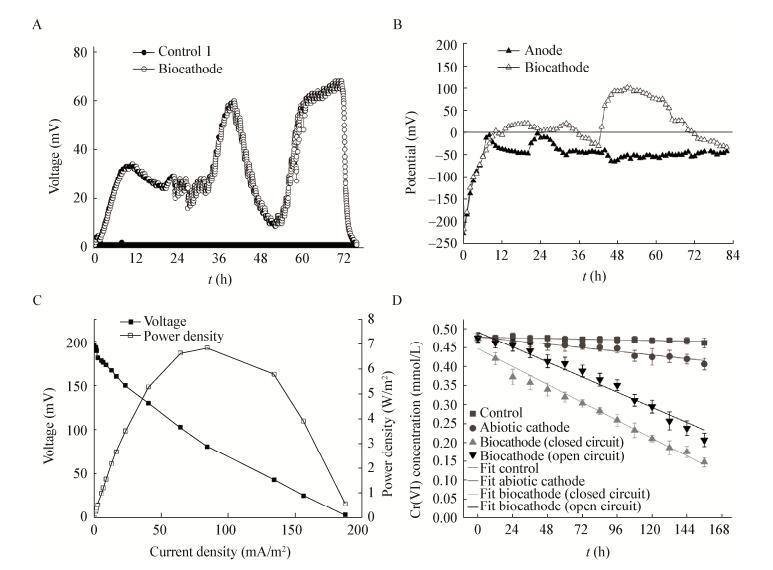
2.2 Cr(Ⅵ)还原菌株在MFC中的应用生物阴极电池组开始运行11 h,电压出现第一个峰值(34 mV),说明MFC已经进入了稳定的产电阶段。数据表明,运行42 h电压出现第二个峰值60 mV,随后的运行过程中电压在71 h达到最大值(68 mV)。对照组MFC因为没有产电微生物的存在,电压在MFC运行周期中一直趋近0 mV (图 4A)。阳极电势在前12 h急剧下降,最后稳定在-52 mV左右说明阳极已形成了稳定的电化学生物活性。生物阴极电势从初始-215 mV到运行结束的电势-45 mV,中间出现两个峰值,分别是45 mV和113 mV (图 4B)。极化曲线可以看出生物阴极电池可以达到的最大功率密度为6.8 W/cm2 (图 4C)。同时,接种LZU-26的生物阴极MFC,Cr(Ⅵ)还原率也有明显的提高。运行结束时接种了LZU-26的生物阴极电池组在闭路状态Cr(Ⅵ)还原率高达68.9%,在开路状态下为56.5%,而Cr(Ⅵ)作为电子受体的化学阴极组Cr(Ⅵ)还原率为14.7%,空白对照组Cr(Ⅵ)几乎没有被还原(2.7%) (图 4D)。
|
| 图 4 微生物燃料电池LZU-26生物阴极的电压输出(A)、电势(B)、极化曲线(C)和Cr(Ⅵ)还原(D) Figure 4 Voltage output (A), potential (B), polarization curve (C) and Cr(Ⅵ) reduction (D) of the microbial fuel cell biocathode 注:外电阻:1 kΩ Note: External resistance: 1 kΩ. |
|
|
首先利用微生物燃料电池还原水体Cr(Ⅵ)的是Li等[31],Cr(Ⅵ)在酸性条件下接受6个电子后被还原成Cr(Ⅲ),公式如下:
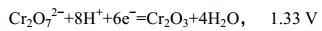
|
(1) |

|
(2) |
这两个方程式表明在酸性条件下Cr(Ⅵ) (1.33 V)比氧气(1.23 V)具有更强的氧化电势[32]。更进一步的研究表明,MFCs可以同时修复Cr(Ⅵ)污染的水体和土壤,与开路对照组相比,实验组运行结束后,上清液中的Cr(Ⅵ)和土壤中总Cr(Ⅵ)均有明显降低,并且土壤类型和外部电阻对电流产生和Cr(Ⅵ)去除效率有显著的影响[33]。本实验不仅用Cr(Ⅵ)作电子受体,同时接种LZU-26构成生物阴极,发现其对阴极液中Cr(Ⅵ)还原具有促进和增强作用。对照1阳极未检测出Cr(Ⅵ),因此排除Cr(Ⅵ)从阴极扩散到阳极。
生物阴极主要分为:(1) 好氧生物阴极,空气中的氧气是好氧生物阴极中常用的电子受体,利用好氧微生物对氧气还原进行电化学催化[34];(2) 厌氧生物阴极,厌氧条件下微生物以硝酸盐、延胡索酸等代替氧气作为最终电子受体[14]。本实验属于厌氧生物阴极,并以Cr(Ⅵ)作为电子受体,但由于LZU-26菌为兼性厌氧菌,为了让其在阴极室中更好的生长,没有在运行前充N2赶走阴极液中的溶解氧,所以阴极室中会有微量的氧气存在。Cr(Ⅵ)可能会被氧气还原成Cr(Ⅲ),同时氧气也会与Cr(Ⅵ)竞争电子[32],所以氧气的存在会对Cr(Ⅵ)的还原有影响。但在本实验中溶氧仪检测结果显示阴极液初始溶氧0.1 mg/L,运行至24 h后溶解氧为0,氧气被消耗殆尽。综上所述,本实验中氧气几乎不影响Cr(Ⅵ)的还原效率。阴极电势出现的波动对应着输出电压的趋势,这意味着在阴极上活跃的生物膜在进行生物催化[11]。
2009年,美国格鲁吉亚大学发表文章,第一次利用微生物燃料电池生物阴极还原Cr(Ⅵ)。富含Cr(Ⅵ)的反硝化和厌氧混合培养物作为阴极接种物,达到的Cr(Ⅵ)最大还原率为0.46 mg/(g VSS·h)[35]。次年,Huang等用约5 g Cr(Ⅵ)污染土壤作为唯一接种物构建生物阴极还原Cr(Ⅵ),当Cr(Ⅵ)起始浓度为32.9 mg/L时Cr(Ⅵ)还原率为2.4±0.2 mg/(g VSS·h)[11]。相比于前人的研究,本实验生物阴极的接种物为LZU-26细菌纯培养。纯培养相对于混合菌群最独特的优势是方便研究产电机制,同时还可以更好地操控实验和分析实验中出现的现象。生成的低毒性的Cr(Ⅲ)也可以被回收利用,例如近几年来的研究表明可以用Cr(Ⅲ)电镀来代替Cr(Ⅵ)电镀,为处理铬污染提供了更加深入、可持续的方法[36]。但对LZU-26菌株促进MFC产电和Cr(Ⅵ)还原的机制还没有进行探索,我们将研究LZU-26产电机制和铬还原机理,并进一步优化MFC的反应条件,提高其产电性能和Cr(Ⅵ)的还原率。
3 结论(1) 从黄河兰州段排污口土壤中分离得到一株对Cr(Ⅵ)有较强抗性和还原能力的细菌LZU-26。研究表明在添加有0.4 mmol/L Cr(Ⅵ)的培养基中,菌株LZU-26可以在48 h还原99.97%的Cr(Ⅵ)。经16S rRNA基因序列比对,LZU-26被鉴定属于纤维化纤维菌(Cellulosimicrobium)。
(2) 将LZU-26应用到微生物燃料电池生物阴极,最大功率密度为6.8 W/cm2,Cr(Ⅵ)还原率较化学阴极MFC增加了54.2%。证明铬还原菌株LZU-26可以被应用在MFC生物阴极,在产电的同时处理含Cr(Ⅵ)的废水。
| [1] | Gómez V, Callao MP. Chromium determination and speciation since 2000[J]. TrAC Trends in Analytical Chemistry, 2006, 25(10) : 1006–1015. DOI:10.1016/j.trac.2006.06.010 |
| [2] | Gibb HJ, Lees PS, Pinsky PF, et al. Lung cancer among workers in chromium chemical production[J]. American Journal of Industrial Medicine, 2000, 38(2) : 115–126. DOI:10.1002/(ISSN)1097-0274 |
| [3] | Chen JM, Hao OJ. Microbial chromium (Ⅵ) reduction[J]. Critical Reviews in Environmental Science and Technology, 1998, 28(3) : 219–251. DOI:10.1080/10643389891254214 |
| [4] | Lloyd JR. Microbial reduction of metals and radionuclides[J]. FEMS Microbiology Reviews, 2003, 27(2/3) : 411–425. |
| [5] | Zhang F, Ge Z, Grimaud J, et al. Long-term performance of liter-scale microbial fuel cells treating primary effluent installed in a municipal wastewater treatment facility[J]. Environmental Science & Technology, 2013, 47(9) : 4941–4948. |
| [6] | Logan BE, Rabaey K. Conversion of wastes into bioelectricity and chemicals by using microbial electrochemical technologies[J]. Science, 2012, 337(6095) : 686–690. DOI:10.1126/science.1217412 |
| [7] | Chaudhuri SK, Lovley DR. Electricity generation by direct oxidation of glucose in mediatorless microbial fuel cells[J]. Nature Biotechnology, 2003, 21(10) : 1229–1232. DOI:10.1038/nbt867 |
| [8] | Chen ZJ, Niu YY, Zhao S, et al. A novel biosensor for p-nitrophenol based on an aerobic anode microbial fuel cell[J]. Biosensors and Bioelectronics, 2016, 85 : 860–868. DOI:10.1016/j.bios.2016.06.007 |
| [9] | Liu H, Cheng SA, Logan BE. Production of electricity from acetate or butyrate using a single-chamber microbial fuel cell[J]. Environmental Science & Technology, 2005, 39(2) : 658–662. |
| [10] | You SJ, Zhao QL, Zhang JN, et al. A microbial fuel cell using permanganate as the cathodic electron acceptor[J]. Journal of Power Sources, 2006, 162(2) : 1409–1415. DOI:10.1016/j.jpowsour.2006.07.063 |
| [11] | Huang LP, Chen JW, Quan X, et al. Enhancement of hexavalent chromium reduction and electricity production from a biocathode microbial fuel cell[J]. Bioprocess and Biosystems Engineering, 2010, 33(8) : 937–945. DOI:10.1007/s00449-010-0417-7 |
| [12] | Richter H, McCarthy K, Nevin KP, et al. Electricity generation by Geobacter sulfurreducens attached to gold electrodes[J]. Langmuir, 2008, 24(8) : 4376–4379. DOI:10.1021/la703469y |
| [13] | López-López A, Expósito E, Antón J, et al. Use of Thiobacillus ferrooxidans in a coupled microbiological-electrochemical system for wastewater detoxification[J]. Biotechnology and Bioengineering, 1999, 63(1) : 79–86. DOI:10.1002/(ISSN)1097-0290 |
| [14] | Chen LX, Xiao Y, Zhao F. Biocathodes in microbial fuel cells[J]. Progress in Chemistry, 2012, 24(1) : 157–162. (in Chinese) 陈立香, 肖勇, 赵峰. 微生物燃料电池生物阴极[J]. 化学进展, 2012, 24(1) : 157–162. |
| [15] | Huang LP, Regan JM, Quan X. Electron transfer mechanisms, new applications, and performance of biocathode microbial fuel cells[J]. Bioresource Technology, 2011, 102(1) : 316–323. DOI:10.1016/j.biortech.2010.06.096 |
| [16] | Chen G, Qin J, Shi DZ, et al. Diversity of soil nematodes in areas polluted with heavy metals and polycyclic aromatic hydrocarbons (PAHs) in Lanzhou, China[J]. Environmental Management, 2009, 44(1) : 163–172. DOI:10.1007/s00267-008-9268-2 |
| [17] | Liu CB, Xu J, Liu CG, et al. Heavy metals in the surface sediments in Lanzhou Reach of Yellow River, China[J]. Bulletin of Environmental Contamination and Toxicology, 2009, 82(1) : 26–30. DOI:10.1007/s00128-008-9563-x |
| [18] | Xia XH, Yang ZF, Wang R, et al. Contamination of oxygen-consuming organics in the Yellow River of China[J]. Environmental Monitoring and Assessment, 2005, 110(1/3) : 185–202. |
| [19] | Zheng Z, Li YB, Zhang XW, et al. A Bacillus subtilis strain can reduce hexavalent chromium to trivalent and an nfrA gene is involved[J]. International Biodeterioration & Biodegradation, 2015, 97 : 90–96. |
| [20] | Chen ZJ, Zou LM, Zhang H, et al. Thioredoxin is involved in hexavalent chromium reduction in Streptomyces violaceoruber strain LZ-26-1 isolated from the Lanzhou reaches of the Yellow River[J]. International Biodeterioration & Biodegradation, 2014, 94 : 146–151. |
| [21] | Bond DR, Lovley DR. Electricity production by Geobacter sulfurreducens attached to electrodes[J]. Applied and Environmental Microbiology, 2003, 69(3) : 1548–1555. DOI:10.1128/AEM.69.3.1548-1555.2003 |
| [22] | Logan BE, Hamelers B, Rozendal R, et al. Microbial fuel cells: methodology and technology[J]. Environmental Science & Technology, 2006, 40(17) : 5181–5192. |
| [23] | Romanenko VI, Koren'kov VN. Pure culture of bacteria using chromates and bichromates as hydrogen acceptors during development under anaerobic conditions[J]. Mikrobiologiia, 1977, 46(3) : 414–417. |
| [24] | Zhu WJ, Chai LY, Ma ZM, et al. Anaerobic reduction of hexavalent chromium by bacterial cells of Achromobacter sp. strain Ch1[J]. Microbiological Research, 2008, 163(6) : 616–623. DOI:10.1016/j.micres.2006.09.008 |
| [25] | Sun JQ, Xu L, Tang YQ, et al. Degradation of pyridine by one Rhodococcus strain in the presence of chromium (Ⅵ) or phenol[J]. Journal of Hazardous Materials, 2011, 191(1/3) : 62–68. |
| [26] | Li D, Zhao YC, Song LY, et al. Advances in molecular mechanism of bacterial reduction of hexavalent chromium[J]. Environmental Science, 2014, 35(4) : 1602–1612. (in Chinese) 李斗, 赵由才, 宋立岩, 等. 六价铬细菌还原的分子机制研究进展[J]. 环境科学, 2014, 35(4) : 1602–1612. |
| [27] | Park CH, Gonzalez C, Ackerley D, et al. Molecular engineering of soluble bacterial proteins with chromate reductase activity[A]//Hinchee RE, Porta A, Pellei M. Remediation and Reuse of Contaminated Sediments. Proceedings of the First International Conference on Remediation of Chlorinated Sediments[C]. Columbus, Ohio: Battelle Press, 2002: 103-112 |
| [28] | Shi L, Rosso KM, Clarke TA, et al. Molecular underpinnings of Fe(Ⅲ) oxide reduction by Shewanella oneidensis MR-1[J]. Frontiers in Microbiology, 2012, 3 : 50. |
| [29] | Wang C, Chen J, Hu WJ, et al. Comparative proteomics reveal the impact of OmcA/MtrC deletion on Shewanella oneidensis MR-1 in response to hexavalent chromium exposure[J]. Applied Microbiology and Biotechnology, 2014, 98(23) : 9735–9747. DOI:10.1007/s00253-014-6143-3 |
| [30] | Field EK, Gerlach R, Viamajala S, et al. Hexavalent chromium reduction by Cellulomonas sp. strain ES6: the influence of carbon source, iron minerals, and electron shuttling compounds[J]. Biodegradation, 2013, 24(3) : 437–450. DOI:10.1007/s10532-012-9600-7 |
| [31] | Li ZJ, Zhang XW, Lei LC. Electricity production during the treatment of real electroplating wastewater containing Cr6+ using microbial fuel cell[J]. Process Biochemistry, 2008, 43(12) : 1352–1358. DOI:10.1016/j.procbio.2008.08.005 |
| [32] | Oh S, Min B, Logan BE. Cathode performance as a factor in electricity generation in microbial fuel cells[J]. Environmental Science & Technology, 2004, 38(18) : 4900–4904. |
| [33] | Wang C, Deng H, Zhao F. The remediation of chromium (Ⅵ)-contaminated soils using microbial fuel cells[J]. Soil and Sediment Contamination: An International Journal, 2016, 25(1) : 1–12. DOI:10.1080/15320383.2016.1085833 |
| [34] | Kontani R, Tsujimura S, Kano K. Air diffusion biocathode with CueO as electrocatalyst adsorbed on carbon particle-modified electrodes[J]. Bioelectrochemistry, 2009, 76(1/2) : 10–13. |
| [35] | Tandukar M, Huber SJ, Onodera T, et al. Biological chromium (Ⅵ) reduction in the cathode of a microbial fuel cell[J]. Environmental Science & Technology, 2009, 43(21) : 8159–8165. |
| [36] | Tu ZM, Zheng J, Li N, et al. Recent development and tendency of trivalent chromium plating[J]. Surface Technology, 2007, 36(5) : 59–63, 87. (in Chinese) 屠振密, 郑剑, 李宁, 等. 三价铬电镀铬现状及发展趋势[J]. 表面技术, 2007, 36(5) : 59–63, 87. |
 2017, Vol. 44
2017, Vol. 44




