扩展功能
文章信息
- 孙娇, 杨海燕, 李力
- SUN Jiao, YANG Hai-Yan, LI Li
- 一株红球菌(Rhodococcus sp.)二噁英降解质粒的稳定性与接合转移特性
- Maintenance and conjugative transfer of dioxin catabolic plasmids in a Rhodococcus sp
- 微生物学通报, 2017, 44(7): 1613-1621
- Microbiology China, 2017, 44(7): 1613-1621
- DOI: 10.13344/j.microbiol.china.170129
-
文章历史
- 收稿日期: 2017-02-19
- 接受日期: 2017-03-14
- 优先数字出版日期(www.cnki.net): 2017-03-16
基因水平转移(Horizontal gene transfer,HGT),通常也称为基因侧向转移,指的是不同的生物个体间,或单个细胞内部的细胞器之间进行遗传物质的交流[1]。基因水平转移打破了亲缘关系的界限,即亲缘关系较近的同属不同种之间,或者亲缘关系较远的生物种之间,甚至没有亲缘关系的生物之间,都可以发生基因水平转移[2-5]。随着分子生物学的发展,发现生物在发展和进化中普遍存在着基因水平转移,基因水平转移能够促使适应环境的优势基因在共同生活的生物体之间发生传递且保存下去[6]。目前,国内外学者通过大量的研究发现在污染环境中存在并发生基因水平转移现象,而污染环境中降解菌的多样性多数与降解基因的水平转移有关。这些发现表明了污染环境中微生物之间存在着广泛的降解基因交流,从而促进更多的菌株获得降解功能[7]。基因水平转移对追踪菌株来源及其降解功能的形成、探讨菌株变迁以及不同污染地区优势菌株之间的关系等具有重要意义。细菌间基因水平转移主要是由可移动基因元件或水平基因库引起的,其中质粒可通过接合转移在细菌间交换遗传物质,并可在受体生物体内稳定表达且向子代传递遗传物质,是一类重要的可移动基因元件[8]。
二噁英(Dioxin)是多氯代二苯并二噁英(Polycholrinated dibenzo-p-dioxin,PCDDs)和多氯代二苯并呋喃(Polychlorinated dibenzofuran,PCDFs)两类物质的合称,为强致癌、致突变性物质,可严重干扰有机体的内分泌系统,对人类及各类生物均存在严重的健康威胁,是迄今为止毒性最大的化合物之一。环境中绝大部分二噁英是人工合成或工业生产的副产物,垃圾焚烧、造纸及冶金工业等是二噁英的主要污染源,存在于大气、土壤和水体之中的二噁英性质十分稳定,物理、化学处理方法对其去除难度较大。微生物由于具备在各类环境中的广泛存在性、底物利用谱的多样性及对不同环境条件的适应性等特征,决定了其在降解利用有机污染物方面有着不可替代的优势,因此微生物降解是治理二噁英污染的一类有效方法[9]。由于二噁英毒性大、溶解性差且价格昂贵,通常选择无氯原子取代的二苯并呋喃作为模式化合物研究二噁英的生物降解,国内外的研究人员已经分离了大量降解二噁英的细菌,主要包括假单胞菌(Pseudomonas)[10-12]、鞘氨醇单胞菌(Sphingomonas)[13-15]、红球菌(Rhodococcus)[16-17]、地杆菌(Terrabacter)[18-19]等。大多数研究考察了这些微生物降解二噁英的分子机制,发现降解基因主要位于质粒上。
Miyakoshi等研究咔唑/二噁英降解质粒pCAR1的复制、稳定性及接合转移特性发现,pCAR1可以向其宿主菌Pseudomonas resinovorans CA10的衍生菌及P. putida KT2440转移,证明质粒pCAR1具有自主转移性[20]。Shimizu等报道联苯降解菌Rhodococcussp. strain RHA1含有3个线状质粒pRHL1 (1 100 kb)、pRHL2 (450 kb)和pRHL3 (330 kb),其中编码联苯降解酶类的质粒pRHL2可在同属菌株之间传递[17]。由于降解基因大多位于质粒上,因此降解性质粒的转移对微生物新的降解能力的形成及其进化起着至关重要的作用,也是对污染环境进行有效生物修复的重要手段[21]。Shintani等将携带gfp标记的降解质粒pBP136和pCAR1的恶臭假单胞菌(P. putida)强化污染系统,通过激光共聚焦显微镜追踪到质粒pBP136-gfp和pCAR1-gfp从假单胞菌供体菌转移到了其他土壤微生物中,获得新的降解菌株,从而加强了咔唑的降解效果[22]。
本课题组前期分离到一株以二苯并呋喃(DF)作为唯一碳源和能源生长的红球菌Rhodococcus sp. strain p52,通过研究发现p52中存在两个参与二噁英起始双羟化的双加氧酶基因簇dfdA1A2A3A4及dbfA1A2,且分别位于转移性质粒pDF01 (170 kb)和pDF02 (242 kb)上[23]。据报道dfdA、dbfA在多株放线菌中有分布,除了本研究对象Rhodococcus sp. strain p52,还包括Rhodococcussp. strain HA01[16],Terrabacter sp. strain YK2[24],Terrabacter sp. strain DBF63[18],且二噁英降解途径其他关键酶的编码基因在这些菌株中具很强的保守性,暗示了二噁英降解基因在不同菌株中通过基因水平转移而获得,然而这些菌株中关于其降解质粒的接合转移特性目前仍缺乏充分的实验证据。鉴于此,本研究以携带二噁英降解质粒pDF01和pDF02的红球菌菌株p52为研究对象,考察pDF01和pDF02的遗传稳定性,及其对于不同菌株的接合转移性能;并进一步分析降解基因在接合子中的表达状况,本研究可为菌株p52用于二噁英污染环境的生物修复提供实验依据。
1 材料与方法 1.1 材料 1.1.1 主要试剂和仪器:分析纯(≥99%)二苯并呋喃(Dibenzofuran,DF)、色谱纯二甲基亚砜(DMSO)、色谱纯乙酸乙酯购自Sigma-Aldrich,将DF溶于DMSO配成50 g/L的储备液备用;Taq DNA聚合酶购自大连宝生物公司;其他分子、生化试剂购自生工生物工程(上海)股份有限公司。气相色谱质谱联用仪6890-5973,Agilent公司;凝胶成像系统、基因扩增仪,Bio-Rad公司;分光光度计6900,Unico公司。
1.1.2 主要菌种:实验所使用的菌株主要特征及来源见表 1。
| 菌株 Strains |
相关特性/用途 Character /Applications |
来源 Sources |
| 红球菌Rhodococcus sp. strain p52 | KmS, SmS, EmS; DF(+)/donor | Laboratory collection[23] |
| 紫红红球菌Rhodococcus rhodochrous | SmR; DF(-)/recipient | CGMCC 4.1147 |
| 红串红球菌Rhodococcus erythropolis | KmR; DF(±)/recipient | CGMCC 1.2362 |
| 枯草芽孢杆菌Bacillus subtilis | KmS, SmS, EmS; DF(-)/recipient | CGMCC 1.1468 |
| 肿大地杆菌Terrabacter tumescens | KmS, SmS, EmS; DF(-)/recipient | CGMCC 1.2032 |
| 大地两面神菌Janibacter terrae | SmR, DF(±)/recipient | MCCC 1A0921 |
| 地杆菌Terrabacter sp. | KmS, SmS, EmS; DF(-)/recipient | MCCC 1A04573 |
| 节杆菌Arthrobacter sp. | KmS, SmS, EmS; DF(-)/recipient | Laboratory collection |
| 注:Km:卡那霉素;Sm:链霉素;Em:红霉素R为抗生素抗性;S为抗生素敏感;DF(+):利用DF生长;DF(-):不利用DF生长;DF(±):利用DF生长较差. Note: Km: kanamycin; Sm: streptomycin; Em: erythromycin; R: antibic resistance; S: antibic sensitivity; DF(+): growth on DF; DF(-): no-growth on DF; DF(±): inferior growth on DF. | ||
LB培养基(g/L):胰蛋白胨10.0,酵母粉5.0,NaCl 10.0[25]。无机盐培养基(g/L):K2HPO4 12.0,KH2PO4 11.0,Na2SO4 2.0,MgSO4·7H2O 0.2,NH4NO3 3.0,微量金属盐溶液1.0 mL。微量金属盐溶液(g/L):FeCl2·4H2O 0.3,CoCl2·6H2O 0.038,MgCl2·4H2O 0.02,ZnCl2 0.014,H3BO3 0.012 4,Na2MoO4·2H2O 0.04,CuCl2·2H2O 0.003 4。
1.2 方法 1.2.1 质粒提取、Southern杂交、菌落杂交分析:降解质粒提取按照Peng等报道的方法[23]进行。质粒提取后通过琼脂糖凝胶电泳进行检测的条件为:0.8%的琼脂糖浓度,TAE buffer,4.5 V/cm电压,恒温4℃,电泳时间5 h。将DNA或菌落转膜后,杂交方法同Peng等[23],其中探针标记、预杂交、杂交、信号检测等均使用试剂盒DIG High Prime DNA Labeling and Detection Strarter Kit I (Roche,Germany)按照使用手册完成。
1.2.2 实验菌株抗生素抗性和二苯并呋喃降解能力试验:接合实验前分别对供体菌、受体菌进行抗生素抗性测试:挑取各菌株LB平板上的单菌落分别接种于LB液体培养基中,培养至OD600=0.8,以5%接种量分别转接到含有各种抗生素(20-50 μg/mL)的LB液体培养基中作为受试组,同时接种到不含抗生素的LB液体培养基中作为阴性对照组,30℃、180 r/min恒温振荡培养,间隔取样测量比较受试组与阴性对照组菌液的吸光度。接合实验前分别对供体菌、受体菌进行DF降解能力检测:将各受体菌株活化后,分别在以DF (浓度300 mg/L)为唯一碳源的无机盐固体培养基上划线,于30℃恒温培养箱中培养2-7 d,观察DF平板上是否有菌落生长,同时在相同培养条件下将受体菌株接种于LB平板作对照;对于DF平板上长出的菌落则进一步通过扩增其16S rRNA基因序列并测序验证其受体身份。供体菌株、受体菌株对于抗生素的抗性及利用DF的能力见表 1。
1.2.3 平板接合实验:平板接合实验以菌株p52为供体菌,分别以表 1中的菌株为受体菌,采用滤膜接合法进行接合实验[22],主要操作步骤如下:挑取供体菌与受体菌的单菌落分别接种于LB培养基中,培养至菌液OD600达到0.8-1.0。分别取供、受体菌液1 mL,12 000 r/min离心2 min收集菌体,加入200μL LB培养基重悬菌体,将供、受体菌悬液混匀后转移至置于LB平板的0.22 μm滤膜上,30℃培养20 h。取出滤膜以2 mL磷酸盐缓冲液(Na2HPO4 2.2 g/L,KH2PO4 0.8 g/L,NH4NO3 3.0 g/L)洗脱菌体,12 000 r/min离心2 min收集菌体,以缓冲液重悬菌体涂布于含有(仅受体菌株可耐受的)抗生素且以DF为唯一碳源的无机盐固体培养基,30℃倒置培养48 h,平板上所生长出的可以利用DF为唯一碳源及能源生长、并对抗生素有抗性的菌落,即为初步筛得的接合子。随机挑取初筛接合子,以菌落PCR扩增其16S rRNA基因片段,测序、确认接合子种属身份;以菌落原位杂交确认降解质粒pDF01及pDF02的存在,或者进一步将接合子培养后提取质粒,通过Southern杂交确认质粒存在。
1.2.4 Rhodococcus sp. strain p52中降解质粒的稳定性分析:将菌株p52单菌落在LB固体培养基上划线,连续传代培养。对每次传代培养后的平板随机挑取单菌落进行菌落PCR,分别扩增位于质粒pDF01上的dfdA1片段和位于pDF02上的dbfA1片段,检测pDF01及pDF02在菌株p52中的丢失状况,并提取质粒进行Southern杂交确认。其中扩增dfdA1片段(1.07 kb)所使用引物为DfdF546/DfdR4900[16],扩增dbfA1片段(1.48 kb)所使用引物为DbfF1 (5′-CGCGACCCCGTCATACGAGC-3′)/DbfR1 (5′-AGACTGCCCGACCAGGTGGG-3′)[26]。
1.2.5 节杆菌接合子降解实验:将获得的节杆菌接合子接种于LB培养基中,待菌液OD600为4.0后,收集菌体并用无机盐培养基洗涤后重悬,分别接种于装有50 mL无机盐培养基的250 mL锥形瓶内(初始OD600约为0.04),加入受试底物DF使其终浓度为500 mg/L,于30℃、180 r/min恒温振荡培养;另外,将节杆菌原受体菌接种于含DF的无机盐培养基中,同样操作作为对照组;同时以未接种菌悬液的含DF的无机盐培养基进行同样操作作为空白组,实验组、对照组与空白组各设3份平行。间隔时间取样,样品采用考马斯亮蓝法对菌体蛋白进行测定[27]获得菌体的生长量;将样品以乙酸乙酯萃取后以气相色谱分析DF的浓度[23],检测DF的降解状况。
2 结果与分析 2.1 Rhodococcus sp. strain p52中降解质粒的稳定性将Rhodococcus sp. strain p52在无选择压力的条件下——LB培养基中连续传代培养47次和65次后,PCR扩增双加氧酶基因dbfA1片段和dfdA1片段的检测结果见图 1。
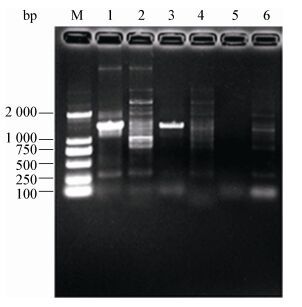
|
| 图 1 LB培养基连续传代后Rhodococcus sp. strain p52中双加氧酶基因dbfA1和dfdA1片段的扩增结果 Figure 1 PCR amplification of dbfA1 and dfdA1 fragments from Rhodococcus sp. strain p52 after continuous transfer in LB medium 注:1、2:菌株p52传代起始dbfA1和dfdA1基因片段扩增结果;3、4:传代47次后p52中dbfA1和dfdA1基因片段扩增结果;5、6:传代65次后p52中dbfA1和dfdA1基因片段扩增结果;M:DL2000 DNA分子量标准. Note: 1, 2: Amplicon of dbfA1 and dfdA1 fragments from strain p52 before transfer; 3, 4: amplicon of dbfA and dfdA fragments from strain p52 after forty-seven times transfer in LB medium; 5, 6: Amplicon of dbfA1 and dfdA1 fragments from strain p52 after sixty-five times transfer in LB medium; M: DL2000 DNA Marker served as molecular mass standard. |
|
|
如图 1所示,经过47次传代培养后,在p52单菌落中仍能够扩增检测到dbfA1基因片段(约1.5 kb),但几乎检测不到dfdA1片段(约1 kb);经过65次传代培养后,在随机挑选的p52单菌落中均无法扩增检测到dfdA1和dbfA1片段。为进一步确认质粒pDF01和pDF02的丢失状况,分别对连续传代47次及65次的p52菌株提取质粒DNA,分别与针对质粒pDF01的dfdA1探针和针对pDF02上的dbfA1探针进行Southern杂交,结果如图 2所示。经Southern杂交检测发现,传代47次后p52中可检测到质粒pDF02,而pDF01丢失;传代65次后p52中的质粒pDF01和pDF02全部丢失,Southern杂交结果与双加氧酶基因dfdA1和dbfA1片段的PCR扩增结果相吻合。
|
| 图 2 LB培养基连续传代后Rhodococcus sp. strain p52中质粒pDF01和pDF02的Southern杂交检测结果 Figure 2 Detection of pDF01and pDF02 by Southern hybridization in Rhodococcus sp. strain p52 before and after continuous transfer in LB medium 注:图A中1、2、3分别为:菌株p52传递起始、传代47次和传代65次后提取质粒pDF01和pDF02的电泳检测结果;图B、C分别为提取质粒pDF02、pDF01的Southern杂交结果:1为菌株p52传代起始提取质粒的Southern杂交结果;2为连续传代47次后菌株p52中提取质粒的Southern杂交结果;3为连续传代65次后菌株p52中提取质粒的Southern杂交结果. Note: A: agarose gel electrophoresis profile of plasmids extracted from strain p52 before transfer (1), after transfer forty-seven times (2) and after transfer sixty-five times (3); detection of pDF02 (B) and pDF01 (C) by Southern hybridization for strain p52 before transfer (1), after transfer forty-seven times (2) and after transfer sixty-five times (3). |
|
|
实验通过在无选择压力条件下连续传代培养,考察了二噁英降解质粒pDF01、pDF02在宿主菌株p52中的稳定保持能力,结果表明菌株p52中的质粒pDF01和pDF02较稳定,经过连续传代(小于47次)培养仍可保持,其中质粒pDF02比pDF01更加稳定。
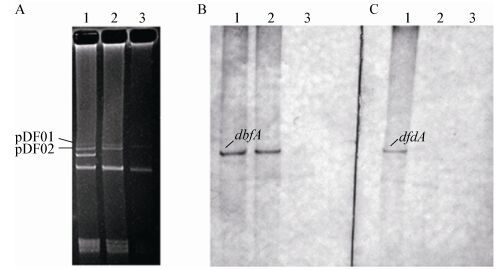
2.2 Rhodococcus sp. strain p52中降解质粒pDF01和pDF02的接合转移特性接合实验前对供体、受体菌株的抗生素抗性检测发现,供体菌株p52对所有测试抗生素均无明显抗性,其他受体菌株则对不同的抗生素抗性不同(表 1)。另外,接合实验前将受体菌株接种于含DF的无机盐培养基中30℃恒温培养2 d后,发现红串红球菌和大地两面神菌可微弱生长,但与dfdA和dbfA探针无杂交信号(结果未附),表明这两株菌虽然未携带含双加氧酶基因dfdA1和dbfA1的质粒,但可能含有其他降解DF的基因。以菌株p52为供体菌,以红球菌同属或不同属的菌株为受体菌,采用滤膜接合法进行接合实验。结果表明,当以紫红红球菌、红串红球菌、大地两面神菌和节杆菌为受体菌时,筛选培养基(含DF及抗生素)上分别长出了类似受体菌形态的菌落,为初步认定的接合子。分别对这些初步认定的接合子一方面扩增其16S rRNA基因序列并测序[28],验证其菌属,证明与受体菌一致;另一方面对接合子菌落分别使用与pDF01及pDF02结合的探针进行菌落杂交试验(图 3),实验中以p52的菌落作为阳性对照、以接合实验之前的原受体菌落作为阴性对照,结果显示上述4种接合子与阳性对照均有杂交信号,而阴性对照均无杂交信号,表明菌株p52中的质粒pDF01和pDF02通过接合作用转移到上述4种受体菌株中,其接合转移频率见表 2。

|
| 图 3 Rhodococcus sp. strain p52和接合子使用dbfA和dfdA探针的菌落杂交结果 Figure 3 Colony hybridization with probes targeting dbfA and dfdA fragments for Rhodococcus sp. strain p52 and different transconjugants 注:1:p52菌落使用dbfA和dfdA探针杂交结果(阳性对照);2、3、4、5:紫红红球菌、红串红球菌、大地两面神菌和节杆菌菌落使用dbfA和dfdA探针的杂交结果. Note: Colony hybridization results with probes targeting dbfA and dfdA fragments are shown for positive control p52 (1), R. rhodochrous transconjugant (2), R. erythropolis transconjugant (3), J. terra transconjugant (4), and Arthrobacter sp. transconjugant (5). |
|
|
| 受体菌株 Recipient strains |
接合转移频率(接合子/供体菌) Transconjugation frequency (Transconjugant/Recipient) |
转移质粒及稳定性* Conjugative plasmid and plasmid stability* |
| 紫红红球菌Rhodococcus rhodochrous | 1.8×10-7 | pDF01, pDF02; unstable |
| 红串红球菌Rhodococcus erythropolis | 2.6×10-7 | pDF01, pDF02; unstable |
| 枯草芽孢杆菌Bacillus subtilis | -a | -b |
| 肿大地杆菌Terrabacter tumescens | -a | -b |
| 大地两面神菌Janibacter terrae | 3.2×10-9 | pDF01, pDF02; unstable |
| 地杆菌Terrabacter sp. | -a | -b |
| 节杆菌Arthrobacter sp. | 3.5×10-6 | pDF01, pDF02; stable |
| 注:a:接合转移频率小于10-10;b:未得到相应的接合子;*:不稳定指以筛选平板传代1-2次即丢失. Note: a: Transconjugation frequency less than 10-10; b: No transconjugant obtained; *: Plasmid unstability: no-growth on selective plate after transfer 1-2 times. | ||
以上研究表明二噁英降解质粒pDF01和pDF02可向紫红红球菌、红串红球菌、节杆菌和大地两面神菌多个菌株转移。其中紫红红球菌、红串红球菌与供体菌株p52为同属,与我们对基因水平转移的一般认识相一致,即降解质粒在同属间容易进行转移。大地两面神菌与供体红球菌同为放线菌目,亲缘关系较近,大地两面神菌虽然自身具有在DF平板上生长的能力,但使用dbfA和dfdA探针进行菌落原位杂交未出现杂交信号,表明自身不含有dbfA1和dfdA1基因,而接合实验之后出现杂交信号,证明该菌株通过质粒接合转移获得了dbfA1和dfdA1基因。这表明菌株p52降解质粒的接合转移宿主范围不局限于同属。节杆菌(Arthrobacter sp.)与供体红球菌同为革兰氏阳性菌,亲缘关系相对较远,表明菌株p52中的二噁英降解质粒具有较宽泛的转移宿主范围。
值得一提的是,在接合实验中有的接合子中只获得了pDF02质粒,但只含pDF02质粒的接合子在含DF的无机盐培养基上生长状况较差,在传代1-2代后质粒即丢失,暗示pDF01、pDF02以及两套双加氧酶基因在DF降解过程中可能存在协作[23]。例如,据报道在Rhodococcus sp. strain HA01中双加氧酶DfdA只可催化降解3-氯代二苯并呋喃但不可降解2-氯代二苯并呋喃;而双加氧酶DbfA可催化降解2-氯代二苯并呋喃但不可降解3-氯代二苯并呋喃[16]。另外,在本研究中与节杆菌受体菌株相比,降解质粒pDF01、pDF02对于其他受体菌株的转移频率(10-6-10-8)较低,且降解质粒在这些宿主菌中更易丢失。需要说明的是,本研究接合转移实验所使用的受体菌株与供体菌株p52一致,全部为革兰氏阳性菌,目前本课题组正在研究二噁英降解质粒pDF01和pDF02能否向革兰氏阴性菌中转移。
2.3 节杆菌接合子中二噁英降解质粒pDF01及pDF02的检测为了进一步确认降解质粒pDF01和pDF02从供体菌株p52接合转移到节杆菌受体菌株,从所得到的节杆菌接合子中提取质粒,同时也提取供体菌株p52的质粒作对照,分别以质粒pDF01上的 dfdA1和pDF02上的dbfA1的部分序列合成探针进行Southern杂交,结果见图 4。

|
| 图 4 提取节杆菌接合子的质粒进行电泳及Southern杂交确认pDF01与pDF02 Figure 4 Detection of the catabolic plasmids pDF01 and pDF02 in Arthrobacter sp. transconjugant by Southern hybridization 注:图A中1、2分别为提取的Rhodococcus sp. strain p52 (阳性对照)和节杆菌接合子的质粒电泳结果;图B中1、2分别为菌株p52和节杆菌接合子质粒与dbfA探针的杂交结果;图C中1、2分别为菌株p52和节杆菌接合子质粒与dfdA探针的杂交结果. Note: A: Agarose gel electrophoresis profiles of plasmids extracted from the donor Rhodococcus sp. strain p52 (1) as a positive control and the Arthrobacter sp. transconjugant (2). B: Southern hybridization results using probe targeting dbfA for the plasmids from the donor strain p52 (1) and the Arthrobacter sp. transconjugant (2). C: Southern hybridization results using probe targeting dfdA for the plasmids from the donor strain p52 (1) and the Arthrobacter sp. transconjugant (2). |
|
|
节杆菌接合子质粒电泳结果显示含有3条带,前两条带大小分别对应于供体菌p52的降解质粒pDF01和pDF02,Southern杂交结果显示,这两条带可分别与dfdA和dbfA探针结合,表明节杆菌接合子中含有质粒pDF01和pDF02。值得一提的是,对节杆菌受体菌株提取质粒进行电泳,未显示对应的质粒条带(结果未附),这与节杆菌受体菌株菌落杂交实验结果相一致,即采用与pDF01及pDF02结合的探针进行菌落杂交时不产生杂交信号,表明受体菌株自身并不含有pDF01和pDF02。
2.4 节杆菌接合子利用二苯并呋喃生长为了进一步明确降解质粒是否能够在新的宿主菌中遗传表达,使得受体菌株获得降解功能,对上述节杆菌接合子降解利用二苯并呋喃作测试分析,并与节杆菌原受体菌株作比较。结果显示节杆菌接合子可以利用DF作为唯一碳源及能源生长,在以DF为唯一碳源的无机盐培养基中,节杆菌接合子的生长伴随着对DF的消耗,而节杆菌原受体菌株则无明显生长及对DF的利用,具体见图 5。
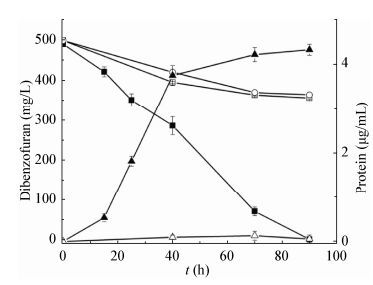
|
| 图 5 Arthrobactersp.接合子及受体菌株对二苯并呋喃的利用与生长 Figure 5 Use of dibenzofuran by the Arthrobacter sp.transconjugant for growth comparing with the recipient strain 注:图中各曲线分别显示以气相色谱检测无机盐培养基无菌对照组二苯并呋喃浓度变化(○)、培养基中接种节杆菌接合子(■)及接种节杆菌原受体菌株(□)二苯并呋喃浓度变化;并以检测蛋白含量显示培养基中接种节杆菌接合子菌体浓度变化(▲)、接种节杆菌原受体菌株菌体浓度变化(△). Note: Decreases in the dibenzofuran levels in the non-inoculation control (○), transconjugant culture (■), recipient culture (□), and were monitored by gas chromatography. Growth is shown as an increase in the protein contents of the transconjugant (▲) and the recipient (△). |
|
|
在接合子培养过程中,含DF的无机盐培养基的颜色逐渐变为橘黄色,呈现出外二醇双加酶作用的特征结果,节杆菌接合子可利用DF生长,经过90 h DF由500 mg/L降至检测限以下,这与供体菌株p52相比较,降解速率略慢,后者在48 h内可将500 mg/L的DF完全降解[23]。另外节杆菌原受体菌株不能利用DF支持生长,其DF浓度变化曲线与无菌空白对照基本吻合,证明降解质粒pDF01、pDF02上的降解基因可在新的节杆菌宿主菌中表达,使节杆菌接合子获得了DF降解能力。
3 结论通过在无选择压力条件下连续传代培养,表明菌株p52中二噁英降解质粒pDF01、pDF02在宿主菌Rhodococcus sp. strain p52中较稳定,经过连续(小于47次)传代培养仍可保持,其中质粒pDF02比pDF01更加稳定。以红球菌菌株p52为供体菌,以同属或不同属菌株为受体菌进行接合实验,证明二噁英降解质粒pDF01和pDF02可向紫红红球菌、红串红球菌、节杆菌和大地两面神菌等多个菌株转移,转移频率为10-6-10-8,表明菌株p52中的二噁英降解质粒具有较宽泛的转移宿主范围。通过提取节杆菌接合子的质粒进行Southern杂交进一步确认了二噁英降解质粒pDF01、pDF02的转移,另外通过降解实验发现节杆菌获得降解质粒后可以利用DF作为唯一碳源及能源生长,降解基因可在新的宿主菌中表达。上述研究表明红球菌菌株p52可通过降解质粒转移强化生物修复过程,在去除环境中二噁英污染中具有良好的应用前景。
| [1] | Thomas CM, Nielsen KM. Mechanisms of, and barriers to, horizontal gene transfer between bacteria[J]. Nature Reviews Microbiology, 2005, 3(9) : 711–721. DOI:10.1038/nrmicro1234 |
| [2] | Davison J. Monitoring horizontal gene transfer[J]. Nature Biotechnology, 2004, 22(11) : 1349. |
| [3] | Poole AM. Horizontal gene transfer and the earliest stages of the evolution of life[J]. Research in Microbiology, 2009, 160(7) : 473–480. DOI:10.1016/j.resmic.2009.07.009 |
| [4] | Hotopp JCD. Horizontal gene transfer between bacteria and animals[J]. Trends in Genetics, 2011, 27(4) : 157–163. DOI:10.1016/j.tig.2011.01.005 |
| [5] | Ou JH, Xie ZX, Chen XD, et al. Horizontal gene transfer[J]. Hereditas, 2003, 25(5) : 623–627. (in Chinese) 欧剑虹, 谢志雄, 陈向东, 等. 水平基因转移[J]. 遗传, 2003, 25(5) : 623–627. |
| [6] | Li ZJ, Li HQ, Diao XM. Methods for the identification of horizontal gene transfer (HGT) events and progress in related fields[J]. Hereditas, 2008, 30(9) : 1108–1114. (in Chinese) 李志江, 李海权, 刁现民. 基因水平转移的评判方法和转移方式研究进展[J]. 遗传, 2008, 30(9) : 1108–1114. |
| [7] | Gogarten JP, Townsend JP. Horizontal gene transfer, genome innovation and evolution[J]. Nature Reviews Microbiology, 2005, 3(9) : 679–687. DOI:10.1038/nrmicro1204 |
| [8] | Horiike T, Miyata D, Tateno Y, et al. Hgt-gen: a tool for generating a phylogenetic tree with horizontal gene transfer[J]. Bioinformation, 2011, 7(5) : 211–213. DOI:10.6026/bioinformation |
| [9] | Jeon JR, Murugesan K, Baldrian P, et al. Aerobic bacterial catabolism of persistent organic pollutants-potential impact of biotic and abiotic interaction[J]. Current Opinion in Biotechnology, 2016, 38 : 71–78. DOI:10.1016/j.copbio.2015.12.016 |
| [10] | Dennis JJ, Zylstra GJ. Complete sequence and genetic organization of pDTG1, the 83 kilobase naphthalene degradation plasmid from Pseudomonas putida strain ncib 9816-4[J]. Journal of Molecular Biology, 2004, 341(3) : 753–768. DOI:10.1016/j.jmb.2004.06.034 |
| [11] | Fortnagel P, Harms H, Wittich RM, et al. Metabolism of dibenzofuran by Pseudomonas sp. strain HH69 and the mixed culture HH27[J]. Applied and Environmental Microbiology, 1990, 56(4) : 1148–1156. |
| [12] | Resnick SM, Gibson DT. Regio-and stereospecific oxidation of fluorene, dibenzofuran, and dibenzothiophene by naphthalene dioxygenase from Pseudomonas sp. strain NCIB 9816-4[J]. Applied and Environmental Microbiology, 1996, 62(11) : 4073–4080. |
| [13] | Hong HB, Chang YS, Nam IH, et al. Biotransformation of 2, 7-dichloro-and 1, 2, 3, 4-tetrachlorodibenzo-p-dioxin by Sphingomonas wittichii RW1[J]. Applied and Environmental Microbiology, 2002, 68(5) : 2584–2588. DOI:10.1128/AEM.68.5.2584-2588.2002 |
| [14] | Keim T, Francke W, Schmidt S, et al. Catabolism of 2, 7-dichloro-and 2, 4, 8-trichlorodibenzofuran by Sphingomonas sp. strain RW1[J]. Journal of Industrial Microbiology and Biotechnology, 1999, 23(4/5) : 359–363. |
| [15] | Wilkes H, Wittich R, Timmis KN, et al. Degradation of chlorinated dibenzofurans and dibenzo-p-dioxins by Sphingomonas sp. strain RW1[J]. Applied and Environmental Microbiology, 1996, 62(2) : 367–371. |
| [16] | Aly HAH, Huu NB, Wray V, et al. Two angular dioxygenases contribute to the metabolic versatility of dibenzofuran-degrading Rhodococcus sp. strain HA01[J]. Applied and Environmental Microbiology, 2008, 74(12) : 3812–3822. DOI:10.1128/AEM.00226-08 |
| [17] | Shimizu S, Kobayashi H, Masai E, et al. Characterization of the 450-kb linear plasmid in a polychlorinated biphenyl degrader, Rhodococcus sp. strain RHA1[J]. Applied and Environmental Microbiology, 2001, 67(5) : 2021–2028. DOI:10.1128/AEM.67.5.2021-2028.2001 |
| [18] | Nojiri H, Kamakura M, Urata M, et al. Dioxin catabolic genes are dispersed on the Terrabacter sp. DBF63 genome[J]. Biochemical and Biophysical Research Communications, 2002, 296(2) : 233–240. DOI:10.1016/S0006-291X(02)00873-2 |
| [19] | Habe H, Ide K, Yotsumoto M, et al. Degradation characteristics of a dibenzofuran-degrader Terrabacter sp. strain DBF63 toward chlorinated dioxins in soil[J]. Chemosphere, 2002, 48(2) : 201–207. DOI:10.1016/S0045-6535(02)00064-4 |
| [20] | Miyakoshi M, Shintani M, Terabayashi T, et al. Transcriptome analysis of Pseudomonas putida KT2440 harboring the completely sequenced IncP-7 plasmid pCAR1[J]. Journal of Bacteriology, 2007, 189(19) : 6849–6860. DOI:10.1128/JB.00684-07 |
| [21] | Musovic S, Dechesne A, Sorensen J, et al. Novel assay to assess permissiveness of a soil microbial community toward receipt of mobile genetic elements[J]. Applied and Environmental Microbiology, 2010, 76(14) : 4813–4818. DOI:10.1128/AEM.02713-09 |
| [22] | Shintani M, Matsui K, Inoue JI, et al. Single-cell analyses revealed transfer ranges of IncP-1, IncP-7, and IncP-9 plasmids in a soil bacterial community[J]. Applied and Environmental Microbiology, 2014, 80(1) : 138–145. DOI:10.1128/AEM.02571-13 |
| [23] | Peng P, Yang HY, Jia RB, et al. Biodegradation of dioxin by a newly isolated Rhodococcus sp. with the involvement of self-transmissible plasmids[J]. Applied Microbiology and Biotechnology, 2013, 97(12) : 5585–5595. DOI:10.1007/s00253-012-4363-y |
| [24] | Iida T, Mukouzaka Y, Nakamura K, et al. Plasmid-borne genes code for an angular dioxygenase involved in dibenzofuran degradation by Terrabacter sp. strain YK3[J]. Applied and Environmental Microbiology, 2002, 68(6) : 3716–3723. |
| [25] | Sambrook J, Fritsch EF, Maniatis T. Molecular cloning: a laboratory manual[M].2nd Edition. Cold Spring Harbor, NY: Cold Spring Harbor Laboratory Press, 1989 . |
| [26] | Yang HY. Degradation of petroleum pollutants by Rhodococcus sp. strain p52[D]. Jinan: Master's thesis of Shandong University, 2014(in Chinese) 杨海燕. 一株红球菌(Rhodococcus sp. strain p52) 对石油污染物的降解研究[D]. 济南: 山东大学硕士学位论文, 2014 http://cdmd.cnki.com.cn/Article/CDMD-10422-1014313908.htm |
| [27] | Bradford MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 1976, 72(1/2) : 248–254. |
| [28] | Lane DJ. 16S/23S rRNA sequencing[A]//Strackebrandt E, Goodfellow M. Nucleic Acid Techniques in Bacterial Systematic[M]. New York: Wiley, 1991. |
 2017, Vol. 44
2017, Vol. 44




