扩展功能
文章信息
- 褚娇艳, 刘腾飞, 张汉虞, 邱乐泉
- CHU Jiao-yan, LIU Teng-fei, ZHANG Han-yu, QIU Le-quan
- 一株邻苯二甲酸二丁酯降解菌的筛选及其降解特性
- Screening and characterization of a dibutyl phthalate-degrading bacterium
- 微生物学通报, 2017, 44(7): 1555-1562
- Microbiology China, 2017, 44(7): 1555-1562
- DOI: 10.13344/j.microbiol.china.170127
-
文章历史
- 收稿日期: 2017-02-18
- 接受日期: 2017-04-18
- 优先数字出版日期(www.cnki.net): 2017-05-31
邻苯二甲酸酯类化合物(Phthalic acid esters,PAEs)是世界上广泛使用的人工合成难降解有机化合物,主要用于塑料增塑剂、涂料、油漆等化工生产中[1]。我国已将PAEs中的邻苯二甲酸-(2-乙基己基)酯(Dioctyl phthalate,DEHP)、邻苯二甲酸二丁酯(Dibutyl phthalate,DBP)、邻苯二甲酸二乙酯(Diethyl phthalate,DEP)和邻苯二甲酸二甲酯(dimethyl phthalate,DMP)列为环境优先污染物[2]。已有证据表明,PAEs是一类环境内分泌干扰物,其最明显的危害是使生殖机能下降,对动物及人类生殖系统有一定损害,可引起睾丸萎缩、精子减少、生殖细胞超微结构改变,且对胚胎发育有一定毒性作用[3]。目前,PAEs在全球主要工业国的生态环境中已达到了普遍检出的程度。PAEs在环境中的水解、光解的速率非常缓慢,属于难降解物质,微生物降解被认为是自然环境中PAEs完全矿化的主要过程[4]。DBP是PAEs中的重要成员,前人研究中已分离到多种微生物表现出降解DBP的能力,如Gordonia sp.[5]、Sphingomonsasp.[6]、Arthrobacter sp.[7]Rhodococcussp.[8]、Acinetobacter sp.[9]等。经典的邻苯二甲酸酯降解途径认为,不管在有氧还是无氧条件下,PAEs在相关酯酶作用下先水解为邻苯二甲酸单酯,再进一步水解为邻苯二甲酸(PA),在有氧环境下,邻苯二甲酸通过邻苯二甲酸双加氧酶催化生成二羟基邻苯二甲酸,再经过脱氢和脱羧最后形成原儿茶酸;原儿茶酸可通过正位或偏位开环形成相应的有机酸,进而转化成丙酮酸、琥珀酸、草酰乙酸等进入三羧酸循环,最终转化为CO2和H2O[4]。为了获得高效的邻苯二甲酸酯降解菌株,有效解决邻苯二甲酸酯类化合物的环境污染,本研究从杭州河道污水出口的淤泥中分离并鉴定了一株DBP降解能力较强的菌株Arthrobacter sp. ZJUTW,研究了其对DBP的降解特性、休止细胞降解能力,并对代谢途径进行了初步分析。
1 材料与方法 1.1 主要试剂和仪器DMP、DEP、DBP、DEHP均为分析纯,国药集团化学试剂有限公司;甲醇(色谱级),天津四友化工有限公司;其余试剂均为分析纯;细菌基因组DNA快速抽提试剂盒、SanPrep柱式PCR产物纯化试剂盒、pUCm-T载体,生工生物工程(上海)股份有限公司。JEM-1230型透射电镜,日本JEOL公司;Agilent 1260高效液相色谱仪、Agilent 6890N/5975c型GC-MS,美国Agilent公司。
1.2 培养基基础无机盐培养基(g/L):K2HPO4·3H2O 1.0,NaCl 1.0,(NH4)2SO40.5,MgSO4·7H2O 0.4,CaCl2 0.075 5,FeCl3 0.014 3,pH 7.0。
选择培养基:每升无机盐培养基加适量DBP的甲醇溶液,使DBP终浓度为125 mg/L。
LB培养基(g/L):胰蛋白胨10.0,酵母提取物5.0,NaCl 10.0,pH 7.0。
1.3 方法 1.3.1 DBP降解菌的筛选与鉴定:取杭州市河道污水出口处淤泥1 g置于100 mL水中,混匀,静置,然后取1 mL加入到250 mL选择培养基中,DBP初始浓度为125 mg/L,30℃、180 r/min培养4 d,重复多次驯化。将有明显生长的培养液稀释涂布培养,同时检测DBP降解情况,平板涂布法分离得到单菌落,挑取单菌落进行形态、生理生化分析。采用细菌基因组DNA快速抽提试剂盒提取菌株ZJUTW基因组,以通用引物27F (5′-AGAGTT TGATCCTGGCTCAG-3′)和1492R (5′-CTACGGCTA CCTTGTTACGA-3′)扩增16S rRNA基因序列[10]。50 μL PCR反应体系为:10×PCR buffer 5 μL,20 mmol/L dNTPs 4 μL,25 mmol/L引物各1.0 μL,菌体DNA 1 μL,5 U/μL Taq DNA聚合酶1μL,加ddH2O至50μL。PCR反应条件为:94℃ 5 min;94℃ 1 min,52℃ 1 min,72℃ 1 min,32个循环;72℃ 10 min。琼脂糖凝胶电泳检测扩增产物,采用SanPrep柱式PCR产物纯化试剂盒回收16S rRNA基因片段,然后克隆至pUCm-T载体,并由生工生物工程(上海)股份有限公司完成测序,用MEGA 4.0软件构建系统发育树。
1.3.2 不同培养条件对菌株降解DBP的影响:将筛选到的菌株接种到LB培养基,30℃、180 r/min培养12 h,4℃4 000 r/min离心收集细胞,用无机盐液体培养基重悬至菌液浓度OD600约为1.0,以此作为种子液,按2%的接种量,通过改变培养基初始pH、温度、DBP浓度等条件,考察各生长因素对菌株降解DBP的影响,并考察了该菌株的底物利用情况和对PAEs混合底物(DMP、DEP、DBP、DEHP各125 mg/L)的降解能力。
有机污染物的降解可采用模型进行降解动力学分析[11]。DBP的降解是微生物胞内酶作用完成的,属酶促反应,其反应过程应符合米氏方程:V=Vm[C]/(Km+[C]),方程中[C]表示底物浓度,V为反应速率,Km表示最大反应速度达一半时的底物浓度;当[C]≪Km时,为一级反应,方程可写为lnC=-Kt+A (C为初始DBP浓度,t为时间,K为反应速率常数,A为常数)。假设菌株对DBP的生物降解遵循一级反应动力学方程,将降解过程中DBP残留浓度的测定数据进行对数转换,用Origin 8.0软件拟合降解动力学方程,并计算DBP的半衰期t1/2=ln2/K。
1.3.3 休止细胞的制备及对DBP的降解:将菌株接种到LB培养基,30℃、180 r/min培养到对数末期,4℃4 000 r/min离心收集细胞,用无菌水洗一次,沉淀悬浮于pH 7.0的0.1 mol/L磷酸钾缓冲液中,制成菌悬液,使其菌体浓度至OD600为1.2。加入DBP至终浓度分别为125、250、400、800和1 200 mg/L,考察对休止细胞降解DBP的影响。
1.3.4 HPLC法检测PAEs:取经不同处理的培养液,加入等体积二氯甲烷,剧烈振荡后静置30 min,将水相再次用等体积二氯甲烷萃取,将两次萃取的有机相合并,旋转蒸发仪上蒸干后用1 mL甲醇溶解,以10 μL进样,用Agilent 1260 HPLC检测,检测条件为:流动相:90%甲醇+10% H2O,流速1.0 mL/min,Hypersil BDS C18色谱柱,二极管阵列(DAD)检测器,检测波长235 nm。
1.3.5 GC-MS测定降解产物:色谱条件:色谱柱为HP-5MS (30 m×250 mm×0.25 μm);载气为高纯度He,载气流速1.0 mL/min;进样口温度:250℃;柱温条件:初始温度60℃,保持1 min,以60℃/min升温至220℃,保持2 min,以5℃/min升温至250℃,保持2 min,再以5℃/min升温至280℃,保持3 min;进样量1 μL,不分流进样。质谱条件:电子轰击(EI)离子源;电离能量70 eV;离子源温度230℃;接口温度280℃;全扫描(SCAN)质量范围:40-400 m/z;选择离子扫描(SIM)。
1.3.6 数据分析:研究中各处理采用3次重复,用Origin 8.0软件进行误差线作图(均值±标准差),用SPSS 16.0进行统计分析。
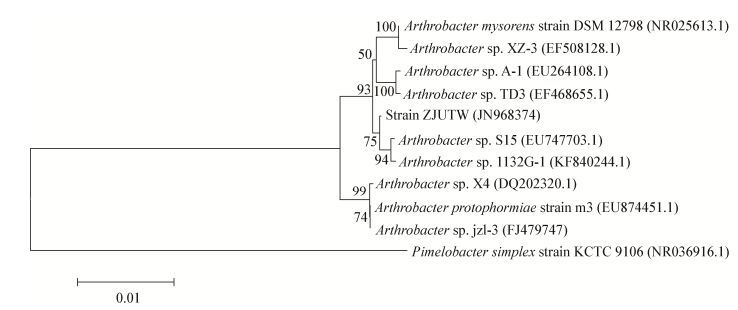
2 结果与分析 2.1 DBP降解菌的筛选与分离经过筛选后分离到一株DBP降解菌株ZJUTW,HPLC分析结果表明(图 1),培养12 h后,菌株已将125 mg/L DBP显著降解。在固体选择平板上形成的菌落呈圆形,凸起,湿润有光泽,乳白色,不透明。在透射电镜下(图 2)呈短杆状,无鞭毛。大小约(0.6-1.0) μm×0.35 μm。此外,菌株生长4 h多呈杆状,而生长24 h则多呈球状,说明菌株ZJUTW在生长过程中存在球、杆形态变化。对该菌株进行生理生化试验,结果表明明胶液化试验、淀粉水解试验、反硝化试验、柠檬酸盐试验、接触酶试验呈阳性;吲哚试验、甲基红试验、伏-普试验、葡萄糖发酵试验、木糖发酵试验结果呈阴性。PCR扩增16S rRNA基因(1 579 bp),Genbank中的序列登录号为JN968374,用MEGA 4.0构建系统发育树(图 3),该菌株与Arthrobacter sp. S15在同一个系统发育分支;结合形态、生理生化特征及16S rRNA基因序列分析,表明该菌株与Arthrobacter属分类特征相符,将其命名为Arthrobacter sp. ZJUTW。

|
| 图 1 菌株ZJUTW降解DBP的HPLC图 Figure 1 HPLC-chromatogram of the degradation of DBP by strain ZJUTW |
|
|

|
| 图 2 菌株ZJUTW的透射电镜图 Figure 2 Photograph of transmission electron microscope of strain ZJUTW |
|
|
|
| 图 3 Arthrobacter sp. ZJUTW的系统进化发育树 Figure 3 Phylogenetic tree of Arthrobacter sp. ZJUTW 注:采用邻接法计算距离,节点上的数值是自展值(%),括号中为菌株的登录号. Note: Distances were calculated using neighbor-joining method. The numbers at the branch nodes are bootstrap values (%). Accession numbers of the bacterial isolates are shown in brackets. |
|
|
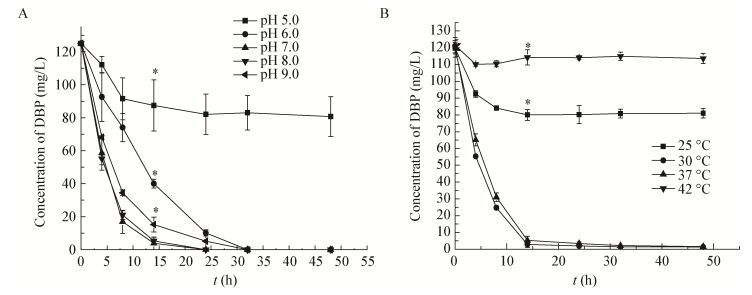
培养基初始pH分别设置为5.0、6.0、7.0、8.0、9.0,DBP浓度为125 mg/L,2%接种量的条件下,菌株ZJUTW对DBP的降解如图 4A所示。在初始pH为6.0-9.0时,DBP均被快速降解,其中pH 7.0-8.0的降解最优,在14 h将DBP基本完全降解,而当初始pH为5.0时,菌株ZJUTW只降解23.8%的DBP,说明最适pH为7.0-8.0。
|
| 图 4 初始pH (A)与温度(B)对菌株ZJUTW降解DBP的影响 Figure 4 Effect of pH (A) and temperature (B) on degradation of DBP by Arthrobacter sp. ZJUTW 注:误差线代表标准差,星号(*)代表显著性差异(p<0.05). Note: Error bars indicate standard deviation. Asterisks (*) indicate a significant difference between treatments (p < 0.05). |
|
|
在不同培养温度(25、30、37、42℃)、DBP初始质量浓度为125 mg/L,2%接种量的条件下,菌株ZJUTW对DBP的降解如图 4B所示。在30℃和37℃时,培养14 h菌株ZJUTW均基本完全降解DBP,其中以30℃最优,而在25℃只能降解36%,42℃的降解率则只有9.6%。
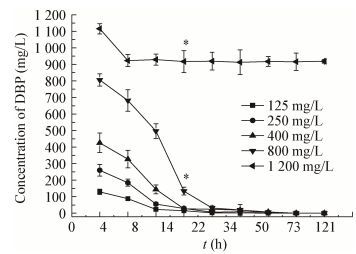
2.3 DBP浓度对菌株ZJUTW降解的影响不同底物浓度对菌株ZJUTW降解DBP的影响如图 5所示,菌株ZJUTW对初始浓度分别为125、250、400及800 mg/L的DBP 14 h的降解率分别为98.5%、93.1%、93.9%和83.4%。但是当DBP浓度升至1 200 mg/L时,菌株ZJUTW对其只能降解23.6%左右。DBP的微生物降解是酶促反应过程,菌株对DBP的降解在125-800 mg/L符合酶促一级反应动力学模型(表 1),遵循一级反应动力学方程:lnC=-Kt+A (C为初始DBP浓度,K为反应速率常数,A为常数),DBP浓度在800 mg/L,其半衰期也仅为10.47 h,说明该菌株对DBP有较高的降解能力,同时对DBP的耐受浓度也可达1 200 mg/L。
|
| 图 5 不同底物浓度对菌株降解DBP的影响 Figure 5 Effect of different initial DBP concentrations on degradation by Arthrobacter sp. ZJUTW 注:误差线代表标准差,星号(*)代表显著性差异(p<0.05). Note: Error bars indicate standard deviation. Asterisks (*) indicate a significant difference between treatments (p < 0.05). |
|
|
| 初始DBP 浓度Initial concentration (mg/L) |
Kinetic equations | t1/2(h) |
| 125 | lnC=-0.121 8t+4.604 5 | 5.69 |
| 250 | lnC=-0.111 9t+5.305 5 | 6.19 |
| 400 | lnC=-0.080 4t+5.919 2 | 8.62 |
| 800 | lnC=-0.066 2t+6.843 7 | 10.47 |
以不同底物为唯一碳源培养菌株ZJUTW,以考察其底物利用情况,结果表明:菌株ZJUTW能够在以DMP、DEP、DBP为唯一碳源的培养基上生长良好,在DEHP、PA及邻苯二酚为唯一碳源的培养基上可以生长,但是无法在以萘、噻吩、咔唑以及苯酚为唯一碳源的培养基上生长。以4种PAEs混合物为底物(DMP、DEP、DBP、DEHP各125 mg/L)、2%接种量、30℃、pH 7.0的条件下,菌株ZJUTW对PAEs混合物的降解如图 6A所示。在24 h内,菌株ZJUTW能够将DBP、DEP和DMP完全降解,其中以DBP最快,在12 h降解了96.2%,其次为DEP和DMP,而DEHP则降解效果最差,培养24 h后降解率只有25%;说明在混合底物中,DBP为最适底物,由于DEHP具有较长的碳链,降解也难度更大。

|
| 图 6 Arthrobacter sp. ZJUTW对PAEs混合物的降解(A)及其休止细胞对不同浓度DBP的降解(B) Figure 6 Degradation of mixed PAEs (A) by Arthrobacter sp. ZJUTW and different initial DBP concentrations (B) by resting cells 注:误差线代表标准差,星号(*)代表显著性差异(p<0.05). Note: Error bars indicate standard deviation. Asterisks (*) indicate a significant difference between treatments (p < 0.05). |
|
|
生长细胞受到外界化学或物理作用后会相应地发生变化,如基因表达、蛋白稳定性的变化等[9]。而采用休止细胞则可以避免这种影响,同时还具有反应专一性强,可以提高底物转化率,不易染杂菌,可减少产物对菌体生长及酶合成的抑制[10]等优点,因此利用休止细胞进行底物降解或转化有明显优势。在不同DBP浓度(125-1 200 mg/L)的磷酸缓冲液,加入菌株ZJUTW的休止细胞至OD600为1.2,30℃、180 r/min考察其对DBP的降解,结果如图 6B所示。休止细胞在8 h内可将125 mg/L和250 mg/L的DBP完全降解。随着DBP浓度的增加,DBP被完全降解的时间也延长,当初始DBP浓度为1 200 mg/L时,休止细胞也可在20 h将其完全降解。而生长细胞虽然可耐受1 200 mg/L的DBP,但降解率很低(23.6%),说明休止细胞的降解效果远优于生长细胞。
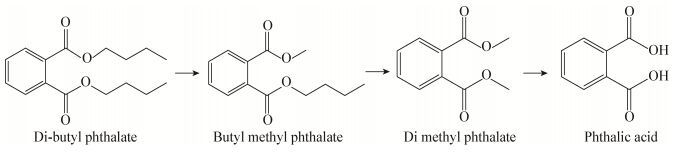
2.6 DBP降解中间产物分析采用GC-MS分析菌株ZJUTW降解DBP的中间产物,结果如图 7A、B所示。降解产物中出现邻苯二甲酸丁基甲酯(butyl methyl phthalate,BMP)、邻苯二甲酸二甲酯(Dimethyl phthalate,DMP)和邻苯二甲酸(phthalic acid,PA),推测当存在甲醇时,菌株先通过DBP酯酶催化酯交换反应,将甲醇的甲基转移置换出一个丁基形成不对称酯,然后再次转移甲基置换出另一个丁基形成DMP,其后再通过酯水解反应形成PA,因此其降解的起始步骤为:DBP→BMP→DMP→PA (图 8)。

|
| 图 7 邻苯二甲酸丁基甲酯(A)与邻苯二甲酸(B)质谱图 Figure 7 Mass spectrum of butyl methyl phthalate (A) and phthalic acid (B) |
|
|
|
| 图 8 DBP的降解途径 Figure 8 The degradation pathway of DBP by Arthrobacter sp. ZJUTW |
|
|
Arthrobacter是一类广泛存在于自然环境中的革兰氏阳性菌,已发现该属的微生物具备降解多种有机污染物的能力。目前也已发现多个菌属的微生物具备DBP降解能力,如Wang等分离到一株Arthrobacter sp. ZH2[7]降解500 mg/L DBP的t1/2为10.19 h;Jin等[5]分离到一株Gordonia sp. strain QH-11降解750 mg/L DBP的t1/2为17.51 h;而Rhodococcus sp. JDC-11[8]则表现出更强的降解能力,可在24 h内将1 000 mg/L的DBP完全降解。本研究筛选到的Arthrobactersp. ZJUTW生长细胞可完全降解800 mg/L的DBP,t1/2为10.47 h,且其休止细胞降解能力远优于生长细胞,可在20 h降解1 200 mg/L的DBP,表现出较强DBP降解能力,具有较好的研究价值。
细菌对PAEs的代谢途径已有较多的研究,PAEs代谢过程中酯键分解是起始降解的关键步骤。目前文献对该起始步骤主要涉及的有酯水解反应[12]、酯交换反应[13]以及β氧化反应[14]等方式。本研究根据GC-MS中间产物分析发现在以甲醇为溶剂时,Arthrobacter sp. ZJUTW可通过酯交换反应方式起始降解。目前对PAEs的微生物降解研究基本集中在酯水解方式上,但由于环境污染物中成分非常复杂,常有醇类污染物存在,极有可能同时存在多种起始降解方式,因此,通过对多种降解方式差异的比较,阐明PAEs的微生物代谢机理,将有助于更透彻地了解PAEs在环境中的行为。
4 结论从杭州市河道污水出口处淤泥中筛选到一株DBP降解菌,经初步鉴定并命名为Arthrobacter sp. ZJUTW,并考察了不同因子对该菌株降解DBP的影响。结果表明,该菌株降解DBP的最优pH为7.0-8.0,最适温度为30℃,在DBP浓度为800 mg/L时,t1/2为10.47 h,且可耐受1 200 mg/L的DBP;此外,该菌株的休止细胞表现出远优于生长细胞的降解能力,可在20 h将1 200 mg/L的DBP完全降解。采用GC-MS分析对菌株ZJUTW降解DBP的中间产物进行分析,发现降解产物中出现BMP、DMP和PA,表明该菌株采用酯交换方式起始DBP的降解,推测其降解的起始步骤为:DBP→BMP→DMP→PA。
| [1] | Staples CA, Peterson DR, Parkerton TF, et al. The environmental fate of phthalate esters: a literature review[J]. Chemosphere, 1997, 35(4) : 667–749. DOI:10.1016/S0045-6535(97)00195-1 |
| [2] | Hu XY, Zhang KR, Sun JH, et al. Study on contamination of phthalic acid esters in Chinese environment[J]. Chinese Journal of Health Laboratory Technology, 2003, 13(1) : 9–14. (in Chinese) 胡晓宇, 张克荣, 孙俊红, 等. 中国环境中邻苯二甲酸酯类化合物污染的研究[J]. 中国卫生检验杂志, 2003, 13(1) : 9–14. |
| [3] | Petersen JH, Breindahl T. Plasticizers in total diet samples, baby food and infant formulae[J]. Food Additives & Contaminants, 2000, 17(2) : 133–141. |
| [4] | Luo ZH, Huang XL, Ye DZ. Advances in research of biodegradation of environmental endocrine disruptors — phthalate esters[J]. Chinese Journal of Applied & Environmental Biology, 2008, 14(6) : 890–897. (in Chinese) 骆祝华, 黄翔玲, 叶德赞. 环境内分泌干扰物——邻苯二甲酸酯的生物降解研究进展[J]. 应用与环境生物学报, 2008, 14(6) : 890–897. |
| [5] | Jin DC, Bai ZH, Chang DD, et al. Biodegradation of di-n-butyl phthalate by an isolated Gordonia sp. strain QH-11: genetic identification and degradation kinetics[J]. Journal of Hazardous Materials, 2012, 221-222 : 80–85. DOI:10.1016/j.jhazmat.2012.04.010 |
| [6] | Whangsuk W, Sungkeeree P, Nakasiri M, et al. Two endocrine disrupting dibutyl phthalate degrading esterases and their compensatory gene expression in Sphingobium sp. SM42[J]. International Biodeterioration & Biodegradation, 2015, 99 : 45–54. |
| [7] | Wang YY, Miao B, Hou DM, et al. Biodegradation of di-n-butyl phthalate and expression of the 3, 4-phthalate dioxygenase gene in Arthrobacter sp. ZH2 strain[J]. Process Biochemistry, 2012, 47(6) : 936–940. DOI:10.1016/j.procbio.2012.02.027 |
| [8] | Jin DC, Liang RX, Dai QY, et al. Biodegradation of di-n-butyl phthalate by Rhodococcus sp. JDC-11 and molecular detection of 3, 4-phthalate dioxygenase gene[J]. Journal of Microbiology and Biotechnology, 2010, 20(10) : 1440–1445. DOI:10.4014/jmb |
| [9] | Wu J, Liao XW, Yu FB, et al. Cloning of a dibutyl phthalate hydrolase gene from Acinetobacter sp. strain M673 and functional analysis of its expression product in Escherichia coli[J]. Applied Microbiology and Biotechnology, 2013, 97(6) : 2483–2491. DOI:10.1007/s00253-012-4232-8 |
| [10] | Fang CR, Yao J, Zheng YG, et al. Dibutyl phthalate degradation by Enterobacter sp. T5 isolated from municipal solid waste in landfill bioreactor[J]. International Biodeterioration & Biodegradation, 2010, 64(6) : 442–446. |
| [11] | Zeng F, Cui KY, Li XD, et al. Biodegradation kinetics of phthalate esters by Pseudomonas fluoresences FS1[J]. Process Biochemistry, 2004, 39(9) : 1125–1129. DOI:10.1016/S0032-9592(03)00226-7 |
| [12] | Xu XR, Li HB, Gu JD. Metabolism and biochemical pathway of n-butyl benzyl phthalate by Pseudomonas fluorescens B-1 isolated from a mangrove sediment[J]. Ecotoxicology and Environmental Safety, 2007, 68(3) : 379–385. DOI:10.1016/j.ecoenv.2006.11.012 |
| [13] | Okamoto Y, Toda C, Ueda K, et al. Transesterification in the microbial degradation of phthalate esters[J]. Journal of Health Science, 2011, 57(3) : 293–299. DOI:10.1248/jhs.57.293 |
| [14] | Wu XL, Liang RX, Dai QY, et al. Complete degradation of di-n-octyl phthalate by biochemical cooperation between Gordonia sp. strain JDC-2 and Arthrobacter sp. strain JDC-32 isolated from activated sludge[J]. Journal of Hazardous Materials, 2010, 176(1/3) : 262–268. |
 2017, Vol. 44
2017, Vol. 44




