扩展功能
文章信息
- 孔冠楠, 许玫英, 宋达, 杨永刚
- KONG Guan-Nan, XU Mei-Ying, SONG Da, YANG Yong-Gang
- Mcc在脱色希瓦氏菌S12电极呼吸中的作用
- Role of Mcc in Shewanella decolorationis S12 electrode respiration
- 微生物学通报, 2017, 44(7): 1547-1554
- Microbiology China, 2017, 44(7): 1547-1554
- DOI: 10.13344/j.microbiol.china.170072
-
文章历史
- 收稿日期: 2017-01-25
- 接受日期: 2017-05-27
- 优先数字出版日期(www.cnki.net): 2017-06-06
2. 广东省微生物研究所 广东省菌种保藏与应用重点实验室 广东 广州 510070;
3. 省部共建华南应用微生物国家重点实验室 广东 广州 510070;
4. 广东省微生物应用新技术公共实验室 广东 广州 510070;
5. 中国科学院大学 北京 100049
2. Guangdong Institute of Microbiology, Guangdong Provincial Key Laboratory of Microbial Culture Collection, Guangzhou, Guangdong 510070, China;
3. State Key Laboratory of Applied Microbiology Southern China, Guangzhou, Guangdong 510070, China;
4. Guangdong Open Laboratory of Applied Microbiology, Guangzhou, Guangdong 510070, China);
5. University of Chinese Academy of Sciences, Beijing 100049, China
微生物的胞外电子传递(Extracellular electron transfer,EET)不仅是多种生物地球化学过程(如异化金属还原、有机物降解等)的重要驱动力,其在生物修复、金属防腐和生物电化学等技术的发展和应用中也发挥了重要作用。近年来,EET研究领域取得了多个重要的发现,如基于纳米导线的EET、微生物细胞间和种间的EET等,并成为微生物学、地球生物化学和生物物理学多个学科共同关注的热点[1-4],但研究者们对EET的分子机制了解还有待完善。
在近30年的EET研究中,希瓦氏菌(Shewanella)和地杆菌(Geobacter)一直是主要的模式微生物[5-6]。目前已知的EET过程可以分为直接和间接两种,前者基于细胞表面细胞色素c或纳米导线与胞外电子受体的直接接触,后者则借助可溶性电子介体从细胞表面携带电子到电子受体[1, 5]。相对于EET的胞外过程,EET的胞内过程(即电子如何从细胞内膜跨越周质空间传递至外膜)可能更为复杂。以S. oneidensis MR-1为例,较多的研究已表明CymA和MtrA分别是位于细胞内膜和外膜的EET关键蛋白,但二者的体积远小于周质空间的宽度(235Å),即二者之间需要其它氧化还原蛋白介导电子传递[7]。Fonseca等发现,周质空间的STC和FccA可分别与CymA和MtrA结合介导电子,但仍然存在物理空缺,而且STC和FccA的突变对S. oneidensis MR-1的EET过程影响较小[8-10]。由此可见,希瓦氏菌周质空间的电子传递的组分和途径尚需要进一步补充。
脱色希瓦氏菌(S. decolorationis) S12是本课题组从某印染废水厂活性污泥中分离到的菌株,具有较强的污染环境适应性和多种胞外电子受体还原功能,其全基因组已测序[11]。通过对该菌基因组中细胞色素c的基因序列分析,发现基因mcc编码一个位于周质空间的单血红素细胞色素c蛋白(GenBank登录号:ESE40622.1),该基因的功能尚未见报道。细胞色素c系统是希瓦氏菌EET过程的主要途径,因而推测mcc可能参与了S. decolorationis S12周质空间的电子传递。本研究主要通过基因突变和生理功能分析,对编码S. decolorationis S12周质空间单血红素细胞色素c的基因mcc在胞外电子传递中的作用进行了研究,进一步补充了希瓦氏菌EET的电子传递机制。
1 材料与方法 1.1 实验材料 1.1.1 菌种和质粒:菌种和质粒详见表 1,其中S. decolorationis S12是本实验室从某印染废水处理厂的活性污泥中分离纯化获得的一株希瓦氏菌新种。该菌株已保藏在中国典型培养物保藏中心(保藏号:CCTCC M203093) 和日本东京大学应用微生物研究所(保藏号:IAM 15094T)。自杀质粒pHGM01由浙江大学高海春教授提供,保存于本实验室。
EasyTaq DNA聚合酶和TransStart FastPfu DNA聚合酶及Ezup柱式基因组DNA抽提试剂盒,北京TransGen公司;凝胶DNA微量DNA回收试剂盒,上海Magen公司,LIVE/DEAD BacLight Staining Kit,Invitrogen公司;改良型BCA蛋白浓度测定试剂盒,生工生物工程(上海)股份有限公司。小型离心机,美国Eppendorf公司;电热鼓风干燥箱,重庆万达公司;Milli-Q超纯水装置,美国Millipore公司;梯度PCR仪,美国Bio-Rad公司;紫外可见-蛋白核酸分析仪、凝胶扫描仪、紫外/荧光成像仪,美国GE Healthcare公司;核酸浓缩仪,美国Labcon公司;快速低温离心机,Sigma公司;高压灭菌锅,日本TOMY Seiko公司。
1.1.3 培养基及培养条件:LB培养基(g/L):蛋白胨10.0,酵母提取物5.0,氯化钠5.0。固体培养基添加1.5 g/L琼脂粉。重组菌筛选硫酸庆大霉素Gm使用浓度50 mg/L,二氨基庚二酸DAP使用浓度50 mg/L,有氧培养在30 ℃、200 r/min条件下进行。12 000×g离心2 min收集在LB培养液中好氧生长的过夜培养物,用磷酸缓冲液(pH 7.4) 洗涤2次后重悬于磷酸缓冲液中制成菌悬液(OD600=1.0,细胞浓度约为108 CFU/mL),然后以2% (体积比)的接种量将菌悬液接种于后续厌氧培养体系中。
铁还原及苋菜红还原实验在100 mL血清瓶中进行。厌氧还原用乳酸基础培养基(LM,g/L):十二水合磷酸氢二钠17.1,磷酸氢二钾3.0,氯化钠0.5,氯化铵1.0,酵母粉0.5,作为电子供体的乳酸钠2.24,苋菜红(0.5 mmol/L)或柠檬酸铁(4 mmol/L)作为电子受体。接种后充入过滤除菌的氮气8 min后用胶垫铝盖封口,转移到厌氧工作站(Ruskinn C0105) 中30℃静置培养,设置3组重复。还原过程使用一次性注射器在超净台中定时取样分析。
电极呼吸实验在微生物燃料电池(Microbial fuel cells,MFC)中进行。玻璃质双室MFC的构建参照参考文献[15]的方法。阳极液为100 mL LM灭菌培养液,阴极液为100 mL磷酸盐缓冲液(含铁氰化钾电解液50 mmol/L)。阳极和阴极均为灭菌的2 cm×4 cm石墨板,使用钛丝连接并串联1 000Ω电阻构成外电路。接种后充入过滤除菌的氮气8 min后用胶垫螺盖封口,转移到30 ℃恒温静置培养,设置3组重复。使用数据采集器(Keithley 2700,Module 7702) 每隔10 min记录电阻两端电压。
1.1.4 突变株及回补株构建:基因敲除方法参考文献[13],简要步骤如下:(1) 设计引物(表 2):上游同源臂引物5O/5I,下游同源臂引物3O/3I (外侧引物5O和3O添加att克隆位点,内侧引物5I和3I添加Linker),验证引物LF/LR和SF/SR;(2) 构建敲除载体:采用PrimeSTAR Max DNA Polymerase扩增上下游同源臂,再进行融合PCR,将上下游同源臂连接到一起。在Gateway BP Clonase Ⅱ Enzyme Mix (Invitrogen)作用下,重组到pHGM01质粒中;(3) 转化:通过热激的方法将敲除载体导入E. coli WM3064感受态细胞中,采用LB+DAP+Gm平板进行筛选,并通过引物5O/3O进行PCR验证;(4) 接合:将转化成功的E. coli WM3064与S12在LB+DAP平板上共同培养过夜;(5) 单交换:将菌体洗下并涂布在LB+Gm的平板上,挑取单菌落转接至LB+Gm和无NaCl的LB+10%蔗糖平板上,选择能够在LB+Gm平板上生长,但在无NaCl的LB+10%蔗糖平板上前期不长的菌体,采用引物LF/SR和SF/LR进行PCR验证;(6) 双交换:将单交换成功的S12突变株在无NaCl的LB液体培养基中培养后,稀释涂布于无NaCl的LB+10%蔗糖平板上培养,挑取单菌落转接至LB+Gm和LB+10%蔗糖平板上,选择能够在LB+10%蔗糖平板上生长,但在LB+Gm平板上不长的菌体,采用引物LF/LR进行PCR验证,获得双交换成功的S12突变株。
| 引物名称 Primers |
序列 Sequences (5′→3′) |
| 5O | GGGGACAAGTTTGTACAAAAAAGCAGGCTACTTTATCTGTTCTGCTTCAG |
| 5I | GGTCCGGGTTCGCTATCTATGATATCCCCAATCTCAGTG |
| 3I | ATAGATAGCGAACCCGGACCTCATTGAGATCCCTTAGC |
| 3O | GGGGACCACTTTGTACAAGAAAGCTGGGTGCTATTACGAAATCTGGG |
| LF | CGTATGCAGGGTTGAGGT |
| SR | CCAAGGCTTATGGGATTT |
| SF | TACCAGAACGCCAATAAGA |
| LR | ACTGAACTCGCTCAAGGA |
| EcoR Ⅰ | CCGGAATTCAAGGGATCTCAATGAAAATG |
| BamH Ⅰ | CGCGGATCCTTGTCAGCAAGCAAACGG |
mcc基因回补株的构建方法如下:PCR扩增目的基因mcc,扩增的PCR产物进行试剂盒纯化回收,由限制性内切酶EcoRⅠ、BamHⅠ处理。用T4 DNA连接酶将mcc同pHG102连接(pHG102带有Shewanella arcA启动子),然后将连接产物转化E.coli WM3064,挑取单克隆进行PCR验证,挑取正确的克隆通过接合转移将质粒转入突变株,培养后进行菌落PCR验证。
1.2 分析方法突变株和野生株的好氧LB生长曲线使用全自动生长仪(Bioscreen C)记录,厌氧浮游细胞使用紫外-可见分光光度计分析600 nm波长处的光密度值(OD600)表示菌体浓度。铁还原测定使用邻菲罗啉法定量二价铁离子浓度。偶氮染料苋菜红还原使用紫外-可见分光光度计分析510 nm处的吸收值表示[15]。MFC电极表面生物膜在电极呼吸速率达到稳定期后取出,并使用无菌PBS缓冲液缓慢淋洗2遍以去除电极表面随机吸附的浮游细胞。使用手术刀切取清洗后生物膜电极的上、中、下不同部位各1 cm2,然后分别使用LIVE/DEAD BacLight Staining Kit避光染色(方法参照试剂盒说明书)。将染色后的电极生物膜在激光共聚焦显微镜下观察,生物膜三维结构使用Zeiss 2010软件的Z-Stack模式逐层扫描观察,并根据活性(绿色)和非活性(红色)像素个数计算生物膜细胞相对活性:相对活性=绿色像素数量/总(绿色+红色)像素数量[15]。将剩余生物膜电极在20 ml NaOH (0.2 mol/L)溶液中煮沸10 min,使生物膜细胞裂解(显微镜检查细胞裂解情况)。取出电极,使用改良型BCA蛋白浓度测定试剂盒测定生物膜细胞裂解液中的蛋白量以表征生物膜生物量。根据溶液中的蛋白总量(即生物膜蛋白总量)及电极样品表面积,计算单位电极面积上的生物膜蛋白密度[15]。
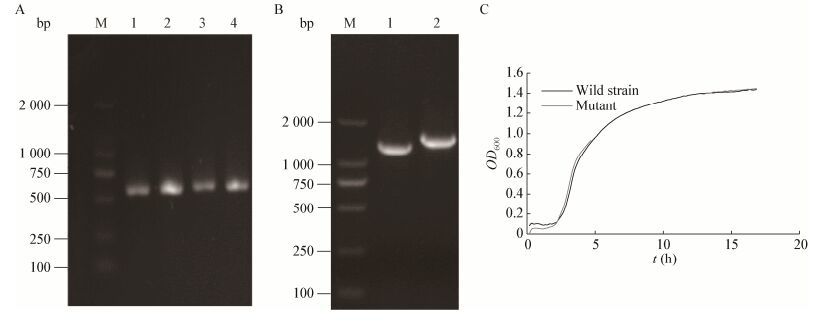
2 结果与分析 2.1 Mcc突变株的构建及其好氧生长特性根据目标基因mcc的序列,使用同源臂引物扩增目的基因上下游片段(图 1A),之后将上下游片段融合并转入大肠杆菌。经两次同源重组后对蔗糖耐受且无Gm抗性的菌落进行PCR验证,目标菌落PCR产物比野生株缺失约330 bp,经测序鉴定确认成功构建mcc突变株(图 1B)。
|
| 图 1 突变株的构建及其在有氧条件下生长特性 Figure 1 PCR identification of mcc-mutant and its growth in aerobic LB 注:A:mcc同源臂引物的扩增的上下游片段;M:DNA marker;1、2、3、4:引物5O/5I和3O/3I的扩增产物. B:同源重组后突变株的PCR验证;M:DNA marker;1、2:突变株、野生株的扩增产物. C:野生株及突变株有氧生长曲线. Note: A: PCR products of the mcc flank segments; M: DNA marker; 1, 2, 3, 4: PCR products by primers 5O/5I and 3O/3I. B: PCR confirmation of mcc knock-out; M: DNA marker; 1: Mutant strain; 2: Wild strain. C: Aerobic growth of the planktonic mutant and wild strains. |
|
|
突变株构建成功后,首先对其在常规有氧LB培养条件下的基本生长特性进行分析。结果发现,突变株与野生株的浮游细胞均在27 h左右OD600稳定在1.3±0.3,进入平台期,生长状况无显著差异(图 1C),表明在有氧丰富培养基条件下,Mcc缺失并不影响S12浮游细胞的正常生长。
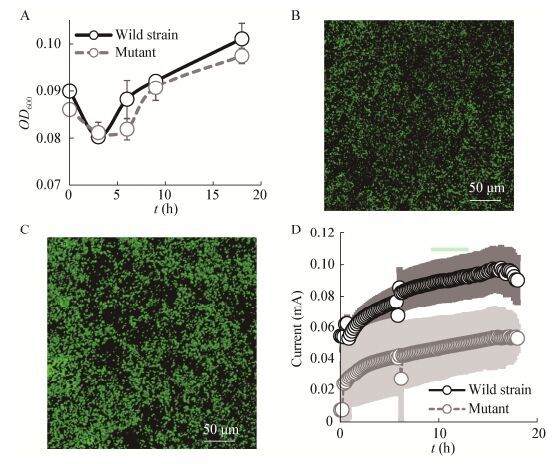
2.2 Mcc突变对S12电极呼吸的影响以MFC技术为代表的微生物电化学系统为研究微生物的生物电化学过程提供了新途径。在本研究的MFC体系中,野生株和突变株的浮游细胞浓度接种后的变化趋势无显著差别(图 2A),在6 h内略有下降,之后持续上升,在18 h后OD600达到0.1±0.005。mcc基因回补株的结果也显示其浮游细胞与野生株无显著差异。
|
| 图 2 突变株和野生株的电极呼吸比较 Figure 2 Comparison of the electrode respiration and growth by mcc-mutant and wild strain 注:A:浮游细胞生长情况;B:突变株的生物膜形态;C:野生株的生物膜形态;D:野生株和突变株的产电情况,灰色背景区域为标准偏差,6 h处的电流波动是由取样造成. Note: A: Planktonic growth; B: mcc-mutant biofilm; C: Wild S12 biofilm; D: Electricity generation by the mutant and wild strain, the gray areas along each electricity curve indicate standard deviations and the current fluctuation at 6 h was caused by sampling. |
|
|
S. decolorationis S12在电极表面形成的生物膜在MFC产电中起到主要作用。对电极表面生物膜蛋白量进行分析显示,突变株的生物膜生物量较野生株减少了23.1% (0.052vs. 0.064 μg/cm2),即突变株的生物膜形成能力显著弱于野生株。mcc基因回补株的生物膜生物量与野生株无显著差异。LSM观察结果与生物量分析一致,突变株和野生株在电极表面形成不均匀的细胞簇,但野生株电极表面的生物膜细胞更为密集,覆盖率也更高。此外,基于细胞膜破损度的生物膜活性染色结果显示,野生株和突变株的生物膜细胞均保持完整的细胞膜(完整细胞为绿色,破损细胞为红色),相对活性均大于90% (图 2B、C)。
MFC的电流输出显示(图 2D),野生株在18 h内产电逐渐上升,达到0.097 mA,而后开始下降,mcc基因回补株的生物膜生物量与野生株无显著差异。突变株从初始就表现出较低的电流,18 h后也基本趋于稳定,最大电流为0.054 mA,比野生株低近44.3%,表明Mcc参与了S. decolorationis S12的电极呼吸过程。由于突变株和野生株浮游细胞浓度无显著差别,且S. decolorationis S12主要通过生物膜产电,所以对单位生物膜生物量的最大产电活性进行进一步的分析,结果显示野生株的产电活性为93.2 μA/μg生物膜蛋白,突变株的产电活性较野生株下降了34.1% (61.4 μA/μg生物膜蛋白)。
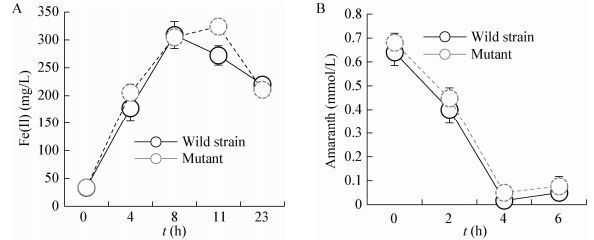
2.3 Mcc突变对S12厌氧铁还原和偶氮还原的影响为进一步研究Mcc是否参与S. decolorationis S12的其它EET过程,比较了野生株和突变株对柠檬酸铁和苋菜红(强极性胞外还原偶氮染料)的还原过程。结果显示,野生株和突变株对柠檬酸铁和偶氮染料的还原速率没有显著差异(图 3),即该基因不参与铁还原和胞外偶氮还原的EET过程。由此可见,Mcc特异性地参与电极呼吸过程,而在铁还原和胞外偶氮还原过程中无显著作用。
|
| 图 3 突变株和野生株的三价铁(A)和胞外偶氮(苋菜红B)还原能力比较 Figure 3 Comparison of the iron and azo dye amaranth reduction by mcc-mutant and wild strains |
|
|
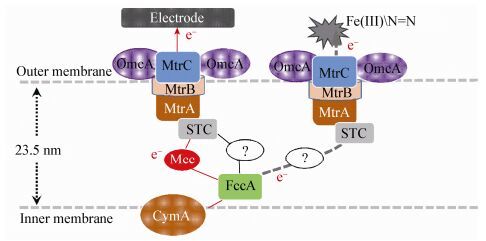
微生物EET过程在金属元素和有机物的生物地球化学循环中发挥着重要作用。希瓦氏菌是微生物EET研究最常用的模式微生物之一,在各种自然环境和工业过程中都普遍存在。因而,希瓦氏菌的EET机制研究一直是微生物学研究的热点之一。CymA-MtrABC-OmcA系统是希瓦氏菌EET的经典模式[5-6](图 4),但电子如何从细胞内膜的CymA传递到外膜的MtrA目前研究较少。
|
| 图 4 脱色希瓦氏菌电极呼吸电子传递途径推测模型 Figure 4 A predicted model of S. decolorationis EET process 注:电极呼吸过程中,CymA将细胞内底物氧化电子依次传递给FccA、Mcc和STC之后传递给外膜MtrABC系统.红色途径为基于Mcc的电极呼吸途径,黑色为不经过Mcc的电极呼吸途径,灰色虚线为脱色希瓦氏菌还原其它胞外电子受体的途径. Note: For electrode respiration, CymA delivers electrons generated from substrate oxidization to FccA, Mcc, STC and then to the MtrABC system. The red line represents a Mcc-participated pathway; The black line represents a non-Mcc-participated pathway. The dashed gray line represent the electron pathway to extracellular acceptors other than electrode. |
|
|
本研究关注的Mcc序列预测为一个位于周质空间功能未知的单血红素细胞色素c,无跨膜区。Mcc的缺失对该菌的有氧生长没有显著影响,这与希瓦氏菌其它细胞色素c的突变株一致[16]。Fonseca等通过NMR分析预测周质空间的FccA和STC分别与CymA和MtrA结合,但FccA和STC之间不能结合,因而推测二者之间存在一个或多个氧化还原蛋白介导电子[8]。本研究的结果证明Mcc是电极呼吸过程中周质空间的重要电子传递蛋白之一。Mcc可能直接与CymA或MtrA发生电子传递,也可能与FccA和STC形成复合体介导CymA或MtrA之间的电子传递。值得注意的是,Mcc突变株的电极呼吸活性比野生株降低了34.1%,表明在该过程中Mcc只参与了部分的电子传递,更多的电子经由周质空间的其他组分完成(图 4)。针对上述推测和尚待解决的问题,我们将结合基因敲除、蛋白纯化及大分子相互作用分析等技术进一步完善希瓦氏菌周质空间的电子传递机制。
另外,本研究结果显示S. decolorationis S12的Mcc是一个电极呼吸特异性的细胞色素c,在铁还原和极性偶氮染料还原过程中并无显著作用。这与之前报道的G. sulfurreducens的外膜细胞色素OmcZ一样,OmcZ也是只参与G. sulfurreducens的电极还原过程而不参与其金属还原[17]。实际上,已有较多的报道表明具有EET能力的细菌甚至古菌可以根据电子受体的特性(可溶性、氧化还原电位、还原位置等)而选择不同的电子传递途径和组分。例如:Shewanella的OmcA、Geobacter的OmcS、OmcE和OmpB只参与固态铁的还原,对可溶性铁还原没有显著作用[15];极端嗜热古菌Ferroglobus placidus在还原可溶性和固态铁氧化物时会表达和利用不同的细胞色素c[18]。本课题组最近的研究也显示,电子受体特性的不同会对EET功能细菌的转录组和代谢途径产生全局性的影响[19]。但是,微生物是如何感应胞外电子受体的物理化学特性并调控基因表达和呼吸代谢途径的,目前尚不清楚。
综上所述,本研究初步证实了S. decolorationis S12的c型周质空间细胞色素Mcc在电极呼吸EET中的作用,为全面认识微生物EET机制提供了必要信息。Mcc在周质空间的具体作用机理、是否与其它蛋白形成复合体及其分子结构等尚需要进一步的研究。
| [1] | Lovley DR. Live wires: direct extracellular electron exchange for bioenergy and the bioremediation of energy-related contamination[J]. Energy & Environmental Science, 2011, 4(12) : 4896–4906. |
| [2] | Summers ZM, Fogarty HE, Leang C, et al. Direct exchange of electrons within aggregates of an evolved syntrophic coculture of anaerobic bacteria[J]. Science, 2010, 330(6009) : 1413–1415. DOI:10.1126/science.1196526 |
| [3] | McGlynn SE, Chadwick GL, Kempes CP, et al. Single cell activity reveals direct electron transfer in methanotrophic consortia[J]. Nature, 2015, 526(7574) : 531–535. DOI:10.1038/nature15512 |
| [4] | Wegener G, Krukenberg V, Riedel D, et al. Intercellular wiring enables electron transfer between methanotrophic archaea and bacteria[J]. Nature, 2015, 526(7574) : 587–590. DOI:10.1038/nature15733 |
| [5] | Yang YG, Xu MY, Guo J, et al. Bacterial extracellular electron transfer in bioelectrochemical systems[J]. Process Biochemistry, 2012, 47(12) : 1707–1714. DOI:10.1016/j.procbio.2012.07.032 |
| [6] | Xiao X, Wu YM, Xu CC, et al. Anaerobic respiratory capabilities of a metal-reducing microorganism Shewanella and its application in environmental remediation[J]. Microbiology China, 2012, 39(11) : 1677–1686. (in Chinese) 肖翔, 吴勇民, 徐灿灿, 等. 金属还原菌希瓦氏菌厌氧呼吸能力及其在环境修复中的研究进展[J]. 微生物学通报, 2012, 39(11) : 1677–1686. |
| [7] | Dohnalkova AC, Marshall MJ, Arey BW, et al. Imaging hydrated microbial extracellular polymers: comparative analysis by electron microscopy[J]. Applied and Environmental Microbiology, 2011, 77(4) : 1254–1262. DOI:10.1128/AEM.02001-10 |
| [8] | Fonseca BM, Paquete CM, Neto SE, et al. Mind the gap: cytochrome interactions reveal electron pathways across the periplasm of Shewanella oneidensis MR-1[J]. Biochemical Journal, 2013, 451(1) : 101–108. DOI:10.1042/BJ20121637 |
| [9] | Coursolle D, Gralnick JA. Modularity of the Mtr respiratory pathway of Shewanella oneidensis strain MR-1[J]. Molecular Microbiology, 2010, 77(4) : 995–1008. |
| [10] | Gordon EH, Pike AD, Hill AE, et al. Identification and characterization of a novel cytochrome c from Shewanella frigidimarina that is involved in Fe(Ⅲ) respiration[J]. Biochemical Journal, 2000, 34(1) : 153–158. |
| [11] | Xu MY, Fang Y, Liu J, et al. Draft genome sequence of Shewanella decolorationis S12, a dye-degrading bacterium isolated from a wastewater treatment plant[J]. Genome Announcements, 2013, 1(6) : e00993–13. |
| [12] | House BL, Mortimer MW, Kahn ML. New recombination methods for Sinorhizobium meliloti genetics[J]. Applied and Environmental Microbiology, 2004, 70(5) : 2806–2815. DOI:10.1128/AEM.70.5.2806-2815.2004 |
| [13] | Chen XJ, Sun GP, Xu MY. Role of iron in azoreduction by resting cells of Shewanella decolorationis S12[J]. Journal of Applied Microbiology, 2011, 110(2) : 580–586. DOI:10.1111/jam.2011.110.issue-2 |
| [14] | Wu L, Wang JX, Tang P, et al. Genetic and molecular characterization of flagellar assembly in Shewanella oneidensis[J]. PLoS One, 2011, 6(6) : e21479. DOI:10.1371/journal.pone.0021479 |
| [15] | Yang YY, Xiang YB, Sun GP, et al. Electron acceptor-dependent respiratory and physiological stratifications in biofilms[J]. Environmental Science and Technology, 2015, 49(1) : 196–202. DOI:10.1021/es504546g |
| [16] | Carpentier W, de Smet L, van Beeumen J, et al. Respiration and growth of Shewanella oneidensis MR-1 using vanadate as the sole electron acceptor[J]. Journal of Bacteriology, 2005, 187(10) : 3293–3301. DOI:10.1128/JB.187.10.3293-3301.2005 |
| [17] | Richter K, Schicklberger M, Gescher J. Dissimilatory reduction of extracellular electron acceptors in anaerobic respiration[J]. Applied and Environmental Microbiology, 2012, 78(4) : 913–921. DOI:10.1128/AEM.06803-11 |
| [18] | Smith JA, Aklujkar M, Risso C, et al. Mechanisms involved in Fe(Ⅲ) respiration by the hyperthermophilic archaeon Ferroglobus placidus[J]. Applied and Environmental Microbiology, 2015, 81(8) : 2735–2744. DOI:10.1128/AEM.04038-14 |
| [19] | Lian YL, Yang YG, Guo J, et al. Electron acceptor redox potential globally regulates transcriptomic profiling in Shewanella decolorationis S12[J]. Scientific Reports, 2016, 6 : 31143. DOI:10.1038/srep31143 |
 2017, Vol. 44
2017, Vol. 44




