扩展功能
文章信息
- 朱杰, 阮志勇, 董卫卫, 郭翔, 孔德龙, 张琪, 赵述淼, 张伟
- ZHU Jie, RUAN Zhi-Yong, DONG Wei-Wei, GUO Xiang, KONG De-Long, ZHANG Qi, ZHAO Shu-Miao, ZHANG Wei
- 一株高效烷烃降解菌Acinetobacter sp. LAM1007的分离鉴定及降解特性
- Isolation, identification and degradation characterization of an alkane-degrading Acinetobacter sp. LAM1007
- 微生物学通报, 2017, 44(7): 1535-1546
- Microbiology China, 2017, 44(7): 1535-1546
- DOI: 10.13344/j.microbiol.china.170012
-
文章历史
- 收稿日期: 2017-01-05
- 接受日期: 2017-04-12
- 优先数字出版日期(www.cnki.net): 2017-05-09
2. 中国农业科学院农业资源与农业区划研究所 农业部农业微生物资源收集与保藏重点实验室 北京 100081;
3. 新疆生产建设兵团塔里木盆地生物资源保护利用重点实验室 新疆 阿拉尔 843300;
4. 华中农业大学生命科学技术学院 农业微生物学国家重点实验室 湖北 武汉 430070
2. Key Laboratory of Microbial Resources Collection and Preservation, Ministry of Agriculture, Institute of Agricultural Resources and Regional Planning, CAAS, Beijing 100081, China;
3. Key Laboratory of Protection and Utilization of Biological Resources, Production & Construction Corps, Alaer, Xinjiang 843300, China;
4. State Key Laboratory of Agricultural Microbiology and College of Life Science and Technology, Huazhong Agricultural University, Wuhan, Hubei 430070, China
随着经济的快速发展,石油已成为日趋需求的主要能源物质。然而石油在勘探、开采、提炼、运输过程中漏油事件频发,造成的环境污染已经威胁到人类健康和其它生物的生存和发展,对海洋、陆地生态系统的平衡也造成了严重迫害[1-2]。烷烃是石油中的主要成分,含量可达50%-95%[3],是主要的石油污染物[4],其中链烷烃(C10-C20)毒性更大[3]。自然界中能够利用饱和烷烃的微生物广泛存在[5],较传统石油污染的物理、化学治理方法,生物修复法具有环保、低成本、高效等特点。利用微生物修复石油污染的方法已经广受关注,并取得一定成效[6-11]。目前已经分离到的石油烃降解菌主要有假单胞菌属(Pseudomonas)[12-13]、不动杆菌属(Acinetobacter)[14-16]、戈登氏菌属(Gordonia)[17-18]、芽孢杆菌属(Bacillus)[19-20]、迪茨氏菌属(Dietzia)[21]和红球菌属(Rhodococcus)[22]等。然而,石油烃类物质属于难降解性物质,一般需要较长时间才能被降解,且大多数已公开报道的石油烃降解菌可降解的烷烃浓度较低,在实际应用中容易受限,所以高效烃类降解菌株的筛选仍然是微生物修复技术的关键。作为最常见的烷烃降解菌,不动杆菌是陆地环境两大主要降解菌之一[23],且众多研究表明不动杆菌在石油降解过程中起着重要的作用[24-26],其产生的表面活性剂促进石油烃乳化,进而有助于石油烃的降解[27-28],因此筛选出该属的高效烷烃降解菌应用于石油烃修复工程仍具有重要意义[29]。
在原油中,中链饱和烷烃正十六烷(C16H34)是其脂肪烃类物质中具有代表性的模式化合物,它也是柴油、矿物油等的主要组成部分,已在许多研究中被选择作为模式污染物[30-31]。目前在正十六烷降解相关的众多研究中尚未见各类菌株耐受浓度高达2.0% (体积比)的报道,多数高效降解菌的实验浓度仅到1.0%[19, 31],而本实验中筛选到的这株高效烷烃降解菌LAM1007可良好生长于2.0% (体积比)的正十六烷无机盐培养基中。因此,本研究以菌株LAM1007为研究对象,通过形态特征、生理生化试验、细胞化学组分及16S rRNA基因序列分析,初步鉴定其为不动杆菌属(Acinetobacter),并进一步展开了其对正十六烷降解特性的研究以及对柴油、液体石蜡降解能力的初步评估。
1 材料与方法 1.1 主要试剂和仪器及培养基正十六烷(99.55%)购于德国Halterman公司;色谱级正己烷(95%)购于Duksan公司;柴油(0#)购于中国石油化工集团公司;液体石蜡(比重范围0.835-0.855) 购于北京益利精细化学品有限公司;细菌基因组提取试剂盒购于北京天根生化科技有限公司;2×Taq PCR Master Mix购于北京博迈德基因技术有限公司。光学显微镜(80i),日本Nikon公司;透射电子显微镜(7500),日本Hitachi公司。
培养基TSB (Tryptic soy broth)和TSA (Tryptic soy agar)购自美国BD公司。无机盐培养基(g/L):KH2PO4 0.5,Na2HPO4·12H2O 1.0,NH4Cl 1.1,MgSO4·7H2O 0.2,微量元素液2 mL,pH 7.3,1×105 Pa灭菌20 min后使用。微量元素液(g/L):EDTA 0.500,ZnSO4·7H2O 0.220,CaCl2 0.005,MnCl·4H2O 0.051,FeSO4·7H2O 0.019 9,(NH4)6Mo2O24·4H2O 0.011,CuSO4·5H2O 0.015 7,CoCl2·6H2O 0.016 1,pH 6.0,1×105 Pa灭菌20 min后使用。
1.2 烷烃降解菌的分离筛选土样为长期受石油污染的大庆油田土壤,在以正十六烷为唯一碳源的无机盐液体培养基中进行富集培养。具体操作如下:将1 g污染土样加入至100 mL的正十六烷无机盐培养基中,30℃、180 r/min振荡培养3 d后,取1 mL进行转接,连续转接4次后取1 mL富集液,经稀释为不同浓度梯度(10-1、10-2、10-3、10-4、10-5和10-6)后,取100 µL稀释液涂布于浓度为0.3% (体积比)的正十六烷无机盐固体平板上,每个梯度3个平行。经恒温30 ℃倒置培养3 d,将平板上生长的菌落根据其不同的形态进行分离纯化,最终将获得的13株纯培养物进行编号并接种于浓度为0.3% (体积比)的正十六烷无机盐液体培养基中,同时设置空白对照(不接菌),30 ℃、180 r/min培养3 d,在此期间观察菌体生长量及浮在培养基表层的正十六烷变化情况。最终筛选到一株长势及降解能力均明显优于其他的菌株并编号为LAM1007,保藏于中国农业微生物菌种保藏管理中心(保藏编号ACCC 19899) 和日本理化研究所生物资源中心(保藏编号JCM 31429)。
1.3 菌株多相分类的鉴定 1.3.1 菌株的形态观察、生理生化试验及细胞化学组分分析:通过光学显微镜和透射电子显微镜对菌株形态进行观察。革兰氏染色、淀粉水解、吐温-20、吐温-40、甲基红、接触酶、氧化酶等的试验主要参照《常见的细菌鉴定手册》,其他生理生化试验及细胞化学组分中脂肪酸与极性脂的分析主要参照Ruan等[32]描述的方法。
1.3.2 16S rRNA基因的扩增及系统发育进化树的构建:通过细菌基因组提取试剂盒(Bacterial DNA kit)提取菌株LAM1007的基因组DNA,以细菌通用引物27F (5′-AGAGTTTGATCCTGGCTCAG-3′)与1492R (5′-GGTTACCTTGTTACGACTT-3′)扩增其16S rRNA基因。PCR反应体系(25 µL):基因组模板2.0 μL,上下游引物(10 μmol/L)各0.5 μL,2×Taq PCR Master Mix 12.5 μL,ddH2O 9.5 μL。PCR扩增条件:95 ℃ 5 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 40 s,30个循环;72 ℃ 5 min。将PCR产物送北京美吉桑格生物医药科技有限公司进行测序。将获得的16S rRNA基因序列于EzTaxon-e数据库中进行相似度比对,最终通过软件MEGA 6.0与ClustalW 1.8进行多重序列比对分析并利用Neighbor-Joining法进行系统发育树的构建。
1.4 正十六烷的降解特性以及柴油、液体石蜡降解能力的初步评估将菌株LAM1007在TSB培养基中培养48 h至对数期后期,8 000 r/min离心菌体,无菌水漂洗两遍并稀释OD600至0.8。以1%的接种量研究了不同温度(25、30、35、40和45℃)、pH (5.0、6.0、7.0、8.0和9.0)、转速(120、150、180和210 r/min)、60 h内对浓度为0.3% (体积比)的正十六烷降解效率的影响。同时分析了不同接种量(0.5%、1%、2%、4%、6%和8%,体积比)与不同初始浓度的正十六烷(0.1%、0.3%、0.5%、1.0%、1.5%和2.0%)对菌株降解能力的影响;研究了在0.3% (体积比)的条件下,菌体生长量与正十六烷残量随时间变化的情况,以未加菌的正十六烷培养基作为空白对照样品。实验中也进一步研究了菌株对2.0% (体积比)柴油及0.3% (体积比)液体石蜡降解能力的初步评估,并分别以未加菌的柴油与液体石蜡培养基作为空白对照样品。
1.5 正十六烷、柴油及液体石蜡的萃取与测定方法烷烃的萃取主要参考Wang等[21]描述的方法,详细步骤为:将30 mL正己烷萃取液加入到100 mL正十六烷液体无机盐培养基中,轻轻振荡混匀以充分溶解上层表面的烷烃相,静置3 min,吸取上层有机相,重复萃取两次,合并萃取液,经无水硫酸钠干燥后定容于100 mL容量瓶。取1 mL萃取液经过0.22µm滤膜除杂,进行GC-MS的测定。气相色谱质谱联用仪为岛津GCMS-QP2010 Plus,色谱柱为HP-1ms (30 m×0.32 mm,0.25 µm),载气:He。色谱条件:80 ℃保持5 min,3℃/min升至165 ℃保持2 min,5 ℃/min升至270 ℃保持10 min。进样口、检测器250 ℃和280 ℃,进样0.5 µL。正十六烷降解率的测定及计算方法主要参照陈小蓉等[18]。柴油与液体石蜡的萃取方法同上,将合并液定容于50 mL容量瓶,经氮气吹干浓缩至4 mL,取1 mL过滤除杂后进行GC-MS测定。气相色谱质谱仪为Agilent 6890GC-5975iMS,色谱柱HP-5ms (60 m×250 μm×0.25 μm),载气:He。色谱条件:50 ℃保持1 min,20 ℃/min升至120 ℃,3 ℃/min升至310 ℃保持25 min,进样1 µL。柴油与石蜡样品中各烃相对百分含量的计算方法以及样品处理前后各烃含量变化的显著情况主要参照何华等[33]描述的方法。
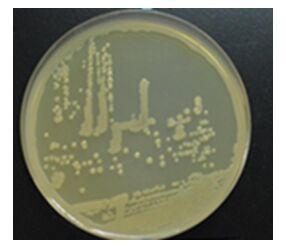
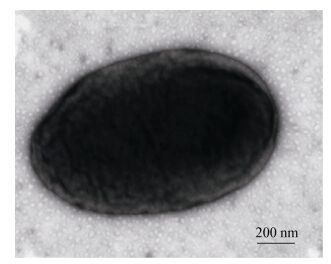
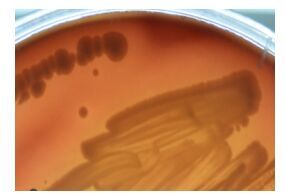
2 结果与分析 2.1 菌株LAM1007的鉴定菌株LAM1007在TSA平板于30 ℃培养48 h后的菌落形态为:淡黄色,圆形,中间凸起,表面湿润光滑,边缘整齐,直径0.5 mm-4.0 mm (图 1)。革兰氏染色为阴性,严格好氧,菌体形态为球杆状(0.7-2.0) µm×(0.5-0.8) µm (图 2)。生长条件:温度为6-45℃,pH为5.0-11.0以及NaCl为0-3% (质量体积比)。溶血反应呈阳性(5%羊血琼脂平板),菌落周围见明显透明圈(图 3)。该菌能够利用柠檬酸、精氨酸、2, 3-丁二醇、吐温-20、吐温-40、吐温-80等底物,其他部分生理生化试验结果见表 1。
|
| 图 1 菌株LAM1007菌落形态 Figure 1 Colony morphology of strain LAM1007 |
|
|
|
| 图 2 菌株LAM1007电镜扫描照 Figure 2 Electron micrograph of strain LAM1007 |
|
|
|
| 图 3 菌株LAM1007的溶血反应 Figure 3 Hemolytic reaction of strain LAM1007 |
|
|
| 生理生化特征 Characteristics |
结果 Result |
| D-棉籽糖 D-Raffinose |
+ |
| D-海藻糖 D-Trehalose |
+ |
| 乙酸 Acetic acid |
+ |
| D-半乳糖酸内脂 D-Galactonic acid lactone |
+ |
| 琥珀酸 Succinic acid |
+ |
| 乙酰甲基甲醇试验 Voges-Proskauer test |
+ |
| β-半乳糖苷酶 β-Galactosidase |
+ |
| 淀粉水解 Starch hydrolysis |
- |
| D-葡萄糖 D-Glucose |
- |
| D-葡萄糖酸 D-Gluconic acid |
- |
| D-半乳糖醛酸 D-Galacturonic acid |
- |
| D-氨基葡萄糖酸 D-Glucosaminic acid |
- |
| 硝酸盐还原反应 Nitrate reduction |
- |
| 明胶水解 Gelatin hydrolase |
- |
| 吲哚反应 Indole production |
- |
| 甲基红 Methyl red |
- |
| 衣康酸 Itaconic acid |
+ |
| 苹果酸 Malic acid |
+ |
| 注:+:阳性;-:阴性. Note: +: Positive; -: Negative. | |
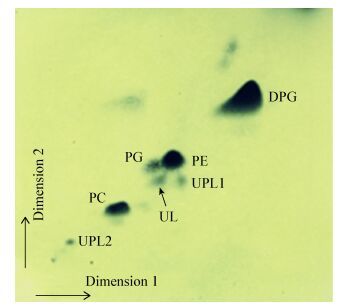
关于细胞化学组分中极性脂的结果如图 4所示。菌株LAM1007中主要的极性脂为:双磷脂酰甘油(Diphosphatidylglycerol,DPG)、磷脂酰乙醇胺(Phosphatidylethanolamine,PE)、磷脂酰胆碱(Phosphatidylcholine,PC)、磷脂酰甘油(Phosphatidylglycerol,PG)、一种未命名的脂质(Unidentified lipids,UL)和两种未命名的磷脂(Unidentified phospholipids,UPL1-2)。菌株LAM1007中主要的细胞脂肪酸(>10%)包括C18:1ω9c、Summed feature 3 (C16:1ω7c/C16:1ω6c)和C16:0,与不动杆菌属内相近的两株菌Acinetobacter junii LMG998T和Acinetobacter venetianus LMG 19082T相比,主要脂肪酸类型一致,只是含量有所不同(表 2)。
|
| 图 4 菌株LAM1007的主要极性脂 Figure 4 The major polar lipids of strain LAM1007 |
|
|
| 脂肪酸 Fatty acid |
LAM1007 | A. junii | A. venetianus |
| C10:0 | 1.1 | 1.3 | 1.0 |
| C12:0 | 3.5 | 3.4 | 4.0 |
| C12:0 2OH | 2.7 | 2.8 | 2.7 |
| C12:0 3OH | 5.6 | 5.5 | 5.9 |
| C16:0 | 12.2 | 20.4 | 15.0 |
| C18:1 ω9c | 37.0 | 34.1 | 38.0 |
| Summed feature 3 | 22.5 | 23.7 | 22.3 |
| Note: Summed feature 3: C16:1ω7c and/or C16:1 ω6c. | |||
同时分析了菌株LAM1007的16S rRNA基因序列,其片段长度为1 443 bp (Genbank登录号:KT957431),经基因序列比对分析,发现其与Acinetobacter junii LMG 998T相似度最高为98.8%,与Acinetobacter venetianus LMG 19082T相似度为97.0%,并且基于它们的16S rRNA基因序列所构建的系统发育进化树也呈现出稳定的亲缘关系(图 5)。
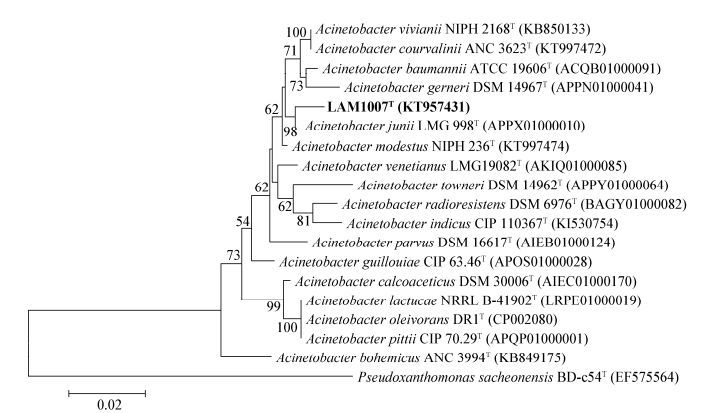
|
| 图 5 基于菌株LAM1007与属内其他相近菌株的16S rRNA基因序列构建的系统发育进化树 Figure 5 Neighbor-joining phylogenetic tree based on a comparison of the 16S rRNA gene sequences of strain LAM1007 and its closest relatives |
|
|
以上多项分类结果初步表明该菌株属于假单胞菌目(Pseudomonadales)莫拉菌科(Moraxellaceae)不动杆菌属(Acinetobacter)。
2.2 菌株LAM1007对正十六烷降解特性的研究 2.2.1 温度对正十六烷降解的影响:由图 6可知,当OD600为0.8,接种量1%,pH 7.0,180 r/min,培养60 h后,菌株可生长并产生降解作用的温度范围宽泛,30℃时菌株对正十六烷的降解率已高达90%,同时在30-40℃之间都能保持稳定且高效的降解能力。当温度在15-25℃时,菌株LAM1007的降解能力明显减弱:当温度为45℃时,菌体生长量很少,降解率也仅为5%。因此最适的温度为30-40℃。
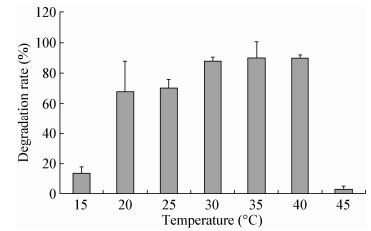
|
| 图 6 不同温度对降解正十六烷的影响 Figure 6 Effects of different temperature on the degradation of n-hexadecane |
|
|
当OD600为0.8,接种量1%,30 ℃,180 r/min时,由图 7可知,初始pH对于菌株降解正十六烷具有明显影响,同时菌株在初始pH 5.0-9.0内均可生长,且降解率在20%-88%之间。初始pH偏酸性时的降解效率与偏碱性时相比明显有所降低,这与姚嫚等[34]的研究结果相一致。当初始pH为7.0时,菌体生长量最多,降解效率最高,为88%。
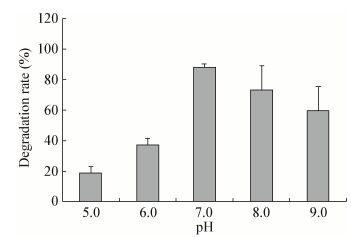
|
| 图 7 不同pH对降解正十六烷的影响 Figure 7 Effects of different pH on the degradation of n-hexadecane |
|
|
当OD600为0.8时,在30 ℃、180 r/min条件下,不同接种量(0.5%-8.0%)培养60 h后,发现接种量对菌株LAM1007降解正十六烷的影响差异较不明显。由图 8可知,当接种量在0.5%-8.0%时,降解率均在70%以上。当接种量为0.5%时降解率为85.0%;当接种量为1%-4%时,降解率最高为90%。因此选取1%的接种量作为最适接种条件。
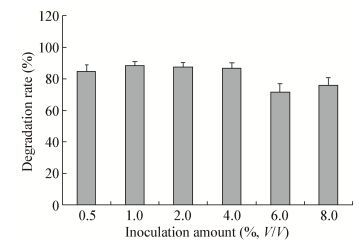
|
| 图 8 不同接种量对菌株LAM1007降解正十六烷的影响 Figure 8 Effects of different inoculation amount on the degradation of n-hexadecane |
|
|
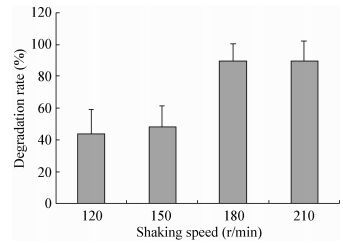
转速对于菌株LAM1007降解正十六烷具有明显的影响,随着转速(通氧量)的增加,菌株降解正十六烷的能力显著增强。由图 9可知,当转速达到180 r/min时,菌株降解正十六烷的能力显著增强;而当转速大于180 r/min后,降解率并无明显增加。因此最佳转速为180 r/min。
|
| 图 9 不同转速对降解正十六烷的影响 Figure 9 Effects of different shaking speed on the degradation of n-hexadecane |
|
|
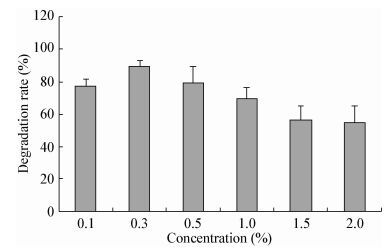
在30 ℃、180 r/min、1%接种量条件下,不同初始浓度的正十六烷(0.1%、0.3%、0.5%、1.0%、1.5%、2.0%) 60 h内的降解效率如图 10所示,当正十六烷的浓度为0.3%时,降解率最高达90%。然而当正十六烷(C16)的浓度为0.1%时,降解率并没有因为C16含量的减少而提高,说明过少的C16不能促进菌体的大量生长,也无法满足菌体大量繁殖所需要的碳源,该现象与刘莎莎[35]的研究结果一致。随着C16浓度的增加,降解率逐渐降低,但即使正十六烷的浓度高达2.0%,降解率也能达53%,因此该菌是一株具有潜在应用价值的高效烷烃降解菌株。
|
| 图 10 菌株LAM1007对不同初始浓度的正十六烷的降解 Figure 10 Degradation of n-hexadecane with different initial concentration by strain LAM1007 |
|
|
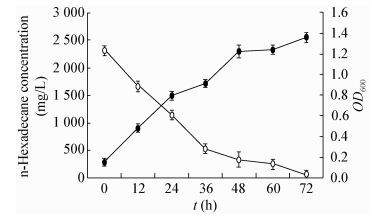
当菌株LAM1007在最适降解条件下(30 ℃,pH 7.0,180 r/min,1%接种量)降解浓度为0.3% (2 310.4 mg/L)的正十六烷时,如图 11所示,菌体生物量在48 h后已经趋于稳定,此时OD600为1.2,降解效率已经高达85%;当培养72 h后,培养物的OD600为1.3,基本将培养基中浓度为2 310.4 mg/L的正十六烷完全降解。这说明菌株对正十六烷的降解能力与其生物量成正相关,降解菌的生长量与正十六烷残量的关系对于后续深入研究有着重要的指导意义。
|
| 图 11 菌株LAM1007的生长量和正十六烷残量随时间变化的关系 Figure 11 The relationship between the biomass of the strain LAM1007 and the residual of n-hexadecane |
|
|
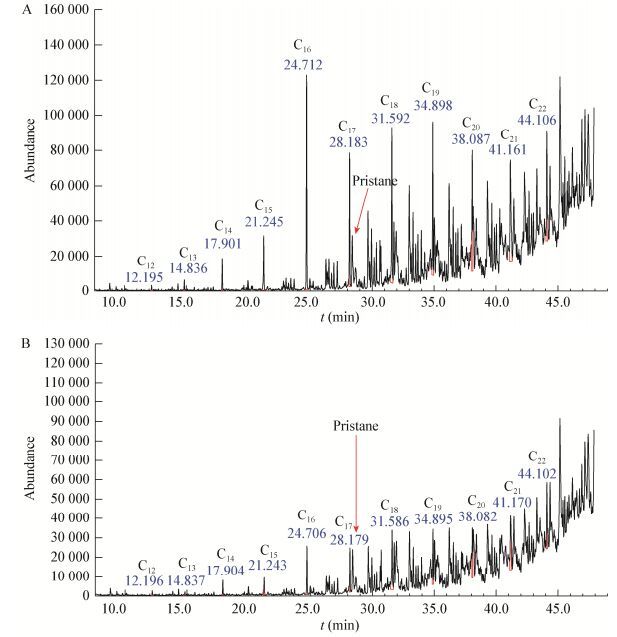
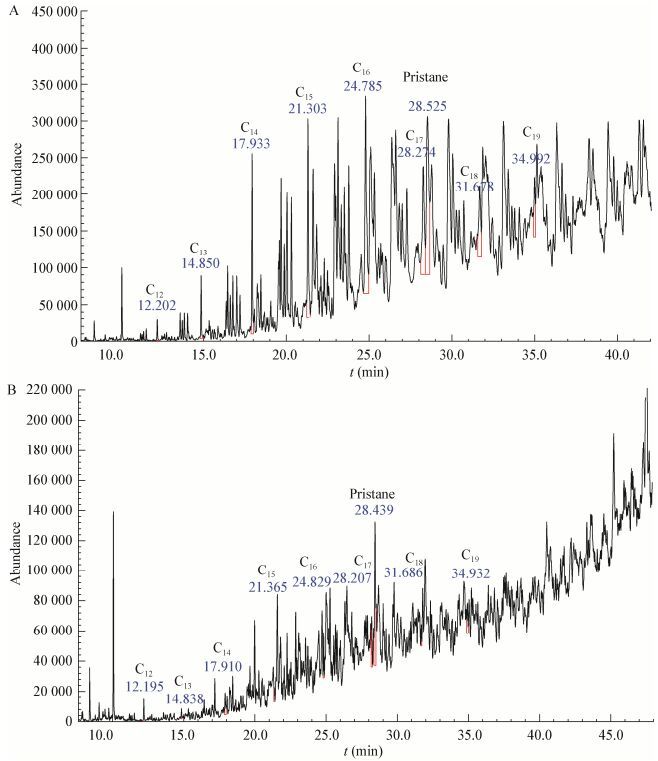
菌株LAM1007在1%的接种量、30 ℃、180 r/min的条件下培养6 d后,对于浓度为2.0% (体积比)的柴油降解前后各烷烃组分的相对含量进行了比较,如图 12所示。同时对各烷烃组分峰面积计算出的相对百分含量数据进行了进一步分析,见表 3。结果表明,菌株对于柴油中烷烃组分(C13-C19)具有显著降解作用,尤其是C16降解效果更显著,而对于姥鲛烷(Pr,异构C19)的降解效果不显著。表明正构烷烃与异构烷烃相比更易被降解,且相较于短链烷烃,菌株LAM1007更偏向选取C16为降解底物,这与Acer等[14]的研究结果一致。不仅如此,该菌株在降解液体石蜡时也表现出相同的规律。图 13为菌株3 d内对0.3% (体积比)液体石蜡降解前后各烷烃组分相对含量的结果比较。同时对各烷烃组分峰面积计算出的相对百分含量数据进行了进一步分析,见表 4。结果表明菌株对于C13-C18降解效果显著,尤其对于C16的降解效果最为显著,这更进一步说明该菌株偏向选取C16为降解底物。菌株LAM1007是一株非常有望应用于石油烃修复工程的广谱高效烷烃降解菌。
|
| 图 12 菌株LAM1007降解前后柴油中烷烃组分的变化 Figure 12 Change of alkane component in the diesel before and after degradation 注:A:空白对照组样品;B实验组样品. Note: A: Control group; B: Experimental group. |
|
|
| 烷烃 Alkane |
空白对照组 Control group |
实验组 Experimental group |
实验组/对照组 Experimental/ Control |
| Pr | 5.46 | 10.59 | 1.94 |
| C12 | 0.30 | 0.64 | 2.16 |
| C13 | 0.65 | 0.51 | 0.78 |
| C14 | 2.46 | 2.16 | 0.88 |
| C15 | 4.35 | 3.30 | 0.76 |
| C16 | 16.28 | 8.81 | 0.54 |
| C17 | 10.13 | 7.97 | 0.79 |
| C18 | 14.09 | 13.35 | 0.95 |
| C19 | 11.70 | 10.70 | 0.91 |
| C20 | 9.70 | 9.96 | 1.03 |
| C21 | 15.26 | 16.79 | 1.10 |
| C22 | 10.67 | 14.18 | 1.33 |
|
| 图 13 菌株LAM1007降解前后液体石蜡中烷烃组分的变化 Figure 13 Change of alkane component in the parraffin liquid before and after degradation 注:A:空白对照组样品;B:实验组样品. Note: A: Control group; B: Experimental group. |
|
|
| 烷烃 Alkane |
空白对照组 Control group |
实验组 Experimental group |
实验组/对照组 Experimental/ Control |
| Pr | 24.91 | 49.15 | 1.97 |
| C12 | 0.86 | 3.49 | 4.05 |
| C13 | 2.61 | 1.81 | 0.69 |
| C14 | 8.88 | 6.10 | 0.69 |
| C15 | 13.73 | 6.28 | 0.45 |
| C16 | 20.19 | 8.51 | 0.42 |
| C17 | 14.49 | 12.67 | 0.87 |
| C18 | 9.60 | 4.81 | 0.50 |
| C19 | 4.75 | 10.02 | 2.11 |
本研究从长期受石油污染的土壤样品中分离筛选出一株高效烷烃降解菌LAM1007,通过形态观察、生理生化试验、细胞化学组分及16S rRNA基因序列分析等鉴定该菌属于不动杆菌属(Acinetobacter)。
以正十六烷为唯一碳源,该菌株可在较宽的温度范围(15-40℃)内降解正十六烷。72 h内对浓度为0.3% (体积比)的C16基本完全降解,同时60 h内对于高浓度2.0% (体积比)即15 402.6 mg/L的正十六烷降解率仍能高达53%,是目前有关报道中耐受正十六烷浓度最高和降解正十六烷能力最强的一株菌。然而其他报道的降解菌均在较低浓度的正十六烷条件下降解效果才比较明显,如姚嫚等[34]分离筛选的菌株C18在47 h内对900 mg/L的C16可完全降解;鲁雅梅等[36]筛选的菌SY16对于150 mg/L以内的正十六烷降解效果较明显;焦春燕等[37]筛选的菌株S5对于低浓度的正十六烷(15 mg/L)具有明显降解趋势。虽然对于菌株利用烃类化合物已有很多报道,但是大多数菌株只能利用范围较窄的底物,而LAM1007菌株可良好地生长于以2.0% (体积比)的柴油及0.3% (体积比)的液体石蜡为唯一碳源的液体培养基中,并分别对高浓度的柴油样品中的烷烃组分(C13-C19)以及液体石蜡样品中的烷烃组分(C13-C18)均具有较明显降解能力。
目前微生物修复中存在的主要问题是微生物降解能力不够理想,主要通过接种高效降解菌和施加安全可靠的生物表面活性剂等方法增强石油烃类的降解[38]。因此,本研究筛选到的菌株LAM1007是一株具有生物修复应用潜力的高效烷烃降解菌。
| [1] | Bao MT, Wang LN, Sun PY, et al. Biodegradation of crude oil using an efficient microbial consortium in a simulated marine environment[J]. Marine Pollution Bulletin, 2012, 64(6) : 1177–1185. DOI:10.1016/j.marpolbul.2012.03.020 |
| [2] | Oren A. Estimation of the contribution of halobacterial to the bacterial biomass and activity in solar salterns by the use of bile salts[J]. FEMS Microbiology Letters, 1990, 73(1) : 41–47. DOI:10.1111/fml.1990.73.issue-1 |
| [3] | Xia WJ, Du ZF, Cui QF, et al. Biosurfactant produced by novel Pseudomonas sp. WJ6 with biodegradation of n-alkanes and polycyclic aromatic hydrocarbons[J]. Journal of Hazardous Materials, 2014, 276 : 489–498. DOI:10.1016/j.jhazmat.2014.05.062 |
| [4] | Qian P, Sun GQ, Zhang CZ. A novel fuzzy neural network method for diesel quantitative analysis with near infrared spectroscopy[J]. Spectroscopy and Spectral Analysis, 2008, 28(12) : 2851–2854. (in Chinese) 钱平, 孙国琴, 张存洲. 基于近红外光谱技术的石油组分定量分析新方法[J]. 光谱学与光谱分析, 2008, 28(12) : 2851–2854. DOI:10.3964/j.issn.1000-0593(2008)12-2851-04 |
| [5] | Atlas RM, Atlas MC. Biodegradation of oil and bioremediation of oil spills[J]. Current Opinion in Biotechnology, 1991, 2(3) : 440–443. DOI:10.1016/S0958-1669(05)80153-3 |
| [6] | Zheng L, Cui ZS, Gao W, et al. Field study of the bioremediation of oil-contaminated Dalian beach by marine oil-degrading bacterial agent[J]. Acta Oceanologica Sinica, 2012, 34(3) : 163–172. (in Chinese) 郑立, 崔志松, 高伟, 等. 海洋石油降解菌剂在大连溢油污染岸滩修复中的应用研究[J]. 海洋学报, 2012, 34(3) : 163–172. |
| [7] | Kostka JE, Prakash O, Overholt WA, et al. Hydrocarbon-degrading bacteria and the bacterial community response in gulf of Mexico beach sands impacted by the deepwater horizon oil spill[J]. Applied and Environmental Microbiology, 2011, 77(22) : 7962–7974. DOI:10.1128/AEM.05402-11 |
| [8] | Thavasi R, Jayalakshmi S, Banat IM. Effect of biosurfactant and fertilizer on biodegradation of crude oil by marine isolates of Bacillus megaterium, Corynebacterium kutscheri and Pseudomonas aeruginosa[J]. Bioresource Technology, 2011, 102(2) : 772–778. DOI:10.1016/j.biortech.2010.08.099 |
| [9] | Gandolfi I, Sicolo M, Franzetti A, et al. Influence of compost amendment on microbial community and ecotoxicity of hydrocarbon-contaminated soils[J]. Bioresource Technology, 2010, 101(2) : 568–575. DOI:10.1016/j.biortech.2009.08.095 |
| [10] | Simon MA, Bonner JS, Page CA, et al. Evaluation of two commercial bioaugmentation products for enhanced removal of petroleum from a wetland[J]. Ecological Engineering, 2004, 22(4/5) : 263–277. |
| [11] | Pritchard PH, Mueller JG, Rogers JC, et al. Oil spill bioremediation: experiences, lessons and results from the Exxon valdez oil spill in Alaska[J]. Biodegradation, 1992, 3(2) : 315–335. |
| [12] | Liu H, Xu J, Liang RB, et al. Characterization of the medium-and long-chain n-alkanes degrading Pseudomonas aeruginosa strain SJTD-1 and its alkane hydroxylase genes[J]. PLoS One, 2014, 9(8) : e105506. DOI:10.1371/journal.pone.0105506 |
| [13] | Zhang ZZ, Hou ZW, Yang CY, et al. Degradation of n-alkanes and polycyclic aromatic hydrocarbons in petroleum by a newly isolated Pseudomonas aeruginosa DQ8[J]. Bioresource Technology, 2011, 102(5) : 4111–4116. DOI:10.1016/j.biortech.2010.12.064 |
| [14] | Acer , Güven K, Bekler FM, et al. Isolation and characterization of long-chain alkane-degrading Acinetobacter sp. BT1A from oil-contaminated soil in Diyarbakır, in the Southeast of Turke[J]. Bioremediation Journal, 2016, 20(1) : 80–87. DOI:10.1080/10889868.2015.1096898 |
| [15] | Liu HJ, Yao J, Yuan ZM, et al. Isolation and characterization of crude-oil-degrading bacteria from oil-water mixture in Dagang oil field, China[J]. International Biodeterioration & Biodegradation, 2014, 87 : 52–59. |
| [16] | Hassanshahian M, Emtiazi G, Cappello S. Isolation and characterization of crude-oil-degrading bacteria from the Persian Gulf and the Caspian Sea[J]. Marine Pollution Bulletin, 2012, 64(1) : 7–12. DOI:10.1016/j.marpolbul.2011.11.006 |
| [17] | Wang LP, Liu YH, Shao ZZ. Isolation and identification of a hydrocarbon-degrading bacterium Gordonia sp. S14-10 from the surface water of Atlantic Ocean and analysis on its related characteristics[J]. Acta Microbiologica Sinica, 2009, 49(12) : 1634–1642. (in Chinese) 王丽萍, 刘昱惠, 邵宗泽. 一株来自大西洋表层海水的烷烃降解菌Gordonia sp. S14-10的分离鉴定及其降解相关特性的分析[J]. 微生物学报, 2009, 49(12) : 1634–1642. DOI:10.3321/j.issn:0001-6209.2009.12.014 |
| [18] | Chen XR, Ruan ZY, Wang YW, et al. Research on the isolation, identification on n-hexadecane biodegrading characteristics of Gordonia sp. LAM0048[J]. Current Biotechnology, 2015, 5(2) : 137–141. (in Chinese) 陈小蓉, 阮志勇, 王彦伟, 等. Gordonia sp. LAM0048的分离鉴定及其降解正十六烷的研究[J]. 生物技术进展, 2015, 5(2) : 137–141. |
| [19] | Das K, Mukherjee AK. Crude petroleum-oil biodegradation efficiency of Bacillus subtilis and Pseudomonas aeruginosa strains isolated from a petroleum-oil contaminated soil from North-East India[J]. Bioresource Technology, 2007, 98(7) : 1339–1345. DOI:10.1016/j.biortech.2006.05.032 |
| [20] | Liu BQ, Ju MT, Liu JP, et al. Isolation, identification, and crude oil degradation characteristics of a high-temperature, hydrocarbon-degrading strain[J]. Marine Pollution Bulletin, 2016, 106(1/2) : 301–307. |
| [21] | Wang XB, Chi CQ, Nie Y, et al. Degradation of petroleum hydrocarbons (C6−C40) and crude oil by a novel Dietzia strain[J]. Bioresource Technology, 2011, 102(17) : 7755–7761. DOI:10.1016/j.biortech.2011.06.009 |
| [22] | Zuo K. Carbon metabolism of Rhodococcus sp. and production of 2-phenylpropionic acid[D]. Shanghai: Masterʼs Thesis of East China University of Science and Technology, 2012(in Chinese) 左可. 烷烃降解菌的代谢和2-苯基丙酸的生物催化[D]. 上海: 华东理工大学硕士学位论文, 2012 http://cdmd.cnki.com.cn/Article/CDMD-10251-1014168863.htm |
| [23] | Gei d rfer W, Kok RG, Ratajczak A, et al. The Genes rubA and rubB for alkane degradation in Acinetobacter sp. strain ADP1 are in an operon with estB, encoding an esterase, and oxyR[J]. Journal of Bacteriology, 1999, 181(14) : 4292–4298. |
| [24] | Li B, Shen L, Zhang DM. Dynamics of Petroleum-degrading bacterial community with biodegradation of petroleum contamination in seawater[J]. Journal of Ningbo University (Natural Science & Engineering Edition), 2009, 22(4) : 477–483. (in Chinese) 李博, 沈璐, 张德民. 石油污染海水中细菌群落的动态变化[J]. 宁波大学学报:理工版, 2009, 22(4) : 477–483. |
| [25] | Labbé D, Margesin R, Schinner F, et al. Comparative phylogenetic analysis of microbial communities in pristine and hydrocarbon-contaminated Alpine soils[J]. FEMS Microbiology Ecology, 2007, 59(2) : 466–475. DOI:10.1111/fem.2007.59.issue-2 |
| [26] | Cui QF, Qi YB, Yi LN, et al. Study on indigenous microorganism activator in a oil reservoir of calcium Chloride water[J]. Science Technology and Engineering, 2015, 15(4) : 78–83. (in Chinese) 崔庆锋, 齐义彬, 伊丽娜, 等. 氯化钙水型油藏内源微生物激活剂研究[J]. 科学技术与工程, 2015, 15(4) : 78–83. |
| [27] | Cao J, Xu ZH, Li LZ, et al. Biosurfactant-producing petroleum-degrader-Acinetobacter BHSN[J]. Journal of Ecology and Rural Environment, 2009, 25(1) : 73–78. (in Chinese) 曹娟, 徐志辉, 李凌之, 等. 产生物表面活性剂的石油降解菌Acinetobacter BHSN的研究[J]. 生态与农村环境学报, 2009, 25(1) : 73–78. |
| [28] | Tan TF, Shao ZZ. Construction of marine oil biodegradation bacterial consortium and its dynamic change in the process of oil consumption[J]. Journal of Xiamen University (Natural Science), 2006, 45(S1) : 262–266. (in Chinese) 谭田丰, 邵宗泽. 海洋石油烃降解菌群构建及其在降解过程中的动态分析[J]. 厦门大学学报:自然科学版, 2006, 45(S1) : 262–266. |
| [29] | Liu YH, Wang H, Hu XK. Recent advances in the biodegradation of hydrocarbons by Acinetobacter species[J]. Microbiology China, 2016, 43(7) : 1579–1589. (in Chinese) 刘玉华, 王慧, 胡晓珂. 不动杆菌属(Acinetobacter)细菌降解石油烃的研究进展[J]. 微生物学通报, 2016, 43(7) : 1579–1589. |
| [30] | Yuan Y, Guo SH, Li FM, et al. Effect of an electric field on n-hexadecane microbial degradation in contaminated soil[J]. International Biodeterioration & Biodegradation, 2013, 77 : 78–84. |
| [31] | Mishra S, Singh SN. Microbial degradation of n-hexadecane in mineral salt medium as mediated by degradative enzymes[J]. Bioresource Technology, 2012, 111 : 148–154. DOI:10.1016/j.biortech.2012.02.049 |
| [32] | Ruan ZY, Wang YW, Song JL, et al. Kurthia huakuii sp. nov., isolated from biogas slurry, and emended description of the genus Kurthia[J]. International Journal of Systematic and Evolutionary Microbiology, 2014, 64 : 518–521. DOI:10.1099/ijs.0.056044-0 |
| [33] | He H, Qiao FD, An ML, et al. Isolation, identification and characterization of a crude-oil-degradating thermophiles in petroleum reservoirs[J]. Biotechnology Bulletin, 2012, 12(14) : 156–162. (in Chinese) 何华, 乔发东, 安明理, 等. 一株油藏耐热原油降解菌的分离鉴定与特性分析[J]. 生物技术通报, 2012, 12(14) : 156–162. |
| [34] | Yao M, Tuo BH, Wang QF, et al. Isolation of an alkane-degradation bacterium and study on its degradation performance and kinetics[J]. Petroleum Processing and Petrochemicals, 2012, 43(2) : 29–32. (in Chinese) 姚嫚, 庹保华, 王巧凤, 等. 一株烷烃降解菌的筛选、降解特性及动力学研究[J]. 石油炼制与化工, 2012, 43(2) : 29–32. |
| [35] | Liu SS. A study on remediating diesel fuel contaminated soil by bioventing and degradation capability of diesel degrading bacteria[D]. Tai'an: Masterʼs Thesis of Shandong Agricultural University, 2013(in Chinese) 刘莎莎. 柴油污染土壤生物通风修复效果及柴油降解菌的降解能力研究[D]. 泰安: 山东农业大学硕士学位论文, 2013 http://cdmd.cnki.com.cn/Article/CDMD-10434-1014154401.htm |
| [36] | Lu YM, Zou DL, Zhao YS, et al. Isolation, characterization, and alkane degradation potential of hydrocarbon-degrading bacteria SY16[J]. Ecology and Environment, 2007, 16(5) : 1394–1398. (in Chinese) 鲁雅梅, 邹东雷, 赵勇胜, 等. 烷烃降解菌SY16的筛选、鉴定及降解能力测定[J]. 生态环境, 2007, 16(5) : 1394–1398. |
| [37] | Jiao CY, Nie MQ. The screening of long n-alkane bacteria and its degradation ability[J]. Environmental Protection and Technology, 2011, 17(1) : 6–9. (in Chinese) 焦春燕, 聂麦茜. 长链烷烃生长菌的筛选及其降解能力的测定[J]. 环保科技, 2011, 17(1) : 6–9. |
| [38] | Li GZ, Lai QL, Yan PS, et al. Advance on marine petroleum pollution and microbial remediation[J]. Current Biotechnology, 2015, 5(3) : 164–169. (in Chinese) 李贵珍, 赖其良, 闫培生, 等. 海洋石油污染及其微生物修复研究进展[J]. 生物技术进展, 2015, 5(3) : 164–169. |
 2017, Vol. 44
2017, Vol. 44




