扩展功能
文章信息
- 郑艳红, 戴芸芸, 杨洋, 刘金莉, 舒明, 钟卫鸿
- ZHENG Yan-Hong, DAI Yun-Yun, YANG Yang, LIU Jin-li, SHU Ming, ZHONG Wei-Hong
- 废次烟叶提取液源木质素降解菌Bacillus subtilis SM降解特性
- lignin degrading characteristics of Bacillus subtilis SM isolated from tobacco waste extract
- 微生物学通报, 2017, 44(7): 1525-1534
- Microbiology China, 2017, 44(7): 1525-1534
- DOI: 10.13344/j.microbiol.china.170081
-
文章历史
- 收稿日期: 2017-01-28
- 接受日期: 2017-05-15
- 优先数字出版日期(www.cnki.net): 2017-06-08
2. 浙江中烟工业有限责任公司技术中心 浙江 杭州 310009
2. Technology Center, China Tobacco Zhejiang Industrial Co. Ltd., Hangzhou, Zhejiang 310009, China
纤维素、半纤维素、木质素和果胶等是构成烟草细胞壁的成分,这些物质尤其是木质素对烟草评吸品质有重要影响。关于生物方法降解木质纤维素,国内外已有大量研究,但在烟草行业涉及较少[1]。木质素是自然界中含量仅次于纤维素的复杂天然高分子化合物原料,广泛存在于高等植物细胞壁中[2]。已知木质素主要由3种不同的羟基肉桂醇聚合而成,它们分别生成3种聚合单体:对-羟基苯基(H)木质素、愈创木基(G)木质素和紫丁香基(S)木质素,这些单体的结构差异主要在于甲基化程度的不同。烟草是中国的重要经济作物,其中烟梗的年产量在386万t左右[3]。烟梗较高的木质化程度增加了其使用难度,近年来对废次烟梗利用包括再造烟叶、制纤维板、提取化学品等[4-7]。随着人们对健康追求的不断提高,降低烟草中焦油等有害成分成了烟草行业发展的趋势。木质素的结构中富含苯环,是烟草焦油中稠环芳烃类、芳香胺等有害物质的主要来源,而且木质素在烟草加工调制过程中含量基本不发生变化,是烟草中一种相对较为稳定的化合物[8]。有发现木质素对再造烟叶烟气中苯酚也有很大的影响,再造烟叶热裂解产生的苯酚及其他酚类物质含量随木质素含量的增加而升高[9],热解产物中含的儿茶酚和烷基儿茶酚,可引起涩口且有促癌活性[10]。烟梗的木质素含量比烟叶高,导致其香气不足,燃吸时的杂气也很重,有刺激性的呛咳,会极大影响卷烟的吸味品质[11]。红外光谱分析显示烟梗木质素是G-S型木质素,而且紫丁香基结构单体的含量相对较多[12]。由于木质素致密的结构导致目前外源性酶制剂在处理烟叶时很难通过烟草细胞壁,给生物处理烟叶带来了一定的难度。近几十年来,木质素的微生物降解研究主要集中在白腐真菌和褐腐真菌等真菌的研究[13],例如周元清等[1]利用黄孢厚毛平革菌和P. brevispora处理烟梗木质素,采用张槐苓等[14]的方法测定木质素含量,得出降解前后木质素含量的变化。但细菌具有生长快、结构简单、产生的酶多为胞外酶等特点。因此,利用细菌降解木质素具有潜在的应用前景[15]。目前已发现多种细菌能够分解木质素,但是对其降解机理[16]、降解能力和检测方法的研究较少。
“再造烟叶”生产工艺近十年来被逐步应用到烟草废弃物的处理和资源化利用的过程中。废次烟叶提取液(TWE)是“再造烟叶”工艺的重要中间过程物料,而且是一个高糖、高渗、高尼古丁含量的环境,一般微生物菌体难以在这样的环境中生存。因此,本研究旨在从废次烟叶提取液中直接筛选高耐受的内源性微生物用于降解烟梗TWE中的木质素,以期实现再造烟叶中木质素的的生物调控,同时提高烟梗的利用率,这对烟草行业的发展有着重要的意义。
1 材料与方法 1.1 主要试剂和仪器Kraft木质素(硫酸盐木质素,型号471003,分子质量为10 000)、RB亮蓝(Remazol Brilliant Blue R,分子质量为626.5),美国Sigma-Alderich公司;木质素磺酸钠(Sodium lignosulfonate,型号S107561,分子质量为534.5),美国Aladdin公司;本论文中只有在用HPLC检测时用分子质量为500的木质素磺酸钠,其余用的均是分子质量为10 000的Kraft木质素;水溶苯胺蓝(Azure-B,分子质量为737.72),中国上海标本模型厂;HPLC所用的乙腈为色谱纯试剂;乙酸为分析纯试剂;水为超纯水;其他所有的试剂都是分析纯。
总有机碳自动测定仪(TOC-L CPN),日本岛津公司;全波长扫描仪(Ultrospec 4300 Pro),Amesham Bioscience公司;高效液相色谱仪(Agilent 1100),美国Agilent公司;UV-1800型紫外分光光度计,上海美谱达公司。
1.2 菌株和培养基Bacillus subtilis SM,本实验室从TWE中分离、鉴定和保藏。
LB培养基(g/L):蛋白胨10.0,酵母提取物5.0,NaCl 10.0。BM培养基(g/L):酵母膏10.0,葡萄糖20.0,琼脂15.0,蒸馏水1 000 mL,自然pH。Kraft木质素无机盐培养基(KL-MSM) (g/L)[17]:Kraft木质素3.00,K2HPO4 1.00,MgSO4·7H2O 0.20,CaCl2 0.10,FeSO4·7H2O 0.05,MnSO4·H2O 0.02,KH2PO4 1.00,(NH4)2SO4 1.90,琼脂15.00,pH 7.0。脱色培养基(g/L):Kraft木质素(分子质量为10 000) 0.5,葡萄糖10.0,蛋白胨5.0,K2HPO4 1.00,MgSO4·7H2O 0.20,CaCl2 0.10,FeSO4·7H2O 0.05,MnSO4·H2O 0.02,KH2PO4 1.00,(NH4)2SO4 1.98,pH 7.0。烟梗无机盐培养基(g/L):烟梗10.0,(NH4)2SO4 2.0,MgSO4·7H2O 0.5,K2HPO4 1.0,NaCl 0.5,pH 7.0。
1.3 Bacillus subtilis SM的木质素降解酶初探将SM接种到以Kraft木质素为唯一碳源的固体平板筛选培养基KL-MSM上,置生化培养箱30 ℃培养,观察菌株的生长情况,考察其木质素降解能力。在200 mL的BM固体培养基中分别加入10 mL浓度为25 g/L的苯胺蓝和RB亮蓝(0.22μm滤膜过滤除菌),接种SM,30℃培养,观察,通过菌落周围脱色圈的有无来定性检测木质素降解酶种类。
1.4 Bacillus subtilis SM降解木质素能力检测和评价方法迄今尚无合适的方法定量测定木质纤维素中总木质素的含量。测定植物原料中木质素含量的最古老和普通的方法是硫酸处理重量分析法[18],这是一种已被制浆和造纸工业技术协会认可的测定木质素含量的方法,但是烟叶中的其他成分(纤维素、半纤维素、大分子糖类、木质素、蛋白质、脂质类、醇类、酯类、杂环类、生物碱、酶类、有机酸、酚类、色素、矿物质、水等)会干扰硫酸处理重量分析法测定木质素的准确度。后来发展的NaOH/尿素低温溶解法[19-20]测定烟梗中木质素的含量时,去除了烟梗中上述物质的干扰,测定结果准确度较高,具体操作步骤为:(1) 首先将干燥的烟梗进行磨粉过60目筛;(2) 称取一定量的烟梗粉(记作m1),以液固比25 mL/g加入到预先冷却至-10 ℃的氢氧化钠/尿素水溶液中,在-8-12 ℃下搅拌30 min,离心得到滤液A,将固体水洗至中性即得预处理后的烟梗粉(固体A);(3) 将固体A以液固比80 mL/g加入质量分数为17.5%的硫酸溶液中,100℃搅拌反应30 min,8 000 r/min离心10 min分离得到滤液B和固体B,滤液B用于测定酸溶木质素含量,将固体B水洗至中性,分别用100 mL丙酮洗涤3次后干燥。干燥后的固体加入100 mL已经预先冷却至-10 ℃的氢氧化钠/尿素溶液中,于-8-12 ℃下搅拌30 min,8 000 r/min离心10 min得滤液C和残渣,残渣经水洗至中性并用定量滤纸过滤,将滤纸和滤渣在烘箱中60-70 ℃烘干至恒重得到固体C。将干燥后定量滤纸和滤渣转移到坩埚中,放入马弗炉,在800 ℃下灼烧4 h,剩余固体即为烟草木质素中的灰分。通过灼烧前后质量之差再减去定量滤纸的质量即为烟梗酸不溶木质素的质量(记作m2)。酸不溶木质素的含量(%)=[m2/m1×(1-w)]×100;(4) 取步骤3中的滤液B稀释后在325 nm处测定紫外吸光度,通过酸溶木质素标准曲线计算得到酸溶木质素的含量。将酸溶木质素的含量和酸不溶木质素的含量相加得到基于烟梗干基的木质素总含量。
由于木质素的特征吸收峰在280 nm附近,对于可溶性的木质素可采取测定280 nm的吸光度方法,但菌体生长过程中产生紫外吸收物质(蛋白质等)会影响该方法的准确性。因而用测定总有机碳(TOC)去除率、HPLC、凝胶渗透色谱(GPC)、脱色率等方法来表征和评价木质素的降解。
1.4.1 菌株生长和TOC测定:SM接种至LB培养基后37 ℃、180 r/min培养过夜,直至培养液OD600为1.2,取3 mL培养液转接至100 mL Kraft木质素无机盐培养基30 ℃、180 r/min培养4 d。每隔24 h取样测定细菌的生长和总有机碳(TOC)的变化。每组实验进行3个重复。将空白对照和加菌组的样品分别在12 000 r/min离心10 min去除菌体及杂质。TOC的测定方法参照文献[21]。
1.4.2 木质素全波长扫描吸收曲线:配制0.3 g/L Kraft木质素溶液,用全波长扫描仪进行200-1 000 nm波长范围扫描,获得Kraft木质素的紫外可见吸收光谱图(图 1)。图 1与郁红艳等[22]采用Kraft木质素所得的紫外可见吸收光谱图相似。Kraft木质素在220 nm附近有个强吸收峰,280 nm附近也有一吸收峰。虽然在220 nm处的吸收要比280 nm处的吸收更为明显,但在这一个波长区域内的吸收较为复杂且线性关系不明显,因此选择稳定性和再现性较好的280 nm作为木质素的检测波长。

|
| 图 1 KL 10 000全波长扫描吸收曲线 Figure 1 Full wavelength scanning absorption curve of KL 10 000 |
|
|
分别配制3 g/L木质素磺酸钠和Kraft木质素的木质素培养基,接入定量SM,取刚接入和培养4 d后培养基采用高效液相色谱仪检测木质素的降解情况。木质素是由愈创木基、紫丁香基和对羟苯基这3个结构单元构成的复杂聚合物,其降解产物一般含有4-羟基苯甲酸、香草酸、紫丁香酸、4-羟基苯甲酸、香草醛和紫丁香醛等物质。上述6种降解产物的全波长扫描(190-400 nm)结果显示其最大吸收峰均在200 nm左右,其次为254 nm和280 nm[23]。HPLC采集数据时样品的检测波长应至少大于流动相截止波长的20 nm,而本研究的流动相乙腈和水的截止波长分别为210 nm和190 nm[24],因此,选择本研究的检测波长为254 nm和280 nm。确定HPLC条件:色谱柱,Zorbax Eclipse XDB-C18柱(250 mm×4 mm×6 mm,5 µm);流动相:A相为1.5%乙酸水溶液;B相为乙腈,pH 2.7;梯度洗脱程序:0-45 min,5%-40% B;45-50 min,40%-100% B;50-55 min,100%-5% B;55-60 min,5% B;柱温:30 ℃;DAD检测波长:分别采用了254 nm和280 nm进行检测;流速:0.80 mL/min;进样量:20 µL[25]。
1.4.4 凝胶渗透色谱(GPC)检测:经过7 d的培养之后,从空白样品和接种了菌体的样品中分别取50 mL培养液,12 000×g离心l0 min去除菌体细胞和杂质,将上清液放入真空冷冻干燥仪中进行冷冻干燥直至恒重。使用0.1 mol/L的Tris-HCl缓冲液(pH 7.5) 溶解经真空冷冻干燥得到的样品粉末,使得样品的浓度为3 g/L;样品采用高效液相色谱仪进行凝胶渗透色谱检测。将0.5 mL此溶液上样至Agilent PL aquagel-OH Aqueous SEC Columns柱型为PL aquagel 7.5 mm id的凝胶色谱柱中,使用0.1 mo1/L的Tris-HCl缓冲液(pH 7.5) 作为流动相洗脱液,流速为l mol/L,在280 nm处检测洗脱样品的信号。由此结果判断SM对Kraft木质素的降解情况。
1.4.5 SM对硫酸盐木质素的脱色:按照脱色培养基分别配制0.5 g/L和3.0 g/L的Kraft木质素,再接入定量的菌体。每隔24 h取1 mL的培养液在12 000×g离心10 min去除菌体,往2.5 mL的磷酸盐缓冲液(pH 7.6) 中加入0.5 mL 3.0 g/L Kraft木质素的上清液,在465 nm处测定吸光度,以吸光度的下降来计算培养液色度的降低[26]。0.5 g/L Kraft木质素的脱色检测是用磷酸盐缓冲液(pH 7.6) 稀释2倍。
1.4.6 SM对烟梗木质素的降解研究:SM接种至LB培养基后进行过夜活化培养,将活化后的种子液以0.1%的接种量接种至烟梗无机盐摇瓶培养基中,实验设置1个对照组和3个实验组,发酵培养3 d后测定培养基中烟梗发酵前后干重的变化,以及采用NaOH/尿素低温溶解法测定发酵前后烟梗中木质素含量的变化。以此来判断SM对烟梗木质素的降解。
2 结果与分析 2.1 SM的木质素降解酶初探在以Kraft木质素为唯一碳源的KL-MSM固体平板上,接种从废次烟叶提取液中分离筛选得到的Bacillus subtilis SM,30℃培养24 h,发现SM在此平板上生长良好(图 2A)。SM可利用Kraft木质素作为唯一碳源生长繁殖。因此,SM具有良好的木质素降解潜力。苯胺蓝的脱色与LiP (不用加入H2O2)及MnP的产生有关[27],但不反映Lac的产生;而Lac的产生可使亮蓝脱色[28]。因此,苯胺蓝和亮蓝平板脱色反应可用于检测木质素降解酶的类型。由平板实验结果可知SM无Lac活性(图 2B),具有Lip及Mnp活性(图 2C)。

|
| 图 2 SM在KL-MSM生长(A)、RB亮蓝(B,检测Lac)和苯胺蓝(C,检测LiP和MnP)平板的显色反应 Figure 2 SM growth on KL-MSM (A), emazol brilliant blue medium (B, detecting Lac) and Azure-B medium (C, detecting LiP and MnP) |
|
|
随着Kraft木质素浓度的升高,SM生长相对较好(图 3A)。这可能是因为Kraft木质素(分子质量为10 000) 为高分子质量的杂聚物,当Kraft木质素浓度越高时,其内所含有的分子量相对较小的片段就越多,因此,随着Kraft木质素浓度的升高SM生长越好。KL-MSM降解培养基中只含有Kraft木质素一种有机物,因此TOC的去除反映KL-MSM培养基中Kraft木质素被消耗的情况(图 3B),也就是Kraft木质素总体上被SM降解的状况。因此,从这些结果来看,SM在4 d内最大矿化能力只能达到5.4%,能力不是很强。

|
| 图 3 KL-MSM培养基中SM的生长(A)和TOC变化(B) Figure 3 Growth of Bacillus subtilis SM (A) and changes of TOC (B) in KL-MSM |
|
|
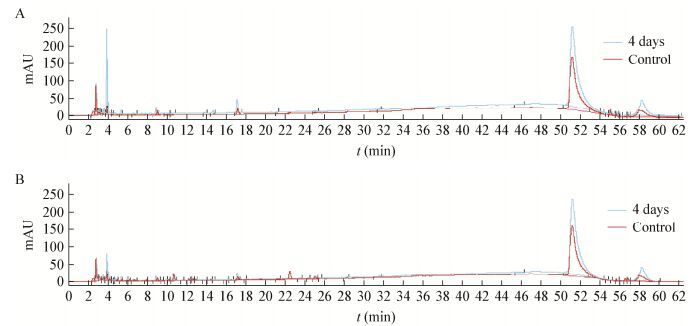
HPLC检测了SM对分子质量为534.51的木质素磺酸钠的降解情况,通过254 nm (图 4A)和280 nm (图 4B)两个波长的检测发现:培养4 d后在保留时间为2-4 min内木质素物质的峰都呈现出明显的降低,木质素磺酸钠是高分子聚合物,降解可以形成4-羟基苯甲酸、香草酸、紫丁香酸、4-羟基苯甲酸、香草醛和紫丁香醛等物质,培养4 d后其样品的组分和丰度均比第0天明显减少,说明木质素磺酸钠中酚类物质的减少,至于具体物质还需通过后续实验进行进一步验证。对于分子质量为10 000的Kraft木质素,通过在254 nm (图 5A)和280 nm (图 5B)下的检测发现:培养4 d后在保留时间为17 min左右出现小峰的增加,该处可能为木质素的降解产物香草酸的产生[29];在49 min和56 min出现峰的增加,可能原因是SM将部分大分子木质素降解成了小分子物质;在280 nm检测条件下保留时间为22 min左右小峰的减少,该处可能是组成木质素中的香草醛组分[29]被菌体利用而降低。

|
| 图 4 SM对MSM中木质素磺酸钠的降解第4天(蓝)和第0天(红)培养液HPLC表征 Figure 4 Result of sodium lignosulfonate in MSM degradation by SM for 4 days (blue) and control (red) in HPLC Note: A: 254 nm; B: 280 nm. |
|
|
|
| 图 5 SM对MSM中Kraft木质素降解第4天(蓝)和第0天(红)培养液HPLC表征 Figure 5 Result of kraft lignin in MSM degradation by SM for 4 days (blue) and control (red) in HPLC Note: A: 254 nm; B: 280 nm. |
|
|
凝胶渗透色谱(GPC)是测量高分子聚合物分子量的最常用方法,在研究木质素降解过程中的分子量分布情况也是一种常用的技术手段,很多研究者都用其来测定木质素降解过程中的分子量分布的变化[30-31]。本文进行了SM对高平均分子质量的Kraft木质素(分子质量为10 000) 降解过程的GPC检测[以0.10 mol/L Tris-HCl (pH 7.5) 为冻干粉样品溶剂和流动相]。
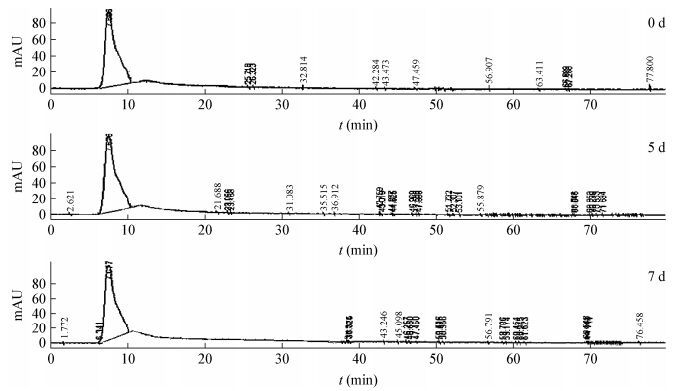
SM降解7 d过程中(图 6),样品的主峰右边产生了很多其他的小峰。这表明Bacillus subtilis SM能部分降解Kraft木质素中高分子量的成分,变成较低分子量的木质素片段,这些结果与前面的HPLC结果相一致。
|
| 图 6 Bacillus subtilis SM降解Kraft木质素(Mw=10 000) 过程GPC检测结果 Figure 6 GPC results of KL (Mw=10 000) degrading process by Bacillus subtilis SM |
|
|
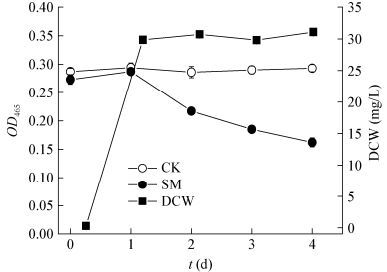
SM在含有葡萄糖和蛋白胨的KL-MSM培养基中具有明显的脱色能力(图 7),而在不含有葡萄糖和蛋白胨的KL-MSM培养基中,SM生长量很小,且无明显的脱色能力。这可能是因为葡萄糖和蛋白胨做为添加氮源可保证SM更好地生长,获得的菌体再把Kraft木质素降解。
|
| 图 7 SM在含10.0 g/L葡萄糖和5.0 g/L蛋白胨及0.5 g/L Kraft木质素MSM培养基中生长及脱色情况 Figure 7 Growth and decolorization of SM in MSM containing 0.5 g/L kraft lignin, 10.0 g/L glucose and 5.0 g/L peptone |
|
|
SM接种到烟梗无机盐发酵培养基中发酵培养3 d后,对照组中烟梗的失重率为18.90%,实验组中烟梗失重率分别为50.80%、57.20%和52.10%。采用NaOH/尿素低温溶解法测定[19-20]发酵前后烟梗中木质素含量的变化,对照组当中木质素含量为17.70%,实验组中木质素含量分别为5.10%、4.40%和5.50%,实验组中木质素减少了70%左右(表 1)。由上述两个实验可以证明SM对烟梗当中的木质素能够起到明显的降解效果。可能其产生木质素过氧化物酶在烟梗发酵液中发挥了很好的降解作用。
| 组别 Group |
失重率 Weight loss rate (%) |
木质素含量 Lignin content (%) |
| 对照组 Control group |
18.90 | 17.70 |
| 实验组1 Test group 1 |
50.80 | 5.10 |
| 实验组2 Test group 2 |
57.20 | 4.40 |
| 实验组3 Test group 3 |
52.10 | 5.50 |
在已报道的具有木质素降解功能的芽孢杆菌菌株中(表 2),芽孢杆菌SM菌株的木质素过氧化物酶活性并不是最高的,但是其对烟梗中的木质素却有明显降解效果。这个结果显示分离自废次烟叶提取液(TWE)的SM菌株可能更适合用于烟草原料木质素降解。
| 菌株 Strain |
来源 Source |
最适培养条件 Culture onditions |
木质素过氧化物酶酶活 Lignin peroxidase |
参考文献 Reference |
| Bacillus subtilis LG-1 | 牛粪便 | 37 ℃ | 1773.30 U/L | [32] |
| Bacillus licheniformis MN-8 | 牛粪便 | 37 ℃,pH 7.0 | 153.33±5.98 U/g | [33] |
| Bacillus amyloliquefaciens N-13 | 牛粪便 | 37 ℃,pH 7.0 | NA* | [34] |
| Bacillus ligninesis L1 | 南海沉积物 | 30 ℃,pH 9.0 | 150 U/L | [35] |
| Bacillus ligniniphilus sp. nov. | 南海沉积物 | 30 ℃,pH 9.0 | NA* | [36] |
| Bacillus subtilis | 堆肥 | 30 ℃ | 0.22 U/g | [37] |
| Bacillus subtilis SM | 废次烟叶提取液 | 30 ℃,pH 7.0 | 80.20 U/L | 本实验 |
| Note: NA*: Not available. | ||||
本研究进行了Bacillus subtilis SM对木质素的降解研究,发现以Kraft木质素为唯一碳源的液体培养基KL-MSM中,SM可降解Kraft木质素进行生长代谢。GPC检测显示SM能部分降解Kraft木质素中高分子量成分,而对较低分子量的木质素片段则能降解成更小的化合物。SM在烟梗无机盐培养基中可使烟梗失重率达到50%以上,烟梗中木质素含量减少70%。本研究将从废次烟叶提取液(TWE)中分离获得的木质素降解菌SM回用到TWE环境中降低木质素含量,这方面的研究迄今未见报道。然而,Bacillus subtilis SM的木质素降解途径、机制和相应的降解酶仍需进行更深入细致的研究,以期提高和控制其木质素降解过程,并最终应用于实践生产。
| [1] | Zhou YQ, Zhou LQ, Zhang X, et al. Preliminary study on enhancing the use value of the cut-stem tobacco through the degaradation of lignin by biotechnology[J]. Journal of Yuxi Teachers' College, 2006, 22(6) : 61–63. (in Chinese) 周元清, 周丽清, 章新, 等. 用生物技术降解木质素提高烟梗使用价值初步研究[J]. 玉溪师范学院学报, 2006, 22(6) : 61–63. |
| [2] | Gosselink RJA, de Jong E, Guran B, et al. Co-ordination network for lignin-standardisation, production and applications adapted to market requirements (EUROLIGNIN)[J]. Industrial Crops and Products, 2004, 20(2) : 121–129. DOI:10.1016/j.indcrop.2004.04.015 |
| [3] | Wang YJ, Bi YY, Gao CY. The assessment and utilization of straw resources in China[J]. Agricultural Sciences in China, 2010, 9(12) : 1807–1815. DOI:10.1016/S1671-2927(09)60279-0 |
| [4] | Akpinar O, Erdogan K, Bakir U, et al. Comparison of acid and enzymatic hydrolysis of tobacco stalk xylan for preparation of xylooligosaccharides[J]. Food Science and Technology, 2010, 43(1) : 119–125. |
| [5] | Akpinar O, Erdogan K, Bostanci S. Enzymatic production of Xylooligosaccharide from selected agricultural wastes[J]. Food and Bioproducts Processing, 2009, 87(2) : 145–151. DOI:10.1016/j.fbp.2008.09.002 |
| [6] | Kleszyk P, Ratajczak P, Skowron P, et al. Carbons with narrow pore size distribution prepared by simultaneous carbonization and self-activation of tobacco stems and their application to supercapacitors[J]. Carbon, 2015, 81 : 148–157. DOI:10.1016/j.carbon.2014.09.043 |
| [7] | Wu XX, Xu CH, Li M, et al. Analysis and identification of two reconstituted tobacco sheets by three-level infrared spectroscopy[J]. Journal of Molecular Structure, 2014, 1069 : 133–139. DOI:10.1016/j.molstruc.2013.12.057 |
| [8] | Wang RX. Tobacco Chemistry[M]. Beijing: China Agriculture Press, 2003 . (in Chinese) 王瑞新. 烟草化学[M]. 北京: 中国农业出版社, 2003 . |
| [9] | Liu G, Yang F, Du YH, et al. Effects of lignin on phenol in mainstream smoke of reconstituted tobacco[J]. Chinese Journal of Spectroscopy Laboratory, 2012, 29(2) : 1118–1122. (in Chinese) 刘刚, 杨飞, 杜云海, 等. 木质素对再造烟叶烟气中苯酚的影响[J]. 光谱实验室, 2012, 29(2) : 1118–1122. |
| [10] | Yan KY, Yan HY, Li XB, et al. Comparative analysis of cell wall substances in flue-cured tobacco leaf[J]. Tobacco Science & Technology, 2005(10) : 6–11. (in Chinese) 闫克玉, 闫洪洋, 李兴波, 等. 烤烟烟叶细胞壁物质的对比分析[J]. 烟草科技, 2005(10) : 6–11. DOI:10.3969/j.issn.1002-0861.2005.10.002 |
| [11] | Wang YT, Xie JP, Zhang H, et al. Studies on technologies of removal of harmful components in cigarette smoke[J]. Acta Tabacaria Sinica, 2003, 9(3) : 1–7. (in Chinese) 王彦亭, 谢剑平, 张虹, 等. 降低卷烟烟气中有害成分的技术研究及应用[J]. 中国烟草学报, 2003, 9(3) : 1–7. |
| [12] | Ji KB. Study on content determination method and structural characterization of lignin in tobacco stem[D]. Guangzhou: Master's Thesis of Institute of South China University of Technology, 2013(in Chinese) 纪楷滨. 烟梗木质素的含量测定方法研究及结构表征[D]. 广州: 华南理工大学硕士学位论文, 2013 http://cdmd.cnki.com.cn/Article/CDMD-10561-1013319783.htm |
| [13] | Kudanga T, Nyanhongo GS, Guebitz GM, et al. Potential applications of laccase-mediated coupling and grafting reactions: a review[J]. Enzyme and Microbial Technology, 2011, 48(3) : 195–208. DOI:10.1016/j.enzmictec.2010.11.007 |
| [14] | Zhang HL, Ge CY, Mu HJ. Tobacco analysis and Inspection[M]. Zhengzhou: Henan Science and Technology Press, 1994 . (in Chinese) 张槐苓, 葛翠英, 穆怀静. 烟草分析与检验[M]. 郑州: 河南科学出版社, 1994 . |
| [15] | Dai YY, Zhong WH. Research progress on degradation of lignocellulose by Bacteria[J]. Chemistry & Bioengineering, 2016, 33(6) : 11–16. (in Chinese) 戴芸芸, 钟卫鸿. 细菌降解木质纤维素的研究进展[J]. 化学与生物工程, 2016, 33(6) : 11–16. |
| [16] | Bugg TD, Ahmad M, Hardiman EM, et al. The emerging role for bacteria in lignin degradation and bio-product formation[J]. Current Opinion in Biotechnology, 2011, 22(3) : 394–400. DOI:10.1016/j.copbio.2010.10.009 |
| [17] | Raj A, Chandra R, Reddy MMK, et al. Biodegradation of kraft lignin by a newly isolated bacterial strain Aneurinibacillus aneurinilyticus from the sludge of a pulp paper mill[J]. World Journal of Microbiology and Biotechnology, 2007, 23(6) : 793–799. DOI:10.1007/s11274-006-9299-x |
| [18] | Dence CW. The determination of lignin[A]//Lin SY, Dence CW. Methods in Lignin Chemistry[M]. Berlin: Springer-Verlag, 1992: 33-61 |
| [19] | Kong HH, Li XL, Huang YF, et al. Study on NaOH/urea dissolving method for determining lignin content in the tobacco stems in low temperature[J]. Acta Tabacaria Sinica, 2014, 20(3) : 9–15. (in Chinese) 孔浩辉, 李秀丽, 黄翼飞, 等. NaOH/尿素低温溶解法测定烟梗木质素含量的研究[J]. 中国烟草学报, 2014, 20(3) : 9–15. |
| [20] | Zhou JP, Zhang LN. Solubility of cellulose in NaOH/Urea aqueous solution[J]. Polymer Journal, 2000, 32(10) : 866–870. DOI:10.1295/polymj.32.866 |
| [21] | State Environmental Protection Administration. Water and wastewater monitoring and analysis methods[M].4th Edition. Beijing: China Environmental Science Press, 2002: 1 -784. (in Chinese) 国家环境保护总局. 水和废水监测分析方法[M].4版. 北京: 中国环境科学出版社, 2002: 1 -784. |
| [22] | Yu HY, Zeng GM, Huang GH, et al. Screening of lignin-degrading fungi and their enzyme production[J]. Chinese Journal of Applied & Environmental Biology, 2004, 10(5) : 639–642. (in Chinese) 郁红艳, 曾光明, 黄国和, 等. 木质素降解真菌的筛选及产酶特性[J]. 应用与环境生物学报, 2004, 10(5) : 639–642. |
| [23] | Jiang ZJ, Zhu JJ, Li X, et al. Determination of main degradation products of lignin using reversed-phase high performance liquid chromatography[J]. Chinese journal of chromatography, 2011, 29(1) : 59–62. (in Chinese) 江智婧, 朱均均, 李鑫, 等. 反相高效液相色谱法定量分析木质素的主要降解产物[J]. 色谱, 2011, 29(1) : 59–62. |
| [24] | Snyder LR, Kirkland JJ. Introduction to modern liquid chromatography[M].2nd Edition. Beijing: Chemical Industry Press, 1988 . (in Chinese) 斯奈德, 柯克兰. 现代液相色谱法导论[M].2版. 北京: 化学工业出版社, 1988 . |
| [25] | García-Aparicio MP, Ballesteros I, González A, et al. Effect of inhibitors released during steam-explosion pretreatment of barley straw on enzymatic hydrolysis[J]. Applied Biochemistry and Biotechnology, 2006, 129(1/3) : 278–288. |
| [26] | Hernández M, Rodríguez J, Soliveri J, et al. Paper mill effluent decolorization by fifty Streptomyces strains[J]. Applied and Environmental Microbiology, 1994, 60(11) : 3909–3913. |
| [27] | Zhang QF, Yu ZL. A strain of lignin-degrading bacteria, sscreening and optimization of enzyme-producing condition[J]. Journal of Agricultural Science and Technology, 2014(2) : 143–148. (in Chinese) 张庆芳, 于宗莲. 一株高效木质素降解细菌的筛选及产酶条件的优化[J]. 中国农业科技导报, 2014(2) : 143–148. |
| [28] | Fan YY, Li K, Zhang JH. The screening of the lignin-degraded bacterium and its lactase activity[J]. Animal Husbandry & Veterinary Medicine, 2015, 47(10) : 35–40. (in Chinese) 樊云燕, 李昆, 张锦华. 木质素降解菌的筛选及其漆酶性质研究[J]. 畜牧与兽医, 2015, 47(10) : 35–40. |
| [29] | Zaldivar J, Martinez A, Ingram LO. Effect of selected aldehydes on the growth and fermentation of ethanologenic Escherichia coli[J]. Biotechnology and Bioengineering, 1999, 65(1) : 24–33. DOI:10.1002/(ISSN)1097-0290 |
| [30] | Himmel ME, Tatsumoto K, Grohmann K, et al. Molecular weight distribution of aspen lignins from conventional gel permeation chromatography, universal calibration and sedimentation equilibrium[J]. Journal of Chromatography A, 1990, 498 : 93–104. DOI:10.1016/S0021-9673(01)84238-2 |
| [31] | Liu MX, Wei PY. Studies on the molecular weight distribution of lignins through gel permeation chromatography (GPC)[J]. China Pulp and Paper, 1988(5) : 49–53. (in Chinese) 刘铭祥, 魏鹏月. 用凝胶色谱法研究木素的分子量分布及其应用[J]. 中国造纸, 1988(5) : 49–53. |
| [32] | Wang Q, Wang H, Li HY, et al. Isolation, identification and enzyme activity determination of a high effective lignin-degradation fungi LG-1[J]. Feed Industry, 2016, 37(12) : 47–52. (in Chinese) 王全, 王会, 李红亚, 等. 一株高效木质素降解菌株LG-1的筛选鉴定及酶活测定[J]. 饲料工业, 2016, 37(12) : 47–52. |
| [33] | Li HY, Li SN, Wang SX, et al. Screening, Identification of lignin-degradating Bacillus MN-8 and its characteristics in degradation of maize straw lignin[J]. Scientia Agricultura Sinica, 2014, 47(2) : 324–333. (in Chinese) 李红亚, 李术娜, 王树香, 等. 产芽孢木质素降解菌MN-8的筛选及其对木质素的降解[J]. 中国农业科学, 2014, 47(2) : 324–333. DOI:10.3864/j.issn.0578-1752.2014.02.012 |
| [34] | Wang NX, Guo XJ, Li SN, et al. Screening and identification on Bacteria N13 with spore and capability of degrading cellulose[J]. Animal Husbandry & Feed Science, 2009, 30(9) : 7–10. (in Chinese) 王纳贤, 郭晓军, 李术娜, 等. 产芽孢木质素降解菌株N13的分离与鉴定[J]. 畜牧与饲料科学, 2009, 30(9) : 7–10. |
| [35] | Zhu DC, Li PP, Tanabe SH, et al. Genome sequence of the alkaliphilic bacterial strain Bacillus ligninesis L1, a novel degrader of Lignin[J]. Genome Announcements, 2013, 1(2) : e00042–13. |
| [36] | Zhu DC, Tanabe SH, Xie CX, et al. Bacillus ligniniphilus sp. nov. an alkaliphilic and halotolerant bacterium isolated from sediments of the South China Sea[J]. International Journal of Systematic and Evolutionary Microbiology, 2014, 64(5) : 1712–1717. |
| [37] | Wang Y, Liu YG, Xi XM, et al. Lignocellulose degrading ability of Bacillus subtilis and its enzyme production[J]. Journal of Microbiology, 2008, 28(4) : 1–6. (in Chinese) 王毅, 刘云国, 习兴梅, 等. 枯草芽胞杆菌降解木质纤维素能力及产酶研究[J]. 微生物学杂志, 2008, 28(4) : 1–6. |
 2017, Vol. 44
2017, Vol. 44




