扩展功能
文章信息
- 赵帆, 赵密珍, 王钰, 庞夫花
- ZHAO Fan, ZHAO Mi-Zhen, WANG Yu, PANG Fu-Hua
- 不同连作年限草莓根际细菌和真菌多样性变化
- Biodiversity of bacteria and fungi in rhizosphere of strawberry with different continuous cropping years
- 微生物学通报, 2017, 44(6): 1377-1386
- Microbiology China, 2017, 44(6): 1377-1386
- DOI: 10.13344/j.microbiol.china.170170
-
文章历史
- 收稿日期: 2017-03-01
- 接受日期: 2017-03-21
- 优先数字出版日期(www.cnki.net): 2017-03-24
2. 江苏省农业科学院果树研究所 江苏省高效园艺作物遗传改良重点实验室 江苏 南京 210014
2. Jiangsu Academy of Agricultural Sciences, Institute of Pomology, Jiangsu Key Laboratory for Horticultural Crop Genetic Improvement, Nanjing, Jiangsu 210014, China
草莓(Fragaria ananassa Duch)属蔷薇科(Rosaceae)草莓属植物,是一种营养价值和经济价值较高的水果,因其色、香、味俱佳,深受消费者青睐。草莓的主要栽培模式为一年一栽,主产区草莓连作障碍现象不仅在我国普遍存在,全世界栽培草莓地区连作障碍同样广泛存在。草莓在同一地块上连续种植2年以上,地下病虫害逐年严重,草莓长势逐年变弱,表现为植株发育受阻,甚至植株死亡,果品质量逐年变劣,产量逐年下降。草莓连作障碍已成为草莓栽培者及研究者广泛关注的焦点。目前,我国已经成为世界第一大草莓生产国[1],草莓连作障碍已严重制约了草莓产业的发展,亟待解决。土壤微生物影响着土壤养分的吸收和转化,微生物种群结构失衡是导致土壤质量下降、作物减产的主要原因[2]。傅佳等[3]、周陈等[4]研究表明,土壤微生物数量变化直接或间接影响土壤中养分的转化。作物连作年限过长,养分消耗单一,肥力水平下降,不利于养分的平衡供给,土壤微生物活性降低,影响了养分的利用效率,土壤微生物种群结构不合理,有害微生物数量逐渐占优势[5]。传统的土壤微生物研究方法如微生物平板培养法、Biolog鉴定系统法、生物标记法等[6]往往会过低估计土壤微生物的群落结构组成,无法详细描述出土壤微生物的群落结构组成方面的信息,也无法描绘出不同群体的生理差异。第二代测序Illumina MiSeq方法有效地避免了通量低、操作复杂和准确率低等缺陷[6-7],具有操作简单、成本较低的优势,并且采用边合成边测序原理,结果可信度高。MiSeq高通量测序平台,不仅可实现对多样品的多个可变区同时测序,而且在测序速度和测序通量上都有进一步提升。目前此平台已在微生物多样性群落结构研究方面得到广泛应用[8-9]。一些研究发现随草莓连作时间逐年增加,根际土壤中细菌数量逐渐降低,真菌数量逐渐升高,细菌和真菌的比值逐渐降低,土壤微生物由“细菌型”向“真菌型”转变,说明土壤真菌与草莓连作关系密切,其中病原真菌是草莓连作障碍因子之一,主要包括镰刀菌属、丝核菌属、轮枝菌属、疫霉属、腐霉属、拟盘多毛孢属和炭疽菌属等致病真菌。国内以镰刀菌和丝核菌为主[10]。不同连作年限草莓根际土壤细菌、真菌群落多样性变化目前还不清楚,本研究以不同连作年限草莓根际土壤为材料,采用高通量测序技术,探讨不同连作年限土壤细菌、真菌多样性的变化,以期为草莓连作障碍调控提供理论依据。
1 材料与方法试验于2016年9−11月在江苏省农业科学院草莓温室大棚进行。
1.1 试验材料试材为生长整齐一致的三叶一心期“宁玉”草莓苗;盆栽土壤分别采集于江苏省农业科学院白马植物基地里3个相邻的农田耕作层,其中一个农田已经荒废多年没有开垦(CK),一个农田连作1年(1Y)草莓且之前一直荒废多年,另一个农田连作8年(8Y)草莓。土壤基本理化性质见表 1。
| 处理 Treatments |
pH | 有机质 OM (g/kg) |
全氮 Total N (g/kg) |
全钾 Total K (mg/g) |
全磷 Total P (g/kg) |
碱解氮 Alkalyzable N (mg/kg) |
速效磷 Available P (mg/kg) |
速效钾 Readily available K (mg/kg) |
| CK | 7.31 | 21.49 | 0.85 | 10.68 | 1.02 | 65.28 | 42.38 | 229.30 |
| 1Y | 6.80 | 38.40 | 2.35 | 12.61 | 2.01 | 142.53 | 97.49 | 389.53 |
| 8Y | 6.79 | 32.22 | 2.38 | 12.34 | 2.12 | 153.67 | 110.02 | 491.99 |
将每种不同连作年限的土壤与珍珠岩以3:1的体积充分混匀装盆。塑料盆直径15 cm,深18 cm,每盆装土1 500 g,每盆栽草莓一株。草莓苗于2016年9月10日定植,定植后早晚各浇一次水并且适当遮阴7 d,之后正常水肥光照管理,温度维持在20−25 ℃之间,光周期约12 h (昼)/12 h (夜)。定植后50 d时(开花前)进行土壤取样及测定分析。各个土壤处理选取长势相似的3盆草莓,采用抖土法获取粘附在根系表面上的根际土壤并充分混匀,重复3次。取得的根际土壤一份于−20 ℃冷冻保存用于土壤微生物分析,一份4 ℃保存备测。
1.3 试验方法 1.3.1 土壤微生物基因组DNA的提取: 提取试剂盒为Omega土壤微生物DNA提取试剂盒,称取0.5 g −20 ℃保存的土壤样品,按试剂盒的试验步骤进行土壤微生物总DNA的提取,DNA样品于−20 ℃保存待用。 1.3.2 试验流程: 提取样品总DNA后,根据设计得到细菌V4+V5 (F:5′-GTGCCAGCMGCCGCGG-3′,R:5′-CCGTCAATTCMTTTRAGTTT-3′)和真菌ITS1+ITS2 (F:5′-CTTGGTCATTTAGAGGAAGT AA-3′,R:5′-GCTGCGTTCTTCATCGATGC-3′)合成的引物,合并引物接头,进行PCR扩增。PCR反应体系:含15 mmol/L MgCl2的10×Buffer 10.0 μL,2.5 mmol/L dNTPs 2.0 μL,10 μmol/L引物各5.0 μL,5 U/μL Taq酶1.0 μL,DNA模板4.0 μL,灭菌去离子水73.0 μL,总体积100 μL。PCR反应条件:94 ℃ 5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,30个循环;72 ℃ 10 min。然后对其产物进行纯化、定量和均一化形成测序文库,建好的文库先进行文库质检,质检合格的文库用Illumina HiSeq PE250进行测序,由南京集思慧远生物科技有限公司完成测序。1.4 生物信息分析方法 1.4.1 数据过滤及质量评估: 数据过滤主要步骤如下:(1) 去除平均质量值低于20的长Reads;(2) 去除Reads含N的碱基数超过3个的长Reads;(3) Reads长度范围为220−500 nt。 1.4.2 序列优化: 利用Mothur软件(version 1.34.4,http://www.mothur.org/)进行序列优化,主要步骤[11]如下:(1) 对序列进行筛选,去除模糊碱基数大于0、单碱基高重复区大于8、重叠区错配数大于0及长度大于97.5%的序列(细菌)、重叠区长小于20 bp的序列(真菌);(2) 进行去冗余处理。 1.4.3 OTU聚类分析: 为便于下游物种多样性分析,将Tags聚类为OTU (Operational taxonomic units)。首先把拼接的Tags中的Singletons (对应Reads只有一条的序列)过滤掉,因为Singletons可能由于测序错误造成,因此将这部分序列去除,不加入聚类分析,利用Usearch在0.97相似度下进行聚类,对聚类后的序列进行嵌合体过滤后,得到用于物种分类的OTU,每个OTU被认为可代表一个物种。1.5 数据分析随机选取相似度在97%条件下的OTU生成稀释曲线,并利用软件Mothur计算丰富度指数Chao和ACE,多样性指数Simpson和Shannon。基于RDP和UNITE分类学数据库对OTU进行物种注释,并用Excel和SPSS进行数据处理,利用Excel和R语言工具对样品物种组成及相对丰度统计结果绘制柱状图和Venn图。
2 结果与分析 2.1 土壤样品测序深度评估9个细菌样品测序,过滤后共获得124.7 Mb数据量,双端reads拼接后共产生331 079条Raw Tags,序列优化后共得到300 784条Clean Tags,聚类一共获得3 192个OTU;9个真菌样品测序,过滤后共获得82.7 Mb数据量,双端reads拼接后共产生344 316条Raw Tags,序列优化后共得到340 298条Clean Tags,聚类一共获得762个OTU。参照文献[12]随机抽取测序序列,将抽到的序列数与它们所能代表OTU的数目构建曲线,在97%相似性水平下聚类OTU并制作各样品的稀释曲线图(图 1),由图 1可知,细菌和真菌曲线逐渐趋向平坦,说明测序数量合理。
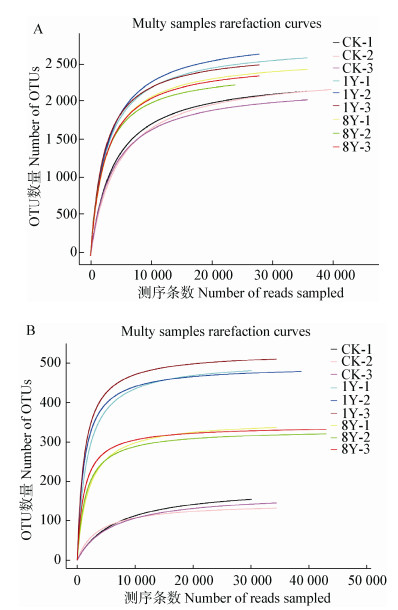
|
| 图 1 土壤样品细菌(A)、真菌(B)多样品稀释曲线 Figure 1 Bacterial (A) and fungal (B) rarefaction curves of different soil samples |
|
|
Observed species指数和Chao指数可反映群落物种丰富度,由表 2可知1Y草莓根际土壤细菌Observed species指数和Chao指数相较于CK分别增加了37.89%和22.66%,8Y草莓根际土壤细菌Observed species指数和Chao指数相较于CK分别增加了27.91%和12.71%,但是相较于1Y分别减少了7.24%和8.12%。1Y草莓根际土壤真菌Observed species指数和Chao指数相较于CK分别增加了3.3倍和2.1倍,8Y草莓根际土壤真菌Observed species指数和Chao指数相较于CK分别增加了1.1倍和1.1倍,但是相较于连作1年分别减少了34.21%和32.64%。显示土壤细菌和真菌群落物种丰富度的变化因连作年限的不同而有较大差异,草莓连作1年可增加土壤细菌和真菌群落物种丰富度,连作8年却会减少土壤细菌和真菌群落物种丰富度。
| 处理Treatments | 细菌(V4+V5区) Bacterial (V4+V5) | 真菌(ITS1+ITS2区) Fungal (ITS1+ITS2) | |||||||
| Observed species指数 | Chao指数 | Simpson指数 | Shannon指数 | Observed species指数 | Chao指数 | Simpson指数 | Shannon指数 | ||
| CK | 1 533.33 | 2 069.88 | 0.97 | 6.98 | 106.33 | 154.31 | 0.84 | 3.09 | |
| 1Y | 2 114.33 | 2 538.94 | 1.00 | 9.15 | 456.00 | 484.72 | 0.97 | 6.26 | |
| 8Y | 1 961.33 | 2 332.86 | 1.00 | 9.09 | 300.00 | 326.14 | 0.93 | 5.05 | |
Simpson指数和Shannon指数可反映群落物种多样性。由表 2可知,1Y草莓根际土壤细菌Simpson指数和Shannon指数相较于CK分别增加了3.09%和31.09%,8Y草莓根际土壤细菌Simpson指数相较1Y没有变化,Shannon指数相较于1Y减少了0.66%。1Y草莓根际土壤真菌Simpson指数和Shannon指数相较于CK分别增加了15.48%和1倍,8Y草莓根际土壤真菌Simpson指数和Shannon指数相较于1Y减少了4.12%和19.33%。可见土壤细菌和真菌群落物种多样性的变化因连作年限的不同而有较大差异,草莓连作1年可增加土壤细菌和真菌群落物种多样性,连作8年却会减少土壤细菌和真菌群落物种多样性。
2.3 不同连作年限草莓根际土壤微生物群落门类组成从门的分类水平看,草莓根际土壤样本中主要检测出细菌10个门,分属变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、芽单胞菌门(Gemmatim-onadetes)、疣微菌门(Verrucomicrobia)、绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteria)、蓝藻门(Cyanobacteria)、浮霉菌门(Planctomycetes)。其中,变形菌门、厚壁菌门、放线菌门、拟杆菌门和蓝藻门为草莓根际土壤的优势菌种(表 3),这些菌在CK、1Y、8Y草莓根际土壤中分别占细菌总数的87.86%、64.83%和61.79%。对各门细菌所占比例分析发现,不同连作年限草莓根际土壤中细菌群落组成发生明显变化(表 3)。芽单胞菌门、疣微菌门和绿弯菌门的比例随连作年限的增加而逐渐增加;蓝藻门的比例则逐渐减小。在1Y的草莓根际土壤生态系统中,变形菌门、酸杆菌门的比例较CK和8Y显著增加,厚壁菌门的比例较CK和8Y显著减小。
| 分类水平Taxonomy | 比例Ratios (%) | |||||
| 门Phyla | 属Genera | CK | 1Y | 8Y | ||
| 细菌 Bacteria |
变形菌门 | 26.10±0.26c | 38.95±0.76a | 32.33±0.87b | ||
| 伯克氏菌属 | 0.09±0.02b | 2.28±0.35a | 0.16±0.01b | |||
| Haliangium | 0.39±0.03c | 1.15±0.08a | 0.70±0.02b | |||
| 盐单胞菌 | 4.43±0.30a | 0.01±0.01b | 0.01±0.01b | |||
| 密斯氏菌属 | 0.24±0.02c | 1.04±0.05a | 0.93±0.01b | |||
| 厚壁菌门 | 13.88±0.51a | 2.89±0.27c | 4.93±0.33b | |||
| 葡萄球菌 | 5.42±0.16a | 0.04±0.02b | 0.01±0.01b | |||
| 芽孢杆菌属 | 0.26±0.02c | 0.72±0.03b | 1.23±0.08a | |||
| 喜盐芽孢杆菌属 | 4.11±0.16a | 0.01±0.01b | 0.00±0.00b | |||
| 动性球菌属 | 0.99±0.07a | 0.34±0.04b | 0.35±0.03b | |||
| 盐水球菌属 | 1.28±0.13a | 0.00±0.00b | 0.00±0.00b | |||
| 放线菌门 | 29.98±0.29a | 13.25±1.48b | 16.30±1.11b | |||
| Gaiella | 0.29±0.05c | 1.17±0.24a | 0.75±0.18b | |||
| 微杆菌属 | 1.80±0.11a | 0.05±0.02c | 0.07±0.03b | |||
| 涅斯捷连科氏菌属 | 7.57±0.15a | 0.09±0.03b | 0.06±0.01b | |||
| 类诺卡氏属 | 0.61±0.06c | 1.97±0.23b | 2.84±0.20a | |||
| 链霉菌属 | 1.17±0.05b | 2.95±0.28c | 5.61±0.36a | |||
| 短杆菌属 | 3.64±0.20a | 0.00±0.00b | 0.02±0.01b | |||
| 拟杆菌门 | 8.71±0.11a | 5.04±0.42b | 5.76±0.40b | |||
| 黄杆菌属 | 2.81±0.24a | 0.59±0.07b | 0.33±0.02c | |||
| Olivibacter | 3.36±0.04a | 0.00±0.00b | 0.00±0.00b | |||
| Niastella | 0.20±0.04a | 0.29±0.05a | 0.22±0.02a | |||
| Flavisolibacter | 0.06±0.04a | 0.13±0.01a | 0.35±0.12a | |||
| 芽单胞菌门 | 1.62±0.10b | 5.31±0.25a | 5.89±0.23a | |||
| 芽单胞菌属 | 0.37±0.02c | 1.69±0.13a | 0.92±0.09b | |||
| 疣微菌门 | 0.83±0.08a | 1.49±0.30a | 2.17±0.31a | |||
| 丰佑菌属 | 0.75±0.10a | 1.34±0.28a | 1.94±0.22a | |||
| 交替球菌属 | 0.02±0.01b | 0.08±0.02a | 0.09±0.02a | |||
| Luteolibacter | 0.00±0.00a | 0.01±0.01a | 0.01±0.00a | |||
| 绿弯菌门 | 3.14±0.09c | 9.06±0.22b | 11.27±0.39a | |||
| 玫瑰弯菌属 | 0.26±0.02b | 0.54±0.05a | 0.41±0.01a | |||
| 厌氧蝇菌属 | 0.01±0.01b | 0.04±0.02b | 0.57±0.04a | |||
| Nitrolancea | 0.05±0.02a | 0.10±0.01a | 0.06±0.02a | |||
| 酸杆菌门 | 3.13±0.15c | 10.62±0.45a | 8.79±0.34b | |||
| Blastocatella | 0.18±0.03b | 0.42±0.06a | 0.32±0.02a | |||
| Bryobacter | 0.09±0.02b | 0.20±0.01a | 0.24±0.07a | |||
| Candidatus Solibacter | 0.06±0.00b | 0.16±0.03a | 0.07±0.02b | |||
| 蓝藻门 | 9.19±0.22a | 4.70±0.68b | 2.47±0.08b | |||
| Microcoleus | 0.27±0.02a | 0.28±0.05a | 0.11±0.02b | |||
| Persicaria minor | 0.12±0.03a | 0.19±0.05a | 0.04±0.02a | |||
| 席藻属 | 0.26±0.01a | 0.03±0.01b | 0.00±0.00b | |||
| 浮霉菌门 | 1.59±0.03b | 4.58±0.51a | 4.53±0.57a | |||
| 浮霉状菌属 | 0.31±0.01b | 1.11±0.14a | 0.86±0.13b | |||
| 小梨形菌属 | 0.20±0.05b | 0.49±0.04a | 0.72±0.09a | |||
| Gemmata | 0.19±0.01b | 0.49±0.05a | 0.58±0.01a | |||
| 其它 | 1.80±0.09c | 4.21±0.29b | 5.55±0.20a | |||
| 真菌Fungi | 子囊菌门 | 68.91±0.56a | 52.40±0.73a | 60.43±3.39a | ||
| 链格孢属 | 0.42±0.04a | 0.36±0.02b | 0.06±0.01c | |||
| 节丛孢属 | 0.00±0.00b | 0.00±0.00b | 0.80±0.25a | |||
| 曲霉属真菌 | 0.09±0.02c | 1.97±0.18b | 5.99±0.06a | |||
| 镰刀菌属 | 0.00±0.00b | 0.31±0.11a | 0.34±0.09a | |||
| 油瓶霉属 | 0.01±0.01b | 0.43±0.08a | 0.00±0.00b | |||
| 绿僵菌属 | 0.00±0.00b | 0.77±0.06a | 0.01±0.01b | |||
| Mycothermus | 0.01±0.00b | 1.79±0.15a | 2.02±0.21a | |||
| 漆斑菌属 | 0.00±0.01b | 0.30±0.03a | 0.39±0.12a | |||
| Parascedosporium | 0.00±0.00b | 0.03±0.00b | 0.94±0.08a | |||
| 青霉菌属 | 0.02±0.01c | 0.98±0.08b | 2.30±0.20a | |||
| Remersonia | 0.00±0.00c | 0.21±0.05b | 1.84±0.16a | |||
| 葡萄穗霉属 | 0.00±0.00c | 0.14±0.06b | 0.25±0.03a | |||
| 踝节菌属 | 0.01±0.01b | 1.29±0.19a | 1.42±0.10a | |||
| Westerdykella | 0.00±0.00b | 0.00±0.00b | 0.67±0.07a | |||
| 担子菌门 | 0.26±0.03b | 16.66±0.86a | 15.75±0.14a | |||
| Phylloporus | 0.01±0.01b | 0.80±0.23a | 0.85±0.13a | |||
| Pseudozyma | 0.00±0.00c | 0.15±0.02b | 0.27±0.10a | |||
| 粉褶蕈属 | 0.03±0.02b | 0.28±0.08a | 0.00±0.00b | |||
| 接合菌门 | 0.02±0.00b | 7.28±0.16a | 15.87±2.79a | |||
| 被孢霉属 | 0.02±0.00a | 7.28±0.16b | 15.15±2.80c | |||
| 壶菌门 | 0.04±0.01c | 5.49±0.21a | 1.51±0.13b | |||
| Rhizophlyctis | 0.00±0.00b | 1.42±0.10a | 0.00±0.01b | |||
| Pateramyces | 0.00±0.00a | 0.00±0.00a | 0.05±0.02a | |||
| Rhizophydium | 0.01±0.01a | 0.01±0.00a | 0.00±0.00a | |||
| 新美鞭菌门 | 0.00±0.00a | 0.00±0.00a | 0.02±0.01a | |||
| Anaeromyces | 0.00±0.00a | 0.00±0.00a | 0.02±0.01a | |||
| 其它 | 30.77±0.54a | 18.17±0.05b | 6.44±0.54c | |||
| 注:每个给定菌群的相对丰度按照测得该菌序列reads数/总测序reads数计算.数据为x±s (n=3).不同字母表示差异显著(p < 0.05).表中仅列出确定的属. Note:The relative abundance of each given group of bacterial was calculated based on pertentage of the reading of sequences of the given group to the reading of the total sequences measured. Data shown were x±s (n=3). Different letters mean significant difference (p < 0.05). Only established genera were listed here. |
||||||
测序结果表明,从草莓根际土壤中鉴定得到的真菌主要来自5个门,包括子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、接合菌门(Zygomycota)、壶菌门(Chytridiomycota)和新美鞭菌门(Neocallimastigomycota) (表 3)。其中,优势菌群为子囊菌门和担子菌门,这两种真菌在CK、1Y、8Y草莓根际土壤中分别占真菌群落的69.17%、69.06%和76.18%。接合菌门的比例随连作年限的增加而逐渐增加,在1Y的草莓根际土壤生态系统中,担子菌门、接合菌门和壶菌门的比例较CK显著增加,分类地位尚不明确或尚未鉴定的真菌比例随连作年限的增加而显著减少。以上结果显示,随连作年限的延长,草莓根际土壤生态系统中细菌和真菌群落各门类组成的比例会发生显著变化。
进一步从属的角度分析发现,不同连作年限草莓根际土壤中的细菌和真菌群落的组成比例同样发生明显改变(表 3)。对不同年限间的比较发现,CK草莓根际土壤中丰度显著增加的细菌群落主要为盐单胞菌(Halomonas)、葡萄球菌属(Staphylococcus)、Halobacillus、动球菌属(Planococcus)、盐水球菌属(Salinicoccus)、微杆菌属(Microbacterium)、涅斯捷连科氏菌属(Genus Nesterenkonia)、短杆菌属(Brevibacterium)、黄杆菌属(Flavobacterium)、Olivibacter、席藻属(Phormidium)。1Y草莓根际土壤中丰度显著增加的细菌群落主要为伯克氏菌属(Burkholderia)、Haliangium、密斯氏菌属(Smithella)、芽孢杆菌属(Bacillus)、Gaiella、类诺卡氏属(Nocardioides)、链霉菌属(Streptomyces)、芽单胞菌属(Gemmatimonas)、玫瑰弯菌属(Roseiflexus)、Blastocatella、Bryobacter、Candidatus Solibacter、浮霉状菌属(Planctomyces)、Pirellula、Gemmata。8Y草莓根际土壤中丰度显著增加的细菌群落主要为Haliangium、密斯氏菌属(Smithella)、芽孢杆菌属(Bacillus)、Gaiella、类诺卡氏属(Nocardioides)、链霉菌属(Streptomyces)、芽单胞菌属(Gemmatimonas)、Alterococcus、玫瑰弯菌属(Roseiflexus)、厌氧绳菌属(Anaerolinea)、Blastocatella、Bryobacter、Pirellula、Gemmata。
对已确定分类地位至属的真菌分析表明,不同连作年限草莓真菌群落组成也发生显著改变(表 3)。CK草莓根际土壤中丰度显著增加的真菌群落主要为链格孢属,1Y草莓根际土壤中丰度显著增加的真菌群落主要为曲霉属真菌(Aspergillus)、镰刀菌属(Fusarium)、油瓶霉属(Lecythophora)、绿僵菌属(Metarhizium)、Mycothermus、漆斑菌属(Myrothecium)、青霉菌属(Penicillium)、Remersonia、葡萄穗霉属(Stachybotrys)、踝节菌属(Talaromyces)、Phylloporus、Pseudozyma、粉褶蕈属(Entoloma)、被孢霉属(Mortierella)、Rhizophlyctis。8Y草莓根际土壤中丰度显著增加的真菌群落主要为节丛孢属(Arthrobotrys)、曲霉属真菌(Aspergillus)、镰刀菌属(Fusarium)、Mycothermus、漆斑菌属(Myrothecium)、Parascedosporium、青霉菌属(Penicillium)、Remersonia、葡萄穗霉属(Stachybotrys)、踝节菌属(Talaromyces)、Westerdykella、Phylloporus、Pseudozyma、被孢霉属(Mortierella)。Pateramyces、根生壶菌属(Rhizophydium)和厌氧鞭菌属(Anaeromyces)所占比例均未发生显著变化。
2.4 不同连作年限草莓根际土壤细菌、真菌类群分析在97%的相似性下,得到了每个样品的OTU个数,如表 4所示,CK、1Y、8Y分别获得2 089、2 639和2 420个细菌OTU,以及153、592和417个真菌OTU。Venn图能够反映组间或样品之间共有和特有OTU的数目,直观地表现出组间或样品间OTU的重叠情况[13]。结合OTU所代表的物种,可以找出不同环境中的核心微生物。从图 2A中可以看出,不同处理之间共有的细菌OTU数目为1 486个,代表的物种分别属于放线菌纲(Actinobacteria)、暖绳菌纲(Caldilineae)、α-变形菌纲(Alphaproteobacteri)、全噬菌纲(Holophagae)和丰佑菌纲(Opitutae)等。各个处理之间也存在差异,CK与1Y之间共有984个各自独有OTU;CK与8Y之间共有1 311个各自独有OTU;1Y与8Y之间共有1 117个各自独有OTU。
| 处理 Treatments |
细菌(V4+V5区)OTU个数 Bacterial (V4+V5) OTU numbers |
真菌(ITS1+ITS2区) OTU个数 Fungal (ITS1+ITS2) OTU numbers |
| CK | 2 089 | 153 |
| 1Y | 2 639 | 592 |
| 8Y | 2 420 | 417 |
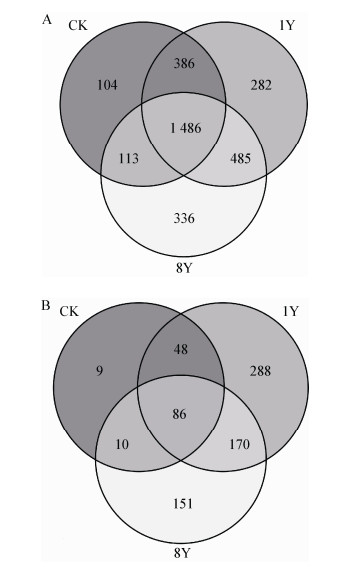
|
| 图 2 不同连作年限草莓根际土壤细菌(A)、真菌(B) Venn图 Figure 2 Venn diagrams of soil bacterial (A) and fungal (B) community with strawberry rhizosphere of different continuous cropping years |
|
|
从图 2B中可以看出,各处理之间共有的真菌OTU数目为86个,主要共有物种分别属于粪壳菌纲(Sordariomycetes)、散囊菌纲(Eurotiomycetes)、伞菌纲(Agaricomycetes)和座囊菌纲(Dothideomycetes)等。各个处理之间也存在差异,CK与1Y之间共有477个各自独有OTU;CK与8Y之间共有377个各自独有OTU;1Y与8Y之间共有497个各自独有OTU。
3 结论与讨论连作障碍,也称再植病或土壤病,是一种特殊的植物化感现象,是指同一地块连续多年种植相同作物造成作物生长状况变差、产量和品质降低、病虫害发生加剧的现象。前人研究表明,造成作物连作障碍的原因可能是多方面的,比如土壤营养失衡、土壤理化性质恶化、自毒物质积累等[14]。越来越多的研究者认为,植物产生的化感自毒物质是作物连作障碍的重要原因,这些物质存在于土壤中,会抑制下一茬同类植物的生长。相关研究表明,草莓的根系分泌物含有乳酸、苯甲酸、琥珀酸、己二酸和对羟基苯甲酸,其中苯甲酸明显抑制根重,对草莓生长抑制作用最强[15]。化感物质可单独对草莓植株造成危害,也可与其他病原复合作用危害草莓,同时促进连作土壤中病原菌菌丝生长、孢子萌发及侵染,加重连作草莓土传根部病害,最终导致再植病害的发生[16]。但是,近年来越来越多的学者认为,根系分泌物生态效应的间接作用及土壤微生物区系紊乱是导致植物连作障碍形成的主要因素[17]。这可能是由于在根系分泌物特定组分的介导下,某些类群的微生物(如土传病原菌)大量繁殖,同时抑制其他有益微生物(如假单胞菌等拮抗菌)的生长,进而改变了植物根系分泌物的组分和数量,为趋化性病原微生物提供更多的碳源、能源,形成恶性循环,造成植物生长发育不良。
本实验中,变形菌门、厚壁菌门、放线菌门、拟杆菌门和蓝藻门为草莓根际土壤细菌的优势菌种。芽单胞菌门、疣微菌门和绿弯菌门的比例随连作年限的增加而逐渐增加;蓝藻门的比例则逐渐减小。在1Y的草莓根际土壤生态系统中,变形菌门、酸杆菌门的比例较CK和8Y显著增加,厚壁菌门的比例较CK和8Y显著减小。真菌优势菌群为子囊菌门和担子菌门。接合菌门的比例随连作年限的增加而逐渐增加,在1Y的草莓根际土壤生态系统中,担子菌门、接合菌门和壶菌门的比例较CK显著增加,分类地位尚不明确或尚未鉴定的真菌比例随连作年限的增加而显著减少。以上结果显示,随连作年限的延长,草莓根际土壤生态系统中细菌和真菌群落各门类组成的比例会发生显著变化。前人研究发现,长期施肥能够影响作物根际微生物的群落组成[18],虽然本研究在采集草莓8年土壤时尽量避开施肥区域,但在长期种植过程中,施肥对草莓根际微生物多样性的影响仍不可避免。因此,可能是根系分泌物介导下的土壤微生物群落结构与功能多样性变化对草莓的生长发育产生重要的影响。
从属的角度分析发现,1Y和8Y草莓根际土壤中丰度显著增加的真菌群落有镰刀菌属(Fusarium)。镰刀菌属(Fusarium)为真菌中较大的一个属,它广泛分布于自然界中,兼寄生或腐生生活。它是人类发现的最重要的植物病原菌之一。它可侵染多种植物(粮食作物、油料作物、经济作物、药用植物及观赏植物)造成植物萎焉、根腐、穗腐等各种类型的腐烂病,导致严重的减产,从而造成重大的经济损失[19]。我国报道的草莓根腐病主要为草莓黑根腐病和红中柱根腐病,已分离鉴定的病原真菌中就有尖孢镰刀菌[20]。
序列分析中有部分属于Norank序列,即在与现有数据库中已知序列进行比对时,无法获得该序列的分类学信息。因此,推断这些序列可能是一些新发现的土壤微生物类群,还需采用其他分析手段进一步鉴定。
| [1] | Tan CH, Dai HP, Lei JJ. Status quo and development trend of world strawberry production and trade[J]. World Agriculture, 2003(5) : 10–12, 40. (in Chinese)谭昌华, 代汉萍, 雷家军. 世界草莓生产与贸易现状及发展趋势(上)[J]. 世界农业, 2003(5) : 10–12, 40. |
| [2] | Ma K, Zhang L, Du Q, et al. Effect of potato continuous cropping on soil microorganism community structure and function[J]. Journal of Soil and Water Conservation, 2010, 24(4) : 229–233. (in Chinese)马琨, 张丽, 杜茜, 等. 马铃薯连作栽培对土壤微生物群落的影响[J]. 水土保持学报, 2010, 24(4) : 229–233. |
| [3] | Fu J, Li XS, Fu JF. The effects of continuous cropping American Ginseng on soil microbes and soil physicochemical properties[J]. Journal of Microbiology, 2009, 29(2) : 63–66. (in Chinese)傅佳, 李先思, 傅俊范. 重茬种植西洋参对其根区土壤微生物与土壤理化性质影响[J]. 微生物学杂志, 2009, 29(2) : 63–66. |
| [4] | Zhou C, Li X, Yang MK, et al. Dynamic change of soil microorganisms and soil nutrition at different growing stage of winter wheat[J]. Acta Agriculture Boreali-Occidentalis Sinica, 2008, 17(3) : 113–116. (in Chinese)周陈, 李许, 杨明开, 等. 冬小麦不同生育期土壤微生物及养分动态变化[J]. 西北农业学报, 2008, 17(3) : 113–116. |
| [5] | Hu RX, Zhao SY, Tan ZJ, et al. The effect of continuous tobacco cropping on the microbes and enzyme activities in rice soil[J]. Journal of Nuclear Agricultural Sciences, 2007, 21(5) : 494–497. (in Chinese)胡汝晓, 赵松义, 谭周进, 等. 烟草连作对稻田土壤微生物及酶的影响[J]. 核农学报, 2007, 21(5) : 494–497. |
| [6] | Schirmer M, Ijaz UZ, D'Amore R, et al. Insight into biases and sequencing errors for amplicon sequencing with the Illumina MiSeq platform[J]. Nucleic Acids Research, 2015, 43(6) : e37. DOI:10.1093/nar/gku1341 |
| [7] | Williams ST, Foster PG, Littlewood DTJ. The complete mitochondrial genome of a turbinid vetigastropod from MiSeq Illumina sequencing of genomic DNA and steps towards a resolved gastropod phylogeny[J]. Gene, 2014, 533(1) : 38–47. DOI:10.1016/j.gene.2013.10.005 |
| [8] | Sogin ML, Morrison HG, Huber JA, et al. Microbial diversity in the deep sea and the underexplored "rare biosphere"[J]. Proceeding of the National Academy of Sciences of the United States of America, 2006, 103(32) : 12115–12120. DOI:10.1073/pnas.0605127103 |
| [9] | Konstantinidis KT, Tiedje JM. Genomic insights that advance the species definition for prokaryotes[J]. Proceeding of the National Academy of Sciences of the United States of America, 2005, 102(7) : 2567–2572. DOI:10.1073/pnas.0409727102 |
| [10] | Elad Y, Chet I, Henis Y. Biological control of Rhizoctonia solani in strawberry fields by Trichoderma harzianum[J]. Plant and Soil, 1981, 60(2) : 245–254. DOI:10.1007/BF02374109 |
| [11] | Kozich JJ, Westcott SL, Baxter NT, et al. Development of a dual-index sequencing strategy and curation pipeline for analyzing amplicon sequence data on the MiSeq Illumina sequencing platform[J]. Applied and Environmental Microbiology, 2013, 79(17) : 5112–5120. DOI:10.1128/AEM.01043-13 |
| [12] | Amato KR, Yeoman CJ, Kent A, et al. Habitat degradation impacts black howler monkey (Alouatta pigra) gastrointestinal microbiomes[J]. The ISME Journal, 2013, 7(7) : 1344–1353. DOI:10.1038/ismej.2013.16 |
| [13] | Chen H, Boutros PC. Venn Diagram: a package for the generation of highly-customizable Venn and Euler diagrams in R[J]. BMC Bioinformatics, 2011, 12(1) : 35. DOI:10.1186/1471-2105-12-35 |
| [14] | Zhang CY, Lin WX. Continuous cropping obstacle and allelopathic autotoxicity of medicinal plants[J]. Chinese Journal of Eco-Agriculture, 2009, 17(1) : 189–196. (in Chinese)张重义, 林文雄. 药用植物的化感自毒作用与连作障碍[J]. 中国生态农业学报, 2009, 17(1) : 189–196. |
| [15] | Kitazawa H, Asao T, Ban T, et al. Autotoxicity of root exudates from strawberry in hydroponic culture[J]. The Journal of Horticultural Science and Biotechnology, 2005, 80(6) : 677–680. DOI:10.1080/14620316.2005.11511997 |
| [16] | Dai L, Zhao HM, Zhen WC. Study on allelopathy in strawberry replanting disease[J]. Science & Technology Review, 2006, 24(6) : 52–54. (in Chinese)代丽, 赵红梅, 甄文超. 草莓再植病害中的化感作用研究[J]. 科技导报, 2006, 24(6) : 52–54. |
| [17] | Qi JJ, Yao HY, Ma XJ, et al. Soil microbial community composition and diversity in the rhizosphere of a Chinese medicinal plant[J]. Communications in Soil Science and Plant Analysis, 2009, 40(9/10) : 1462–1482. |
| [18] | Lundberg DS, Lebeis SL, Paredes SH, et al. Defining the core Arabidopsis thaliana root microbiome[J]. Nature, 2012, 488(7409) : 86–90. DOI:10.1038/nature11237 |
| [19] | Zhang XM. History and current research on taxonomy of the genus Fusarium[J]. Journal of Fungal Research, 2005, 3(2) : 59–62. (in Chinese)张向民. 镰刀菌属分类学研究历史与现状[J]. 菌物研究, 2005, 3(2) : 59–62. |
| [20] | Zeng FC, Huang Y, Zhao YQ, et al. Biological characteristics of strawberry fusarium wilt[J]. Journal of Sichuan Agricultural University, 2006, 24(2) : 157–160. (in Chinese)曾富春, 黄云, 赵艳琴, 等. 草莓枯萎病菌的生物学特性[J]. 四川农业大学学报, 2006, 24(2) : 157–160. |
 2017, Vol. 44
2017, Vol. 44




