扩展功能
文章信息
- 陶新娉, 王彬, 管清真, 王彦, 杨淑仪, 刘守柱
- TAO Xin-Ping, WANG Bin, GUAN Qing-Zhen, WANG Yan, YANG Shu-Yi, LIU Shou-Zhu
- 莱氏绿僵菌对斜纹夜蛾的致病力及生理效应
- Virulence and physiological effects of Metarhizium rileyi against Spodoptera litura
- 微生物学通报, 2017, 44(6): 1349-1357
- Microbiology China, 2017, 44(6): 1349-1357
- DOI: 10.13344/j.microbiol.china.160644
-
文章历史
- 收稿日期: 2016-09-09
- 接受日期: 2016-11-18
- 优先数字出版日期(www.cnki.net): 2016-11-29
莱氏绿僵菌(Metarhizium rileyi)属子囊菌门(Ascomycota)粪壳菌纲(Sordariomycetes)肉座菌目(Hypocreales)麦角菌科(Clavicipitacea),是一种广泛分布的昆虫病原真菌(Entomopathogenic fungus)。M. rileyi旧称莱氏野村菌Nomuraea rileyi,是野村菌属的模式种,但Kepler比较了Metarhizium和Nomuraea属的若干蛋白质编码基因后,认为Nomuraea属应当合并到Metarhizium属中[1],因此N. rileyi相应地改成M. rileyi。该菌可以寄生多种鳞翅目害虫,尤其对夜蛾科害虫具有较高的侵染能力[2]。除了昆虫外,该菌对牛身上的寄生性蜱虫Rhipicephalus microplus也有一定的防治效果[3]。作为一种生防菌,莱氏绿僵菌在国外的研究和利用取得了较大的成功[4],在田间应用并引起了昆虫疾病的流行。国内对该菌的研究和利用也取得了很多成果:在应用方面,研究了M. rileyi对甜菜夜蛾Spodoptera exigua[5]、棉铃虫Helicoverpa armigera[6]、斜纹夜蛾Spodoptera litura[7]等夜蛾科害虫的致病力;在寄主-病原菌互作方面研究了孢子附着机制[8]、侵染过程中的几丁质酶活性[9]、侵染后的寄主抗氧化酶活性变化[10]等生理生化过程,筛选出了一批致病力强的菌株,为实际应用奠定了良好的技术基础。
作为一种侵染性的致病菌,莱氏绿僵菌主要通过体壁穿透进入昆虫的血腔,因而其致病能力的强弱在一定程度上取决于体壁穿透能力。在体壁穿透过程中,几丁质酶是必不可少的活性成分,协助孢子萌发的芽管溶解体壁,进入血腔[9]。芽管侵入昆虫血腔后,通过出芽或裂解的方式进行增殖,形成酵母状的细胞(Yeast-like cells),称为虫菌体(Hyphal bodies)。虫菌体利用昆虫血淋巴中的营养成分进行扩增,其数量增长到一定程度后,诱导寄主产生密度感应分子(Quorum-sensing molecular,QSM),QSM进一步诱导改变虫菌体的生长方式,由出芽生长转变为两端生长,形成真正的菌丝(Mycelia)并杀死寄主[2, 11]。
一般认为,大部分病原微生物在侵入昆虫体内后会触发寄主的免疫反应,然后被寄主通过吞噬作用(Phagocytosis)、形成结节(Nodule formation)、包囊反应(Encapsulation)、黑化反应(Melanization)等过程清除。作为关键因子,酚氧化酶(Phenoloxidase,PO)在免疫反应中起着非常重要的作用[12]。因此,是否引起寄主的免疫反应,以及免疫反应的强弱,决定了昆虫病原菌穿透寄主体壁屏障后在寄主血腔内定殖的成功率,直接影响生防菌的防治效果。
为了进一步了解莱氏绿僵菌对斜纹夜蛾的侵染能力及致病机制,以Nr5772为供试菌株,测定了M. rileyi对不同龄期斜纹夜蛾幼虫和蛹的致死能力,以及侵染后的发育过程和寄主的生理反应,以期为该菌的开发利用提供理论指导。
1 材料与方法 1.1 主要试剂、仪器及培养基多巴胺,Sigma公司;ImrkTM酶标仪,Bio-Rad公司;OlympusTM BX51显微镜及OlympusTM DP72显微摄像头,奥林巴斯公司。莱氏绿僵菌培养基采用萨氏麦芽糖酵母琼脂培养基(SMAY),根据文献[11]报道的方法配制。
1.2 供试菌株与试虫饲养莱氏绿僵菌Nr5772菌株,由美国佛罗里达大学Drion G. Boucias教授提供,在实验室内用SMAY继代培养,冷藏保存。鉴于菌种多次培养保存后有活力退化现象,因而使用前先接种斜纹夜蛾进行复壮,然后从僵尸回接至培养基,纯化后使用。
斜纹夜蛾第一代购自河南科云生物公司,在人工气候养虫室内用人工饲料继代饲养,饲料配制参照文献[13]报道的方法进行。养虫室温度25,相对湿度50%,光暗比16 h:8 h。斜纹夜蛾1-3龄幼虫置于90 mm培养皿内饲养,4龄后置于30 mL养虫盒内单头饲养。
1.3 孢子悬浮液制备为最大限度保证孢子的活力,从接种后死亡的斜纹夜蛾僵尸上刮取孢子粉,将其放于15 mL离心管中,加入10 mL含吐温-80 (0.01%)的无菌水,振荡均匀,使之形成稳定的悬浮液,然后用血球计数板计数孢子浓度,3 000 r/min离心5 min后弃去上清液,加入适量的吐温-80水,调整孢子浓度为5×109个/mL,然后10倍稀释,得到5×109-5×105个/mL的孢子悬浮液各5 mL,用作试虫或蛹的毒力测定。
1.4 M. rileyi对斜纹夜蛾的毒力测定采用浸渍法分别接种斜纹夜蛾幼虫和蛹。用镊子夹取斜纹夜蛾3、4、5和6龄幼虫及蛹,放入各浓度莱氏绿僵菌孢子悬液中浸渍10 s后移入玻璃皿中自然晾干,然后移入放有人工饲料的养虫盒中单头饲养。每个浓度处理试虫20头,以0.01%吐温-80水处理作为对照。接种后置于人工气候养虫室中饲养,观察、记录10 d死亡虫数或至化蛹。重复3次。
蛹晾干后放入用湿润脱脂棉保湿的玻璃皿中,每个浓度处理蛹30只,以0.01%吐温-80水处理作为对照。置于人工气候养虫室中,每天观察,记录死亡蛹数直至羽化。重复3次。
1.5 离体虫菌体制备及接种用接种环从Nr5772平板中刮取分生孢子,接入含有萨氏麦芽糖酵母液体培养基(SMY)的三角瓶中,25、180 r/min振荡培养3 d,制备离体虫菌体[11]。取1 mL培养好的虫菌体,用血球计数板计数虫菌体数量后,3 000 r/min离心5 min,移去液体培养基,加入适量无菌水,调整数量为2.5×103个/μL,用于试虫接种。
离体虫菌体的接种采用注射法。挑选健壮的5龄幼虫30只,70%酒精消毒后,用10 μL的尖头微量进样器吸取2 μL虫菌体悬浮液,经由腹足进行穿刺,将虫菌体注射入试虫血腔,缓慢抽出针尖,以不流血淋巴或流量较小为注射成功标准。以注射相同量无菌水的试虫作为对照。所有试虫置于养虫盒中,按前述方法饲养。
1.6 血淋巴采集、虫菌体发育观察及斜纹夜蛾幼虫血细胞计数幼虫注射接种后,分别在10、20、24、32、44、55、64、72 h后用消毒的昆虫针穿刺腹足,把血淋巴滴在冰冷的Parafilm膜上,每头幼虫提取30 μL左右,分装于3个预冷的1.5 mL离心管中,分别用于虫菌体计数、拍照,以及血细胞计数和酚氧化酶活性测定。每次取样3只幼虫。
虫菌体和血细胞总数用血球计数板在普通显微镜下进行计数,由于感染后期虫菌体数量太多,需要进行稀释。虫菌体在不同阶段的形态特征用装备有显微摄像头OlympusTM DP72的显微镜OlympusTM BX51进行拍照。
1.7 酚氧化酶活性测定酚氧化酶的活性测定采用酶标仪法进行[14],并稍有改动。简言之,血淋巴用2倍的磷酸缓冲液(0.2 mol/L Na2HPO4-NaH2PO4,pH 7.0) 稀释后取10 μL加入96孔板,然后再加入90 μL上述磷酸缓冲液,用移液枪吹匀后加入100 μL 20 mmol/L多巴胺,使总测酶活体系为200 μL。反应开始后,用Bio-Rad ImrkTM酶标仪在495 nm处检测吸光度(OD)的动态变化(动力学检测),每隔60 s测量一次,间隔期振荡30 s,共测10次,以稀释后每10 μL血淋巴每分钟OD495值变化0.001为1个酶活力单位(1 U)。各处理血淋巴分别采自3头幼虫,PO活性测定3次。
1.8 数据统计分析采用SPSS 22.0软件对所获得的数据进行分析。M. rileyi分生孢子对斜纹夜蛾幼虫的LC50、LT50计算根据参考文献[15]报道的方法进行,其他数据的差异显著性用ANOVA方差分析。
2 结果与分析 2.1 M. rileyi对斜纹夜蛾的毒力测定不同龄期的幼虫对M. rileyi的敏感性不同(表 1),3龄幼虫易受病菌感染,LC50最低;6龄虫的抵抗力则较强。以3龄幼虫LC50为标准计算相对毒力指数,可以看出莱氏绿僵菌分生孢子对6龄幼虫的毒力极低,较3龄虫低1 000倍以上。M. rileyi分生孢子对不同龄期幼虫的差异较大,并随幼虫龄期增加而提高。
| 虫龄 Instar |
回归方程 Regression |
LC50 (conidia/mL) |
毒力指数 Toxic index |
| 3 | Y=−3.947+0.608x | 3.12×106 | 100.00 |
| 4 | Y=−5.552+0.769x | 1.65×107 | 18.909 |
| 5 | Y=−4.237+0.573x | 2.46×107 | 12.683 |
| 6 | Y=−7.018+0.733x | 3.79×109 | 0.082 |
随着孢子浓度的增加,各龄期幼虫的死亡速度增快,LT50变小(表 2)。相同孢子浓度处理,低龄幼虫死亡速度快于高龄幼虫,趋势明显。低浓度(5×105孢子/mL)处理,4、5龄幼虫最终累计死亡率较低,未能测得LT50。除5×109孢子/mL处理外,6龄幼虫各浓度处理最终累计死亡率均较低,大部分化蛹并成功羽化,因而也未能测定LT50。总体来看,幼虫龄期越小,孢子浓度越高,死亡速度越快。
| 虫龄 Instar |
孢子浓度(个/mL) Conidia (cell/mL) |
回归方程 Regression |
LT50 (d) |
| 3 | 5×105 | y=−5.784+0.718x | 8.06 |
| 5×106 | y=−5.547+0.955x | 6.81 | |
| 5×107 | y=−5.954+1.099x | 6.42 | |
| 5×108 | y=−7.288+1.501x | 4.86 | |
| 5×109 | y=−6.954+1.527x | 4.55 | |
| 4 | 5×105 | − | − |
| 5×106 | y=−6.232+0.780x | 7.99 | |
| 5×107 | y=−5.594+0.748x | 7.48 | |
| 5×108 | y=−7.268+1.094x | 6.64 | |
| 5×109 | y=−6.974+1.187x | 5.85 | |
| 5 | 5×105 | − | − |
| 5×106 | y=−6.815+0.608x | 9.34 | |
| 5×107 | y=−7.240+0.902x | 8.02 | |
| 5×108 | y=−5.542+0.740x | 7.49 | |
| 5×109 | y=−8.020+1.239x | 6.55 | |
| 注:−:由于死亡率低,未测出LT50. Note: −: LT50was not determined due to the low mortality. | |||
M. rileyi孢子不仅可以寄生斜纹夜蛾幼虫,对蛹也有一定的寄生能力,但致病性较弱(表 3)。5×109孢子/mL处理后10 d,累计死亡率为33.3%,大部分蛹均正常羽化,低浓度处理未见死亡蛹,说明蛹不是该菌的主要寄生虫态。
| 孢子浓度(个/mL) Conidia (cells/mL) |
累计校正死亡率 Corrected mortality (%) |
|||||
| 1−6 d | 7 d | 8 d | 9 d | 10 d | ||
| 对照control | 0 | 0 | 0 | 0 | 0 | |
| 5×105 | 0 | 0 | 0 | 0 | 0 | |
| 5×106 | 0 | 0 | 0 | 0 | 0 | |
| 5×107 | 0 | 0 | 0 | 0 | 0 | |
| 5×108 | 0 | 0 | 0 | 3.33 | 6.67 | |
| 5×109 | 0 | 0 | 20 | 30.00 | 33.33 | |
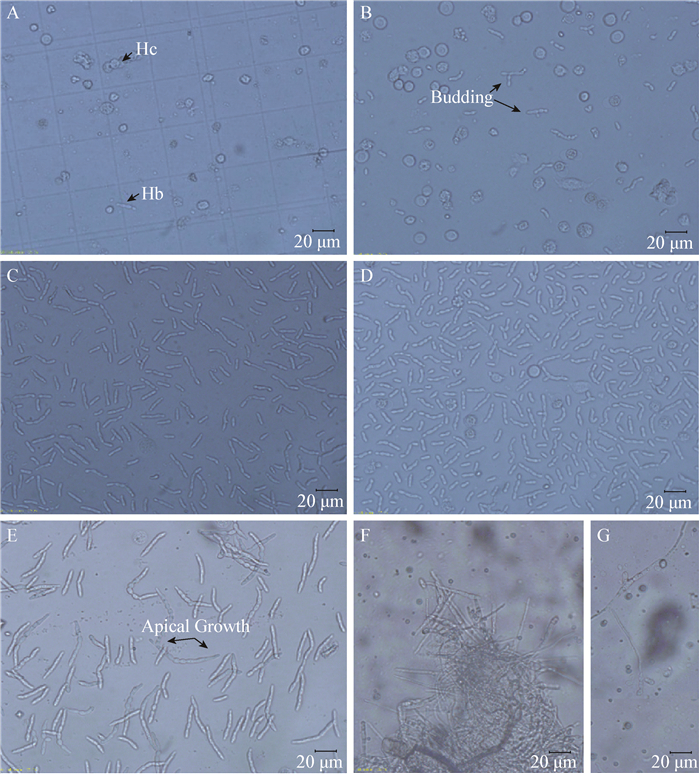
虫菌体注入幼虫血腔后,很快就利用血淋巴中的营养成分进行增殖,并且单个虫菌体的细胞数和长度大小不断增长,密度不断增大(图 1)。在接种初期,虫菌体以出芽生长为主(图 1A、B),接种大约64 h左右,生殖方式由出芽生殖转换为两端生长,形态逐渐向形成菌丝的方向转变(图 1E)。在注射后64 h左右,虽然菌丝体的数量在不断增多,消耗寄主的营养,但幼虫此时外观表现正常,取食量和活动性没有明显的减弱,虫菌体在昆虫血腔中随血淋巴流动,并未侵染组织器官。
|
| 图 1 侵入斜纹夜蛾幼虫体内后虫菌体的发育过程 Figure 1 Hyphal bodies development in haemocoel of S. litura larvae 注:A:接种后24 h,虫菌体较小且数量少于血细胞数量;Hb: Hyphal bodies:虫菌体;Hc: Hemocytes:血细胞. B:32 h后,虫菌体数量增多,变大,明显以出芽的方式生长. C、D:接种44 h和55 h后,虫菌体数量快速增长,密度在108个/mL以上,远大于血细胞密度且长度明显增加. E:64 h,虫菌体密度达到阈值后,生长方式由出芽生长转变为两端生长,两端尖细,逐渐形成菌丝. F:72 h,幼虫开始死亡,逐渐僵化,虫菌体已经全部转化成菌丝,缠绕在一起,形成菌丝团. G:分离开的单条菌丝. Note: A: post inoculation 24 h, the hyphal bodies are small, and fewer than hemocytes; Hb: Hyphal bodies; Hc: Hemocytes. B: 32 h later, hyphal bodies elongated and the number increased, obviously, it's reproductive is by budding growth. C, D: 44 h and 55 h later, hyphal bodies increased rapidly, over 108/mL, far more than hemocytes, and its length increased. E: 66 h later, densities of hyphal bodies reached the threshold, and the growth transited from budding growth to apical growth, so, yeast-like cell transformed to mycelial cell. The larva begins to die in this stage. F: 72 h later, larva died and the body mummified, all the hyphal bodies turned into mycelia, adhered each other to form clusters. G: single mycelia separated from mycelial clusters. |
|
|
注射后72 h左右,酵母状虫菌体已完全转换为菌丝,幼虫开始出现死亡。刚死亡的幼虫身体较软,但1-2 h左右即僵化变硬。此时,昆虫体内的虫菌体已全部形成菌丝(图 1F、G),虫体的器官组织被菌丝穿透,虫体表面长出白色的菌丝,1 d后出现绿色的分生孢子。
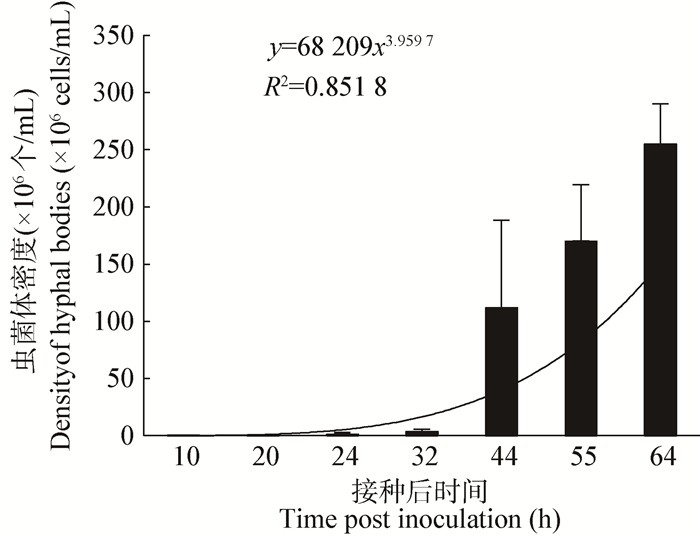
虫菌体进入昆虫血腔后,在开始阶段增长较为缓慢(图 2),30 h左右其密度达到1×106个/mL以上,此后增殖速度加快,44 h后虫菌体数量明显多于血细胞数量(图 1C、D),此时,虫菌体的密度达到一定阈值(图 2,大于1×108/mL),增长速度减缓。至64 h左右,虫菌体密度接近上限,不再大幅增长,生长方式开始出现转变。接种后72 h,幼虫已经死亡,虫菌体完全转换为菌丝。对取得的数据进行曲线模拟,其增长模型与幂函数较为相符。
|
| 图 2 虫菌体在斜纹夜蛾幼虫体内的增长趋势 Figure 2 Growth curve of hyphal bodies in haemocoel of S. litura larvae |
|
|
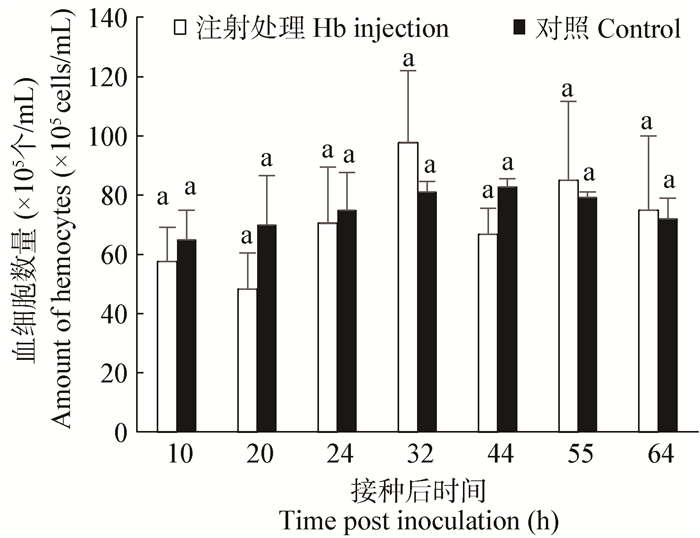
斜纹夜蛾幼虫感染M. rileyi后,在试虫死亡之前,血淋巴细胞的总体数量未出现剧烈的变化,波动幅度大部分在6×106/mL-8×106/mL之间,仅有少量幼虫血细胞总数超过1×107/mL (图 3)。经ANOVA方差分析,注射处理组与对照组幼虫的细胞总量差异不明显。同时,显微观察未发现有细胞崩解或凝结成团的现象(图 1A-E),也未在脂肪体等组织上发现黑色的结节或包囊等常见的细胞免疫现象。
|
| 图 3 斜纹夜蛾感染M. rileyi后血细胞数量变化 Figure 3 Hemocyte counts of S. litura larvae after injection with hyphal bodies of M. rileyi 注:柱形图上方相同字母表示方差分析差异不显著(P < 0.05). Note: the values withe same letters above the column is of no significant difference by ANOVA test (P < 0.05). |
|
|
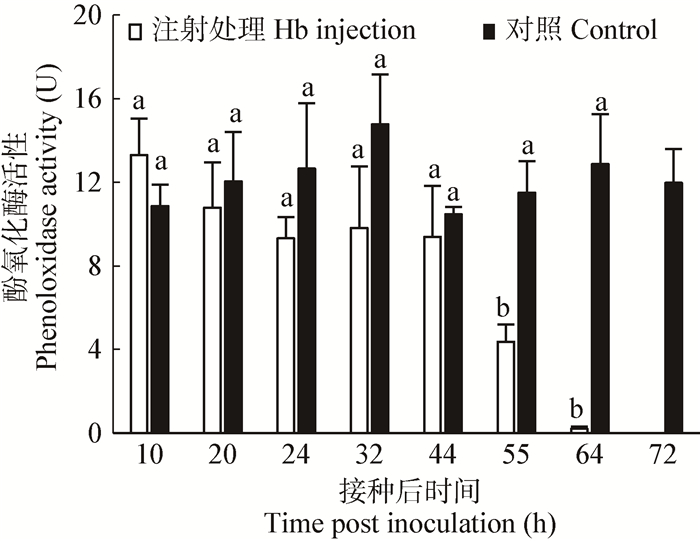
M. rileyi侵入斜纹夜蛾幼虫血腔后,在初始阶段,虫菌体的增殖对酚氧化酶的活性没有明显的影响,PO活性水平与对照无显著差异(图 4)。接种55 h后,PO活性开始出现明显的下降,64 h后,PO活性大幅下降,72 h后(幼虫已经死亡),PO活性完全消失,无法检测。结合虫菌体的增殖趋势分析(图 2),PO活性强弱与虫菌体密度存在一定程度的负相关性。
|
| 图 4 M. rileyi接种后斜纹夜蛾幼虫酚氧化酶活性变化 Figure 4 Phenoloxidase activity from larvae of S. litura post inoculation with M. rileyi 注:柱形图上方相同字母表示方差分析差异不显著(P < 0.05). Note: the values withe same letters above the column is of no significant difference by ANOVA test (P < 0.05). |
|
|
作为一种昆虫寄生真菌,自然状况下,M. rileyi主要通过体壁侵染进入昆虫体内,而体壁的化学组成成分和厚度是影响病菌入侵成功的重要因素[16]。不同种类、不同龄期的昆虫其体壁厚度及组成成分存在差异,一般而言,低龄幼虫体壁较高龄幼虫体壁薄,因而更有利于病原菌的入侵。本研究中,斜纹夜蛾不同龄期幼虫对M. rileyi的抵抗力差异明显,低龄幼虫死亡率和致死速度优于高龄幼虫,其主要原因应是体壁厚度不同;更为明显的是,蛹因其蛹壳的厚度远大于幼虫的的体壁(目测观察),因而对M. rileyi抗性更强,死亡率更低(表 3)。幼虫感病后的病程较长,4–5 d后逐渐死亡(表 2),在此期间,其取食量与取食活动没有明显变化,因此防治高龄幼虫并不能对作物起到有效的保护作用。因此在应用M. rileyi防治害虫时,应掌握在幼虫低龄期,以增加病原菌的侵染成功率,保护作物免受危害。
M. rileyi在侵入昆虫体内后,其发育过程具有二型现象(Dimorphism),即具有酵母状虫菌体(酵母型)和丝状菌丝体(菌丝型)两种不同的形态[2, 17]。虫菌体消耗昆虫血淋巴中的营养进行增殖,但对寄主没有明显伤害,感病个体与健康个体表现一致,取食行为不受影响;虫菌体转换为菌丝体后,开始破坏寄主的器官组织,并分泌代谢物(包括毒素),杀死寄主。在感病第一阶段,虫菌体的数量增长明显没有受到寄主的抑制,即寄主的免疫系统未能识别出M. rileyi这种外来病原物,虫菌体以幂函数的形式自由生长2-3 d (图 2),同时,虫菌体对寄主的生理活动也没有不利影响。在其密度达到一定阈值时,触发寄主产生QSM,QSM诱导虫菌体发生形态改变,进入感病第二阶段,形成菌丝体,在较短的时间内(几小时)杀死寄主[11]。从本实验的结果分析,寄主在被侵染64 h后产生QSM,此时的虫菌体密度约为2.5×108个/mL左右,推测诱导产生QSM的密度阈值为2.5×108个/mL虫菌体。M. rileyi侵染成功后,虫菌体达到QSM阈值的增殖速度,成为影响病菌致死速度的主要因素。
一般情况下,病原物侵入昆虫体内后,通常会引起寄主的免疫反应。如念珠菌Candida albicans注入Spodoptera exigua血腔后,则很快被吞噬细胞吞噬,形成黑色的结节[18]。然而,昆虫寄生菌,如M. rileyi和B. bassiana等在长期的进化过程中,都形成了避开昆虫免疫屏障的特殊形态。球孢白僵菌B. bassiana孢子萌发穿透体壁侵入甜菜夜蛾Spodoptera exigua血淋巴后,形成特殊的形态——芽孢子(Blastspores),芽孢子无法被寄主识别,免疫反应过程不能启动[18]。但是,把白僵菌的孢子直接注射到昆虫Eurygaster integriceps体内后,寄主的血细胞数量和血细胞的类型发生明显变化,免疫反应强烈[19],说明孢子无法逃避寄主免疫系统的监视。本研究中,虫菌体在血腔中大量增殖,寄主血淋巴细胞的数量没有明显变化,吞噬和包囊现象均未被观察到,说明虫菌体与芽孢子一样,可以躲避寄主免疫系统的攻击。昆虫之所以无法对虫菌体进行免疫识别,主要原因是虫菌体细胞表面缺少免疫识别因子,表面抗原无法被寄主识别为非自身成分(Non-self)[20],因而细胞的吞噬和包囊作用等无法进行。
PO是昆虫免疫系统中的关键酶,尤其是包囊、结节形成及黑化等反应过程[21-22],也是测定免疫能力的常用指标。寄主在受到病原侵染后,PPO级联反应(Prophenoloxidase cascade)启动,无活性的PPO被水解形成有活性的PO[23],从而导致血淋巴中PO活性升高。毫无疑问,高活性PO的存在不利于昆虫病原菌的发育。如前所述,M. rileyi在虫菌体阶段、B. basisana在芽孢子阶段不能被寄主免疫系统识别,但在转换为菌丝体后这种“隐身”能力消失。研究发现,B. basisana接种S. exigua后,在初期阶段(芽孢子),血淋巴PO活性没有明显变化,但侵染后期血细胞PO活性明显降低[24],主要原因是菌丝体发育过程中可分泌次生代谢物抑制PO活性[19]。与此类似,M. rileyi侵染后的55 h内,寄主血淋巴PO活性没有变化,但虫菌体转换为菌丝体后,PO活性开始下降,至试虫死亡时,PO活性降为0 (图 4),这可能因为菌丝分泌的代谢产物抑制了PO活性,至于是何种成分,则需要进一步进行分离纯化。
昆虫病原菌与寄主的互作是个非常复杂的过程,包含很多不同的生理生化过程,其中细胞的数量和类型,包囊、结节的数量,PPO与PO活性,溶菌酶(Lysozyme)活性等是免疫功能强弱的直观反映,虽然各指标之间相互独立,但在生理过程中却是互相参与、互相影响的,有一定的内在联系。本研究对感染后期虫菌体的数量增长趋势与PO活性变化进行了比较,可以看出两者之间存在负相关性,即随着虫菌体数量的增长,PO活性下降。与此类似,绿僵菌侵染沙漠蝗Schistocerca gregaria后,PO活性与溶菌酶活性之间也有明显的相关性[25]。
虽然M. rileyi对斜纹夜蛾有较好的防治效果,而且有诸多优点,但从长远利用的角度考虑应当注意不可滥用。已有研究证实,连续用白僵菌进行抗性选育25代后,面对巨大的选择压力,大蜡螟Galleria mellonella可对白僵菌表现明显的抗性[26],说明微生物制剂与化学农药一样,可引起害虫抗性产生。抗性的产生除了因为昆虫体壁屏障得到加强外,免疫功能的加强可能也是原因之一[27]。M. rileyi如果在未来得到大量应用,应当与其他生物农药交替使用,以避免可能的抗性风险。
| [1] | Kepler RM, Humber RA, Bischoff JF, et al. Clarification of generic and species boundaries for Metarhizium and related fungi through multigene phylogenetics[J]. Mycologia, 2014, 106(4) : 811–829. DOI:10.3852/13-319 |
| [2] | Boucias DG, Pendland JC. Principles of Insect Pathology[M].Boston: Kluwer Academic Publishers, 1998. |
| [3] | Perinotto WMS, Terra ALM, Angelo IC, et al. Nomuraea rileyi as biological control agents of Rhipicephalus microplus tick[J]. Parasitology Research, 2012, 111(4) : 1743–1748. DOI:10.1007/s00436-012-3018-3 |
| [4] | Li F, Xie M, Wan FH, et al. Proceedings of Nomuraea rileyi[A]//The 2nd National Conference on New Technology and Products of Green Pestcides[C]. Xiamen: China Society of Plant Protection, 2003: 72-79 (in Chinese)李锋, 谢明, 万方浩, 等. 莱氏野村菌研究及应用进展[A]//第二届全国绿色环保农药新技术、新产品交流会论文集[C]. 厦门: 中国植物保护学会, 2003: 72-79 |
| [5] | Liu Q, Xu J, Yin XD, et al. Study on the biological characteristics of Nomuraea rileyi and its pathogenicity against Spodoptera exigua[J]. Jiangsu Journal of Agricultural Sciences, 2009, 25(1) : 68–72. (in Chinese)刘琴, 徐建, 殷向东, 等. 莱氏野村菌的生物学特性及其对甜菜夜蛾的致病力研究[J]. 江苏农业学报, 2009, 25(1) : 68–72. |
| [6] | Lu YY, Yin CD. Infectivity of Nomuraea rileyi to Heicoverpa armigera and its control in cotton fields[J]. Plant Protection, 1998, 24(4) : 14–17. (in Chinese)陆永跃, 尹楚道. 莱氏野村菌对棉铃虫致病力及田间控制作用初步研究[J]. 植物保护, 1998, 24(4) : 14–17. |
| [7] | Yuan SY, Kong Q, Zhang HR, et al. Pathogenicity of Nomuraea rileyi against Spodoptera litura[J]. Plant Protection, 2010, 36(5) : 171–173. (in Chinese)袁盛勇, 孔琼, 张宏瑞, 等. 莱氏野村菌对斜纹夜蛾幼虫的致病性[J]. 植物保护, 2010, 36(5) : 171–173. |
| [8] | Fan MZ, Huang B, Wang JL, et al. Fluorescence and scanning electron microscopy study on appresorium morphology of some entomogenous fungi[J]. Mycosystema, 1999, 18(3) : 249–253. (in Chinese)樊美珍, 黄勃, 王建林, 等. 几种虫生真菌附着胞的荧光显微及扫描电镜观察[J]. 菌物系统, 1999, 18(3) : 249–253. |
| [9] | Wang JF, Liu GY, Zhai Y, et al. Cloning and expression of the chitinase gene Chit1 from entomopathogenic fungus Nomuraea rileyi CQ[J]. Acta Microbiologica Sinica, 2010, 50(4) : 493–499. (in Chinese)王金芳, 刘光英, 翟逸, 等. 莱氏野村菌Cq菌株几丁质酶基因的克隆与表达分析[J]. 微生物学报, 2010, 50(4) : 493–499. |
| [10] | Tang WY, Xing CC, Dong YG, et al. Changes in the activities of antioxidant enzymes in Spodoptera litura (Lepidoptera: Noctuidae) larvae infected by the fungus Nomuraea rileyi[J]. Acta Entomologica Sinica, 2015, 58(5) : 526–534. (in Chinese)唐维媛, 邢丛丛, 董永刚, 等. 斜纹夜蛾幼虫感染莱氏野村菌后的抗氧化酶活性变化[J]. 昆虫学报, 2015, 58(5) : 526–534. |
| [11] | Boucias D, Liu S, Meagher R, et al. Fungal dimorphism in the entomopathogenic fungus Metarhizium rileyi: detection of an in vivo quorum-sensing system[J]. Journal of Invertebrate Pathology, 2016, 136 : 100–108. DOI:10.1016/j.jip.2016.03.013 |
| [12] | Kanost MR, Jiang HB, Yu XQ. Innate immune responses of a lepidopteran insect, Manduca sexta[J]. Immunological Reviews, 2004, 198(1) : 97–105. DOI:10.1111/imr.2004.198.issue-1 |
| [13] | Sun G, Liu SW, Chang XH, et al. Study on effect of an improved artificial rearing technique for Spodoptera litura Fabricius[J]. Shandong Agricultural Sciences, 2015, 47(2) : 104–106. (in Chinese)孙庚, 刘少武, 常秀辉, 等. 一种改进的斜纹夜蛾人工饲养技术的效果研究[J]. 山东农业科学, 2015, 47(2) : 104–106. |
| [14] | Xiao T, Liu SH, Xue CB, et al. The comparison of colorimetry and microtitration methods for defermining the protein content and activity of phenoloxidase in insect hemolymph test[J]. Chinese Bulletin of Entomology, 2008, 45(2) : 306–309. (in Chinese)肖婷, 刘守柱, 薛超彬, 等. 紫外分光光度计法与酶标仪微量法测定酚氧化酶蛋白含量及活力的比较[J]. 昆虫知识, 2008, 45(2) : 306–309. DOI:10.7679/j.issn.2095-1353.2008.067 |
| [15] | Xiong HM, Wei BQ, Wei RJ, et al. Calculation of median lethal dose (LD50) for Yersinia pestis by SPSS package[J]. Chinese Journal of Zoonoses, 2013, 29(11) : 1127–1130. (in Chinese)熊浩明, 魏柏青, 魏荣杰, 等. 用SPSS软件计算鼠疫菌半数致死量(LD50)[J]. 中国人兽共患学报, 2013, 29(11) : 1127–1130. |
| [16] | Zhou SL. The relationship between insect cuticle and infection of entomopathogenic fungi[J]. Journal of Wuhan Institute of Education, 1997, 16(6) : 11–13. (in Chinese)周世力. 昆虫的体壁与真菌的入侵[J]. 武汉教育学院学报, 1997, 16(6) : 11–13. |
| [17] | Jiang JJ, Ma ZY, Li JL, et al. Morphogenesis of blastospores of Nomuraea rileyi, an important entomogenous fungus[J]. Mycosystema, 2010, 29(3) : 340–346. (in Chinese)蒋婧婧, 马中友, 李佳丽, 等. 重要虫生真菌莱氏野村菌芽生孢子的形态发生[J]. 菌物学报, 2010, 29(3) : 340–346. |
| [18] | Hung SY, Boucias DG, Vey AJ. Effect of Beauveria bassiana and Candida albicans on the cellular defense response of Spodoptera exigua[J]. Journal of Invertebrate Pathology, 1993, 61(2) : 179–187. DOI:10.1006/jipa.1993.1032 |
| [19] | Zibaee A, Bandani AR, Talaei-hassanlouei R, et al. Cellular immune reactions of the sunn pest, Eurygaster integriceps, to the entomopathogenic fungus, Beauveria bassiana and its secondary metabolites[J]. Journalof Insect Science, 2011, 11(1) : 138. |
| [20] | Pendland JC, Boucias DG. Physicochemical properties of cell surfaces from the different developmental stages of the entomopathogenic hyphomycete Nomuraea rileyi[J]. Mycologia, 1991, 83(3) : 264–272. DOI:10.2307/3759986 |
| [21] | Liu SH, Du XL, Dai MX. Characteristics and physiological functions of phenoloxidase from insect[J]. Journal of Anhui Agricultural Science, 2010, 38(34) : 19249–19251, 19304. (in Chinese)刘守柱, 杜学林, 戴明勋. 昆虫酚氧化酶特性及其生理学功能[J]. 安徽农业科学, 2010, 38(34) : 19249–19251, 19304. DOI:10.3969/j.issn.0517-6611.2010.34.001 |
| [22] | Xu GZ, Liu SZ. Research review of phenoloxidase in insects[J]. Journal of Liaocheng University (Natural Science), 2015, 28(1) : 62–66. (in Chinese)徐广增, 刘守柱. 昆虫酚氧化酶研究综述[J]. 聊城大学学学报:自然科学版, 2015, 28(1) : 62–66. |
| [23] | Ashida M, Brey PT. Role of the integument in insect defense: pro-phenol oxidase cascade in the cuticular matrix[J]. Proceedings of the National Academy of Sciences of the United States of America, 1995, 92(23) : 10698–10702. DOI:10.1073/pnas.92.23.10698 |
| [24] | Hung SY, Boucias DG. Phenoloxidase activity in hemolymph of naive and Beauveria bassiana-infected Spodoptera exigua larvae[J]. Journal of Invertebrate Pathology, 1996, 67(1) : 35–40. DOI:10.1006/jipa.1996.0006 |
| [25] | Gillespie JP, Burnett C, Charnley AK. The immune response of the desert locust Schistocerca gregaria during mycosis of the entomopathogenic fungus, Metarhizium anisopliae var acridum[J]. Journal of Insect Physiology, 2000, 46(4) : 429–437. DOI:10.1016/S0022-1910(99)00128-6 |
| [26] | Dubovskiy IM, Whitten MMA, Yaroslavtseva ON, et al. Can insects develop resistance to insect pathogenic fungi[J]. PLoS One, 2013, 8(4) : e60248. DOI:10.1371/journal.pone.0060248 |
| [27] | Enríquez-vara JN, Córdoba-aguilar A, Guzmán-Franco AW, et al. Is survival after pathogen exposure explained by host's immune strength? A test with two species of white grubs (Coleoptera: Scarabaeidae) exposed to fungal infection[J]. Environmental Entomology, 2012, 41(4) : 959–965. DOI:10.1603/EN12011 |
 2017, Vol. 44
2017, Vol. 44




