扩展功能
文章信息
- 李星月, 何朋俊, 朱天辉, 潘宗英
- LI Xing-Yue, HE Peng-Jun, ZHU Tian-Hui, PAN Zong-Ying
- 核桃枯枝病新病原及生物学特性
- Characterization of a new pathogen in walnut twig blight
- 微生物学通报, 2017, 44(6): 1339-1348
- Microbiology China, 2017, 44(6): 1339-1348
- DOI: 10.13344/j.microbiol.china.160946
-
文章历史
- 收稿日期: 2016-12-23
- 接受日期: 2017-03-03
- 优先数字出版日期(www.cnki.net): 2017-04-06
2. 重庆工贸职业技术学院 重庆 408000
2. Chongqing Industry and Trade Polytechnic, Chongqing 408000, China
核桃(Juglans regia L.)属金缕梅亚纲(Hamamelidae)壳斗目(Fagales)胡桃科(Juglandaceae)胡桃属(Juglans L.),落叶乔木。核桃果实营养丰富,被誉为“21世纪的超级食品”[1]。中国是核桃起源地之一,分布广泛,除黑龙江、上海、广东、海南外,其他25个省、自治区、直辖市均有栽培,种质资源极为丰富。近年来,随着农业生产转型,四川核桃种植面积增长迅速,核桃产量逐年提高。但由于经营管理粗放,核桃大多品质劣、抗性差、经济效益低,致使病害滋生日益严重[2]。其中,核桃枯枝病作为核桃常见病害,主要危害枝干,造成枝干干枯腐朽,严重时导致全株死亡。病原菌多从枝梢或侧枝进行侵染致感病后,再从顶端逐渐向下蔓延到主干。1−2年生的嫩枝以及有伤口的枝干更容易受到病原菌的侵染。病原菌主要以分生孢子盘或菌丝体在枝条、树干病部越冬,翌年条件适宜时,产生的分生孢子借风雨或昆虫传播蔓延,通过枝条上的伤口发生初次侵染[3]。
目前鉴定出来的核桃枯枝病病原有黑盘孢菌Melanconium oblongum[3-4]、胡桃楸拟茎点霉Phomopsis juglandis[5-6]、小新壳梭孢Neofusicoccum parvum[7-8]、越橘间座壳Diaporthe vaccinii Shear[9]等。不同病原引起的核桃枯枝病在病症上有细微差别,由Melanconium oblongum引起的核桃枯枝病在发病初期2年生侧枝上可见红褐色不规则病斑,染病枯死的枝条皮层变褐坏死[3]。胡桃楸拟茎点霉Phomopsis juglandis能使感病核桃在枝条皮层生有黄褐色瘤状突起,成熟后外露,逐渐干燥开裂并露出灰褐色的木质部[6]。由越橘间座壳Diaporthe vaccinii Shear引起的核桃枯枝病随着病程发展,用手指按压病斑会流出带泡沫的含酒精气味的液体[9]。
四川省广元市剑阁县核桃种植面积广,而该地区核桃枯枝病病原研究处于空白状态,本文通过采集鉴定该地区核桃种植基地的核桃枯枝病病株,确定了引起该病害的病原菌种类,并对其生物学特性进行研究,以期为核桃枯枝病的防控提供依据。
1 材料与方法 1.1 试验材料2016年3月开始,对四川省广元市剑阁县核桃种植基地内的发病核桃进行田间调查,调查核桃枯枝病的发病时期和病症特点,釆集典型的发病病株用于病原分离。采用常规组织分离法[10]分离纯化菌种,获得的菌株斜面培养于4 ℃保存备用。
1.2 主要试剂和仪器植物基因组DNA提取试剂盒,天根生化科技(北京)有限公司;PCR扩增引物、Taq DNA聚合酶,生工生物工程(上海)股份有限公司。
BSG-800程控光照培养箱,上海博讯实业有限公司;梯度PCR扩增仪,新加坡艺思高科技有限公司;LG10-2.4A高速离心机,北京瑞邦兴业科技有限公司;DELTA-320 pH计,北京联合科力科技有限公司;BX51显微镜,奥林巴斯株式会社。
1.3 供试培养基马铃薯葡萄糖琼脂(Potato dextrose agar,PDA)培养基(g/L):马铃薯200.0,葡萄糖20.0,琼脂20.0,pH自然。
马铃薯葡萄糖液体(Potato dextrose broth,PDB)培养基(g/L):马铃薯200.0,葡萄糖20.0,pH自然。
马铃薯蔗糖琼脂(Potato sucrose agar,PSA)培养基(g/L):马铃薯200.0,蔗糖20.0,琼脂20.0,pH自然。
胡萝卜煎汁(Carrot agar,CA)培养基(g/L):胡萝卜20.0,琼脂20.0,pH自然。
燕麦(Oat meal agar,OMA)培养基(g/L):燕麦30.0,琼脂20.0,pH自然。
玉米粉(Corn meal agar,CMA)培养基(g/L):玉米粉300.0,琼脂20.0,pH自然。
查氏(Czapek,CZ)培养基(g/L):蔗糖30.0,硝酸钠2.0,硫酸镁0.5,氯化钾0.5,硫酸铁0.01,磷酸氢二钾1.0,琼脂20.0,pH自然。
2%水琼脂(Water agar,WA)培养基(g/L):琼脂20.0,pH自然。
以上培养基有一定改良[10],灭菌条件均为:1×105 Pa灭菌30 min。
1.4 病原菌的分离培养选择发病较轻、症状典型的枝干,先用自来水冲洗表面,自然晾干后用无菌滤纸吸干组织表面剩余水分。用无菌解剖刀沿着病健交界处切取小块病组织(5 mm×5 mm)数块,每小块相隔一定的间隙。在70%的酒精中浸30 s左右,再在2%次氯酸钠消毒液中浸泡1−2 min,最后用无菌水连续浸洗3次,用无菌吸水纸蘸干多余水分,用灭菌的镊子挑取一小块病组织无菌转入PDA培养基内,每皿接种一小块,置于25 ℃恒温光照培养,5 d后挑取菌落边缘的菌丝转皿培养,纯化。
1.5 分离物的致病性测定采用活体枝条接种法进行致病性测定[11-12]。真菌培养物培养5 d后,用直径为5 mm的打孔器打取菌饼备用。选取健康、大小均匀的核桃苗枝干,自来水清洗枝干表面,再用75%的酒精擦拭消毒接种部位,分别采用有伤接种和无伤接种2种方法进行接种。有伤接种用灭菌的小刀在健株上每隔4−5 cm割成大小均匀的丁字形伤口并剥开,将菌饼以菌丝面贴于伤口上,用已浸湿无菌水的脱脂棉保湿菌饼,并用保鲜膜缠绕以防止水分散失。无伤接种方法为直接在枝条上接种菌饼,用浸水脱脂棉和保鲜膜固定覆盖。有伤接种和无伤接种均以接种相同直径的空白菌饼作为对照。各接种20株核桃苗枝干,每个枝干上接种5个菌饼,进行6次重复,并挂牌标记。逐日观察接种结果,从病斑再次分离病原菌,并与最初的接种菌进行比较,完成柯赫氏法则的验证。
1.6 病原菌的形态学观察将供试菌株接种于PDA平板上,25 ℃光照培养,逐日观察记录菌落颜色、形态、气生菌丝的疏密程度。待其产孢后,使用显微镜观察产孢结构、分生孢子种类与形态,测量分生孢子的大小。根据宏观的培养性状(菌落特征)、微观的个体形态特征及一些生物学特性与真菌鉴定手册[13]对比鉴定病原菌。
1.7 病原菌的鉴定将菌株接种在PDA平板上,25 ℃光照培养5 d,用打孔器取菌饼转接至含有PDB培养基的锥形瓶中,于28 ℃、140 r/min培养3 d。采用四层灭菌纱布过滤菌丝体,无菌水冲洗4−5次,经50 ℃恒温鼓风干燥后,−20 ℃冰冻过夜。病原菌DNA提取的具体方法参照植物基因组DNA提取试剂盒的操作步骤[14]。将供试菌株的基因组DNA作为模板,采用真菌核糖体基因转录间隔区(ITS)真菌通用引物ITS4 (5′-TCCTCCGCTTATTGATATGC-3′)和ITS5 (5′-GG AAGTAAAAGTCGTAACAAGG-3′)进行扩增。PCR反应体系:DNA模板(100 mg/L) 0.5 μL,引物ITS4 (10 μmol/L)和ITS5 (10 μmol/L)各1.0 μL,Taq DNA聚合酶(5 U/μL) 12.5 μL,ddH2O 10.0 μL。PCR反应条件:95 ℃ 4 min;94 ℃ 1 min,55 ℃ 1 min,72 ℃ 1 min,35个循环;72 ℃ 10 min。扩增产物用1%琼脂糖凝胶电泳进行检测之后送往生工生物工程(上海)股份有限公司测序。将分离所得菌株的核糖体DNA-ITS序列与NCBI GenBank中相关序列进行比较分析,选取近缘种用ClustalX 2.0软件比对序列,再用MEGA 5.05软件构建系统发育树,其中Bootstrap检验的重复次数设置为1 000次。
1.8 病原菌的生物学特性以下试验均用已灭菌打孔器(直径5 mm)在预先培养(PDA平板上25 ℃培养5 d)好的菌落边缘打取菌饼,再将菌饼转接到各平板中央。每处理重复6次,第5天用十字交叉法测量菌落直径。除温度和光照试验以外,其余均在25 ℃的恒温条件下光照培养。
1.8.1 培养基种类对菌丝生长的影响: 将菌饼分别转接到PDA、PSA、CA、OMA、CMA、CZ、WA培养基。 1.8.2 不同碳源、氮源对菌丝生长的影响: 采用查氏培养基为基础培养基,以蔗糖为碳源,分别用等碳量的葡萄糖、乳糖、甘露醇、麦芽糖、果糖、山梨醇和木糖替换蔗糖,以无碳源的培养基作为对照,配制9种不同碳源培养基。同理以硝酸钠为氮源,分别用含等氮量的硝酸钾、蛋白胨、硝酸铵、氯化铵、硫酸铵、钼铵酸、苯丙氨酸和脲替换硝酸钠,以无氮源的培养基作为对照,配制成含有不同氮源的培养基,再将菌饼接种到各平板中央。 1.8.3 温度对菌丝生长的影响: 将菌饼接种于PDA培养基上,分别置于5−40 ℃ (每5 ℃为一个梯度) 8种温度条件下恒温光照培养。 1.8.4 pH对菌丝生长的影响: 用1 mol/L HCl和1 mol/L NaOH将PDA培养基的pH调配为4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0,接入菌饼。 1.8.5 光照对菌丝生长的影响: 将菌饼接种到PDA平板中央,分别置于全黑暗、全光照、半黑暗半光照各12 h交替3种条件下25 ℃恒温培养。1.9 数据处理与统计分析应用Excel 2010和SPSS 20.0分析处理数据并制图。采用单因素方差分析法(One-Way ANOVA)分析各组数据差异显著性。
2 结果与分析 2.1 核桃枯枝病病害症状核桃枯枝病在各调查区均有发生(发病率15%−25%)。在感病初期,病部皮层首先失绿呈现灰黑色,病部组织稍下陷,并在枝干上产生灰褐色椭圆或圆形病斑。后期枝干病斑逐渐扩展,病斑褐色至暗褐色,当天气潮湿时,能在病斑上发现密集的黄黑色粒状凸起物,即病原物,随着湿度的增大,分生孢子盘口处涌出大量的分生孢子,形成黑色馒头状突起。当病斑扩展缠绕枝干一周时,受害枝的叶片变黄脱落,全株死亡。调查发现,5−6月是发病初期,感病枝条病斑范围小,7−8月为发病盛期,至9月后停止发病。
2.2 病原菌的分离、纯化通过对采集自核桃种植基地的30份典型枯枝病枝干样品进行病菌的分离、纯化之后,共获得180个菌株,根据其培养性状和形态特征可以将其合并为6种类型。其中,所有样本中均分离到一种生长迅速、具有显著竞争优势的菌株LXY-01,将不同类型的菌株进行纯化后编号为LXY-01−06,各类菌株的分离频率统计如表 1所示。
| 菌株编号 Strain code |
数量 Quantity |
分离频率 IF (%) |
| LXY-01 | 140 | 77.78 |
| LXY-02 | 7 | 3.89 |
| LXY-03 | 5 | 2.78 |
| LXY-04 | 9 | 5.00 |
| LXY-05 | 7 | 3.89 |
| LXY-06 | 12 | 6.67 |
| 注:分离频率(IF)=分离菌株数目/菌株总数. Note: The isolation frequency (IF) was calculated as the frequency of strain per sample exhibiting fungal growth. | ||
将所分离到的6类菌株接种到未出现上述症状的健康核桃上,有伤接种7 d后观察发现,仅菌株LXY-01引起植株发病,发病核桃枝干上接种处组织凹陷,病健交界处出现轻微隆起,病斑呈现褐色,接种25 d后,接种枝干上病斑面积蔓延扩展,且表面黑色瘤状突起(图 1B),由此可知该病原菌可以从伤口侵入。取接种病发的树干病健交界处的组织,再次分离所得病原菌的菌落形态特征和培养性状上与原接种病原菌相同,而无伤接种、对照组及其他5种内生菌接种后未发现有上述症状。根据柯赫氏法则,菌株LXY-01是核桃枯枝病的病原菌。

|
| 图 1 核桃枯枝病病症及病原菌形态特征 Figure 1 Symptoms of walnut twig blight and morphology of Phomopsis capsici 注:A:田间发病症状;B:接种后发病症状;C:PDA中菌落特征;D:分生孢子器;E:聚生的分生孢子器;F:分生孢子器释放的分生孢子角;G:产孢细胞(40×);H:α和β分生孢子(40×);I:β分生孢子(100×);J:α分生孢子(100×). Note: A: Symptom in the field; B: Symptom of walnut twig blight inoculated with Phomopsis capsici; C: Colony characters on PDA; D: Pycnidia; E: Gregarious pycnidia; F: Pycnidia with cirrhi; G: Conidiogenous cells (40×); H: α and β conidium (40×); I: β conidium (100×); J: α conidium (100×). |
|
|
LXY-01在PDA培养基中生长较快,培养5 d后菌落基本长满整个平板(直径9 cm)。在25 ℃培养初期菌丝白色或无色、气生菌丝较稀疏且长势较弱,棉絮毛状,菌丝紧贴培养基表面生长;培养后期菌丝逐渐变成致密的白色绒毛状,边缘气生菌丝倒伏紧贴培养基(图 1C)。
培养20 d左右菌丝表面出现黑色的分生孢子器(图 1D),散生或聚生,表面坚硬(图 1E)。后期释放出黄色分生孢子角(图 1F)。甲型(α)分生孢子,无色单孢,未见分隔,卵圆形至椭圆形,两端有两个明显油球,(5.6–9.2) μm×(1.0–2.2) μm (图 1J);乙型(β)分生孢子无色单孢,未见分隔,弯曲的线形,一端常呈钩状,无油球,(21.6–30.4) μm× (0.2–0.4) μm (图 1I)。α孢子数量小于β孢子。
通过在PDA培养基上的菌落形态、分生孢子器形态特征、分生孢子形态和大小,根据《中国真菌志第三十四卷拟茎点霉属》[15],将菌株LXY-01确定为拟茎点霉属Phomopsis sp.。
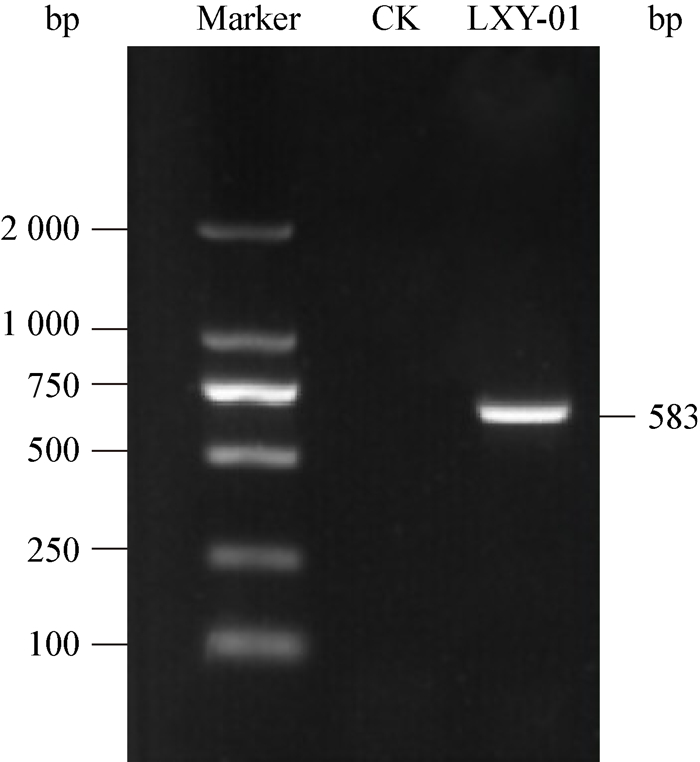
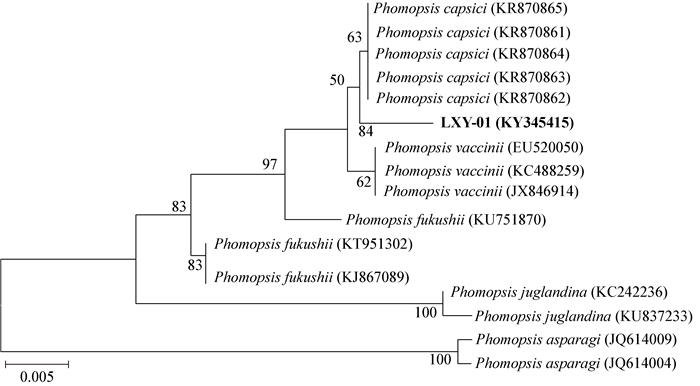
2.5 病原菌rDNA-ITS序列分析用真菌通用引物ITS4和ITS5对菌株LXY-01的rDNA-ITS序列进行PCR扩增,经琼脂糖凝胶电泳之后得到一条约500 bp清晰明亮的条带(图 2)。将PCR产物测序之后,得到583 bp的rDNA-ITS片段(GenBank登录号:KY345415),将菌株LXY-01的rDNA-ITS序列与GenBank中核酸数据库中的ITS区相关的DNA序列进行同源性比对,发现该核桃枯枝病病原菌与甜椒果腐病菌P. capsici的相似性高达99% (登录号:KR870865)。采用邻接法(Neighbor-Joining,NJ)构建系统发育树(图 3),结果表明,菌株LXY-01与甜椒果腐病菌P. capsici的亲缘关系最近,位于系统发育树的同一分支,与梨干枯病菌Phomopsis fukushii的亲缘关系最远。因此,结合致病性测定的结果、病原菌形态学特征和序列分析,将菌株LXY-01鉴定为P. capsici。
|
| 图 2 病原菌rDNA-ITS序列PCR扩增产物电泳图 Figure 2 Pathogen rDNA-ITS sequence of PCR amplification products electrophoregram |
|
|
|
| 图 3 基于rDNA-ITS基因序列构建的系统发育树 Figure 3 phylogenetic tree based on rDNA-ITS gene sequences 注:括号内数值为菌株在GenBank中的登录号;分支点上的数字表示自展支持值( > 50%);标尺表示每个核苷酸位点上的0.005替换值. Note: Numbers in parentheses are GenBank accession numbers; Values above the branches are parsimony bootstrap ( > 50%); 0.005 on the scale represents each nucleotide sites replacement value. |
|
|
|
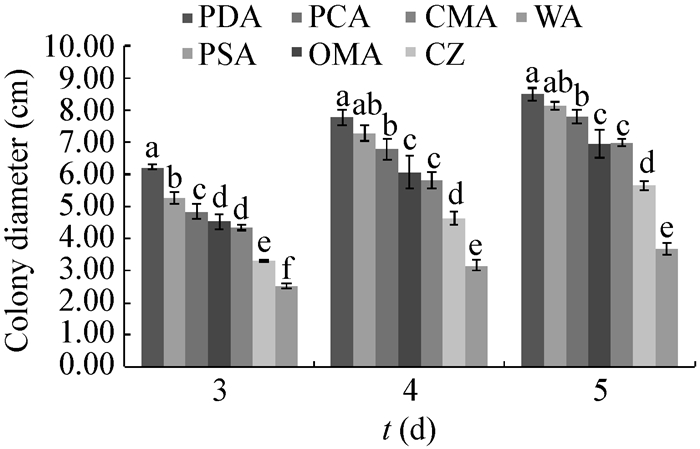
| 图 4 不同种类培养基对菌丝生长的影响 Figure 4 Effect of different kinds of culture media on mycelium growth 注:相同颜色图柱上标有不同字母表示不同处理间差异显著(P < 0.05). Note: The different letters above the same color column diagram denote significant differences among treatments (P < 0.05). |
|
|
|
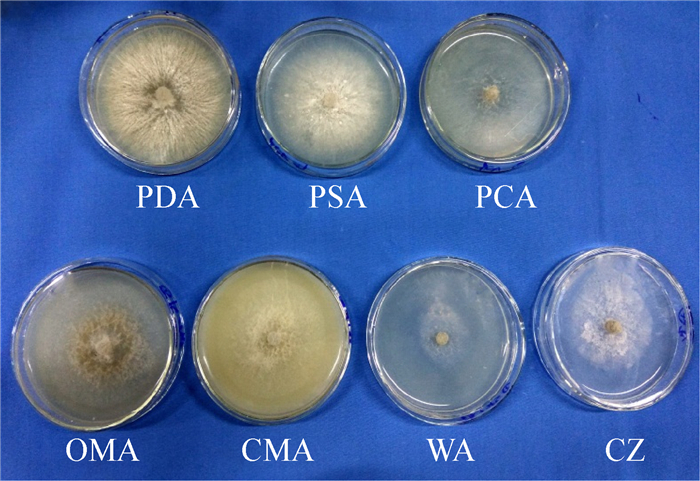
| 图 5 菌丝在不同种类培养基上的生长情况 Figure 5 Mycelium growth on different kinds of culture media |
|
|
| 碳源 Carbon source |
菌落直径Colony diameter (cm) | ||
| 3 d | 4 d | 5 d | |
| 蔗糖Sucrose | 3.32±0.03ab | 4.64±0.20a | 5.65±0.13a |
| 葡萄糖Glucose | 2.58±0.15d | 3.60±0.25c | 4.17±0.31c |
| 乳糖Lactose | 2.62±0.45d | 3.83±0.24c | 4.43±0.30c |
| 甘露醇Mannitol | 3.15±0.13abc | 4.23±0.13b | 4.95±0.10b |
| 麦芽糖Maltose | 2.88±0.24cd | 3.88±0.08c | 4.47±0.06c |
| 果糖Fructose | 2.97±0.20bcd | 4.25±0.18b | 5.00±3.12b |
| 山梨醇Sorbitol | 3.38±0.10a | 4.53±0.08b | 5.40±0.05a |
| 木糖Xylose | 2.55±0.09d | 3.68±0.18c | 4.42±0.20c |
| CK | 2.92±0.28bcd | 3.87±0.33c | 4.45±0.20c |
| 注:小写字母表示同一列在不同处理间差异显著(P < 0.05). Note: Different lowercase letters in the same column denote significant differences among treatments (P < 0.05). | |||
|
| 图 6 菌丝在不同碳源培养基上的生长情况 Figure 6 Mycelium growth on different kinds of carbon source culture media 注:A:培养5 d后;B:培养10 d后. Note: A: Cultured for 5 d; B: Cultured for 10 d. |
|
|
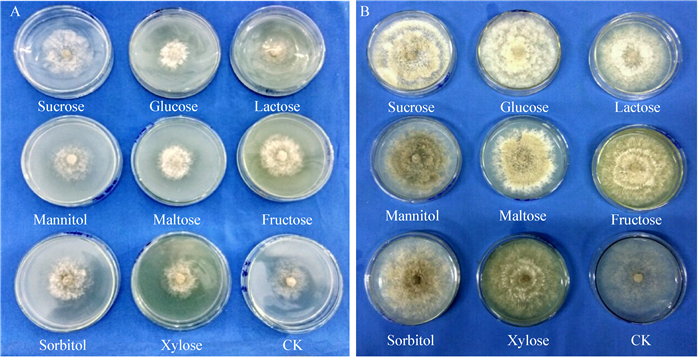
由表 3和图 7可知,病菌在9种供试氮源中均能生长,但形态差异较大。钼氨酸、苯丙氨酸、蛋白胨和硝酸钾作为氮源的基础培养基较适合病菌菌丝的生长,第5天菌落直径分别7.10、6.48、6.40、6.38 cm。然而在以硫酸铵和氯化铵为氮源的基础培养基中菌丝生长较差,且对照(无N)培养基上菌丝生长稀疏透明(图 7A)。培养10 d以后,含硫酸铵和氯化铵的两种培养基中菌丝不再生长,且整个菌落变成灰褐色(图 7B)。
| 氮源 Nitrogen source |
菌落直径Colony diameter (cm) | ||
| 3 d | 4 d | 5 d | |
| 硝酸钾Potassium nitrate | 3.67±0.10ab | 5.12±0.16b | 6.38±0.20b |
| 蛋白胨Tryptone | 3.50±0.17abc | 5.10±0.22b | 6.40±0.15b |
| 钼氨酸Molybdenum glycine | 3.87±0.45a | 5.75±0.41a | 7.10±3.97a |
| 硝酸铵Ammonium nitrate | 3.62±0.35ab | 4.58±0.26c | 5.22±0.47c |
| 苯丙氨酸Phenylalanine | 3.67±0.23ab | 5.27±0.32b | 6.48±0.53b |
| 硫酸铵Ammonium sulfate | 3.25±0.17c | 4.28±0.21cd | 4.92±0.26cd |
| 氯化铵Ammonium chloride | 3.10±0.15c | 3.98±0.13d | 4.40±0.30e |
| 脲Urea | 1.92±0.03d | 3.18±0.16e | 4.28±0.15e |
| CK | 3.52±0.08abc | 3.98±0.16d | 6.13±0.23b |
| 注:小写字母表示同一列在不同处理间差异显著(P < 0.05). Note: Different lowercase letters in the same column denote significant differences among treatments period (P < 0.05). |
|||
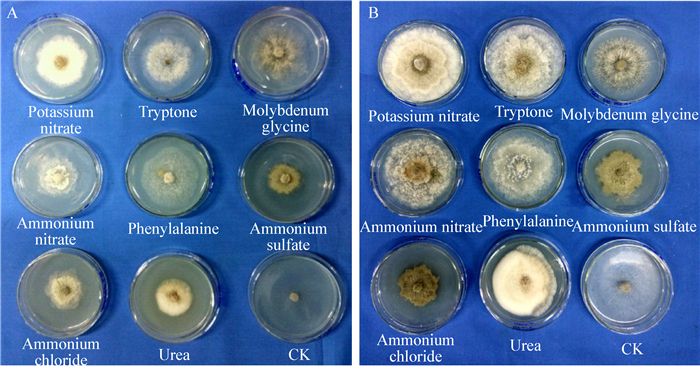
|
| 图 7 菌丝在不同氮源培养基上的生长情况 Figure 7 Mycelium growth on different kinds of nitrogen source culture media 注:A:培养5 d后;B:培养10 d后. Note: A: Cultured for 5 d; B: Cultured for 10 d. |
|
|
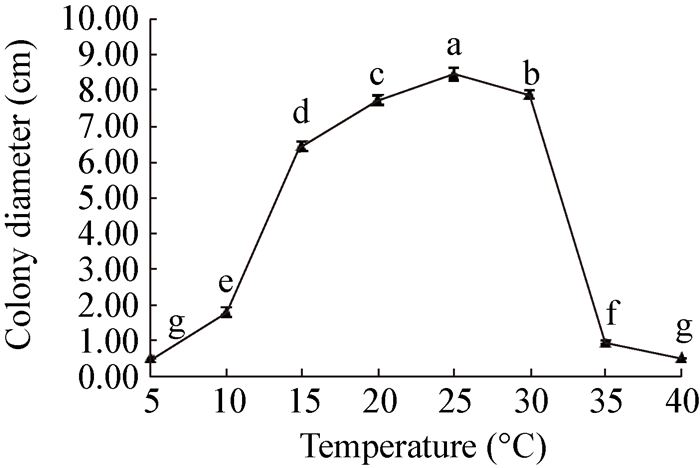
|
| 图 8 温度对病原菌生长的影响 Figure 8 Effect of temperature on mycelium growth |
|
|
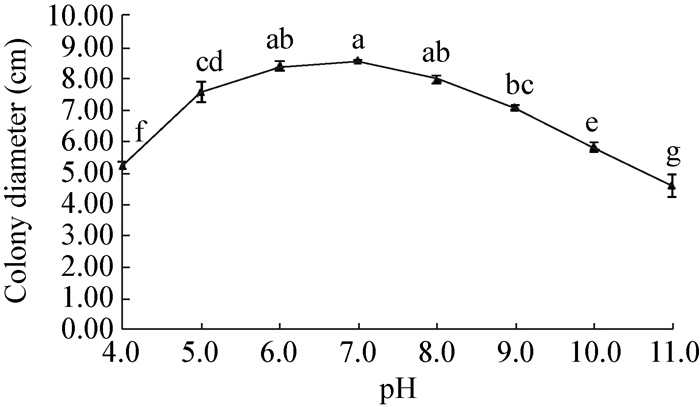
|
| 图 9 pH对病原菌生长的影响 Figure 9 Effect of pH on mycelium growth |
|
|
|
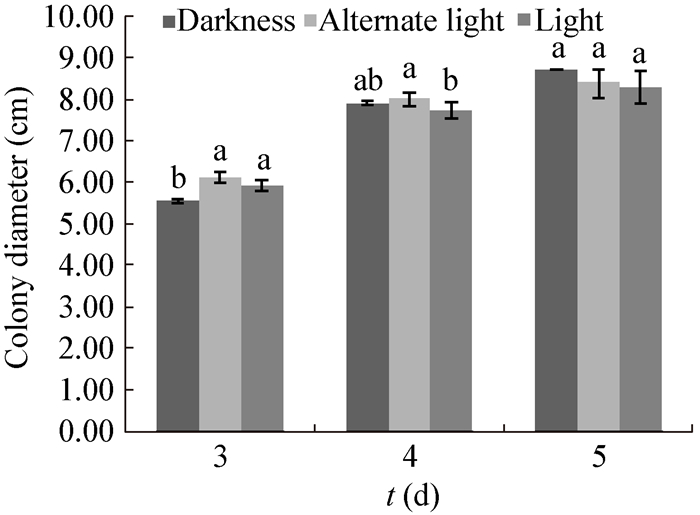
| 图 10 光照对病原菌生长的影响 Figure 10 Effect of illumination on mycelium growth |
|
|
|
| 图 11 菌丝在不同光照培养基上的生长情况 Figure 11 Mycelium growth on different illumination culture media |
|
|
拟茎点霉属(Phomopsis sp.)是半知菌亚门(Deuteromycotina)腔孢纲(Coelomycetes)球壳孢目(Sphaeropsidales)球壳孢科(Sphaeropsidaceae)中的重要真菌属,间座壳属(Diaporthe)为其有性态[16]。拟茎点霉属作为病原菌,主要侵染植物的枝叶及果实,能引起植物溃疡、烂茎、根腐、果腐、叶枯、枝枯和树皮坏死[17]。拟茎点霉属真菌的一些种没有寄主限制,它们可以侵染同一科内几个属甚至是不同科的植物;而同一植物的不同部位又可以存在不同种的拟茎点霉。研究表明,拟茎点霉属真菌可引起蔬菜、果树等作物病害,如滇刺枣褐斑病、芦笋茎枯病、葡萄叶斑病等,严重影响了作物的品质和产量[18-20]。
目前在国内外没有P. capsici引起核桃枯枝病的相关报道,国外有学者证实P. capsici和炭疽病菌Colletotrichum coccodes同时侵染辣椒,引起果实腐烂[21-22],他们分离到的P. capsici有α、β两型分生孢子,其中β孢子大小为29.8 μm×1.8 μm,α孢子大小为6.8 μm×2.9 μm,将此菌株人为接种在甜椒果实上产生形态介于前述两型孢子之间的γ孢子,大小为11.0 μm×2.9 μm。笔者在研究中仅观察到α和β两型分生孢子,且分生孢子形态和大小与甜椒果腐病菌P. capsici很相似。虽然曾有孙俊[6]对胡桃楸拟茎点霉Phomopsis juglandi (登录号:KC242236) 引起核桃枯枝病的报道,但其病征、产生的分生孢子形态大小与本试验观察到的不同,所构建的系统发育树(图 3)也显示胡桃楸拟茎点霉Phomopsis juglandi与本试验的病原菌亲缘关系较远。致病性测定的试验也验证P. capsici引起核桃枯枝病。因此笔者将核桃枯枝病病原菌鉴定为拟茎点霉P. capsici。在P. capsici对核桃的致病性试验中,只有以菌饼接种在有伤口的健康的核桃枝干上时会形成黑褐色病斑,说明有伤口存在时会提高P. capsici感染核桃引起枯枝的风险。
本试验首次对该病原菌的生物学特性进行了研究,结果表明,P. capsici适宜生长的温度范围为20−30,25是病原菌最适合生长的温度,这与此病在5、6月开始发病,7、8月份高温多雨的环境下加速病害蔓延的规律相符合。该病原菌在全黑环境中菌丝生长速率最快,另外该病原菌的生长对营养的要求并不苛刻,在不同种类培养基以及供试碳、氮源中均能生长。试验表明该菌最适合生长的培养基为PDA,最适碳源为蔗糖,最佳供试氮源为钼氨酸。此外,P. capsici产孢时间较长,在PDA培养基内黑暗条件下培养更容易产生分生孢子。
本研究明确了拟茎点霉引起的核桃枯枝病的症状及其生物学特性,为生产中诊断和防治核桃枯枝病提供了理论依据,然而,本文仅研究了P. capsici单独接种时的发病情况,证明其可单独造成核桃枯枝病,但P. capsici可否与其他病菌混合侵染核桃枝干以及该病原菌对其他植物的侵染性等问题还有待进一步研究。目前我国对于该病害的发生和防治均未能引起足够的重视,因此,需要尽快开展针对该病害的良种壮苗培育工作和抗病品种选育工作以保证栽植植株发育充实,同时还应该筛选出高效防治药剂,从而有效控制核桃枯枝病的发生和蔓延。
| [1] | Li YT. Walnut (Juglans regia) embryo development and the dynamics of nutrient metabolism[D]. Jinan: Master's Thesis of Shandong Agricultural University, 2011 (in Chinese)李永涛. 核桃(Juglans regia)胚发育及其营养代谢动态研究[D]. 济南: 山东农业大学硕士学位论文, 2011 http://cdmd.cnki.com.cn/Article/CDMD-10434-1011097994.htm |
| [2] | Gao HZ, Wu C, Li SR, et al. The application of synthetic index method on superior variety selection of walnut[J]. Scientia Silvae Sinicae, 2002, 38(3) : 171–176. (in Chinese)高焕章, 吴楚, 李申如, 等. 综合指数法在核桃选种中的应用研究[J]. 林业科学, 2002, 38(3) : 171–176. DOI:10.11707/j.1001-7488.20020330 |
| [3] | Hu GL, Li WB, Ma LJ. Observation and research on Carya cathayensis Sarg[J]. Journal of Zhejiang Forestry Science and Technology, 1992, 12(1) : 18–22. (in Chinese)胡国良, 李文彪, 马良进. 山核桃枝枯病观察与研究[J]. 浙江林业科技, 1992, 12(1) : 18–22. |
| [4] | Shao JM, Zhang SY. A study on the biological characters of Melanconium oblongum berk and the toxicity test of fungicides[J]. Journal of Shanxi Agricultural Sciences, 1994, 22(1) : 49–51. (in Chinese)邵嘉鸣, 张述义. 核桃枝枯病菌生物学特性研究及药剂毒力测定[J]. 山西农业科学, 1994, 22(1) : 49–51. |
| [5] | Xi RT, Zhang YP. Juglans Regia L[M].Beijing: China Forestry Publishing House, 1992: 406-430. (in Chinese)郗荣庭, 张毅萍. 中国核桃[M].北京: 中国林业出版社, 1992: 406-430. |
| [6] | Sun J. Identification of walnut twig blight in Liaoning province[J]. Journal of Fruit Science, 2013, 30(4) : 669–671. (in Chinese)孙俊. 辽宁新病害核桃枝枯病病原鉴定[J]. 果树学报, 2013, 30(4) : 669–671. |
| [7] | Thomidis T, Michailides TJ, Exadaktylou E. Neofusicoccum parvum associated with fruit rot and shoot blight of peaches in Greece[J]. European Journal of Plant Pathology, 2011, 131(4) : 661–668. DOI:10.1007/s10658-011-9840-0 |
| [8] | Cheon W, Kim YS, Lee SG, et al. First report of branch dieback of walnut caused by Neofusicoccum parvum in Korea[J]. Plant Disease, 2013, 97(8) : 1114–1115. |
| [9] | Wu YK, Yu JY, Zhu XE. Identification of the causal agent of branch blight disease of walnut trees in Guizhou[J]. Guizhou Forestry Science and Technology, 2016, 44(4) : 1–6. (in Chinese)吴跃开, 余金勇, 朱秀娥. 贵州核桃枝枯病病原菌的初步鉴定[J]. 贵州林业科技, 2016, 44(4) : 1–6. |
| [10] | Fang ZD. Plant Pathology Research Methods[M].3rd Edition.Beijing: China Agriculture Publishing House, 1998: 46-124. (in Chinese)方中达. 植病研究法[M].第3版.北京: 中国农业出版社, 1998: 46-124. |
| [11] | Sun JM, Zhang JZ, Wei D, et al. Identification and biological characterization of the pathogen causing a new black spot disease on Musa spp[J]. Acta Phytopathologica Sinica, 2016, 46(1) : 119–123. (in Chinese)孙嘉曼, 张进忠, 韦弟, 等. 一种新的香蕉黑斑病病原菌鉴定及生物学特性研究[J]. 植物病理学报, 2016, 46(1) : 119–123. |
| [12] | Sun DW, Cao JF, Pei WH, et al. Identification of a new Phytophthora blight disease on konjac in Yunnan[J]. Acta Phytopathologica Sinica, 2015, 45(1) : 84–87. (in Chinese)孙道旺, 曹继芬, 裴卫华, 等. 云南魔芋新病害—疫病病原菌的鉴定[J]. 植物病理学报, 2015, 45(1) : 84–87. |
| [13] | Wei JC. Fungi Identification Manual[M].Shanghai: Shanghai Science and Technology Press, 1979: 405-425. (in Chinese)魏景超. 真菌鉴定手册[M].上海: 上海科学技术出版社, 1979: 405-425. |
| [14] | Wu CY, Chen HN, Li J, et al. Optimization of ISSR-PCR reaction system of carrot by orthogonal design[J]. Molecular Plant Breeding, 2013, 11(6) : 838–842. |
| [15] | Qi PK, Jang ZD, Xiang MM. Chinese Fungi Records. 34th Volume, Phomopsis sp[M].Beijing: Science Press, 2007: 4-16. (in Chinese)戚佩坤, 姜子德, 向梅梅. 中国真菌志第三十四卷拟茎点霉属[M].北京: 科学出版社, 2007: 4-16. |
| [16] | Zhang YP, Qu HX, Luo SC, et al. Advance of biology and pathogenic mechanisms research on some major crops diseases caused by Phomopsis sp[J]. Chinese Agricultural Science Bulletin, 2013, 29(33) : 327–332. (in Chinese)张岳平, 瞿华香, 罗绍春, 等. 一些重要作物拟茎点霉属病原生物学及致病机制研究概况[J]. 中国农学通报, 2013, 29(33) : 327–332. DOI:10.3969/j.issn.1000-6850.2013.33.058 |
| [17] | Lao JP. Study on the diversity of endophytic Phomopsis species[D]. Hangzhou: Master's Thesis of Zhejiang University, 2007 (in Chinese)劳佳萍. 植物内生真菌拟茎点霉生物多样性研究[D]. 杭州: 浙江大学硕士学位论文, 2007 http://cdmd.cnki.com.cn/Article/CDMD-10335-2007090455.htm |
| [18] | Yuan GQ, Wei JG, Li QQ, et al. A new species of Phomopsis causing brown spot of Ziziphus mauritiana[J]. Mycosystema, 2008, 27(5) : 631–633. (in Chinese)袁高庆, 韦继光, 黎起秦, 等. 引起滇刺枣褐斑病的拟茎点霉属一新种[J]. 菌物学报, 2008, 27(5) : 631–633. |
| [19] | Ma LP, Hao BQ, Qin S, et al. Antagonistic inhibition analysis and biocontrol of asparagus stem blight Phomopsis asparagi[J]. Chinese Journal of Eco-Agriculture, 2009, 17(6) : 1229–1233. (in Chinese)马利平, 郝变青, 秦曙, 等. 芦笋茎枯病的生物防治及机理研究[J]. 中国生态农业学报, 2009, 17(6) : 1229–1233. |
| [20] | Anco DJ, Kim S, Mitchell TK, et al. Transformation of Phomopsis viticola with the green fluorescent protein[J]. Mycologia, 2009, 101(6) : 853–858. DOI:10.3852/09-007 |
| [21] | Rodeva R, Stoyanova Z, Pandeva R. A new fruit disease of pepper in Bulgaria caused by Phomopsis capsici[J]. Acta Horticulturae, 2009, 830 : 551–556. |
| [22] | Rodeva R, Karov I, Stoyanova Z, et al. Phompsis capsici and Colletotrichum coccoides infecting pepper in Macedonia[C]. International Symposium on Current Trends in Plant Protection. Belgrade, Serbia, 2012: 257-263 |
 2017, Vol. 44
2017, Vol. 44




