扩展功能
文章信息
- 谢丽丹, 王素英, 董世瑞
- XIE Li-Dan, WANG Su-Ying, DONG Shi-Rui
- 环境因子与螺旋藻(节旋藻)分布及丰度的相关性分析
- Correlation analysis of environmental factors to Spirulina (Arthrospira) distribution and abundance
- 微生物学通报, 2017, 44(6): 1295-1302
- Microbiology China, 2017, 44(6): 1295-1302
- DOI: 10.13344/j.microbiol.china.160709
-
文章历史
- 收稿日期: 2016-10-04
- 接受日期: 2017-02-09
- 优先数字出版日期(www.cnki.net): 2017-03-01
螺旋藻(节旋藻)喜高盐、高碱(pH 8.5-10.5) 和高温(28-35 ℃)环境,是35亿年前出现的多细胞丝状自养型蓝藻,也是地球上最古老的物种之一[1-2]。从16世纪西方探险家从印地安原始部落发现螺旋藻至今,已有的研究表明环境条件显著影响螺旋藻的分布、丰度,丁昌玲等[3]调查发现东海蓝藻中螺旋藻主要分布在靠近外海区,而靠近长江河口区域丰度很低,环境因子中温度对其生长具有明显的影响。周然等[4]对渤海海湾螺旋藻数量与环境因子关系研究发现螺旋藻主要分布于河口附近,认为温度是关键环境因子,这与Sun等[5]报道的渤海螺旋藻丰度变化受水温控制的结论相一致。Naselli-Flores[6]研究了西西里岛的21个水库,认为水位变化、pH值、富营养程度对螺旋藻丰度有较大影响,付贵萍等[7]研究也验证了这一点。柴毅等[8]和郭术津等[9]研究发现硝态氮是显著影响海河和长湖螺旋藻丰度变化的环境因子。目前对湿地螺旋藻(节旋藻)分布、丰度与环境因子之间的关系鲜有报道,因此本研究以海岸线较长、湿地类型比较多样化的渤海湿地作为研究对象,在对螺旋藻(节旋藻)数量与环境因子进行调查和测定的基础上,分析螺旋藻(节旋藻)分布、丰度与环境因子之间的关系,旨在筛选影响螺旋藻(节旋藻)分布、丰度的关键环境因子,改进实验室和养殖场培养螺旋藻(节旋藻)的环境条件,并在一定基础上为研究渤海海滨湿地微生物多样性提供依据。
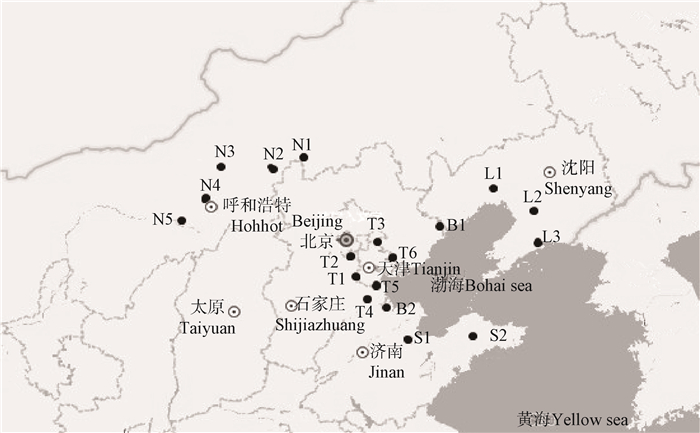
1 调查区域与分析方法 1.1 调查时间与区域针对渤海海滨湿地及其周边水域的螺旋藻(节旋藻)分布进行综合调查,在5个地区共设置18个采样点,如图 1所示,采样时间为2015年7-9月,其中,T1天津西青津静公路S110处;T2天津商业大学西院天然池塘;T3天津城建大学天然池塘;T4天津官港湿地;T5天津海河教育园区天然池塘;T6天津七里海湿地;B1河北北戴河湿地;B2河北南大港湿地;S1山东东营黄河桥西堤湿地;S2山东东营黄河大桥东堤湿地;L1辽宁盘锦红海滩度假村天然湿地;L2辽宁盘锦临港仓储物流园对面天然池塘;L3辽宁盘锦兆海苇业湿地;N1内蒙古巴哈尔西湖;N2内蒙古巴哈尔北湖;N3内蒙古索贝尔湖;N4内蒙古巴彦淖尔碱湖;N5内蒙古科研镇。
|
| 图 1 渤海海滨湿地采样位点 Figure 1 Sampling station along the route of the Bohai sea coastal wetlands |
|
|
每个采样点用采水器取5个平行样,采样水深20 cm-50 cm,每个样品为远离陆地2 m的4次或更多次数的采集水体的混合样品,样品采集后灌入经过高温湿热灭菌的采样瓶中,将样品以最短的时间带回实验室用CiL型尼康三目生物显微镜进行镜检,镜检前将水样混合均匀,吸取0.1 mL在10×40倍下用视野法计数各采样点的个体数,计数30-50个视野,以形态为依据初步判断螺旋藻(节旋藻)[10-11]。形态依据:藻丝体呈浅绿色或深绿色、粗细一致,顶部多宽圆且无顶冠、丝外无胶鞘,丝状螺旋[12]。
1.3 环境因子测定测定样品以下理化指标:温度、溶解氧(DO)、pH、盐度、总磷(TP)、总氮(TN)、氨氮(NH3-N)[13]。其中,温度、溶解氧浓度、pH和盐度在取样现场测定。其他理化指标按照国家标准进行测定。
1.4 数据处理采用SPSS软件对18个采样点的螺旋藻(节旋藻)数量进行聚类并分析其与环境因子的相关性,环境因子对螺旋藻(节旋藻)数量影响强弱采用灰关联分析[14-18],进行灰关联分析时,为了消除不同量纲带来的影响,采用均值法对原始数据进行无量纲处理,关联系数公式如下:
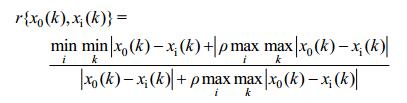
|
式中,ρ为分辨系数ρ,其越小分辨率越高,一般ρ的取值区间为[0, 1],通常取ρ=0.05[19-21],得关联度:
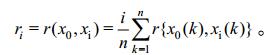
|
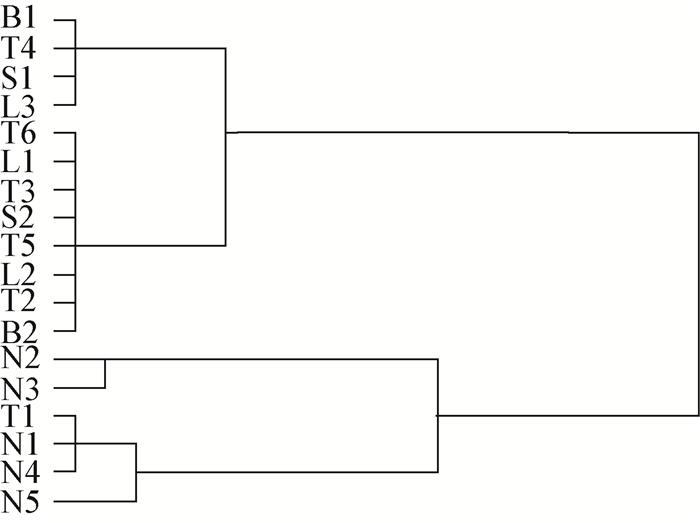
对18个采样点水样的螺旋藻(节旋藻)进行镜检计数,结果见表 1。对不同水样螺旋藻(节旋藻)数量进行聚类,结果见图 2。
| 编号No. | 数量范围Quantity range (×104 ind/L) | 平均数量Average number (×104 ind/L) |
| T1 | 110-201 | 194 |
| T2 | 76-113 | 98 |
| T3 | 102-134 | 111 |
| T4 | 9-28 | 17 |
| T5 | 86-121 | 103 |
| T6 | 103-148 | 127 |
| B1 | 13-28 | 17 |
| B2 | 19-29 | 23 |
| S1 | 99-134 | 112 |
| S2 | 65-82 | 79 |
| L1 | 121-146 | 135 |
| L2 | 87-118 | 107 |
| L3 | 18-42 | 25 |
| N1 | 187-213 | 197 |
| N2 | 346-392 | 364 |
| N3 | 291-332 | 321 |
| N4 | 145-201 | 178 |
| N5 | 218-287 | 255 |
|
| 图 2 18个采样点螺旋藻(节旋藻)数量聚类分析 Figure 2 Cluster analysis of Spirulina (Arthrospira) from the 18 sampling points |
|
|
由表 1可知,实验所采水样均可明显观察到目的藻丝体,说明螺旋藻(节旋藻)在渤海海滨湿地水域中广泛存在,但不同来源水样中螺旋藻(节旋藻)的数量存在明显差异,T4 (天津官港)、B1 (北戴河口)、B2 (南大港湿地)、L3 (盘锦兆海苇业湿地)等水样中仅观察到极个别藻丝体,其余水样中均较丰富。另外在观察过程中发现,水样中均不同程度地存在目的藻丝与其它微藻共存的现象,主要是小球藻及细丝状藻丝体。另外,不同地区螺旋藻(节旋藻)分布不同,内蒙古水样中螺旋藻(节旋藻)数量较多,而河北水样中则较少;同一地区不同水域分布也不同,天津湿地中除官港外,其他水域螺旋藻(节旋藻)数量相对较多,辽宁盘锦湿地中,除盘锦兆海苇业湿地外,螺旋藻(节旋藻)数量相对较多,山东湿地中,东营黄河桥西堤湿地螺旋藻(节旋藻)数量多于东营黄河大桥东堤湿地。
由图 2可知,基于螺旋藻(节旋藻)数量可将18个采样点分成两大组群,Ⅰ组群采样点主要分布于内蒙古地区和一个天津地区采样点(T1),剩余采样点为Ⅱ组群,对所划分的两个组群分别包含的采样点进行显著性分析,两组群差异极显著(P < 0.05),表明两组群样本中螺旋藻(节旋藻)数量差异显著。
2.2 环境因子根据国家水质指标测定方法对18个采样点的温度、溶解氧(DO)、pH、盐度、总磷(TP)、总氮(TN)、氨氮(NH3-N)进行测定,对5个地区的各个环境因子进行单因素方差分析Tukey HsD多重比较,结果如表 2所示。
| 编号 No. |
酸碱度 pH |
温度 Temperature |
溶解氧 DO |
盐度 Salinity |
总氮 TN |
总磷 TP |
化学需氧量 COD |
氨氮 NH3-N |
| T | 8.62 b | 30.42 a | 3.17 b | 2.51 c | 2.16 c | 0.48 a | 32.78 c | 0.39 c |
| B | 7.51 c | 29.01 a | 4.61 a | 6.62 b | 3.35 b | 0.15 b | 28.31 e | 1.34 b |
| S | 8.66 b | 29.51 a | 4.25 a | 1.51 d | 1.85 c | 0.14 b | 60.71 b | 0.58 c |
| L | 8.03 c | 28.33 a | 2.18 bc | 1.86 d | 0.73 d | 0.11 b | 30.93 cd | 0.08 d |
| N | 9.94 a | 24.61 b | 0.39 d | 29.66 a | 13.48 a | 0.39 a | 167.41 a | 2.42 a |
| 注:a、b、c、d、e为多重比较结果,同列标有不写字母者表示组间差异显著(P < 0.05),标有相同字母者表示组间差异不显著(P > 0.05),T、B、S、L、N分别为天津、河北、山东、辽宁、内蒙古地区. Note: a, b, c, d, e are the results of the multiple comparisons. Rows marked with different letters indicate that the difference is significant (P < 0.05), while the same letter state the opposite (P > 0.05). T, B, S, L, N represents Tianjin, Hebei, Shandong, Liaoning, Inner Mongolia respectively. | ||||||||
从表 2可以看出,各个地区水样的环境因子存在差异,发现内蒙古地区水样的8个环境因子与其他地区水样间存在显著差异;天津与山东、河北与辽宁地区水样的pH值差异不显著,天津、河北、山东、辽宁地区水样的温度差异不显著,河北与山东、天津与辽宁地区水样的DO差异不显著,山东与辽宁地区水样的盐度差异不显著,天津与山东地区的TN和NH3-N差异不显著,河北、山东、辽宁3个地区水样的TP差异不显著,天津与辽宁地区水样的COD差异不显著,其余差异显著。各个地区水样环境因子空间分布规律明显。
结合环境因子的空间分布规律,分析其与螺旋藻(节旋藻)数量的关系,结果如图 3所示。
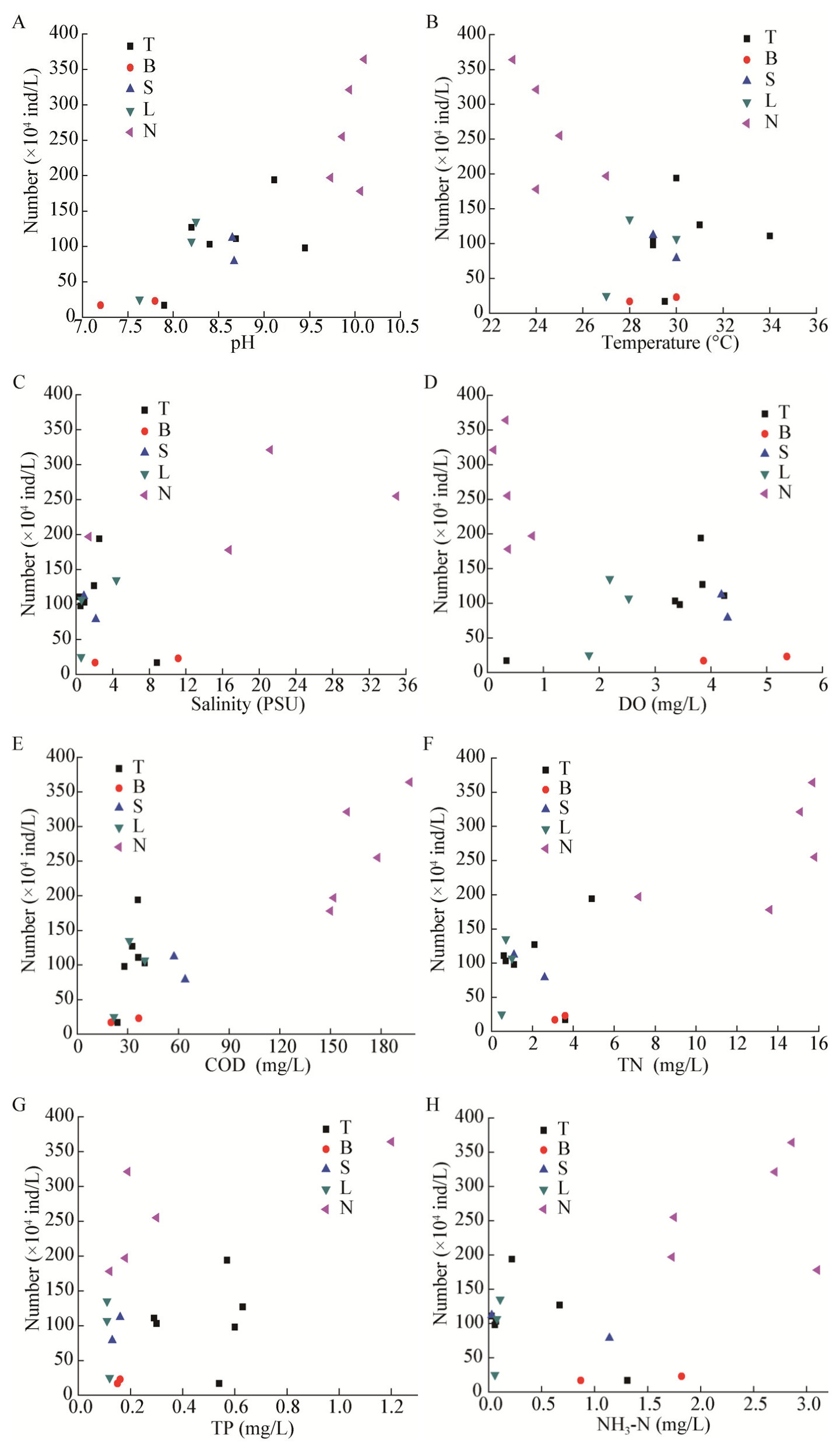
|
| 图 3 18个采样点螺旋藻(节旋藻)数量与环境因子的关系 Figure 3 Relationship between Spirulina (Arthrospira) quantity and environmental factors from 18 sampling points |
|
|
从图 3可以看出,在高碱(pH 8.5-10.5)、高温(28-35 ℃)和高盐水体环境中,螺旋藻(节旋藻)数量较高。当水体pH值大于8.2时,螺旋藻(节旋藻)数量明显增大,由此可以推断,适宜螺旋藻(节旋藻)生长的水体pH值在8.2-10.1之间(图 3a);温度在24-34 ℃之间,18个采样点水样中螺旋藻(节旋藻)均有分布,说明24-34 ℃适合螺旋藻(节旋藻)生长(图 3b);螺旋藻(节旋藻)在盐度较高的内蒙古地区数量较高,而在其他地区的低盐环境中数量较少,说明螺旋藻(节旋藻)喜高盐环境(图 3c);18个采样点中DO较低的水域,螺旋藻(节旋藻)数量较高,DO较高的水域,螺旋藻(节旋藻)数量较低(图 3d),而螺旋藻(节旋藻)数量与COD的关系则与DO相反(图 3e);水样TN和TP分别在4.9-15.8 mg/L和0.10-0.63 mg/L之间时,螺旋藻(节旋藻)数量较大,因此认为该条件下的水体适宜螺旋藻(节旋藻)的生长(图 3f、g),NH3-N的变化规律与TN相似,在1.8-3.0 mg/L时螺旋藻(节旋藻)数量较大(图 3h)。
参照我国地面水环境质量标准[22],DO、COD作为水污染的指标,当水中DO低于3-4 mg/L时,表明水已经受到污染,当COD浓度超过40 mg/L时,表示水体已经受到有机物的污染。由图 3d和图 3e可知内蒙古水样中的DO小于3 mg/L,COD大于40 mg/L,辽宁地区水样的DO小于3 mg/L,山东地区的东营大桥和西提的COD大于40 mg/L,天津地区的官港DO小于3 mg/L,说明这些湿地已经受到不同程度的污染。
2.3 螺旋藻(节旋藻)数量与环境因子相关性对螺旋藻(节旋藻)数量与环境因子进行Pearson相关分析及t检验,结果表明螺旋藻(节旋藻)数量与pH、盐度、TN、TP、COD、NH3-N的相关系数分别为0.671、0.794、0.677、0.566、0.744、0.55 (r > 0),且t检验P < 0.05,P < 0.01,说明螺旋藻(节旋藻)数量与pH、盐度、TN、TP、COD、NH3-N呈显著正相关;螺旋藻(节旋藻)数量与DO的相关系数为-0.466,且t检验P < 0.05,说明螺旋藻(节旋藻)数量与DO呈显著负相关;螺旋藻(节旋藻)数量与温度的相关系数为-0.345,且t检验P > 0.05,说明螺旋藻(节旋藻)数量与温度呈负相关,但相关不显著,说明温度不是引起18个采样点水样中螺旋藻(节旋藻)数量差异的原因。
2.4 螺旋藻(节旋藻)数量与环境因子关联度由表 3可知,各环境因子与螺旋藻(节旋藻)数量的关联度是不一样的,表明其对螺旋藻(节旋藻)数量的影响大小不一样,各环境因素对螺旋藻(节旋藻)数量关联程度依次为:COD > pH > TN > 温度 > TP > DO > 盐度 > NH3-N,影响最大的环境因子是COD,最小是NH3-N。
| 环境因子Environmental factor | 关联度Correlation degree | 排序Sort |
| pH | 0.373 | 2 |
| Temperature | 0.342 | 4 |
| DO | 0.279 | 6 |
| Salinity | 0.272 | 7 |
| TN | 0.363 | 3 |
| TP | 0.331 | 5 |
| COD | 0.375 | 1 |
| NH3-N | 0.267 | 8 |
综上分析,发现渤海海滨湿地螺旋藻(节旋藻)数量与环境因子具有相关性。本研究中发现螺旋藻(节旋藻)数量与pH值呈正相关,且相关性显著,当水体pH值大于8.2时,螺旋藻(节旋藻)数量明显增大,由此可以推断,适宜螺旋藻(节旋藻)生长的水体pH值在8.2-10.1之间,这个结果与文献[23]中报道的螺旋藻的最适pH值在8.5-10.5之间基本吻合;温度是影响螺旋藻(节旋藻)数量分布的重要因素[24-25],Motham等[26]认为螺旋藻生长的最适温度范围是25-35 ℃,因此夏季是螺旋藻(节旋藻)等浮游植物的生长繁殖的旺季,本研究也证明了这一点,在夏季渤海海滨湿地的平均温度在28.5 ℃,是螺旋藻(节旋藻)生长的最适温度,使螺旋藻(节旋藻)的数量得到急剧增加;目前大面积培养的螺旋藻(节旋藻)藻种大多源于碱性湖水中,通常在淡水培养基中培养,内蒙古水样盐度远远高于其他水样,说明螺旋藻(节旋藻)在盐度较高的环境下生长速率快,这与Masmoudi等[27]报道的结果相一致;水中的溶解氧,一部分来自于大气,另一部分来自浮游植物的光合作用,调查结果显示,渤海海滨湿地的螺旋藻(节旋藻)数量与DO负相关,这可能是由于螺旋藻(节旋藻)浓度过大导致DO偏小,此外,有研究表明温度与DO呈现负相关[28],但本研究的结果是两者呈正相关,与之矛盾,这可能是由于夏季螺旋藻等浮游植物光合作用产生氧气而导致溶解氧增加;很多调查数据表明[29]COD对藻类(或叶绿素a)的影响排列于水环境各因子的前二位并呈正相关,与本研究的结论一致,螺旋藻(节旋藻)数量与COD显著正相关,COD过高易引起螺旋藻(节旋藻)的大量繁殖,可能是因为有机污染物在水体微生物的分解作用下,能够产生C、N、P等藻类生长所需要的营养物质[30]。本研究调查数据显示:内蒙古地区的COD明显高于其他地区,螺旋藻(节旋藻)数量也高于其他地区;本研究中TP未表现出与螺旋藻(节旋藻)数量明显相关性,究其原因可能是受水体中除藻类外的其他生物与非生物环境条件的影响。
4 结论分析水样的镜检结果及水质指标可知:螺旋藻(节旋藻)在渤海海滨湿地及其周边水域中广泛存在,但是由于生长环境不同,螺旋藻的生物量也不尽相同,藻丝数量从2-3个/滴到103个/滴不等。根据18个采样点螺旋藻(节旋藻)的数量可知,不同地区水样中螺旋藻(节旋藻)分布不同,以内蒙古地区最高,河北地区最低,同一地区不同湿地水样中螺旋藻(节旋藻)分布也不同,天津湿地中除官港外,其他水域螺旋藻(节旋藻)分布较高,辽宁盘锦湿地中,除盘锦兆海苇业湿地外,螺旋藻(节旋藻)分布较高,山东湿地中,东营黄河水湿地西堤螺旋藻(节旋藻)数量多于东营黄河水湿地大桥。通过对螺旋藻(节旋藻)数量与环境因子的相关性进行分析,发现螺旋藻(节旋藻)数量与pH、盐度、TN、TP、COD、NH3-N呈正相关,且相关显著(P < 0.05,P < 0.01),与DO呈负相关,且相关显著(P < 0.05,P < 0.01),与温度呈负相关,但相关不显著(P > 0.05),各环境因素对螺旋藻(节旋藻)数量关联程度依次为:COD > pH > TN > 温度 > TP > DO > 盐度 > NH3-N,影响最大的环境因子是COD,最小是NH3-N。
通过对渤海海滨湿地螺旋藻(节旋藻)分布调查,可知渤海海滨湿地螺旋藻(节旋藻)资源丰富,后期可根据调查结果对螺旋藻(节旋藻)分布较高的地区进行螺旋藻分离纯化,并结合与环境因子相关性关系,设计最优培养基扩大培养,获得大量适合北方低温环境生长的螺旋藻(节旋藻)新种。
| [1] | Chislock MF, Sharp KL, Wilson AE. Cylindrospermopsis raciborskii dominates under very low and high nitrogen-to-phosphorus ratios[J]. Water Research, 2013, 49 : 207–214. |
| [2] | Xiao J, Teng JL. Research progress of plant Spirulina[J]. Biology Teaching, 2014, 39(5) : 7–8. (in Chinese)肖军, 滕继林. 植物螺旋藻研究进展[J]. 生物学教学, 2014, 39(5) : 7–8. |
| [3] | Ding CL, Sun J, Zhou F. The quantities and distributions of nitrogen-fixing cyanobacteria along hypoxia area and adjacent waters in the East China Sea[J]. Transactions of Oceanology and Limnology, 2012(4) : 177–188. (in Chinese)丁昌玲, 孙军, 周峰. 东海低氧区及邻近海域固氮蓝藻丰度与分布[J]. 海洋湖沼通报, 2012(4) : 177–188. |
| [4] | Zhou R, Peng ST, Qin XB, et al. Phytoplankton assemblages and their relation to environmental factors by multivariate statistic analysis in Bohai Bay[J]. Environmental Science, 2013, 34(3) : 864–873. (in Chinese)周然, 彭士涛, 覃雪波, 等. 渤海湾浮游植物与环境因子关系的多元分析[J]. 环境科学, 2013, 34(3) : 864–873. |
| [5] | Sun J, Lui DY, Qian SB. Preliminary study on seasonal succession and development pathway of phytoplankton community in the Bohai Sea[J]. Acta Oceanologica Sinica, 2001, 20(2) : 251–260. |
| [6] | Naselli-Flores L. Phytoplankton assemblages in twenty-one Sicilian reservoirs: relationships between species composition and environmental factors[J]. Hydrobiologia, 2000, 424(1) : 1–11. DOI:10.1023/A:1003907124528 |
| [7] | Fu GP, Ning KL, Zhang JH, et al. Phytoplankton community and their correlative environmental factors in Shiyan Reservoir and Tiegang Reservoir in Shenzhen[J]. Journal of Shenzhen University Science and Engineering, 2014, 31(4) : 428–435. (in Chinese)付贵萍, 宁凯乐, 张佳红, 等. 深圳石岩、铁岗水库藻类及环境影响因子分析[J]. 深圳大学学报理工版, 2014, 31(4) : 428–435. |
| [8] | Chai Y, Peng T, Guo K, et al. Community characteristics of phytoplankton in Lake Changhu and relationships with environmental factors in the summer of 2012[J]. Chinese Journal of Plant Ecology, 2014, 38(8) : 857–867. (in Chinese)柴毅, 彭婷, 郭坤, 等. 2012年夏季长湖浮游植物群落特征及其与环境因子的关系[J]. 植物生态学报, 2014, 38(8) : 857–867. |
| [9] | Guo SJ, Li YQ, Zhang CX, et al. Phytoplankton community in the Bohai Sea and its relationship with environmental factors[J]. Marine Science Bulletin, 2014, 33(1) : 95–105. (in Chinese)郭术津, 李彦翘, 张翠霞, 等. 渤海浮游植物群落结构及与环境因子的相关性分析[J]. 海洋通报, 2014, 33(1) : 95–105. DOI:10.11840/j.issn.1001-6392.2014.01.013 |
| [10] | Ma CX, Bian SW, Yu HX, et al. Correlation between phytoplankton abundance and environmental factors in Xingkai Lake[J]. Journal of Northeast Forestry University, 2012, 40(2) : 78–80. (in Chinese)马成学, 卞少伟, 于洪贤, 等. 兴凯湖浮游植物丰度与环境因子的相关性[J]. 东北林业大学学报, 2012, 40(2) : 78–80. |
| [11] | Ekroos J, Rundl f M, Smith HG. Trait-dependent responses of flower-visiting insects to distance to semi-natural grasslands and landscape heterogeneity[J]. Landscape Ecology, 2013, 28(7) : 1283–1292. DOI:10.1007/s10980-013-9864-2 |
| [12] | Yang LJ, Yu PF, Zhu JQ, et al. Community structure characteristics of phytoplankton and related affecting factors in Hengshan Reservoir, Zhejiang, China[J]. Chinese Journal of Applied Ecology, 2014, 25(2) : 569–576. |
| [13] | Katherine RM, Rochelle GL, Mike C, et al. Phosphorus availability, phytoplankton community dynamics, and insect-specific plant reactions[J]. Trends in Plant Science, 2012, 17(5) : 250–259. DOI:10.1016/j.tplants.2012.01.003 |
| [14] | Zhou Q, Chen BJ, Lou FR, et al. Grey relational analysis between phytoplankton diversity and environmental factors in Yantan reservoir[J]. Guangdong Agricultural Sciences, 2015, 42(3) : 140–146. (in Chinese)周晴, 陈柏娟, 娄方瑞, 等. 岩滩水库浮游植物多样性与环境因子的灰色关联性分析[J]. 广东农业科学, 2015, 42(3) : 140–146. |
| [15] | Lira GA, Moura AN, Vilar MC, et al. Vertical and temporal variation in phytoplankton assemblages correlated with environmental conditions in the Mundau reservoir, semi-arid northeastern Brazil[J]. Brazilian Journal of Biology, 2014, 74(3 Suppl 1) : S93. |
| [16] | Nassar MZ, El-Din NGS, Gharib SM. Phytoplankton variability in relation to some environmental factors in the eastern coast of Suez Gulf, Egypt[J]. Environmental Monitoring and Assessment, 2015, 187 : 648. DOI:10.1007/s10661-015-4874-y |
| [17] | Landeira JM, Ferron B, Lunven M, et al. Biophysical interactions control the size and abundance of large phytoplankton chains at the ushant tidal front[J]. PLoS One, 2014, 9(2) : e90507. DOI:10.1371/journal.pone.0090507 |
| [18] | Liu H. Correlation analysis on phytoplankton quantity and environmental factors in Hedi Reservoir[J]. Research of Soil and Water Conservation, 2015, 22(1) : 163–167. (in Chinese)刘华. 鹤地水库浮游植物数量与环境因子的相关分析[J]. 水土保持研究, 2015, 22(1) : 163–167. |
| [19] | Wang L, Wang C, Deng G, et al. Temporal and spatial variations in phytoplankton: correlations with environmental factors in Shengjin Lake, China[J]. Environmental Science and Pollution Research, 2015, 22(18) : 14144–14156. DOI:10.1007/s11356-015-4640-2 |
| [20] | Xiao ZS, Lin C, Yang S, et al. Community structure of phytoplankton and its relation with environmental factors in Xinhua Lake of China[J]. Chinese Bulletin of Botany, 2016, 51(3) : 353–362. (in Chinese)肖智顺, 林聪, 杨双, 等. 大庆新华湖藻类植物群落结构与环境因子的相关性[J]. 植物学报, 2016, 51(3) : 353–362. DOI:10.11983/CBB15094 |
| [21] | Coupel P, Jin HY, Ruiz-pino D, et al. Phytoplankton distribution in the Western Arctic Ocean during a summer of exceptional ice retreat[J]. Biogeosciences Discussions, 2011, 8(4) : 6919–6970. DOI:10.5194/bgd-8-6919-2011 |
| [22] | Xia Q, Liu HP, Liu F, et al. The revision of the national standard GB3838-88 People's Republic of China environmental quality standard for surface water[J]. Environmental Science Research, 1988, 1(5) : 1–102. (in Chinese)夏青, 刘和平, 刘锋, 等. 中华人民共和国国家标准GB3838-88地面水环境质量标准修订说明[J]. 环境科学研究, 1988, 1(5) : 1–102. |
| [23] | Liu CG, Jin XC, Sun L, et al. Effects of pH on growth and species changes of Algae in freshwater[J]. Journal of Agro-Environmental Science, 2005, 24(2) : 294–298. (in Chinese)刘春光, 金相灿, 孙凌, 等. pH值对淡水藻类生长和种类变化的影响[J]. 农业环境科学学报, 2005, 24(2) : 294–298. |
| [24] | Fehling J, Davidson K, Bolch CJS, et al. The relationship between phytoplankton distribution and water column characteristics in North West European Shelf Sea Waters[J]. PLoS One, 2012, 7(7) : e34098. |
| [25] | Siemering B, Bresnan E, Painter SC, et al. Phytoplankton distribution in relation to environmental drivers on the North West European Shelf Sea[J]. PLoS One, 2016, 11(10) : e0164482. DOI:10.1371/journal.pone.0164482 |
| [26] | Motham M, Peerapornpisal Y, Tongsriri S, et al. High subzero temperature preservation of spirulina platensis (Arthrospira fusiformis) and its ultrastucture[J]. Chiang Mai Journal of Science, 2012, 39(4) : 554–561. |
| [27] | Masmoudi S, Tastard E, Guermazi W, et al. Salinity gradient and nutrients as major structuring factors of the phytoplankton communities in salt marshes[J]. Aquatic Ecology, 2015, 49(1) : 1–19. DOI:10.1007/s10452-014-9500-5 |
| [28] | Liu JK. Advanced Hydrobiology[M].Beijing: Science Press, 1999. (in Chinese)刘建康. 高级水生生物学[M].北京: 科学出版社, 1999. |
| [29] | Jiang YJ, He W, Liu WX, et al. The seasonal and spatial variations of phytoplankton community and their correlation with environmental factors in a large eutrophic Chinese lake (Lake Chaohu)[J]. Ecological Indicators, 2014, 40 : 58–67. DOI:10.1016/j.ecolind.2014.01.006 |
| [30] | Wei P, Huang LM, Feng JH, et al. Distribution characteristics of COD and DO and its influencing factors in the Guangzhou sea zone of the Pearl River Estuary[J]. Ecology and Environmental Sciences, 2009, 18(5) : 1631–1637. (in Chinese)魏鹏, 黄良民, 冯佳和, 等. 珠江口广州海域COD与DO的分布特征及影响因素[J]. 生态环境学报, 2009, 18(5) : 1631–1637. |
 2017, Vol. 44
2017, Vol. 44




