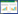扩展功能
文章信息
- 曾加会, 李元媛, 阮迪申, 晁元卿, 仇荣亮, 杨燕花, 王诗忠
- ZENG Jia-Hui, LI Yuan-Yuan, RUAN Di-Shen, CHAO Yuan-Qing, QIU Rong-Liang, YANG Yan-Hua, WANG Shi-Zhong
- 植物根际促生菌及丛枝菌根真菌协助植物修复重金属污染土壤的机制
- Phytoremediation of heavy metal contaminated soils by plant growth-promoting rhizobacteria and arbuscular mycorrhizal fungi
- 微生物学通报, 2017, 44(5): 1214-1221
- Microbiology China, 2017, 44(5): 1214-1221
- DOI: 10.13344/j.microbiol.china.160507
-
文章历史
- 收稿日期: 2016-07-12
- 接受日期: 2016-10-12
- 优先数字出版日期(www.cnki.net): 2016-11-08
2. 广东省环境污染控制与修复技术重点实验室 中山大学 广东 广州 510275
2. Guangdong Provincial Key Laboratory of Environmental Pollution Control and Remediation Technology, Sun Yat-sen University, Guangzhou, Guangdong 510275, China
随着工业、农业及采矿业的迅速发展,重金属污染问题日益突出。土壤重金属污染已成为人类生存和发展所面临的严重环境问题。近年来,植物修复以其经济、环保、修复面积大等优势而广受关注,已成为主要土壤重金属污染修复措施。Marrugo-Negrete等[1]研究了麻疯树对Hg污染土壤的植物修复效果,结果显示麻疯树具有较高的生物富集系数及低转移系数,对Hg污染土壤具较大修复潜力。然而,重金属污染土壤的植物修复效果主要取决于植物的提取能力和生物量,但大多数超富集植物或富集植物具有生物量较低、根系扩张深度有限、且对重金属的转移率偏低等不足[2]。
因此,改善植物修复技术的关键需提高植物的生物量和重金属转移率。目前,植物根际促生菌(Plant growth-promoting rhizobacteria,PGPR)联合植物修复重金属污染土壤的研究已多见报道。PGPR的分泌物不但可提供植物生长所需养分,还可提高根际重金属活性及其在植物体内的转移系数。陈生涛等[3]研究发现植物促生细菌Rhizobium sp.W33能显著促进黑麦草对Cu的吸收,同时提高植物对Cu的富集、转移系数。此外,丛枝菌根真菌(Arbuscular mycorrhizal fungi,AMF)在植物修复中的贡献也不容忽视。AMF侵染植物根系后形成菌根共生体,可扩大根系吸收面积,促进植物对养分的获取和对重金属的富集,还可提高宿主植物的抗逆性[4]。通过比较研究8种AMF对紫花苜蓿吸收污染土壤Cd、Zn的影响,黄晶等[5]发现在Cd、Zn污染下,AMF仍能明显侵染植物根系,并促进了紫花苜蓿吸收积累Cd、Zn。
当前针对PGPR-植物互作体系已有大量研究,但在PGPR的应用方面仍存在挑战,一方面由于目前发现的高效菌株数量有限,且存在高效菌株不易筛选等难题,PGPR单菌接种对植物的促生效果不显著;另一方面,在实地修复中PGPR菌株的生长往往受环境条件限制,阻碍了菌株对植物根际环境的适应以及与植物形成较好的共生关系。因此,植物根际微生物的互作对植物的影响开始受到研究者的关注。据文献报道,PGPR和AMF对植物生长可能存在某种协同促进作用[6-7],Vivas等[8-9]的研究结果也揭示了重金属胁迫条件下PGPR和AMF可能的共生效应。
基于当前研究的进展和不足,本文对重金属污染土壤植物修复过程中PGPR作用机制、AMF作用途径以及PGPR和AMF的互作关系进行梳理总结,以期为微生物-植物修复体系的深入研究提供一定参考。
1 植物根际促生菌(PGPR)作用机制植物根际促生菌(PGPR)是指定殖于植物根际系统,且能对植物生长产生促进作用的一类细菌的总称[7]。据文献报道,PGPR可通过固氮、溶磷,分泌植物激素,合成铁载体及1-氨基-1-羧基环丙烷(1-Aminocyclopropane-1-carboxylic acid,ACC)脱氨酶等物质,促进植物生长及增强植物对重金属的耐性[2, 10]。Kumar等[11]研究发现,具有固氮溶磷能力的根际细菌Bacillus megeterium、Arthrobacter chlorophenolicus和Enterobacter sp.可显著促进小麦植株生长,且3种菌共同接种的促生效果最佳。Dell’Amico等[12]给受Cd胁迫的欧洲油菜接种可产吲哚乙酸(Indole acetic acid,IAA)、铁载体和ACC脱氨酶的Cd耐性PGPR菌株,发现植物生物量及对Cd的总累积量皆得到显著提高。在重金属污染土壤修复过程中,PGPR-植物联合作用主要有两种形式:一种是通过PGPR产生铁载体、有机酸及表面活性剂等物质改变重金属的生物有效性及转移性,从而促进或抑制植物对重金属的吸收[2];另一种主要是通过PGPR产生的生长调节因子及酶类等提高植物养分吸收,促进植物生长。
有研究发现,重金属胁迫条件能促进PGPR分泌ACC脱氨酶、IAA、铁载体等物质[13],对植物的抗氧化系统或重金属抗性基因表达产生较大影响,可能是PGPR参与修复过程的主要作用机制(图 1)。

|
| 图 1 植物根际促生菌(PGPR)、丛枝菌根真菌(AMF)联合植物修复重金属污染土壤机理 Figure 1 Mechanism of heavy metal contaminated soils remediated by phytoremediation coupled with plant growth-promoting rhizobacteria (PGPR) and arbuscular mycorrhizal fungi (AMF) 注:IAA:吲哚乙酸;ACC:1-氨基-1-羧基环丙烷. Note: IAA: Indole-3-acetic acid; ACC: 1-Amino-1-carboxyl cyclopropane. |
|
|
乙烯可参与植物对抗生物或非生物胁迫过程。重金属胁迫诱导植物产生大量的应激乙烯,过量的乙烯会抑制植物根生长,从而间接减少植物对重金属的吸收。植物分泌的ACC作为乙烯合成的前体,可被PGPR产生的ACC脱氨酶水解成α-酮丁酸(α-Ketobutyrate)和氨(可被PGPR利用为氮源),从而降低了植物体ACC含量,抑制乙烯合成[2],减轻了胁迫对植物生长的抑制作用。陈佛保等[14]从多金属污染土壤筛选获得具有ACC脱氨酶活性的菌株,可缓解Zn胁迫对水稻的影响,促生效果显著。植物激素主要通过其合成、运输、信号传导途径以及激素间的相互作用来调控植物的生长响应[15],并诱导植物对胁迫环境产生系统抗性。潘风山等[16]从植物根际筛选出的4株产IAA的Cd耐性菌株可促进油菜植株生长;而Agami等[17]对Cd胁迫下的小麦作外源IAA处理,不但增强了小麦抗氧化酶活性,缓解了Cd胁迫对植株的不利影响,还降低了小麦对Cd的积累量。此外,陈燕玫等[18]也证实接种具有ACC脱氨酶活性的菌株DBM1可有效促进Pb胁迫下红麻的生长,且DBM1对红麻的促生作用有胁迫诱导的特性。PGPR分泌产生的铁载体对土壤中游离态铁具有较强的螯合作用,形成的铁-铁载体复合体既可被PGPR和植物吸收利用,同时又竞争了病原菌生存所需要的铁,从而大大降低病原菌的繁衍和侵染能力;铁载体不但可以增加土壤中可利用铁的浓度,还可以增强土壤中重金属的可移动性,从而促进植物对重金属的吸收[2, 10]。Chen等[19]研究揭示Enterobacter sp. strain EG16受重金属Cd胁迫诱导可增加铁载体合成,且这一过程还可缓解Cd胁迫对IAA合成的抑制作用,从而强化该菌在Cd胁迫条件下对植物的促生能力。Braud等[20]研究表明,Cr、Pb的存在可诱导铜绿假单胞菌(Pseudomonas aeruginosa)分泌铁载体,并能提高宿主植物对重金属的提取效率。此外,Karimzadeh等[21]的研究也发现,向土壤溶液中添加微生物铁载体去铁敏-B (DFO-B)可增强超富集植物天蓝遏蓝菜对Cd的吸收,并促进了Cd由根向茎转移,提高了植物提取效率。
此外,PGPR还可通过固氮、溶磷作用增加植物N营养以及对土壤中不溶性P的转化与吸收,也可通过氧化、还原、水解、甲基化等过程转化土壤中重金属形态,从而促进或抑制重金属的转移,最终达到植物修复的目的。
2 丛枝菌根真菌(AMF)作用途径AMF在自然界广泛存在,可以与超过80%的陆生高等植物形成共生体[22]。在重金属污染土壤中,AMF不但可降低重金属对植物的毒害,还可以通过调节重金属的吸收、转运过程,来提高重金属的植物提取或植物稳定效率[23]。研究发现,AMF可抑制植物体内重金属转移,减轻重金属对植物的毒害,从而促进植物生长。李霞等[24]发现,接种摩西球囊霉(Glomus mosseae)和根内球囊霉(Glomus intraradices)可增加铅锌矿区先锋植物翅荚木的生物量,而根内球囊霉可降低Pb、Zn的转移系数,有效强化植物根系固持Pb、Zn的能力。Adewole等[25]的研究显示,摩西球囊霉和根内球囊霉也可以降低向日葵中Pb、Cd的转移,增强了植物的重金属耐性,产量增加。另外,AMF促进植物对重金属的吸收可提高植物提取效率,以达到污染修复目的。Leung等[26]从As污染采矿区筛选到土著AMF接种至蜈蚣草和狗牙根,加强了蜈蚣草对As的吸收及狗牙根根部As含量。
关于AMF协助植物对抗重金属毒害机制(图 1)已有大量文献报道,AMF可直接作用于重金属,也可通过直接或间接途径影响宿主植物对重金属的耐受性。例如,AMF可通过菌丝体吸附重金属,细胞壁及原生质膜组分如几丁质、纤维素等结合固定重金属[22-23],从而抑制重金属在植物体内的转移。改善宿主植物的矿质营养状况也是AMF主要功能之一,尤其是P素营养。Andrade等[27]发现接种AMF可提高Cu、Zn胁迫下咖啡树P、K、Ca、Mg等元素含量,且降低了植株中Cu、Zn浓度。AMF还可对土壤pH值、植物根系分泌物及根际微生物群落结构等产生影响,土壤中重金属有效性受pH值影响较大[28]。Li等[28]研究表明,摩西球囊霉(Glomus mosseae)降低了Zn污染土壤中红三叶草对Zn的吸收,而土壤溶液中pH值的升高可能对Zn的溶解性产生了较大影响。此外,AMF侵染植物根系改变了植物根系形态,可使植物根系生物量和根长增加,从而影响植物吸收和重金属转移[27, 29]。Bedini等[30]研究发现,AMF还可以产生球囊霉素改变土壤团聚性,改善土壤质量。AMF产生球囊霉素、有机酸、植物生长素等次生代谢产物,导致植物生理代谢调节发生变化[4, 31],改变重金属的生物有效性;球囊霉素也可与重金属结合,益于植物固定作用[23]。
在重金属胁迫下,AMF还可通过影响防御酶活性、调节某些基因表达及重金属诱导蛋白合成来增强植物的重金属抗性[31-32]。Ouziad等[32]研究了重金属胁迫下菌根定殖对番茄基因表达的影响,发现接种根内球囊霉(Glomus intraradices)后,番茄植株中编码植物螯合肽合成酶和金属硫蛋白的基因减少,而编码抗氧化酶的基因增加,说明AMF主要作用是增强了宿主植物的抗氧化胁迫能力。Guarino等[33]发现,重金属胁迫条件下赤桉接种AMF后抗氧化酶和相关蛋白恢复至正常水平,而植物络合素谷胱甘肽含量则显著升高。
3 PGPR和AMF的协同作用与机制随着研究的不断深入,PGPR和AMF在重金属污染土壤修复中的作用备受关注,二者在植物修复重金属污染过程产生的协同作用更是逐步进入研究者的视线。目前研究发现的可与AMF产生协同作用的PGPR大多是假单胞菌属(Pseudomonas)和芽孢杆菌属(Bacillus)细菌[34-36]。Vivas等[37]从Cd污染土壤中分离出土著AMF和PGPR,发现AMF和短芽孢杆菌(Brevibacillus sp.)对三叶草的生长及N、P养分吸收有协同促进作用,且在高浓度Cd胁迫下,两种菌的协同效应显著,明显降低了植物对Cd的吸收,增强了植物耐Cd性。而具有Ni抗性的短芽孢杆菌(Brevibacillus brevis)和摩西球囊霉(Glomus mosseae)也可共同作用于植物,减少植物吸收Ni含量,降低对植物的毒害,从而促进植物生长[38]。Soni等[39]从植物根际土壤筛选到细杆菌属Cr(Ⅵ)还原细菌(Microbacterium sp. SUCR140),同几种AMF共接种于玉米,结果显示菌株SUCR140处理改善了AMF产孢量和根际定殖,并且二者共同作用使土壤中Cr(Ⅵ)生物有效性降低,减少了植物对铬的吸收,同时抑制了铬从植物根到茎的转移。
AMF、PGPR和宿主植物的相互作用过程复杂。AMF和PGPR间存在相互促进、相互抑制作用,也可能互不影响,而菌种间相互作用的性质取决于AMF、PGPR及宿主植物种类[40]。从以上研究可以发现,发生相互作用的AMF和PGPR间可能存在高度的专化性。然而,虽然对AMF和PGPR相互作用已有大量报道,但二者在自然状态或是胁迫条件下产生协同作用的具体机制仍有待深入揭示。基于已有研究成果,二者协同作用可能的机制(图 1)主要表现为以下几点:(1) AMF和PGPR相互作用促进植物对养分的吸收,尤其是改善了植物对N素和P素的利用,从而促进植物生长[41]。Meyer等[42]研究结果显示,恶臭假单胞菌(Pseudomonas putida)和土著AMF共接种可明显促进三叶草的养分吸收,植物根干重和结瘤数增加。Vivas等[9]的研究也发现在Zn胁迫下,细菌菌株B-I和土著AMF可协同促进三叶草吸收N、P,植物生物量显著增加。(2) 两种微生物通过合成植物激素促进植物生长[4, 13],细菌合成ACC脱氨酶等物质及真菌合成的球囊霉素降低胁迫影响[41];Gamalero等[43]研究表明具有ACC脱氨酶活性的细菌Pseudomonas putida UW4可与Gigaspora roseax协同促进黄瓜生长。(3) 两种微生物可以协同抑制病原菌生长[40]。Alizadeh等[44]研究发现共接种真菌和细菌可协同增强黄瓜对病原菌的抗性,且改变了防御病原菌相关的基因表达。(4) AMF根外菌丝在土壤中扩展,促进了根围各类细菌的传播,尤其可增加溶磷菌在根际的定殖。Artursson等[6]报道了丛枝菌根真菌可影响细菌群落结构;Azcón等[45]研究发现接种丛枝菌根真菌使土壤中细菌丰度增加至原来的233%,同时还改变了细菌菌落结构。(5) 细菌有助于菌根定殖,促进AMF生长发育[46],改变根际环境状况,还可提高根际土壤相关酶活性[47]。Medina等[36]的研究显示,相对于单接种,摩西球囊霉(Glomus mosseae)和短小芽孢杆菌(Bacillus licheniformis)共接种使紫花苜蓿产生了最大的生物量和植物根长,且细菌作用显著促进了菌根侵染。同样,在重金属污染条件下也观察到类似结果,Moreira等[48]给多金属矿山土中生长的玉米接种Pseudomonas reactans EDP28和Rhizophagus irregularis,发现细菌作用显著促进了AMF在植物根定殖,且二者共接种处理协同促进了植物生长。此外,有文献报道细菌合成的ACC脱氨酶可影响植物乙烯水平,改善植物根生长,从而可能促进了菌根定殖[43];也有研究表明,细菌分泌的植物激素和菌根共生体发育存在紧密联系[7, 49-50]。
目前,PGPR、AMF可对重金属污染土壤中生长的植物产生影响已被广泛报道,PGPR和AMF的共同作用研究也取得一些成果[13, 50]。PGPR促进植物生长和对重金属的解毒作用[3]、AMF在植物修复中为植物生长提供养分及降低重金属毒害[28]均有相关研究证实,也为AMF-PGPR联合植物修复体系提供了扎实的研究基础。然而,PGPR、AMF及植物三者的相互作用过程极为复杂,受环境条件、菌种、植物等多种因素共同影响。此外,重金属污染条件下PGPR诱导植物产生系统抗性过程仍不明确,其分泌物与植物间的信号传导路径尚需进一步探究;且AMF因自身不能纯培养等限制因素[50],使其分子水平作用机制研究受限。因此,AMF-PGPR-植物修复体系中三者相互作用机制研究成为一大难题,当前尚只能通过植物生长、菌株形态等表观现象及作用效果同分泌物的相关性间接体现,至于具体的分子机制仍需随着技术的进步予以深入研究。
4 展望在重金属污染土壤植物修复中,PGPR和AMF既可以分别促进植物生长和增强植物重金属抗性,又可共同作用于植物产生协同效应。随着研究的不断深入,越来越多的高效菌种被发现,且更多可协作的新细菌、真菌组合也在不断地被证实。可以预见的是,随着从宏观到微观、从理论到应用的相关技术的不断开发完善,PGPR-AMF-植物联合修复重金属污染土壤成为可能,且具有一定应用潜力。然而,当前关于PGPR、AMF和植物相互作用的研究仍存在不足,如下几方面的工作有待进一步展开:
(1) 更详细地研究PGPR和宿主植物相互作用的信号传导机制。相关研究结果普遍认为PGPR的作用机制主要是使植物具备诱导系统抗性(Induced systemic resistance,ISR)和诱导系统耐受性(Induced systemic tolerance,IST)。国内外对干旱、盐胁迫等条件下PGPR和宿主植物相互作用的信号传导机制已有较广泛研究,然而对重金属胁迫下该机制的研究仍存在不确定性。有研究者认为PGPR或通过分泌IAA、水杨酸等物质为信号分子,进而诱导植物抗性,但作用路径仍不明确,尚缺乏有力证据。因此,研究PGPR与植物间的信号传导机制可更好地揭示重金属胁迫下PGPR的作用机制。
(2) 深入研究PGPR和AMF相互作用机制。PGPR与AMF相互作用机制研究仍处于表观水平,而随着分子生物学、基因工程及AMF纯培养等新的研究方法的发展和应用,从分子水平尤其是通过特定信号分子传导的途径解释二者相互作用机制将成为可能。此外,PGPR及AMF的生长及相互作用均受环境因素影响。当前研究主要关注室内可控环境条件下PGPR与AMF相互作用及由此对植物修复的促进效果,而进一步开展更多的室外实验,研究适宜PGPR、AMF和修复植物的最佳环境条件,将实验室条件下效果显著的菌种应用到大田实践中进行验证,是PGPR与AMF协助重金属污染土壤植物修复实际应用的前提,也可为重金属污染土壤修复提供理论参考。
(3) 筛选更多可应用于重金属污染土壤修复的高效协作PGPR、AMF菌种组合。从重金属污染土壤中筛选的高效PGPR,是否可与从不同污染场地分离的耐性AMF及新的宿主植物建立良好协作关系并提高修复效率,目前尚未见相关研究报道。因此,应积极开展具有协作关系的PGPR和AMF筛选工作,建立各种不同植物的PGPR-AMF协作菌种库,为不同重金属污染土壤的微生物-植物联合修复技术提供高效PGPR-AMF-植物组合,构建最佳修复模式。
| [1] | Marrugo-Negrete J, Durango-Hernández J, Pinedo-Hernández J, et al. Phytoremediation of mercury-contaminated soils by Jatropha curcas[J]. Chemosphere, 2015, 127 : 58–63. DOI:10.1016/j.chemosphere.2014.12.073 |
| [2] | Ma Y, Prasad MNV, Rajkumar M, et al. Plant growth promoting rhizobacteria and endophytes accelerate phytoremediation of metalliferous soils[J]. Biotechnology Advances, 2011, 29(2) : 248–258. DOI:10.1016/j.biotechadv.2010.12.001 |
| [3] | Chen ST, He LY, Li Y, et al. Effect of Rhizobium sp. W33 on copper accumulation and organic exudations of different plants grown on copper-contaminated soil[J]. Acta Scientiae Circumstantiae, 2014, 34(8) : 2077–2084. (in Chinese) 陈生涛, 何琳燕, 李娅, 等. Rhizobium sp. W33对不同植物吸收铜和根际分泌物的影响[J]. 环境科学学报, 2014, 34(8) : 2077–2084. |
| [4] | Jeffries P, Gianinazzi S, Perotto S, et al. The contribution of arbuscular mycorrhizal fungi in sustainable maintenance of plant health and soil fertility[J]. Biology and Fertility of Soils, 2003, 37(1) : 1–16. |
| [5] | Huang J, Ling WT, Sun YD, et al. Impacts of arbuscular mycorrhizal fungi inoculation on the uptake of cadmium and zinc by alfalfa in contaminated soil[J]. Journal of Agro-Environment Science, 2012, 31(1) : 99–105. (in Chinese) 黄晶, 凌婉婷, 孙艳娣, 等. 丛枝菌根真菌对紫花苜蓿吸收土壤中镉和锌的影响[J]. 农业环境科学学报, 2012, 31(1) : 99–105. |
| [6] | Artursson V, Finlay RD, Jansson JK. Interactions between arbuscular mycorrhizal fungi and bacteria and their potential for stimulating plant growth[J]. Environmental Microbiology, 2006, 8(1) : 1–10. DOI:10.1111/EMI.2006.8.issue-1 |
| [7] | Nadeem SM, Ahmad M, Zahir ZA, et al. The role of mycorrhizae and plant growth promoting rhizobacteria (PGPR) in improving crop productivity under stressful environments[J]. Biotechnology Advances, 2014, 32(2) : 429–448. DOI:10.1016/j.biotechadv.2013.12.005 |
| [8] | Vivas A, Azcón R, Biró B, et al. Influence of bacterial strains isolated from lead-polluted soil and their interactions with arbuscular mycorrhizae on the growth of Trifolium pratense L. under lead toxicity[J]. Canadian Journal of Microbiology, 2003, 49(10) : 577–588. DOI:10.1139/w03-073 |
| [9] | Vivas A, Biró B, Ruíz-Lozano JM, et al. Two bacterial strains isolated from a Zn-polluted soil enhance plant growth and mycorrhizal efficiency under Zn-toxicity[J]. Chemosphere, 2006, 62(9) : 1523–1533. DOI:10.1016/j.chemosphere.2005.06.053 |
| [10] | Yang J, Kloepper JW, Ryu CM. Rhizosphere bacteria help plants tolerate abiotic stress[J]. Trends in Plant Science, 2009, 14(1) : 1–4. DOI:10.1016/j.tplants.2008.10.004 |
| [11] | Kumar A, Maurya BR, Raghuwanshi R. Isolation and characterization of PGPR and their effect on growth, yield and nutrient content in wheat (Triticum aestivum L.)[J]. Biocatalysis and Agricultural Biotechnology, 2014, 3(4) : 121–128. DOI:10.1016/j.bcab.2014.08.003 |
| [12] | Dell'Amico E, Cavalca L, Andreoni V. Improvement of Brassica napus growth under cadmium stress by cadmium-resistant rhizobacteria[J]. Soil Biology and Biochemistry, 2008, 40(1) : 74–84. DOI:10.1016/j.soilbio.2007.06.024 |
| [13] | Dimkpa CO, Svatoš A, Dabrowska P, et al. Involvement of siderophores in the reduction of metal-induced inhibition of auxin synthesis in Streptomyces spp.[J]. Chemosphere, 2008, 74(1) : 19–25. DOI:10.1016/j.chemosphere.2008.09.079 |
| [14] | Chen FB, Bai J, Lin QQ, et al. Application of plant growth-promoting rhizobacteria (PGPR) for reducing zinc stress on paddy rice[J]. Journal of Agro-Environment Science, 2012, 31(1) : 67–74. (in Chinese) 陈佛保, 柏珺, 林庆祺, 等. 植物根际促生菌(PGPR)对缓解水稻受土壤锌胁迫的作用[J]. 农业环境科学学报, 2012, 31(1) : 67–74. |
| [15] | Santner A, Estelle M. Recent advances and emerging trends in plant hormone signalling[J]. Nature, 2009, 459(7250) : 1071–1078. DOI:10.1038/nature08122 |
| [16] | Pan FS, Chen B, Ma XX, et al. Isolation and characterization of a specific endophytic bacterium from the Cd hyperaccumulator Sedum alfredii Hance[J]. Acta Scientiae Circumstantiae, 2014, 34(2) : 449–456. (in Chinese) 潘风山, 陈宝, 马晓晓, 等. 一株镉超积累植物东南景天特异内生细菌的筛选及鉴定[J]. 环境科学学报, 2014, 34(2) : 449–456. |
| [17] | Agami RA, Mohamed GF. Exogenous treatment with indole-3-acetic acid and salicylic acid alleviates cadmium toxicity in wheat seedlings[J]. Ecotoxicology and Environmental Safety, 2013, 94 : 164–171. DOI:10.1016/j.ecoenv.2013.04.013 |
| [18] | Chen YM, Bai J, Yang YX, et al. Phytoremediation of Pb polluted soil by kenaf with assistance of plant growth promoting rrhizobectrium (PGPR)[J]. Journal of Agro-Environment Science, 2013, 32(11) : 2159–2167. (in Chinese) 陈燕玫, 柏珺, 杨煜曦, 等. 植物根际促生菌辅助红麻修复铅污染土壤[J]. 农业环境科学学报, 2013, 32(11) : 2159–2167. DOI:10.11654/jaes.2013.11.009 |
| [19] | Chen YM, Chao YQ, Li YY, et al. Survival strategies of the plant-associated bacterium Enterobacter sp. strain EG16 under cadmium stress[J]. Applied and Environmental Microbiology, 2016, 82(6) : 1734–1744. DOI:10.1128/AEM.03689-15 |
| [20] | Braud A, Jézéquel K, Bazot S, et al. Enhanced phytoextraction of an agricultural Cr-and Pb-contaminated soil by bioaugmentation with siderophore-producing bacteria[J]. Chemosphere, 2009, 74(2) : 280–286. DOI:10.1016/j.chemosphere.2008.09.013 |
| [21] | Karimzadeh L, Heilmeier H, Merkel BJ. Effect of microbial siderophore DFO-B on Cd accumulation by Thlaspi caerulescens hyperaccumulator in the presence of zeolite[J]. Chemosphere, 2012, 88(6) : 683–687. DOI:10.1016/j.chemosphere.2012.03.075 |
| [22] | Gaur A, Adholeya A. Prospects of arbuscular mycorrhizal fungi in phytoremediation of heavy metal contaminated soils[J]. Current Science, 2004, 86(4) : 528–534. |
| [23] | Göhre V, Paszkowski U. Contribution of the arbuscular mycorrhizal symbiosis to heavy metal phytoremediation[J]. Planta, 2006, 223(6) : 1115–1122. DOI:10.1007/s00425-006-0225-0 |
| [24] | Li X, Peng XW, Wu SL, et al. Effect of arbuscular mycorrhizae on growth, heavy metal uptake and accumulation of Zenia insignis Chun seedlings[J]. Environmental Science, 2014, 35(8) : 3142–3148. (in Chinese) 李霞, 彭霞薇, 伍松林, 等. 丛枝菌根对翅荚木生长及吸收累积重金属的影响[J]. 环境科学, 2014, 35(8) : 3142–3148. |
| [25] | Adewole MB, Awotoye OO, Ohiembor MO, et al. Influence of mycorrhizal fungi on phytoremediating potential and yield of sunflower in Cd and Pb polluted soils[J]. Journal of Agricultural Sciences, 2010, 55(1) : 17–28. |
| [26] | Leung HM, Ye ZH, Wong MH. Interactions of mycorrhizal fungi with Pteris vittata (As hyperaccumulator) in As-contaminated soils[J]. Environmental Pollution, 2006, 139(1) : 1–8. DOI:10.1016/j.envpol.2005.05.009 |
| [27] | Andrade SAL, Silveira APD, Mazzafera P. Arbuscular mycorrhiza alters metal uptake and the physiological response of Coffea arabica seedlings to increasing Zn and Cu concentrations in soil[J]. Science of the Total Environment, 2010, 408(22) : 5381–5391. DOI:10.1016/j.scitotenv.2010.07.064 |
| [28] | Li XL, Christie P. Changes in soil solution Zn and pH and uptake of Zn by arbuscular mycorrhizal red clover in Zn-contaminated soil[J]. Chemosphere, 2001, 42(2) : 201–207. DOI:10.1016/S0045-6535(00)00126-0 |
| [29] | Sudová R, Vosátka M. Differences in the effects of three arbuscular mycorrhizal fungal strains on P and Pb accumulation by maize plants[J]. Plant and Soil, 2007, 296(1) : 77–83. |
| [30] | Bedini S, Pellegrino E, Avio L, et al. Changes in soil aggregation and glomalin-related soil protein content as affected by the arbuscular mycorrhizal fungal species Glomus mosseae and Glomus intraradices[J]. Soil Biology and Biochemistry, 2009, 41(7) : 1491–1496. DOI:10.1016/j.soilbio.2009.04.005 |
| [31] | Hildebrandt U, Regvar M, Bothe H. Arbuscular mycorrhiza and heavy metal tolerance[J]. Phytochemistry, 2007, 68(1) : 139–146. DOI:10.1016/j.phytochem.2006.09.023 |
| [32] | Ouziad F, Hildebrandt U, Schmelzer E, et al. Differential gene expressions in arbuscular mycorrhizal-colonized tomato grown under heavy metal stress[J]. Journal of Plant Physiology, 2005, 162(6) : 634–649. DOI:10.1016/j.jplph.2004.09.014 |
| [33] | Guarino C, Conte B, Spada V, et al. Proteomic analysis of eucalyptus leaves unveils putative mechanisms involved in the plant response to a real condition of soil contamination by multiple heavy metals in the presence or absence of mycorrhizal/rhizobacterial additives[J]. Environmental Science & Technology, 2014, 48(19) : 11487–11496. |
| [34] | Berta G, Copetta A, Gamalero E, et al. Maize development and grain quality are differentially affected by mycorrhizal fungi and a growth-promoting pseudomonad in the field[J]. Mycorrhiza, 2014, 24(3) : 161–170. DOI:10.1007/s00572-013-0523-x |
| [35] | Larsen J, Cornejo P, Barea JM. Interactions between the arbuscular mycorrhizal fungus Glomus intraradices and the plant growth promoting rhizobacteria Paenibacillus polymyxa and P. macerans in the mycorrhizosphere of Cucumis sativus[J]. Soil Biology and Biochemistry, 2009, 41(2) : 286–292. DOI:10.1016/j.soilbio.2008.10.029 |
| [36] | Medina A, Probanza A, Mañero FJG, et al. Interactions of arbuscular-mycorrhizal fungi and Bacillus strains and their effects on plant growth, microbial rhizosphere activity (thymidine and leucine incorporation) and fungal biomass (ergosterol and chitin)[J]. Applied Soil Ecology, 2003, 22(1) : 15–28. DOI:10.1016/S0929-1393(02)00112-9 |
| [37] | Vivas A, Vörös I, Biró B, et al. Symbiotic efficiency of autochthonous arbuscular mycorrhizal fungus (G. mosseae) and Brevibacillus sp. isolated from cadmium polluted soil under increasing cadmium levels[J]. Environmental Pollution, 2003, 126(2) : 179–189. DOI:10.1016/S0269-7491(03)00195-7 |
| [38] | Vivas A, Biró B, Németh T, et al. Nickel-tolerant Brevibacillus brevis and arbuscular mycorrhizal fungus can reduce metal acquisition and nickel toxicity effects in plant growing in nickel supplemented soil[J]. Soil Biology and Biochemistry, 2006, 38(9) : 2694–2704. DOI:10.1016/j.soilbio.2006.04.020 |
| [39] | Soni SK, Singh R, Awasthi A, et al. A Cr(Ⅵ)-reducing Microbacterium sp. strain SUCR140 enhances growth and yield of Zea mays in Cr(Ⅵ) amended soil through reduced chromium toxicity and improves colonization of arbuscular mycorrhizal fungi[J]. Environmental Science and Pollution Research, 2014, 21(3) : 1971–1979. DOI:10.1007/s11356-013-2098-7 |
| [40] | Dai M, Wang HX, Yin YY, et al. Effects and mechanisms of interactions between arbuscular mycorrrhizal fungi and plant growth promoting rhizobacteria[J]. Acta Ecologica Sinica, 2008, 28(6) : 2854–2860. (in Chinese) 戴梅, 王洪娴, 殷元元, 等. 丛枝菌根真菌与根围促生细菌相互作用的效应与机制[J]. 生态学报, 2008, 28(6) : 2854–2860. |
| [41] | Gamalero E, Lingua G, Berta G, et al. Beneficial role of plant growth promoting bacteria and arbuscular mycorrhizal fungi on plant responses to heavy metal stress[J]. Canadian Journal of Microbiology, 2009, 55(5) : 501–514. DOI:10.1139/W09-010 |
| [42] | Meyer JR, Linderman RG. Response of subterranean clover to dual inoculation with vesicular-arbuscular mycorrhizal fungi and a plant growth-promoting bacterium, Pseudomonas putida[J]. Soil Biology and Biochemistry, 1986, 18(2) : 185–190. DOI:10.1016/0038-0717(86)90025-8 |
| [43] | Gamalero E, Berta G, Massa N, et al. Synergistic interactions between the ACC deaminase-producing bacterium Pseudomonas putida UW4 and the AM fungus Gigaspora rosea positively affect cucumber plant growth[J]. FEMS Microbiology Ecology, 2008, 64(3) : 459–467. DOI:10.1111/fem.2008.64.issue-3 |
| [44] | Alizadeh H, Behboudi K, Ahmadzadeh M, et al. Induced systemic resistance in cucumber and Arabidopsis thaliana by the combination of Trichoderma harzianum Tr6 and Pseudomonas sp. Ps14[J]. Biological Control, 2013, 65(1) : 14–23. DOI:10.1016/j.biocontrol.2013.01.009 |
| [45] | Azcón R, Medina A, Roldán A, et al. Significance of treated agrowaste residue and autochthonous inoculates (Arbuscular mycorrhizal fungi and Bacillus cereus) on bacterial community structure and phytoextraction to remediate soils contaminated with heavy metals[J]. Chemosphere, 2009, 75(3) : 327–334. DOI:10.1016/j.chemosphere.2008.12.029 |
| [46] | Vivas A, Marulanda A, Gómez M, et al. Physiological characteristics (SDH and ALP activities) of arbuscular mycorrhizal colonization as affected by Bacillus thuringiensis inoculation under two phosphorus levels[J]. Soil Biology and Biochemistry, 2003, 35(7) : 987–996. DOI:10.1016/S0038-0717(03)00161-5 |
| [47] | Vivas A, Barea JM, Azcón R. Interactive effect of Brevibacillus brevis and Glomus mosseae, both isolated from Cd contaminated soil, on plant growth, physiological mycorrhizal fungal characteristics and soil enzymatic activities in Cd polluted soil[J]. Environmental Pollution, 2005, 134(2) : 257–266. DOI:10.1016/j.envpol.2004.07.029 |
| [48] | Moreira H, Pereira SIA, Marques APGC, et al. Mine land valorization through energy maize production enhanced by the application of plant growth-promoting rhizobacteria and arbuscular mycorrhizal fungi[J]. Environmental Science and Pollution Research, 2016, 23(7) : 6940–6950. DOI:10.1007/s11356-015-5914-4 |
| [49] | Azcón R, de Aguilar CAG, Barea JM. Effects of plant hormones present in bacterial cultures on the formation and responses to VA endomycorrhiza[J]. New Phytologist, 1978, 80(2) : 359–364. DOI:10.1111/nph.1978.80.issue-2 |
| [50] | Hanlon MT, Coenen C. Genetic evidence for auxin involvement in arbuscular mycorrhiza initiation[J]. New Phytologist, 2011, 189(3) : 701–709. DOI:10.1111/j.1469-8137.2010.03567.x |
 2017, Vol. 44
2017, Vol. 44