扩展功能
文章信息
- 石晓璐, 张英春, 张兰威, 向鑫玲
- SHI Xiao-Lu, ZHANG Ying-Chun, ZHANG Lan-Wei, XIANG Xin-Ling
- 乳酸杆菌S-层蛋白的特性及功能性研究进展
- Research progress on the features and functions of Lactobacillus S-layer protein
- 微生物学通报, 2017, 44(5): 1206-1213
- Microbiology China, 2017, 44(5): 1206-1213
- DOI: 10.13344/j.microbiol.china.160456
-
文章历史
- 收稿日期: 2016-06-15
- 接受日期: 2016-12-16
- 优先数字出版日期(www.cnki.net): 2016-12-19
S-层蛋白(Surface layer protein,SLP)是古生菌和细菌中的S-层(Surface-layer)最常见的一种结构,由单分子蛋白质亚单位组成的晶状体结构。它在菌体表面可自动装配为规则的晶格单分子层,以非共价键方式结合在细胞外膜上,被认为是进化中最简单的生物膜。目前已证实多种乳酸杆菌含有S-层蛋白,具有保护菌体、影响菌体表面性质、参与菌体黏附肠道过程和抑制病原菌对肠道入侵等作用。国内外对乳酸杆菌S-层蛋白相关结构、组装以及生理生化特性都取得了一定的研究进展,揭示其在生物技术、纳米科技和生物医药方面都展现出了巨大的应用前景,但与研究较早的其他革兰氏阳性细菌的S-层蛋白相比,乳酸杆菌S-层蛋白的研究工作还很少。本文详细介绍了乳酸菌S-层蛋白性质和功能的研究现状。
1 S-层蛋白的性质S-层蛋白覆盖在整个菌体表面,占细胞总蛋白的10%−15%,在细胞分裂的20 min内,预计每秒可产生500个S-层蛋白分子,说明S-层蛋白的基因在细菌中表达的效率很高[1]。乳酸杆菌S-层蛋白的分子量在25−71 kD之间,是分子质量最小的一类S-层蛋白。乳酸杆菌S-层蛋白亚基的氨基酸组成相近,疏水性氨基酸和碱性氨基酸占主体,含硫氨基酸的含量低,带正电荷的氨基酸含量高于带负电荷的氨基酸含量,使得乳酸杆菌S-层蛋白的等电点较高,为9.4−10.4,这是区别于其他细菌S-层蛋白的典型特征。Schuster等[2]用高分辨电镜和原子力显微镜研究乳酸杆菌表面发现,S-层蛋白能组装成斜形、正方形或六边形。每个形态单元的中心间距约5−35 nm。乳酸杆菌的S-层一般5−25 nm厚,而古生菌的S-层厚达70 nm,它们表现出相同大小和形态的孔隙。S-层表面是高度多孔的蛋白晶格,高达30%−70%的表面孔隙率,大多数S-层露出一个相当光滑的外表面和一个以上的波纹内表面。尹琼芳等[3]用扫描电镜观察嗜酸乳杆菌CGMCC 1.1878的S-层蛋白表面形态,显示S-层蛋白的表面虽光滑但多褶皱,外层多突起,呈现出无规则纹路。
乳酸菌中含有S-层蛋白的主要是杆菌,还未发现乳球菌中有关于S-层蛋白的报道,且有的乳杆菌含有多个S-层蛋白基因。乳酸菌不同菌株间的S-层蛋白氨基酸序列不同[4],即使同种菌株的不同菌体之间也存在着差异[5],这样,不同种的乳酸菌或同种的不同菌体就能够黏附到不同的受体上,以便在同一环境中共存[6]。
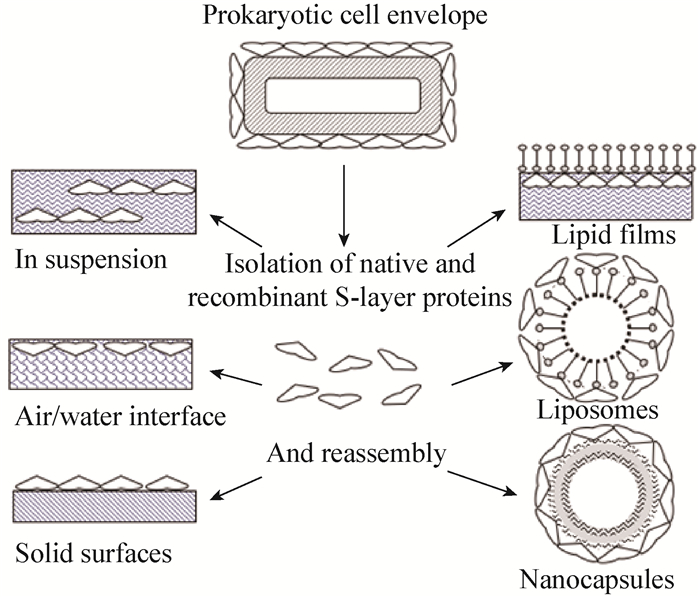
1.1 S-层蛋白的基因研究 1.1.1 基因的可变性: Ventura等[7]之前的研究认为,利用S-层蛋白的多样性和特异性,可以采用PCR技术或基因探针技术来鉴定乳杆菌。然而Waśko等[8]最近对存在S-层的11株瑞士乳杆菌的蛋白质和slph基因检查,氨基酸的多序列比对显示出所有研究的slph基因都有强烈的序列保守性,透射电子显微镜分析菌体均显示出典型的S-层细胞壁结构,蛋白质的氨基酸组成、二级结构和物理特性非常类似于其他乳酸杆菌的S-层蛋白质。而PCR分析表明,检测到的瑞士乳杆菌中有5株没有slph基因。这一发现表明,S-层蛋白基因不能被认为是持家基因,并且不能用作瑞士乳杆菌的分子标记来鉴定瑞士乳杆菌。 1.1.2 具有锚定功能的基因: 球形芽胞杆菌C3-1成熟S-层蛋白的N端(从31位开始)存在3个重复的保守结构域,称为S-层同源模体(S-layer-homologous,SLH),起着将S-层蛋白锚定在细胞表面的作用。具有一个或两个SLH区的蛋白仍具有锚定功能,而第3个SLH区(152−210) 对锚定的稳定性起关键作用,并且锚定功能具有种属差异性[9]。Yanagihara等[10]对CP23和L-92株的slpA基因的DNA序列,包括上游区域进行分析,发现预测的用于细胞锚定的C末端氨基酸序列无显著差异,仅一个额外的丙氨酸-缬氨酸-丙氨酸序列插入在成熟CP23蛋白的N端区域。但通过LiCl分离的CP23和L-92的SlpA,仅对LiCl处理的L-92菌体成功地锚定;此外ELISA测得CP23培养基中有更高水平的SlpA。这些结果表明,CP23细胞表面SlpA分子水平低可能是因为细胞壁对SlpA的锚固能力小,导致SlpA在CP23细胞的培养基中的积累,说明了菌体表面的结构对SlpA分子的锚定也有重要影响。 1.2 S-层蛋白的自组装乳酸杆菌S-层蛋白单体能够在许多基质中进行重新装配,如固体表面、气-液界面、脂质体和悬浮液中[11],如图 1所示。自组装下的分子重排受多种因素影响[12]:分子识别、分子亚单元自身差别以及溶剂性质与结构(尤其是能破坏分子间相互作用力的溶剂类型、浓度和pH等)。相邻的S-层蛋白个体间通过氢键、离子键和疏水作用等的非共价作用相互连接,而且它们也能通过这些非共价作用连接到细菌的细胞壁和宿主的黏附位点上。高浓度的变性剂可以破坏S-层蛋白的氢键,将其从细胞表面提取出来,但由于S-层蛋白具有自组装能力,因此提取完后的S-层蛋白液体透析去除变性剂后,又可以自动聚集为有活性的S-层蛋白。
|
| 图 1 离体条件下Slps在不同基质上自动聚集示意图 Figure 1 Schematic drawing of Slps self-assembly in different mediums in vitro |
|
|
S-层蛋白是微生物细胞最外层普遍存在的一类表面结构,用S-层蛋白进行细胞表面展示有很多优点。首先,S-层蛋白的表达量高,由蛋白质或糖蛋白亚基组成单分子晶体点阵,形成有孔的网格结构覆盖在细胞表面;其次,研究发现乳酸杆菌的S-层蛋白胞内合成后,通过信号肽穿过细胞膜并通过与细胞壁上的磷壁酸或者肽聚糖作用而锚定在细胞表面。乳酸杆菌是人和动物消化道内重要的益生菌,利用乳酸杆菌S-层蛋白的细胞壁结合结构域,作为锚定基序构建表面展示系统有着巨大的潜在应用价值[18]。乳酸杆菌作为食品级疫苗载体是目前基因工程疫苗研究领域的热点之一,国外学者己在乳酸杆菌细胞表面成功展示了一些生物活性蛋白或多肽,即利用S-层蛋白的特性,通过基因工程等方法使外源蛋白表达并展示到细菌的细胞外膜上。
2 S-层蛋白对乳酸杆菌性质的影响及保护作用 2.1 S-层蛋白对乳酸杆菌表面性质的影响乳杆菌的表面性质包括自动聚集性、与病原菌的共聚集性、表面疏水性和表面电荷四个方面,能在一定程度上影响乳杆菌的黏附能力。S-层蛋白高含量的疏水性氨基酸是S-层蛋白自动聚集性的基础。高树明[19]通过实验验证,S-层蛋白能显著地提高乳杆菌的表面疏水性。菌株表面电荷会影响菌株静电作用的强弱,进而影响乳杆菌与宿主间的非特异性黏附过程中的静电作用,从而影响菌株的黏附能力和益生作用的发挥。Zhang等[20]将植物乳杆菌NL42中与编码相关黏附蛋白的基因cwaA在乳酸乳球菌中表达,可显著增加乳球菌菌体的自聚集性和疏水性,并使其获得了通过靶向细胞表面蛋白黏附到人结肠癌上皮细胞HT-29的能力。朱晓[21]证明未经LiCl处理的4株乳杆菌都有很强的三氯甲烷吸附能力,给电子能力较强,而对乙酸乙酯的吸附能力很低,说明接受电子的能力很弱,印证了4株乳杆菌表面呈现路易斯碱性,均为电子供体。经过LiCl处理后菌体S-层蛋白被移除,4株乳杆菌的三氯甲烷吸附率都出现显著性下降,说明S-层蛋白对乳杆菌的表面电荷有着较大的贡献。
2.2 S-层蛋白对乳酸杆菌黏附性的影响黏附是微生物能够定殖于宿主肠道内的前提,成为乳酸菌是否具有良好益生功能的标准之一。研究发现将嗜酸乳酸杆菌M92用氯化锂处理去除其S-层蛋白后,菌株不能与鼠的回肠上皮细胞发生黏附[4]。任大勇[22]的实验表明,无论是体外实验还是体内实验,去除S-层蛋白的唾液乳杆菌和植物乳杆菌黏附能力均下降。第2−6天,去除S-层蛋白的乳酸菌在体内的黏附力明显比活菌低(除在空肠中的情况),与体外实验的结果一致。考虑到S-层蛋白的可再生性,推测第6天之后可能是因为菌体表面重新生成了S-层蛋白,有利于乳酸菌的黏附。除了S-层蛋白之外,细胞外的其他成分也可参与菌株的黏附,如Lactobacillus acidophilus NCFM的S-层蛋白突变株与野生株相比黏附能力下降了84%,这种黏附能力的下降是因为被S-层蛋白包被的表面蛋白的丢失而引起,所以菌株的黏附有可能不是一种蛋白的独立作用,而是各个表面蛋白相互作用的结果[23]。考虑到菌体表面的其他蛋白,较好地直接证明S-层蛋白黏附功能的实验是:通过遗传手段将短乳酸杆菌ATCC 8287的S-层蛋白的slpA片段融合表达到大肠杆菌的鞭毛亚基上,发现融合表达的鞭毛能与人上皮细胞结合[24]。
2.3 S-层蛋白对菌体的保护作用S-层蛋白被报道在有害环境中对乳酸杆菌具有保护作用。S-层蛋白的存在减小了嗜酸乳杆菌M92对胃和胰液的易感性[25]和希氏乳杆菌B706在葡萄酒相关条件下的易感性[26],Meng等[27]发现去除了S-层蛋白的3株乳酸杆菌在模拟胃液和肠液环境中较原菌株的生存时间减少了2−3 d。Dias等[28]发现Lactobacillus hilgardii、Lactobacillus collinoides和Lactobacillus fructivorans对溶菌酶的耐受浓度可高达2 000 mg/L,主要是由于表面层有S-层蛋白的保护。某些微生物的S-层蛋白在菌体去除金属的能力中有着重要影响[29],Gerbino等[30]研究表明乳杆菌CIDCA 8348和JCM 5818去除S-层蛋白后能比原菌体结合更高水平的铅,而孤立的S-层蛋白结合铅的能力低,推断当表面含S-层蛋白时,菌体表面带电基团未暴露,因而铅去除的效率降低,而S-层蛋白对菌体的保护并不是通过螯合金属离子实现的。
3 S-层蛋白在乳酸杆菌调节肠道功能中的作用肠道动态平衡是通过肠上皮细胞、黏膜免疫细胞和肠道微生物之间与众多病原体识别受体(Pattern-recognition receptors,PRRs),包括在胃肠表达的C型凝集素受体(C-type lectinreceptors,CLRs)等相互作用建立起的免疫机制。这些严格的监管机制包括微生物基因产物、代谢物和改变细胞因子环境等的改变或破坏,可能导致破坏性的自身炎性疾病。微生物菌群失调导致不平衡的微环境,释放可溶性介质激活肠浸润致病性T淋巴细胞群,甚至促炎性的T细胞群,并由高度活化的细胞包括树突细胞(Dendritic cells,DCs)产生免疫信号(例如IL-1β),导致肠组织损伤和肠道屏障功能障碍[31-32]。乳酸杆菌S-层蛋白不仅可以抵御致病菌的黏附和入侵[33],还可以通过引起免疫细胞的响应(例如Th1和Th17)[34]引起细胞免疫应答反应,进而调节肠道炎症。S-层蛋白介导了乳酸杆菌对宿主肠道黏膜细胞益生作用的相关信号[35]。
3.1 S-层蛋白对细胞的调节作用正常的细胞凋亡通常对机体防御起积极作用,可以介导对入侵细菌的清除,有利于上皮屏障的修复,而病原菌诱导宿主非正常的细胞凋亡主要表现为引起炎症反应或者推迟凋亡时间[36]。李鹏成[37]发现从嗜酸乳酸杆菌提取并纯化后S-层蛋白可显著拮抗鼠伤寒沙门氏菌引起的细胞凋亡,并且可能主要是通过抑制Caspase-3的活性实现的,而Xue等[38]证实了乳杆菌S-层蛋白可以通过降低Caspase-3的活性,保护沙门氏菌诱导的HT-29细胞凋亡。此外,乳酸菌表面分子可与肠上皮细胞表面受体结合,促进吞噬细胞和淋巴细胞的增殖与成熟。尹琼芳等[39]将嗜酸乳杆菌ATCC 4356的S-层蛋白与巨噬细胞RAW264.7共同孵育,随着S-层蛋白浓度的升高,细胞增殖速度也随之升高,促进了巨噬细胞溶酶体的分泌。这表明S-层蛋白在一定程度上能增进巨噬细胞免疫能力。李海红等[40]利用氯化锂结合盐酸胍提取植物乳杆菌、干酪乳杆菌、鼠李糖乳杆菌、发酵乳杆菌及戊糖片球菌的S-层蛋白,发现不同菌株的S-层蛋白对肠上皮细胞的诱导增殖指数为0.05−0.35、对巨噬细胞为0.05−0.42以及对脾细胞为0.02−0.40,诱导效应具有菌株和剂量依赖性,也说明了乳酸菌表面的蛋白类因子在激活免疫细胞中发挥了重要作用。
3.2 S-层蛋白参与免疫调控的信号通路DCs是专门的抗原递呈细胞,能激活初始型T细胞启动相应的免疫反应和免疫耐受。Konstantinov等[41]研究证实嗜酸乳杆菌的S-层蛋白可以直接与树突细胞DC-SIGN (DC-sepecific ICAM-grabbing non-integrin)受体相连,作为DC-SIGN的受体配体,调节DCs和T细胞的功能。Uroić等[42]也用实验证明了短乳杆菌D6表面的S-层蛋白可以与细胞因子生成中单核细胞衍生的树突细胞响应。Martínez等[43]研究嗜酸乳杆菌S-层蛋白的抗病毒机制发现,S-层蛋白不是依靠糖基化发挥抗病毒作用,而是通过高等电环境产生的静电力吸引DC-SIGN,一定程度上与病毒竞争了病毒受体,从而抑制了病毒对细胞的感染。嗜酸乳杆菌NCFM编码S-层蛋白的基因有:slpA (LBA0169)、slpB (LBA0175) 和slpX (LBA0512)[44],Sahay等[45]利用能单一表达SlpA的嗜酸乳杆菌基因缺陷型菌株NCK2187,发现该菌体及其纯化的SlpA不仅显著减轻了小鼠体内T细胞诱导的结肠炎,也保护了肠道微生物群落和肠道的屏障功能。SIGNR3 (CD209d)是小鼠8个同源的DC-SIGN之一,与人DC-SIGN的生物化学特征最为相似[46]。Lightfoot等[47]通过基因敲除得到SIGNR3缺陷型小鼠,与正常小鼠对比,发现NCK2187菌株及其纯化的SlpA可与C型凝集素SIGNR3连接,进而发挥调控信号,维持健康的胃肠道微生物区系,缓解结肠炎症,而这种保护作用并未在SIGNR3缺陷型小鼠中发现。实验表明SlpA分子可与SIGNR3相互作用,影响极化状态下的固有细胞和T细胞所诱发的结肠炎。
乳酸菌在肠道炎症调控中涉及到一些细胞信号途径,主要的调节途径是NF-κB信号途径和p38MAPK信号途径。Toll样受体是重要的模式识别受体,可以识别病原相关分子模式,进而激活免疫系统。Toll受体与NF-κB构成的TLR-NF-κB信号通路将先天性免疫和获得性免疫连接在一起。李鹏成[37]通过实验推测乳酸杆菌和S-层蛋白可能主要通过TLRS-MyD88-NF-κB途径来发挥生物学功能,Taverniti等[48]从Lactobacillus helveticus MIMLh5中提取到的SlpA可通过减少肠上皮Caco-2细胞的NF-κB活化而发挥抗炎作用,并且作用结果具有线性关系,而与人巨噬细胞U937作用后,被证明通过细胞表面TLR2识别,刺激先天免疫系统引发促炎因子TNF-α和COX-2的表达。
3.3 S-层蛋白对肠道黏膜的保护作用乳酸杆菌可通过保证肠黏膜的完整性来改善肠道屏障功能,S-层蛋白对肠黏膜也有一定的保护作用。张丹等[49]用经氯化锂脱除S-层蛋白的嗜酸乳杆菌和未处理菌体对受致病性大肠杆菌感染的小鼠灌胃,未处理菌体灌胃组的小鼠肠上皮细胞脱落现象大幅度减少,绒毛高度也有所增加,排列较为整齐,感染症状明显减轻;而处理灌胃组小鼠的症状稍有改善,但效果远不如原菌体本身对小鼠肠黏膜的保护作用。Lightfoot等[47]也得到了相似的实验结果:经SlpA治疗的小鼠与未治疗(PBS组)小鼠对比,证实了SlpA蛋白对结肠炎的治疗效果。范郁冰[50]以细胞的总蛋白为抗原,以S-层蛋白为抗体进行的试验结果提示:乳酸菌S-层蛋白与肠细胞作用时,引起了肠细胞内部蛋白质的变化,且更倾向于降低蛋白质的表达量或不表达某些蛋白。在前人的研究中发现,S-层蛋白可与层黏连蛋白、纤黏蛋白及點蛋白相互结合,由双向电泳检测出来的差异蛋白是否为此类蛋白或是否为此类蛋白的调控蛋白还有待进一步的研究确定。
目前的文献[49, 51]报道中,乳酸菌及其代谢产物对肠炎的调节还主要集中在其对炎症因子的调节,通过抑制肠道上皮细胞中的某些信号途径进而对炎性因子的产生进行调控,从而发挥抗肠炎作用。张丹等[49]发现乳酸杆菌可使受感染小鼠的血清中含量明显升高的IFN-γ、TNF-α及白细胞介素IL-1β显著下降,而使各黏膜中的SIgA和IL-10含量明显升高,嗜酸乳杆菌灌胃后可显著降低上述异常升高的指标,但脱除S-层蛋白后,该作用效果相对减弱。而Rong等[51]从蒙古发酵乳酒分离到乳酸菌L. helveticus NS8能够减少脂多糖诱导小鼠巨噬细胞系RAW264.7产生的高水平IL-10,但纯化的S-层蛋白对IL-10的产生无影响,推测这种差异可能与菌株的性质及S-层蛋白的多样性有关。
在体外实验中,乳酸杆菌的S-层蛋白能够诱导不同细胞发生不同细胞因子的响应[52]。乳酸杆菌免疫调节性质的差异与乳酸杆菌菌株的不同、细胞的来源有关。在体内实验中,通过脱除S-层蛋白的菌体与正常菌体对炎症小鼠的治疗作用对比,验证了S-层蛋白对肠道炎症的免疫调节作用,但这种对比实验结果得到的结论不如直接用纯化的S-层蛋白治疗炎症小鼠的结论可靠,之后实验设计的重点应放在是否能直接验证S-层蛋白功能上。
4 展望对于乳酸杆菌S-层蛋白的研究,最开始集中于确定S-层蛋白是否在乳酸杆菌调节肠道炎症中发挥重要作用,大多是采用脱去S-层蛋白的菌株与原菌株,在体外对肠癌细胞如Caco-2、Ht-29或巨噬细胞等作用,测定炎症调控下细胞因子的含量并对比,来证明S-层蛋白免疫调节的作用。近期,研究重点开始倾向于研究S-层蛋白发挥免疫调节作用的机制,不仅从体外细胞入手,还从菌体表面分离纯化出S-层蛋白,甚至进行了小鼠体内实验,都获得了一定的研究成果。由于动物体内复杂的环境和各种生物化学反应,在某些方向上开展更多的动物实验还有一定难度。Sahay等[45]在动物实验中为了减少提取方法对纯化的S-层蛋白作用小鼠的影响,用氯化钠代替更常用的氯化锂提取S-层蛋白,排除了利用LiCl纯化的S-层蛋白口服给实验动物时导致低度炎症和潜在的肠组织的诱导损伤,排除了可能引起的潜在毒性;为避免非SlpA蛋白的污染,采用了单一表达SlpA的嗜酸乳杆菌菌株NCK2187,增加了实验结果的说服力,同时这也为今后设计动物实验提供了新的思路和方法。今后还应该加强对S-层蛋白免疫调节作用机制的研究,并做体内实验验证,以期为肠道炎症的治疗创造新方法。
乳酸杆菌S-层蛋白来源广泛,菌体含量较高,提取纯化方法成熟。虽然不同菌种的S-层蛋白有不同性质和功能,但总体上看,在食品、生物和医学等方面都有很好的应用价值,尤其是近年来加大了有关S-层蛋白调节肠道炎症免疫功能和机制的研究,并取得了一定的研究成果,为今后针对特定疾病如肠炎等开发更为安全的益生菌干预治疗方法提供了可靠的依据。
| [1] | Sleytr UB, Messner P. Crystalline surface layers on bacteria[J]. Annual Reviews in Microbiology, 1983, 37(1) : 311–339. DOI:10.1146/annurev.mi.37.100183.001523 |
| [2] | Schuster B, Sleytr UB. Composite S-layer lipid structures[J]. Journal of Structural Biology, 2009, 168(1) : 207–216. DOI:10.1016/j.jsb.2009.03.004 |
| [3] | Yin QF, Pan DD, Guo YX, et al. Extraction and characterization of S layer protein from Lactobacillus acidophilus CGMCC 1.1878[J]. Journal of Chinese Institute of Food Science and Technology, 2016, 16(5) : 224–229. (in Chinese) 尹琼芳, 潘道东, 郭宇星, 等. 嗜酸乳杆菌S-层蛋白的提取和鉴定[J]. 中国食品学报, 2016, 16(5) : 224–229. |
| [4] | Åvall-Jääskeläinen S, Palva A. Lactobacillus surface layers and their applications[J]. FEMS Microbiology Reviews, 2005, 29(3) : 511–529. |
| [5] | Gatti M, Rossetti L, Fornasari ME, et al. Heterogeneity of putative surface layer proteins in Lactobacillus helveticus[J]. Applied and Environmental Microbiology, 2005, 71(11) : 7582–7588. DOI:10.1128/AEM.71.11.7582-7588.2005 |
| [6] | Hagen KE, Guan LL, Tannock GW, et al. Detection, characterization, and in vitro and in vivo expression of genes encoding S-proteins in Lactobacillus gallinarum strains isolated from chicken crops[J]. Applied and Environmental Microbiology, 2005, 71(11) : 6633–6643. DOI:10.1128/AEM.71.11.6633-6643.2005 |
| [7] | Ventura M, Callegari ML, Morelli L. S-layer gene as a molecular marker for identification of Lactobacillus helveticus[J]. FEMS Microbiology Letters, 2000, 189(2) : 275–279. DOI:10.1111/fml.2000.189.issue-2 |
| [8] | Waśko A, Polak-Berecka M, Kuzdraliński A, et al. Variability of S-layer proteins in Lactobacillus helveticus strains[J]. Anaerobe, 2014, 25 : 53–60. DOI:10.1016/j.anaerobe.2013.11.004 |
| [9] | Li J, Hu XM, Zheng DS, et al. The relationship between structure and function of S-layer protein from Bacillus sphaericus C3-41[A]//The second session of the National Institute of Microbiology and the Eleventh National Symposium on the research and industrialization of agricultural microbiology and Hubei Society for Microbiology and Essays in 2008 of Inner Mongolia Society for Microbiology[C]. Hohhot: Chinese Society for Microbiology, 2008 (in Chinese) 黎佳, 胡晓敏, 郑大胜, 等. 球形芽胞杆菌C3-41菌株S-层蛋白结构与功能相互关系研究[A]//中国微生物学会第二届全国农业微生物研究及产业化研讨会和第十一届全国杀虫微生物学术研讨会暨湖北省暨武汉市微生物学会和内蒙古微生物学会2008年会论文集[C]. 呼和浩特: 中国微生物学会, 2008 |
| [10] | Yanagihara S, Kato S, Ashida N, et al. Lactobacillus acidophilus CP23 with weak immunomodulatory activity lacks anchoring structure for surface layer protein[J]. Journal of Bioscience and Bioengineering, 2015, 119(5) : 521–525. DOI:10.1016/j.jbiosc.2014.10.003 |
| [11] | Sleytr UB, Schuster B, Egelseer EM, et al. S-layers: principles and applications[J]. FEMS Microbiology Reviews, 2014, 38(5) : 823–864. DOI:10.1111/1574-6976.12063 |
| [12] | Xiao R. Screening of the Lactobacillus brevis M8 and cloning and expression analysis of its surface layer gene slpM[D]. Changsha: Doctoral Dissertation of Hunan Agricultural University, 2012 (in Chinese) 肖荣. 短乳杆菌M8菌株的筛选及其slpM基因的克隆与表达研究[D]. 长沙: 湖南农业大学博士学位论文, 2012 |
| [13] | Zhang YY. Optimization of culture medium for Lactobacillus helveticus, isolation and application of surface layer proteins[D]. Qingdao: Master's Thesis of Ocean University of China, 2013 (in Chinese) 张莹莹. 瑞士乳杆菌(Lactobacillus helveticus)发酵条件的优化及S层蛋白的提取和应用[D]. 青岛: 中国海洋大学硕士学位论文, 2013 |
| [14] | Yan YX, Chen HQ, Lu CP. Purification and characterization of S-layer protein from Aeromonas hydrophila[J]. Acta Microbiologica Sinica, 1996, 36(2) : 144–150. (in Chinese) 严亚贤, 陈怀青, 陆承平. 嗜水气单胞菌S蛋白的提纯及特性分析[J]. 微生物学报, 1996, 36(2) : 144–150. |
| [15] | Pum D, Sára M, Schuster B, et al. Bacterial surface layer proteins: a simple but versatile biological self-assembly system in nature[A]//Chen JH, Jonoska N, Rozenberg G. Nanotechnology: Science and Computation[M]. Berlin Heidelberg: Springer, 2006: 277-290 |
| [16] | Asadi N, Chand N, Rassa M. Crystalline bacterial surface layer (S-Layer) opens golden opportunities for nanobiotechnology in textiles[J]. IEEE Transactions on Nanobioscience, 2015, 14(8) : 952–959. DOI:10.1109/TNB.2015.2495143 |
| [17] | Hollmann A, Delfederico L, Glikmann G, et al. Characterization of liposomes coated with S-layer proteins from lactobacilli[J]. Biochimicaet Biophysica Acta (BBA)-Biomembranes, 2007, 1768(3) : 393–400. DOI:10.1016/j.bbamem.2006.09.009 |
| [18] | Hu SM. Construction and potential applications of the novel surface display systems for lactic acid bacteria[D]. Jinan: Doctoral Dissertation of Shandong University, 2011 (in Chinese) 胡淑敏. 新型乳酸菌表面展示系统的构建及其潜在应用研究[D]. 济南: 山东大学博士学位论文, 2011 |
| [19] | Gao SM. Influence of surface layer proteins on theprobiotic functions of lactobacilli[D]. Wuxi: Master's Thesis of Jiangnan University, 2015 (in Chinese) 高树明. 乳杆菌表层蛋白对菌株益生特性的影响[D]. 无锡: 江南大学硕士学位论文, 2015 |
| [20] | Zhang B, Zuo FL, Yu R, et al. Comparative genome-based identification of a cell wall-anchored protein from Lactobacillus plantarum increases adhesion of Lactococcus lactis to human epithelial cells[J]. Scientific Reports, 2015, 5 : 14109. DOI:10.1038/srep14109 |
| [21] | Zhu X. The properties, structure and functions of lactic acid bacteria S-layer proteins[D]. Wuxi: Master's Thesis of Jiangnan University, 2012 (in Chinese) 朱晓. 乳酸菌表层蛋白的性质、结构与功能[D]. 无锡: 江南大学硕士学位论文, 2012 |
| [22] | Ren DY. Research on adhesion and immunoregulation of probiotic Lactobacillus strains[D]. Changchun: Doctoral Dissertation of Jilin University of China, 2013 (in Chinese) 任大勇. 益生乳酸杆菌的黏附及免疫调节作用研究[D]. 长春: 吉林大学博士学位论文, 2013 |
| [23] | Lee YK, Mazmanian SK. Has the microbiota played a critical role in the evolution of the adaptive immune system?[J]. Science, 2010, 330(6012) : 1768–1773. DOI:10.1126/science.1195568 |
| [24] | Hynönen U, Westerlund-Wikström B, Palva A, et al. Identification by flagellum display of an epithelial cell-and fibronectin-binding function in the SlpA surface protein of Lactobacillus brevis[J]. Journal of Bacteriology, 2002, 184(12) : 3360–3367. DOI:10.1128/JB.184.12.3360-3367.2002 |
| [25] | Frece J, Kos B, Svetec IK, et al. Importance of S-layer proteins in probiotic activity of Lactobacillus acidophilus M92[J]. Journal of Applied Microbiology, 2005, 98(2) : 285–292. DOI:10.1111/jam.2005.98.issue-2 |
| [26] | Dohm N, Petri A, Schlander M, et al. Molecular and biochemical properties of the S-layer protein from the wine bacterium Lactobacillus hilgardii B706[J]. Archives of Microbiology, 2011, 193(4) : 251–261. DOI:10.1007/s00203-010-0670-9 |
| [27] | Meng J, Zhu X, Gao SM, et al. Characterization of surface layer proteins and its role in probiotic properties of three Lactobacillus strains[J]. International Journal of Biological Macromolecules, 2014, 65 : 110–114. DOI:10.1016/j.ijbiomac.2014.01.024 |
| [28] | Dias R, Vilas-Boas E, Campos FM, et al. Activity of lysozyme on Lactobacillus hilgardii strains isolated from Port wine[J]. Food Microbiology, 2015, 49 : 6–11. DOI:10.1016/j.fm.2015.01.007 |
| [29] | Schut S, Zauner S, Hampel G, et al. Biosorption of copper by wine-relevant lactobacilli[J]. International Journal of Food Microbiology, 2011, 145(1) : 126–131. DOI:10.1016/j.ijfoodmicro.2010.11.039 |
| [30] | Gerbino E, Carasi P, Araujo-Andrade C, et al. Role of S-layer proteins in the biosorption capacity of lead by Lactobacillus kefir[J]. World Journal of Microbiology & Biotechnology, 2015, 31(4) : 583–592. |
| [31] | Geremia A, Biancheri P, Allan P, et al. Innate and adaptive immunity in inflammatory bowel disease[J]. Autoimmunity Reviews, 2014, 13(1) : 3–10. DOI:10.1016/j.autrev.2013.06.004 |
| [32] | Belkaid Y, Hand TW. Role of the microbiota in immunity and inflammation[J]. Cell, 2014, 157(1) : 121–141. DOI:10.1016/j.cell.2014.03.011 |
| [33] | Lu QH, Zhang YC, Zhang LW. Advances in S-layer protein properties of Lactobacillus and its probiotic functions[J]. Microbiology China, 2014, 41(1) : 122–129. (in Chinese) 卢千慧, 张英春, 张兰威. 乳酸杆菌S-层蛋白性质及其益生功能研究进展[J]. 微生物学通报, 2014, 41(1) : 122–129. |
| [34] | Kajikawa A, Zhang L, Lavoy A, et al. Mucosal immunogenicity of genetically modified Lactobacillus acidophilus expressingan HIV-1 epitope within the surface layer protein[J]. PLoS One, 2015, 10(10) : e0141713. DOI:10.1371/journal.pone.0141713 |
| [35] | Johnson BR, Hymes J, Sanozky-Dawes R, et al. Conserved S-layer-associated proteins revealed by exoproteomic survey of S-layer-forming lactobacilli[J]. Applied and Environmental Microbiology, 2016, 82(1) : 134–145. DOI:10.1128/AEM.01968-15 |
| [36] | Faherty CS, Maurelli AT. Staying alive: bacterial inhibition of apoptosis during infection[J]. Trends in Microbiology, 2008, 16(4) : 173–180. DOI:10.1016/j.tim.2008.02.001 |
| [37] | Li PC. Study on the mechanism of S-layer proteins from lactobacillus acidophilus against enteropathogenic bacterias to adhere or invade host-cell[D]. Nanjing: Doctoral Dissertation of Nanjing Agricultural University, 2011 (in Chinese) 李鹏成. 嗜酸乳酸杆菌S-层蛋白拮抗肠道病原菌粘附或入侵宿主细胞机制的研究[D]. 南京: 南京农业大学博士学位论文, 2011 |
| [38] | Xue CH, Zhang LW, Fan RB, et al. Protective action of S-layer proteins from Lactobacillus paracasei M7 against Salmonella infection and mediated inhibition of Salmonella-induced apoptosis[J]. European Food Research and Technology, 2015, 240(5) : 923–929. DOI:10.1007/s00217-014-2396-4 |
| [39] | Yin QF, Pan DD, Guo YX, et al. Effects of Lactobacillus acidophilus S-layer protein on adhesion tointestinal cells and macrophage proliferation[J]. Modern Food Science and Technology, 2015, 31(9) : 51–55. (in Chinese) 尹琼芳, 潘道东, 郭宇星, 等. 嗜酸乳杆菌S-层蛋白对肠道细胞黏附及巨噬细胞增殖的影响[J]. 现代食品科技, 2015, 31(9) : 51–55. |
| [40] | Li HH, Yang ZQ, Wang XL, et al. Surface proteins of lactic acid bacteria induce the proliferation and inhibit the adherence of immunocytes[J]. Chinese Journal of Microecology, 2016, 28(1) : 15–20. (in Chinese) 李海红, 杨振泉, 王晓霖, 等. 乳酸菌表面蛋白对免疫细胞的诱导增殖及粘附抑制效应[J]. 中国微生态学杂志, 2016, 28(1) : 15–20. |
| [41] | Konstantinov SR, Smidt H, de Vos WM, et al. S layer protein A of Lactobacillus acidophilus NCFM regulates immature dendritic cell and T cell functions[J]. Proceedings of the National Academy of Sciencesof the United States of America, 2008, 105(49) : 19474–19479. DOI:10.1073/pnas.0810305105 |
| [42] | Uroić K, Novak J, Hynönen U, et al. The role of S-layer in adhesive and immunomodulating properties of probiotic starter culture Lactobacillus brevis D6 isolated from artisanal smoked fresh cheese[J]. LWT-Food Science and Technology, 2016, 69 : 623–632. DOI:10.1016/j.lwt.2016.02.013 |
| [43] | Martínez MG, Acosta MP, Candurra NA, et al. S-layer proteins of Lactobacillus acidophilus inhibits JUNV infection[J]. Biochemical and Biophysical Research Communications, 2012, 422(4) : 590–595. DOI:10.1016/j.bbrc.2012.05.031 |
| [44] | Goh YJ, Azcárate-Peril MA, O'Flaherty S, et al. Development and application of a upp-based counterselective gene replacement system for the study of the S-Layer protein SlpX of Lactobacillus acidophilus NCFM[J]. Applied and Environmental Microbiology, 2009, 75(10) : 3093–3105. DOI:10.1128/AEM.02502-08 |
| [45] | Sahay B, Ge Y, Colliou N, et al. Advancing the use of Lactobacillus acidophilus surface layer protein A for the treatment of intestinal disorders in humans[J]. Gut Microbes, 2015, 6(6) : 392–397. DOI:10.1080/19490976.2015.1107697 |
| [46] | Powlesland AS, Ward EM, Sadhu SK, et al. Widely divergent biochemical properties of the complete set of mouse DC-SIGN-related proteins[J]. Journal of Biological Chemistry, 2006, 281(29) : 20440–20449. DOI:10.1074/jbc.M601925200 |
| [47] | Lightfoot YL, Selle K, Yang T, et al. SIGNR3-dependent immune regulation by Lactobacillus acidophilus surface layer protein A in colitis[J]. The EMBO Journal, 2015, 34(7) : 881–895. DOI:10.15252/embj.201490296 |
| [48] | Taverniti V, Stuknyte M, Minuzzo M, et al. S-layer protein mediates the stimulatory effect of Lactobacillus helveticus MIMLh5 on innate immunity[J]. Applied and Environmental Microbiology, 2013, 79(4) : 1221–1231. DOI:10.1128/AEM.03056-12 |
| [49] | Zhang D, Zhang DD, Zhang JY, et al. Effects of the S-layer protein of Lactobacillus acidophilus on intestinalmucosal immune function in mice infected with Escherichia coli[J]. Modern Food Science and Technology, 2015, 31(10) : 13–17. (in Chinese) 张丹, 张丹丹, 章金叶, 等. 嗜酸乳杆菌S-层蛋白对感染大肠杆菌小鼠肠黏膜免疫功能的影响[J]. 现代食品科技, 2015, 31(10) : 13–17. |
| [50] | Fan YB. Study of L. brevis M8 S-layer protein's adhesion and its influence on different expression of protein from Caco-2[D]. Changsha: Master's Thesis of Hunan Agricultural University, 2012 (in Chinese) 范郁冰. L. brevis M8 S-层蛋白的黏附性及其引起Caco-2细胞蛋白质差异表达研究[D]. 长沙: 湖南农业大学硕士学位论文, 2012 |
| [51] | Rong JJ, Zheng HF, Liu M, et al. Probiotic and anti-inflammatory attributes of an isolate Lactobacillus helveticus NS8 from Mongolian fermented koumiss[J]. BMC Microbiology, 2015, 15 : 196. DOI:10.1186/s12866-015-0525-2 |
| [52] | Zhang YC, Xiang XL, Zhang LW, et al. A review on the structure and immune regulation function of Lactobacillus S-layer protein[J]. Food Science, 2016, 37(3) : 229–234. (in Chinese) 张英春, 向鑫玲, 张兰威, 等. 乳酸杆菌S-层蛋白的结构及免疫调控功能研究进展[J]. 食品科学, 2016, 37(3) : 229–234. DOI:10.7506/spkx1002-6630-201603040 |
 2017, Vol. 44
2017, Vol. 44