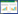扩展功能
文章信息
- 周旭东, 李彩云, 高鹏程, 蒋心诚, 赵振宇, 韩稳社
- ZHOU Xu-Dong, LI Cai-Yun, GAO Peng-Cheng, JIANG Xin-Cheng, ZHAO Zhen-Yu, HAN Wen-She
- 活体微藻吸附水体中Cd2+的性能特征
- Adsorption of Cd2+ in water by living microalgae
- 微生物学通报, 2017, 44(5): 1182-1188
- Microbiology China, 2017, 44(5): 1182-1188
- DOI: 10.13344/j.microbiol.china.160556
-
文章历史
- 收稿日期: 2016-07-31
- 接受日期: 2016-10-09
- 优先数字出版日期(www.cnki.net): 2016-10-09
藻类广泛分布于江河湖海,属第一性生产力,是水体中其他生物赖以生存的基础[1]。许多藻类富含蛋白质、糖类、脂肪、多种维生素和矿物质等,有些藻类甚至含有其他生物罕有的人体必需成分如藻胆蛋白(素)等物质,因此,广泛应用于食品、化妆品、医药以及能源生产[1-2]。然而,随着全球水体环境恶化,给藻制品生产和使用带来了安全隐患,特别是水体中重金属被藻类吸收和吸附,经过生物链逐级浓缩和放大,从而导致鱼类等水产品重金属含量超标,成为通过食品进入人体的主要渠道[3-5]。
藻类对重金属离子的吸附富集作用早在20世纪60年代就引起了科学家的关注[6],由于藻类与重金属离子极强的亲和性,大多数研究聚焦于藻类对重金属离子的吸附特性[7-12],而自然环境中藻类种类繁多、产量高、普遍性存在的特征也为研究者提供了极为丰富的研究材料,围绕着藻类对重金属离子的吸附性能[13-16]、吸附机理[16-22]及影响因素[18-22]等开展了大量研究,然而,这些研究的出发点多是将藻作为廉价吸附材料用以去除污水中的重金属离子,研究方法也多将藻制成藻粉投入待处理水样中。
鉴于活体藻细胞与藻粉间表面特性差异显著[8, 19-20],对重金属离子吸附性能和吸附机理方面也必然有所不同。研究选取4种地表水常见的微藻作为试验材料,通过室内模拟实验,建立等温吸附模型,探讨活体微藻对水体中Cd2+的吸附性能和吸附机理,旨在为Cd2+等重金属离子进入水体后的去向及去除提供理论依据和技术参考。
1 材料与方法 1.1 实验材料实验用微藻选取钝顶螺旋藻(Spirulina platensis)、铜绿微囊藻(Microcystis aeruginosa)、四尾栅藻(Scenedesmus quadricauda)和小球衣藻(Chlamydomonas microsphaera)均购自中国科学院武汉水生生物研究所,微藻形态,如图 1所示。在无菌操作条件下对4种微藻在相应培养基上接种后,置于温度25 ℃、光照强度1 600 lx、光暗周期12 h:12 h的光照培养箱中进行培养,至对数生长期取定量藻体备用。

|
| 图 1 四种微藻显微镜照片 Figure 1 Microphotographs of microalgae 注:A:钝顶螺旋藻;B:铜绿微囊藻;C:四尾栅藻;D:小球衣藻. Note: A: Spirulina platensis; B: Microcystis aeruginosa; C: Scenedesmus quadricauda; D: Chlamydomonas microsphaera. |
|
|
实验用含Cd2+溶液采用分析纯Cd(NO3)2·4H2O配制成1 000 mg/L Cd2+储备液,置于4 ℃保存,使用前根据所需浓度进行稀释。
电子天平PTF-A500,福州华志科学仪器有限公司;全自动立式电热压力蒸汽灭菌锅YXQ-LS-SⅡ,上海博迅实业有限公司医疗设备厂;离心机TGL16M,湖南湘立科学仪器有限公司;双目显微镜XSP-2CA,上海光学仪器一厂;pH计FE28,梅特勒-托利多仪器有限公司;恒温振荡器THZ-92A,上海跃进医疗器械有限公司;光照培养箱SPX-250B-G,上海博迅实业有限公司医疗设备厂;火焰原子吸收光谱仪Z-2000,日立。
1.2 实验方法 1.2.1 微藻细胞干重与藻液光密度关系: 取对数生长期4种藻液为母液,对其进行不同倍数稀释,分别在最佳吸收波长处测定相应浓度藻液的光密度值(OD)。取40 mL藻原液,25 ℃、4 000 r/min离心5 min后弃上清液,并用去离子水清洗2次,将已称重的离心管和管内的藻泥置于烘箱中,60 ℃烘5 h,冷却至室温后称重。根据管内藻泥干重与藻液体积,计算藻细胞干重浓度,将测定的OD与对应的藻细胞干重浓度(DW)进行一元线性回归,建立4种微藻OD与干细胞浓度DW关系。 1.2.2 微藻吸附Cd2+等温吸附研究: 取10 mL用去离子水清洗后的藻液,分别加入到装有10 mL不同浓度Cd2+溶液的玻璃试管中,使得微藻浓度为0.10±0.01 g/L,Cd2+浓度分别为0、0.5、1.0、2.0、5.0、10.0、20.0、50.0、80.0、100.0 mg/L,用1.0 mol/L HNO3和NaOH溶液调节至pH 7.0,置于温度为25 ℃、光照强度为1 600 lx的光照培养箱中,每2 h振荡(140 r/min) 10 min,24 h后用0.45 µm滤膜过滤,最后用火焰原子吸收光谱仪测定滤液中的Cd2+平衡浓度,每个处理3次重复,研究4种微藻对水体中Cd2+的等温吸附性能。 1.2.3 微藻对Cd2+吸附量: 微藻对Cd2+的单位吸附量计算采用以下公式:

|
式中,Qe为吸附达到平衡时(24 h)微藻对Cd2+的单位吸附量(mg/g),C0为Cd2+初始浓度(mg/L),Ce为吸附平衡时溶液中Cd2+浓度(mg/L),V为溶液体积(L),W为微藻干重(g)。
1.2.4 微藻对Cd2+等温吸附模型: 建立等温吸附模型是分析吸附剂吸附特征的基本方法。目前关于微藻富集重金属离子的等温吸附平衡模型有多种[13, 23],本文选择最为常用的Langmuir、Freundlich和Dubinin-Radushkevich (D-R) 3种模型。(1) Langmuir模型:

|
式中,Ce为吸附平衡时藻液中Cd2+的浓度(mg/L),Qe为吸附平衡时微藻对Cd2+的吸附量(mg/g),Qm为微藻对Cd2+的最大吸附量(mg/g),KL为吸附常数(L/mg)。Langmuir模型可变型为:
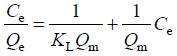
|
通过对Ce/Qe与Ce进行线性回归,求得KL和Qm。
(2) Freundlich模型:
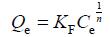
|
式中,Qe和Ce同Langmuir模型,n与KF为吸附常数。将方程取对数变型为:
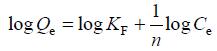
|
通过对logQe与logCe进行回归,求得KF和n。
(3) D-R模型:


式中,Qe和Ce同Langmuir模型,β为吸附常数(mol2/kJ2),ε为Polanyi电位,R热力学常数8.3145 J/(K·mol),T为溶液热力学温度(K)。将方程取对数变型为:
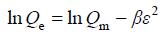
|
通过对lnQe与ε2进行线性回归,求得β和Qm。吸附自由能E通过吸附常数β来求取:
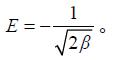
|
运用Origin 7.5软件进行统计分析、线性作图和建立等温吸附模型,计算各模型参数。
2 结果与分析 2.1 微藻干重与藻液光密度关系在微藻培养以及吸附研究中,利用称重法测定生物质是对微藻直接定量的常用措施。鉴于称重法操作繁琐、耗时耗力,目前在微藻研究中普遍利用分光光度法测定藻液光密度(OD)来间接反映微藻干重(DW)[24-25]。
钝顶螺旋藻(SP)、铜绿微囊藻(MA)、四尾栅藻(SQ)和小球衣藻(CM)最大吸收波长分别为560.0、330.0、441.5和650.0 nm,4种微藻在相应最大吸收波长DW与藻液OD间关系如图 2所示。由图 2可知,4种微藻DW与OD均呈显著正相关(P < 0.05),说明可以通过测定藻液OD来确定藻液中藻浓度,为后续吸附研究中微藻溶液浓度的快速配制提供了技术依据。

|
| 图 2 微藻干重DW与藻液光密度OD关系 Figure 2 Relationship between dry weight concentration and optical density of microalgae suspension Note: A: SP; B: MA; C: CM; D: SQ. |
|
|
等温吸附模型是研究固体吸附剂对溶液中吸附质吸附性能与特征的常用方法,在藻类对重金属离子的吸附研究中被广泛采用[9, 13-16]。通过建立不同类型的等温吸附模型,求解相应的模型参数,可以了解吸附质的表面特性、与吸附剂的亲和性、最大吸附量以及吸附机理。
分别利用Langmuir、Freundlich和D-R模型对4种微藻吸附Cd2+进行拟合,结果见表 1。由表 1可知,所有吸附模型拟合均达显著相关水平(P < 0.05),除用Langmuir模型拟合小球衣藻吸附Cd2+,其他所有吸附模型均达极显著相关水平(P < 0.01),说明3种等温模型均可以描述4种微藻吸附Cd2+。其中Langmuir是描述钝顶螺旋藻吸附Cd2+最佳吸附模型,铜绿微囊藻和小球衣藻吸附Cd2+最符合Freundlich模型,而小球衣藻吸附Cd2+最符合D-R模型。
| 吸附模型 | 吸附参数 | 钝顶螺旋藻 | 铜绿微嚢藻 | 四尾栅藻 | 小球衣藻 |
| Models | Parameters | Spirulina platensis | Microcystes aeruginosa | Scenedesmus quadricauda | Chlamydomonas microsphaera |
| Langmuir | KL(L/mg) | 0.273 | 0.027 | 0.039 | 0.015 |
| Qm(mg/g) | 4.360 | 8.990 | 18.520 | 5.170 | |
| R2 | 0.997 4** | 0.895 1** | 0.965 2** | 0.589 7* | |
| Freundlich | KF(L/mg) | 1.020 | 0.385 | 0.947 | 0.184 |
| N | 2.649 | 1.601 | 1.587 | 1.751 | |
| R2 | 0.840 3** | 0.986 2** | 0.986 9** | 0.942 1** | |
| D-R | B(mol2/kJ2) | 0.003 26 | 0.005 22 | 0.005 37 | 0.004 71 |
| Qm(mg/g) | 14.950 | 19.230 | 79.360 | 9.320 | |
| |E|(kJ/mol) | 12.390 | 9.790 | 9.650 | 10.310 | |
| R2 | 0.870 4** | 0.974 9** | 0.990 6** | 0.918 0** | |
| Note: *: P < 0.05; **: P < 0.01. | |||||
Langmuir模型中参数Qm代表吸附剂对吸附质单层吸附单位最大吸附量,KL是吸附常数,用以表达吸附剂与吸附质之间的亲和度,因此,Qm和KL是评价吸附材料吸附效能的重要参数,通过建立Langmuir模型计算Qm和KL是比较研究不同吸附材料吸附性能的常用方法。
由表 1可知,研究中4种微藻对Cd2+的Qm介于4.36−18.52 mg/g,说明4种微藻均对Cd2+有较强的吸附能力,它们对Cd2+吸附Qm排序为四尾栅藻 > 铜绿微囊藻 > 小球衣藻 > 钝顶螺旋藻;4种微藻KL大小为钝顶螺旋藻 > 四尾栅藻>铜绿微囊藻 > 小球衣藻。说明研究中四尾栅藻对Cd2+的吸附量最大,而钝顶螺旋藻对Cd2+的吸附量最小,但它与Cd2+亲和力最强。
由此可知,Cd2+进入水体后会被水体中大量存在的微藻所吸附,改变了水体中Cd2+的存在形式,从而缓减了Cd2+等重金属离子对环境的直接影响;另一方面,四尾栅藻和铜绿微囊藻对Cd2+较高的吸附容量也使其具备了用于制作吸附水体重金属离子材料的基本条件。
3 讨论利用Langmuir、Freundlich和D-R模型研究藻类对重金属离子的吸附性能与特征是目前国内外相关研究常用方法。不同的微藻在吸附Cd2+过程中表现出不一样的特征,本研究利用Langmuir模型描述小球衣藻吸附Cd2+的R2远小于其他3种微藻,主要是由于Langmuir模型更适合用以描述表面均匀的吸附剂,相对于钝顶螺旋藻、铜绿微囊藻和四尾栅藻,小球衣藻藻细胞多以不同方式聚合[1],使其在水体中形成表面不均、形态各异的聚体,影响了微藻表面的均一性。
本文发现Langmuir是描述钝顶螺旋藻吸附Cd2+最佳吸附模型,与Solisio等[9]、Edris等[14]与Al-Homaidan等[21]研究结果一致。比较Langmuir吸附参数KL值发现,钝顶螺旋藻是其他3种藻的7−18倍,说明钝顶螺旋藻对Cd2+的亲和性明显高于其他3种藻,这与钝顶螺旋藻细胞壁富含蛋白质,而蛋白质与Cd2+间高亲和性有关。然而,钝顶螺旋藻Qm却最低,低于四尾栅藻的1/4,与其个体体型较大[1],藻细胞间存在相互缠绕,导致比表面积小、吸附点位数少有关,最终使得吸附容量降低;与之相反,四尾栅藻均以4−8个细胞的群体在水体中均匀分布,个体较小,而且具有鞭毛[1],增加了吸附表面积,因此具有较高的Qm;而铜绿微囊藻虽以个体形式存在,且有较好的分散性,比表面积大,然而其细胞外被有颗粒状泡沫形的假空泡[1],一方面减少了表面吸附点位,另一方面也减弱了对Cd2+的吸附强度,其Qm介于铜绿微囊藻和四尾栅藻间,KL值也较低。
4种微藻Freundlich模型参数n均大于1,意味着该4种微藻对于Cd2+的吸附属于主动吸附[14],其中钝顶螺旋藻的KF值最大,与Langmuir模型呈现出一致的规律,同样反映出钝顶螺旋藻对Cd2+的亲和力最强[13-14, 21]。根据表 1中的D-R模型参数,4种微藻|E|均介于8−16 kJ/mol,表明微藻对Cd2+的吸附类型属于离子交换型化学吸附[13],这是由于微藻细胞壁表面由多糖、蛋白质和脂肪等物质组成,含有许多功能团如−COOH、−OH、−PO3、−NH2、−SH等[17],在自然水体中,这些基团与Ca2+、Mg2+、Na+和K+等轻金属离子或H+结合,一旦Cd2+等重金属离子进入水体,由于重金属离子比轻金属离子与上述功能团有更强的亲和性,替代基团上的Ca2+、Mg2+、Na+、K+或H+而被微藻吸附[18]。活性炭是一种最为常用的广谱性吸附剂。本研究中铜绿微囊藻对Cd2+吸附的Qm与活性炭[26-27]相当,而四尾栅藻高于活性炭,表明微藻对水体Cd2+较强的吸附能力。4种微藻KL均远高于活性炭,说明微藻对Cd2+的亲和性大于活性炭,与二者对Cd2+不同的吸附机理有关,活性炭KL吸附Cd2+主要基于巨大的表面积,属于物理吸附,而微藻吸附Cd2+属于化学吸附,与Cd2+结合更为牢固。
表 2为同类研究所得微藻对Cd2+吸附的Langmuir模型参数。由表 2可知,同为活体钝顶螺旋藻吸附Cd2+研究,Al-Homaidan等[21]研究所得Qm为本研究的2倍多,这主要是由于二者不同的吸附条件,Al-Homaidan等溶液pH为8.0,而本研究为7.0,随着pH升高,一方面溶液中H+浓度降低,与Cd2+竞争吸附的离子浓度下降,有利于Cd2+被微藻吸附,另一方面碱性条件使得溶液中的Cd2+易形成Cd(OH)2沉淀从溶液中分离出来。Katırcıoğlu等[20]利用活体颤藻所得Qm远大于本研究对Cd2+吸附量最高的四尾栅藻,不是由于2种微藻间吸附能力的差异,主要是由于Katırcıoğlu等将颤藻活体附着在经海藻酸钙修饰的玻璃粉(Ca-alginate beads)上,活体微藻经改性后,Cd2+吸附量增加所致[20]。然而,上述所有研究对Cd2+吸附Qm远低于Solisio等[9]、Edris等[14]、ÇeleKLi等[15]、Sheng等[16]以及Aksu等[23]利用钝顶螺旋藻藻粉、扇藻藻粉和小球藻藻粉吸附Qm,主要是由于微藻粉比活体微藻有更好的分散性、更大的表面积、更多的吸附点位以及更为广泛的适用条件[6, 12],因此Qm更高。
| 吸附材料 Materials |
吸附参数Parameters | 参考文献 Reference |
|
| KL(L/g) | Qm(mg/g) | ||
| 活性炭Activated carbon | 0.004 2 | 10.10 | Erto等[26] |
| 钝顶螺旋藻(藻粉) Spirulina platensis (powder) | 0.310 0 | 149.00 | Solisio等[9] |
| 钝顶螺旋藻(藻粉) Spirulina platensis (powder) | 0.485 0 | 73.60 | Çelekli等[15] |
| 扇藻(藻粉) Padina sp. (powder) | 0.050 0 | 84.30 | Sheng等[16] |
| 小球藻(藻粉) Chlorella vulgaris (powder) | 0.013 0 | 149.90 | Edris等[14] |
| 小球藻(藻粉) Chlorella vulgaris (powder) | 0.025 0 | 111.10 | Aksu等[23] |
| 钝顶螺旋藻(活体) Spirulina platensis (living) | 0.093 0 | 10.60 | Al-Homaidan等[21] |
| 颤藻(活体) Oscillatoria sp. (living) | 0.050 0 | 32.20 | Katircioğlu等[20] |
| 钝顶螺旋藻(活体) Spirulina platensis (living) | 0.273 0 | 4.36 | 本文 |
| 铜绿微囊藻(活体) Microcystis aeruginosa (living) | 0.027 0 | 8.99 | 本文 |
| 四尾栅藻(活体) Scenedesmus quadricauda (living) | 0.039 0 | 18.52 | 本文 |
| 小球衣藻(活体) Chlamydomonas microsphaera (living) | 0.015 0 | 5.17 | 本文 |
鉴于本实验中微藻与Cd2+接触时间为24 h,在此条件下研究微藻对Cd2+的富集作用,仅考虑吸附作用是可行的,而自然水体中,往往是微藻在整个生命周期与重金属离子相互作用,因此,无法回避微藻对重金属离子的吸收和转化作用,二者关系复杂。目前对于微藻吸附Cd2+研究仅聚焦在钝顶螺旋藻、颤藻、小球藻等少数藻种,本文选用的铜绿微囊藻和栅藻等材料尚未见报道,是一种新的尝试。事实上自然水体中,微藻种类数以千计,对于新微藻种对重金属离子吸附潜力以及吸附性能与特征等有待进一步深入探讨。
| [1] | Hu HJ, Wei YX. The Freshwater Algae of China: Systematics, Taxonomy and Ecology[M]. Beijing: Science Press, 2006: 19, 61-142, 602-650 (in Chinese) 胡鸿钧, 魏印心.中国淡水藻类:系统, 分类及生态[M].北京:科学出版社, 2006: 19, 61-142, 602-650 |
| [2] | Anastopoulos I, Kyzas GZ. Progress in batch biosorption of heavy metals onto algae[J]. Journal of Molecular Liquids, 2015, 209 : 77–86. DOI:10.1016/j.molliq.2015.05.023 |
| [3] | Mount DR, Barth AK, Garrison TD, et al. Dietary and waterborne exposure of rainbow trout (Oncorhynchus mykiss) to copper, cadmium, lead and zinc using a live diet[J]. Environmental Toxicology and Chemistry, 1994, 13(12) : 2031–2041. DOI:10.1002/etc.v13:12 |
| [4] | Wang WX, Onsanit S, Dang F. Dietary bioavailability of cadmium, inorganic mercury, and zinc to a marine fish: effects of food composition and type[J]. Aquaculture, 2012, 356-357 : 98–104. DOI:10.1016/j.aquaculture.2012.05.031 |
| [5] | Qiu YW. Bioaccumulation of heavy metals both in wild and mariculture food chains in Daya Bay, South China[J]. Estuarine, Coastal and Shelf Science, 2015, 163 : 7–14. DOI:10.1016/j.ecss.2015.05.036 |
| [6] | Pan JF, Lin RG, Ma L. A review of heavy metal adsorption by marine algae[J]. Chinese Journal of Oceanology and Limnology, 2000, 18(3) : 260–264. DOI:10.1007/BF02842673 |
| [7] | Febrianto J, Kosasih AN, Sunarso J, et al. Equilibrium and kinetic studies in adsorption of heavy metals using biosorbent: a summary of recent studies[J]. Journal of Hazardous Materials, 2009, 162(2/3) : 616–645. |
| [8] | Terry PA, Stone W. Biosorption of cadmium and copper contaminated water by Scenedesmus abundans[J]. Chemosphere, 2002, 47(3) : 249–255. DOI:10.1016/S0045-6535(01)00303-4 |
| [9] | Solisio C, Lodi A, Soletto D, et al. Cadmium biosorption on Spirulina platensis biomass[J]. Bioresource echnology, 2008, 99(13) : 5933–5937. DOI:10.1016/j.biortech.2007.11.002 |
| [10] | Ferreira LS, Rodrigues MS, de Carvalho JCM, et al. Adsorption of Ni2+, Zn2+ and Pb2+ onto dry biomass of Arthrospira (Spirulina) platensis and Chlorella vulgaris. I. Single metal systems[J]. Chemical Engineering Journal, 2011, 173(2) : 326–333. DOI:10.1016/j.cej.2011.07.039 |
| [11] | Wu S, Sun FH, Yan YB, et al. Biosorption of Sb(Ⅴ) by Cyanobacteria from Taihu lake[J]. Research of Environmental Sciences, 2012, 25(7) : 764–769. (in Chinese) 吴珊, 孙福红, 鄢元波, 等. 太湖蓝藻对Sb(Ⅴ)的生物吸附作用[J]. 环境科学研究, 2012, 25(7) : 764–769. |
| [12] | Kőnig-Péter A, Csudai C, Felinger A, et al. Potential of various biosorbents for Zn(Ⅱ) removal[J]. Water, Air & Soil Pollution, 2014, 225(9) : 2089. |
| [13] | Cid H, Ortiz C, Pizarro J, et al. Characterization of copper(Ⅱ) biosorption by brown algae Durvillaea antarctica dead biomass[J]. Adsorption, 2015, 21(8) : 645–658. DOI:10.1007/s10450-015-9715-3 |
| [14] | Edris G, Alhamed Y, Alzahrani A. Biosorption of cadmium and lead from aqueous solutions by Chlorella vulgaris biomass: equilibrium and kinetic study[J]. Arabian Journal for Science and Engineering, 2014, 39(1) : 87–93. DOI:10.1007/s13369-013-0820-x |
| [15] | Çelekli A, Bozkurt H. Bio-sorption of cadmium and nickel ions using Spirulina platensis: kinetic and equilibrium studies[J]. Desalination, 2011, 275(1/3) : 141–147. |
| [16] | Sheng PX, Ting YP, Chen JP, et al. Sorption of lead, copper, cadmium, zinc, and nickel by marine algal biomass: characterization of biosorptive capacity and investigation of mechanisms[J]. Journal of Colloid and Interface Science, 2004, 275(1) : 131–141. DOI:10.1016/j.jcis.2004.01.036 |
| [17] | Ivánová D, Kaduková J, Kavuličová J, et al. Determination of the functional groups in algae Parachlorella kessleri by potentiometric titrations[J]. Nova Biotechnologica et Chimica, 2012, 11(2) : 93–99. |
| [18] | Kratochvil D, Volesky B. Advances in the biosorption of heavy metals[J]. Trends in Biotechnology, 1998, 16(7) : 291–300. DOI:10.1016/S0167-7799(98)01218-9 |
| [19] | Doshi H, Ray A, Kothari IL. Bioremediation potential of live and dead Spirulina: spectroscopic, kinetics and SEM studies[J]. Biotechnology and Bioengineering, 2007, 96(6) : 1051–1063. DOI:10.1002/(ISSN)1097-0290 |
| [20] | Katırcıoğlu H, Aslım B, Türker AR, et al. Removal of cadmium(Ⅱ) ion from aqueous system by dry biomass, immobilized live and heat-inactivated Oscillatoria sp. H1 isolated from freshwater (Mogan Lake)[J]. Bioresource Technology, 2008, 99(10) : 4185–4191. DOI:10.1016/j.biortech.2007.08.068 |
| [21] | Al-Homaidan AA, Alabdullatif JA, Al-Hazzani AA, et al. Adsorptive removal of cadmium ions by Spirulina platensis dry biomass[J]. Saudi Journal of Biological Sciences, 2015, 22(6) : 795–800. DOI:10.1016/j.sjbs.2015.06.010 |
| [22] | Qari HA, Hassan IA. Removal of pollutants from waste water using Dunaliella algae[J]. Biomedical & Pharmacology Journal, 2014, 7(1) : 147–151. |
| [23] | Aksu Z. Equilibrium and kinetic modelling of cadmium(Ⅱ) biosorption by C. vulgaris in a batch system: effect of temperature[J]. Separation and Purification Technology, 2001, 21(3) : 285–294. DOI:10.1016/S1383-5866(00)00212-4 |
| [24] | Myers JA, Curtis BS, Curtis WR. Improving accuracy of cell and chromophore concentration measurements using optical density[J]. BMC Biophysics, 2013, 6(1) : 4. DOI:10.1186/2046-1682-6-4 |
| [25] | Lin HL, Lin CC, Lin YJ, et al. Revisiting with a relative-density calibration approach the determination of growth rates of microorganisms by use of optical density data from liquid cultures[J]. Applied and Environmental Microbiology, 2010, 76(5) : 1683–1685. DOI:10.1128/AEM.00824-09 |
| [26] | Erto A, Di Natale F, Musmarra D, et al. Modeling of single and competitive adsorption of cadmium and zinc onto activated carbon[J]. Adsorption, 2015, 21(8) : 611–621. DOI:10.1007/s10450-015-9712-6 |
| [27] | Venkatesan G, Senthilnathan U, Rajam S. Cadmium removal from aqueous solutions using hybrid eucalyptus wood based activated carbon: adsorption batch studies[J]. Clean Technologies and Environmental Policy, 2014, 16(1) : 195–200. DOI:10.1007/s10098-013-0628-0 |
 2017, Vol. 44
2017, Vol. 44