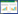扩展功能
文章信息
- 吴小卡, 徐达, 荆雅玮, 吕小龙, 胡剑刚, 米荣升, 黄燕, 王成明, 陈兆国, 韩先干
- WU Xiao-Ka, XU Da, JING Ya-Wei, LV Xiao-Long, HU Jian-Gang, MI Rong-Sheng, HUANG Yan, WANG Cheng-Ming, CHEN Zhao-Guo, HAN Xian-Gan
- 鸭疫里默氏杆菌Mtan对底物SAH的催化活性
- Catalytic activity of Mtan catalyzing S-adenosylhomocysteine in Riemerella anatipestifer
- 微生物学通报, 2017, 44(5): 1165-1170
- Microbiology China, 2017, 44(5): 1165-1170
- DOI: 10.13344/j.microbiol.china.160537
-
文章历史
- 收稿日期: 2016-07-25
- 接受日期: 2016-11-09
- 优先数字出版日期(www.cnki.net): 2016-12-19
2. 扬州大学兽医学院 江苏 扬州 225009
2. College of Veterinary Medicine, Yangzhou University, Yangzhou, jiangsu 225009, China
鸭疫里默氏杆菌病是由鸭疫里默氏杆菌(Riemerella anatipestifer, RA)引起的鸭的主要细菌性传染病,研究RA的致病机制对开展该病的防控具有重要意义。RA对宿主的致病性受其毒力因子、生物被膜和密度感应系统的调控。广泛存在于革兰氏阴性和阳性菌中的LuxS/AI-2型密度感应系统能产生通用信号分子AI-2,AI-2由LuxS和Pfs催化底物S-adenosylhomocysteine (SAH)产生,SAH在Pfs作用下,产生S-核糖同型半胱氨酸(S-ribosyl-homocysteine,SRH),SRH在LuxS作用下产生等量的同型半胱氨酸(Homocysteine,HCY)和AI-2,AI-2参与调控细菌众多的生理功能[1]。
在大肠杆菌中pfs基因的编码产物Pfs不但参与AI-2的合成,同时也是细菌甲硫氨酸循环中的重要组分,其对于有毒代谢产物SAH的清除也是必需的[2]。研究表明,pfs在细菌的感染过程中发挥重要作用,参与调控包括细菌的毒力、生物被膜形成等功能[3]。
本实验室的前期研究表明,在RA中不存在luxS基因,不产生AI-2,但存在编码Mtan蛋白的pfs[3]。由于RA血清型众多,不同血清型的pfs是否存在差异,pfs的编码产物Mtan蛋白是否在体外具有催化SAH的能力,目前尚未见相关研究。
在宿主的消化道、泌尿生殖道、呼吸道和皮肤等病原菌入侵部位存在微生物菌群(microbiota),并且微生物菌群中的细菌可以产生AI-2,由于AI-2不具有种属特异性,是一种通用的信号分子,因此不产生该类信号分子的细菌,可以利用环境中其他细菌产生的AI-2来调节其生物学特性,如苜蓿中华根瘤菌(Sinorhizobium meliloti)自身不产生AI-2,但可以利用其他细菌产生的AI-2来调控自身的行为[4]。RA在感染过程中,是否存在类似的作用,目前仍未见相关报道。
本研究通过对RA不同血清型pfs的序列分析,进一步研究其重组表达产物RA-Mtan的催化活性,为研究pfs对RA的调控作用提供参考。
1 材料与方法 1.1 主要的菌体、相关试剂和仪器不同血清型的9株RA分离自樱桃谷鸭,由本实验室分离、保存;哈维弧菌BB170、哈维弧菌BB152由本实验室保存;RA的pfs重组表达质粒pCold-RA-pfs、禽致病性大肠杆菌(APEC)的pfs和luxS原重组表达质粒pET28a-APEC-pfs和pET28a-APEC-luxS均由本实验室前期构建、保存[5]。
DNA Marker DL5000、DL2000,2×PrimeSTAR Max DNA Polymerase高保真酶购自宝生物工程(大连)有限公司;2×Taq PCR Master Mix购自北京康为世纪有限公司;蛋白超滤管购自Millipore公司;自动高压灭菌锅购自日本TOMY公司;恒温培养箱购自上海新苗公司;多功能酶标仪购自美国Biotek公司。
1.2 RA的pfs基因扩增及序列分析以不同血清型的9株鸭疫里默氏杆菌CH3 (血清1型)、WJ4 (血清1型)、YXB12 (血清1型)、TH4 (血清2型)、YB2 (血清2型)、YXB1 (血清2型)[6]、YXL1 (血清10)、XYB1 (血清10)、HXB2 (血清10型)基因组为模板[6],以RA-pfs-F (5′-CCGGAATTCA TGAAAATAGTCGTTATTGGAGC-3′,划线部分为EcoR Ⅰ酶切位点)和RA-pfs-R (5′-CCCAAGCTTC TATAAACTTTTAATTAAATC-3′,划线部分为Hind Ⅲ酶切位点)为引物,PCR扩增pfs基因,PCR扩增体系为:25.0 μL PCR Mix,上下游引物(10.0 μmol/L)各1.0 μL,基因组DNA (100 mg/L) 1.0 μL,双蒸水补充至50.0 μL;PCR扩增条件为:98 ℃ 40 s;98 ℃ 15 s,56 ℃ 15 s,72 ℃ 30 s,35个循环;72 ℃ 10 min。产物回收后连接T载体,送华津生物科技公司测序。利用DNAStar软件中的MegAlign进行核苷酸序列的同源性分析。
1.3 重组蛋白的表达、纯化将本实验室前期构建的分别表达APEC的luxS和pfs重组表达质粒pET28a-APEC-luxS和pET28a-APEC-pfs[5]和本实验构建的表达RA的pfs重组表达质粒pCold-RA-pfs分别转化大肠杆菌BL21(DE3) 菌株,37 ℃培养至OD600约为0.6-0.8,经IPTG诱导表达后,收集菌体,用超声细胞裂解仪130 Hz工作90 s,间歇90 s,超声破碎裂解菌体,4 ℃、12 000 r/min离心10 min,分别收集上清和沉淀并进行SDS-PAGE分析,以检测基因表达情况。将上述表达的重组蛋白分别命名为APEC-LuxS、APEC-Pfs和RA-Mtan。
重组蛋白的纯化用美国Bio-Rad公司的高效亲和纯化层析仪进行。将收集的洗脱蛋白进行SDS-PAGE鉴定蛋白纯度,并采用BCA蛋白浓度测定试剂盒测定样品蛋白的浓度。
1.4 HCY标准曲线的建立通过测定重组蛋白APEC-LuxS、APEC-Pfs和RA-Mtan催化底物SAH后形成HCY的量,评价蛋白的酶活。参照文献[7]方法并进行适当修改,建立HCY标准曲线,具体方法如下:将100 μL不同浓度的同型半胱氨酸(用10 mmol/L pH 7.5磷酸钠缓冲液,将HCY稀释到1-200 μmol/L)与50 μL 5 mmol/L的Ellman’s试剂混匀后,避光置于37 ℃培养箱孵育30 min,用酶标仪测量不同浓度的HCY在412 nm的吸收峰值,建立HCY标准曲线。
1.5 RA的Mtan对SAH的催化活性检测将纯化蛋白超滤后,在3管终浓度为1 mmol/L SAH的磷酸钠(10 mmol/L,pH 7.5) 缓冲液中,分别加入终浓度为0.5 mg/mL的APEC-LuxS+APEC-Pfs (阳性对照)、APEC-LuxS+RA-Mtan和RA-Mtan (阴性对照),37 ℃孵育1 h。将反应液用10 kD蛋白超滤管进行超滤,去除反应液中的蛋白后,取出100 μL滤液与50 μL 5 mmol/L的Ellman’s试剂混匀后避光置于37 ℃孵育30 min。用酶标仪测量每组在412 nm处的吸收峰值,参照1.4 HCY标准曲线,测定每组生成同型半胱氨酸的浓度。
1.6 生成AI-2活性检测将哈维弧菌BB170在28 ℃培养过夜,培养至OD600为3.0,用新配制的AB培养基[1]以1:5 000稀释BB170培养物。将1.5中反应产物超滤液在无菌条件下用0.22 μm的滤器过滤后,用于AI-2活性检测。具体方法参照文献[1],并做适当修改。具体方法如下:900 μL的AB培养基,加入无菌的各蛋白滤液100 μL,28 ℃培养3 h后用多功能酶标仪测定生物发光。同时以哈维弧菌BB152培养上清为阳性对照、DH5α培养上清为阴性对照,每组重复3次。
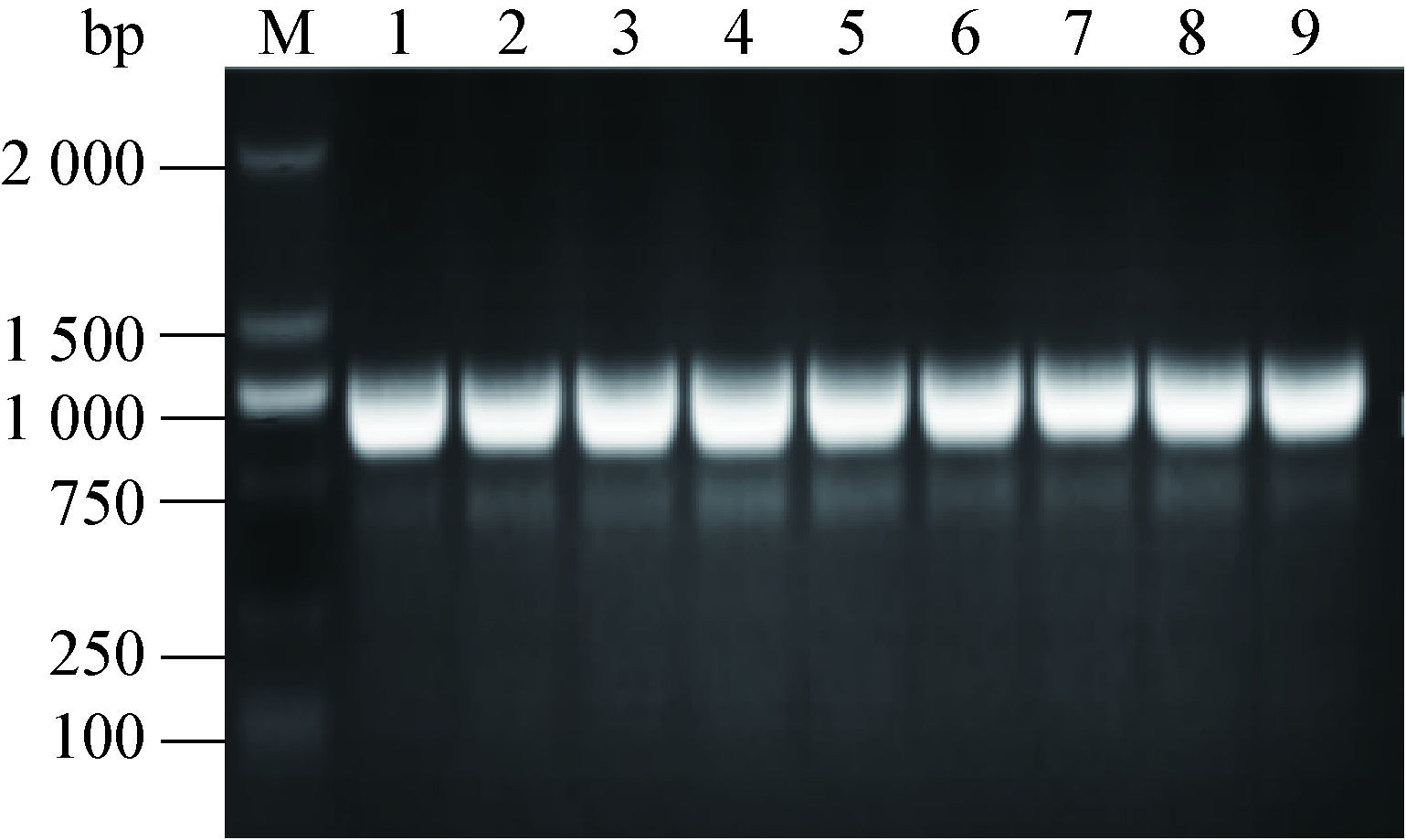
2 结果与分析 2.1 不同血清型鸭疫里默氏杆菌pfs基因的PCR扩增结果及序列分析PCR检测结果表明,不同血清型的RA菌株均可以扩增到大小约为688 bp的pfs基因(图 1)。对扩增的序列测序后,运用DNAStar软件进行序列分析,结果表明该基因在不同血清型间的核苷酸一致在93.9%-100%之间(图 2)。
|
| 图 1 9株不同血清型鸭疫里默氏杆菌pfs基因PCR检测 Figure 1 The pfs gene was amplified from 9 isolation strains of Riemerella anatipestifer from different serotypes 注:M:DL2000 DNA分子标准;1-9:RA 9株不同血清型的pfs基因PCR扩增条带. Note: M: DL2000 DNA marker; 1-9: The pfs from different serotypes in RA. |
|
|
|
| 图 2 核苷酸序列比对分析图 Figure 2 Nucleotide sequence analysis |
|
|
将包含重组表达质粒pCold-RA-pfs的BL21重组菌经IPTG诱导后,用SDS-PAGE检测,结果表明,获得以可溶性方式表达的RA的重组Mtan蛋白,大小约为85 kD,与预期大小一致(图 3)。

|
| 图 3 RA-Mtan的表达、纯化 Figure 3 Experession and purification of RA-Mtan 注:M:蛋白质分子质量Marker;1:转化空质粒pColdTF的BL21 (阴性对照);2:纯化的RA-Mtan;3:转化pCold-RA-pfs的BL21重组菌;4:转化pCold-RA-pfs的BL21重组菌超声上清. Note: M: Protein marker; 1: The total cellular proteins from E. coli BL21 containing pColdTF (serve as negative control); 2: The purification of RA-Mtan; 3: The total cellular proteins containing expression plasmids pCold-RA-pfs; 4: The supermatant of total cellular proteins containing expression plasmids pCold-RA-pfs. |
|
|
APEC-LuxS和APEC-Pfs的纯化、表达参照本实验室前期建立的方法。RA-Mtan、APEC-LuxS和APEC-Pfs通过His-Binding-Resin进行亲和层析纯化后,经BCA法测定的浓度分别为0.67、1.30和2.30 g/L。
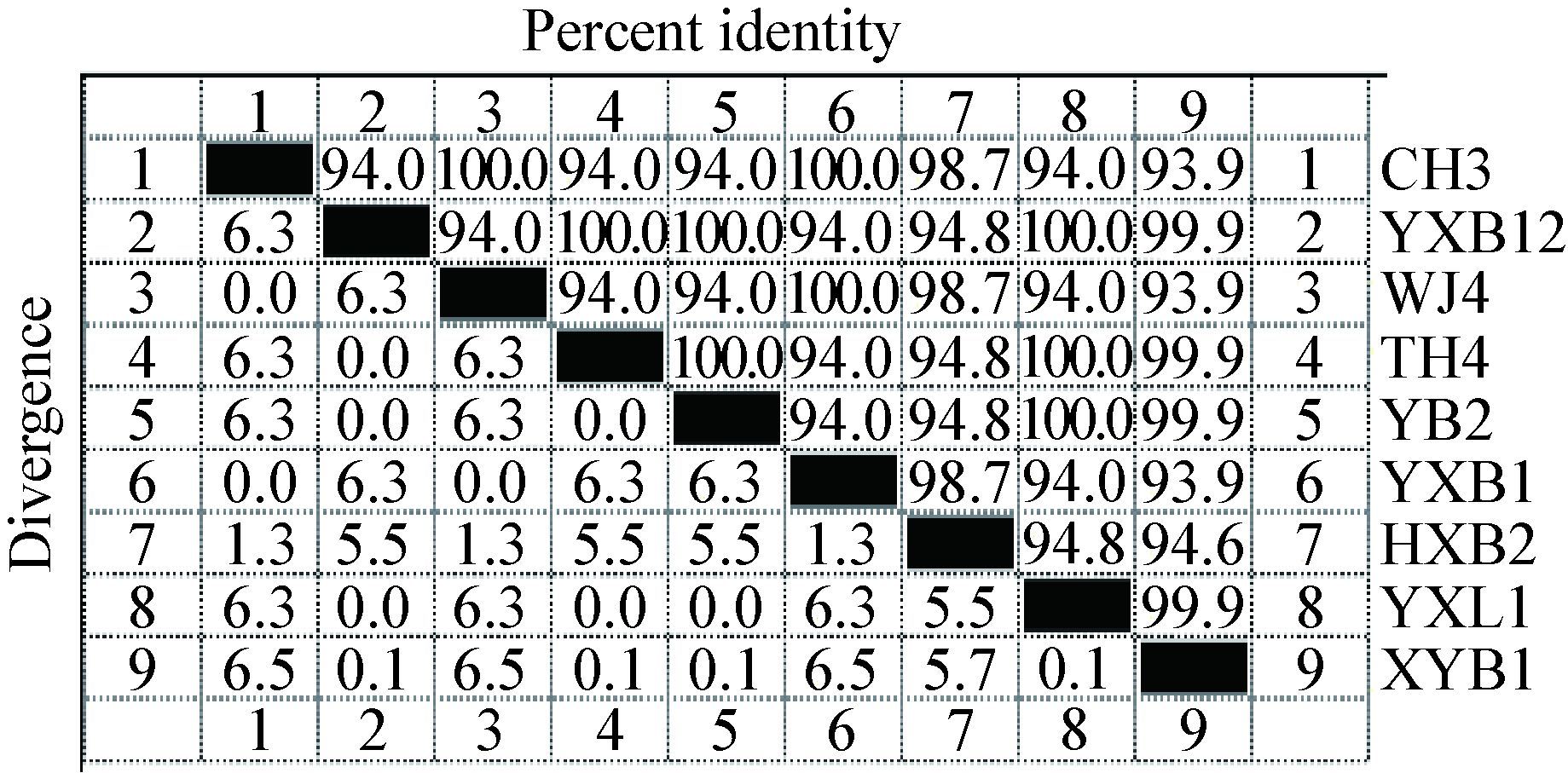
2.3 建立HCY标准曲线及测定RA-Mtan的酶活将不同浓度(0-200 μmol/L)的同型半胱氨酸(HCY)分别与5 mmol/L Ellman’s试剂混匀,37 ℃作用30 min后,测定其在412 nm波长下的光吸收值。依据得到的数据建立HCY浓度测定标准曲线(图 4)。
|
| 图 4 HCY浓度测定标准曲线 Figure 4 Standard curve to determine HCY concentration |
|
|
当200 μL 0.5 g/L的APEC-LuxS与APEC-Pfs酶蛋白组合共同作用于200 μL 1 mmol/L的底物SAH时,可以生成306.6 μmol/L的HCY,当APEC-LuxS和RA-Mtan酶蛋白组合共同作用于相同浓度的SAH时,生成HCY的浓度为176.7 μmol/L,而当RA-Mtan单独作用于底物SAH时,不能产生HCY。
2.4 Mtan催化SAH生成AI-2活性AI-2活性检测结果表明,当APEC-LuxS和APEC-Pfs共同作用于SAH时,能产生有活性的AI-2分子;同样地,当APEC-LuxS和RA-Mtan共同作用于SAH时,也能产生有活性的AI-2。但当RA-Mtan单独作用于SAH时,不能产生AI-2,表明鸭疫里默氏杆菌中Mtan与大肠杆菌的Pfs功能相似,参与AI-2的合成(图 5)。
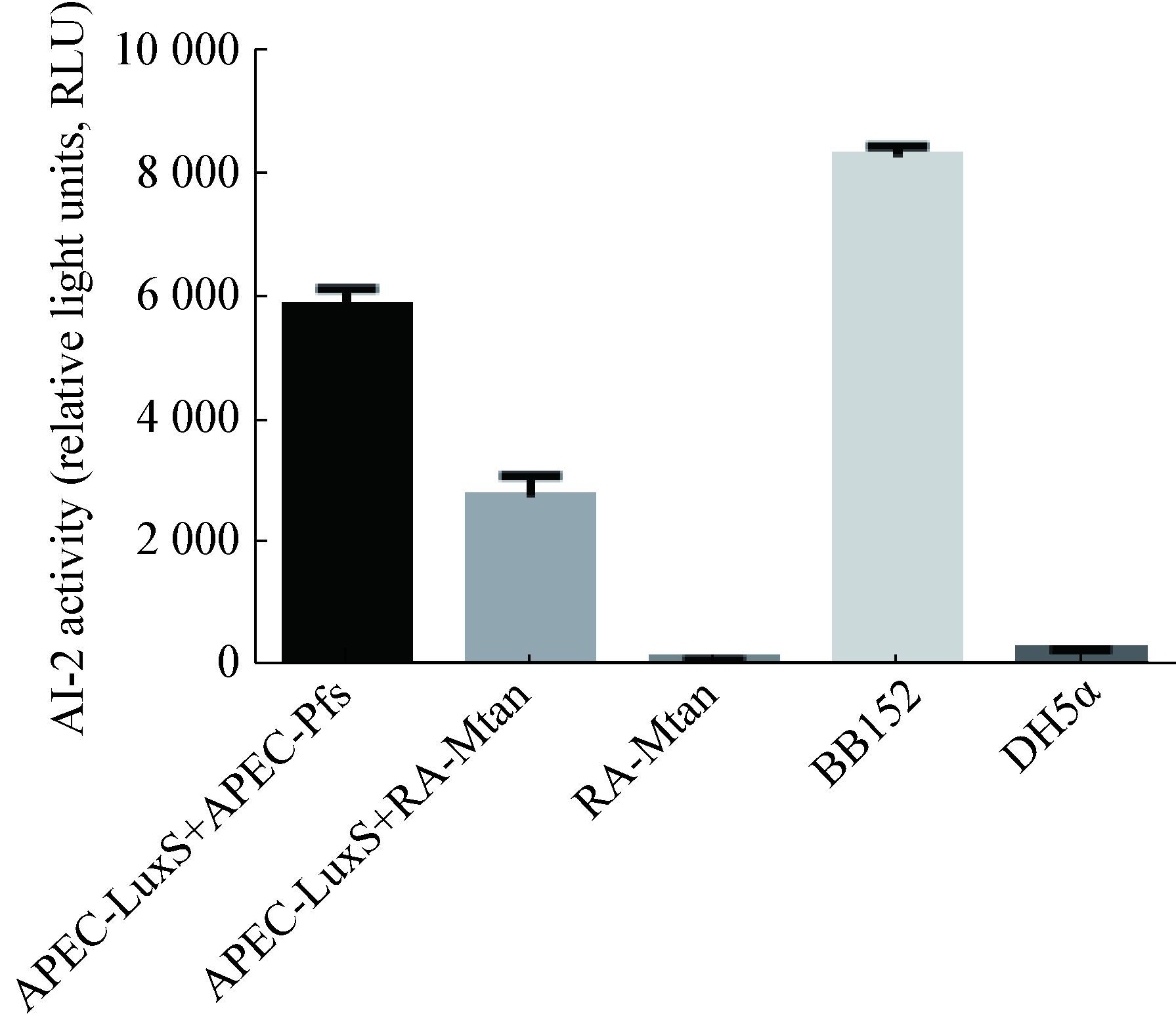
|
| 图 5 AI-2活性检测 Figure 5 AI-2 bioassay |
|
|
pfs基因编码Pfs (又称为Mtan),是细菌甲硫氨酸循环的关键酶,主要参与多聚胺的生物合成、密度感应系统调控、嘌呤和蛋氨酸的合成与代谢等过程[8]。不同的细菌采用不同的甲硫氨酸代谢通路,在布鲁氏菌和铜绿假单胞菌中,甲硫氨酸与ATP反应生成S-腺苷甲硫氨酸(S-Adenosylmethionine,SAM),SAM去甲基后生成SAH,SAH在SahH作用下生成HCY,HCY重新生成甲硫氨酸,此过程不产生AI-2[9-11]。但在大肠杆菌和沙门氏菌中,甲硫氨酸代谢需要Pfs和LuxS的参与,通过催化底物SAH和SRH产生AI-2[12]。
近年的研究表明,pfs在细菌代谢过程中具有重要作用,参与调控细菌的众多生理过程。在金黄色葡萄球菌中pfs基因缺失,可降低金黄色葡萄球菌的自溶能力和影响其生物被膜的形成能力[13],在肺炎链球菌中pfs编码Mtan蛋白,参与对其密度感应系统的调控[2, 14]。本实验室前期研究表明RA不产生AI-2[3],但存在pfs。RA的致病性研究结果表明,RA主要的致病血清型是1、2和10型,其pfs序列是否存在差异?在体外RA的pfs基因编码产物Mtan蛋白是否能催化SAH产生具有活性的AI-2分子?目前尚未见相关研究报道。本研究对9株RA的1、2和10型的pfs序列进行克隆、测序,序列分析表明,pfs在3种血清型中的一致性高,表明该基因保守性高,与血清型的相关性不大。
AI-2分子的产生需要LuxS和Pfs的参与[1],虽然RA中存在pfs,但其编码产物Mtan是否能催化SAH产生AI-2分子仍不明确。因此本研究利用禽致病性大肠杆菌的LuxS和RA的Mtan共同作用于SAH验证其催化活性,结果表明在体外Mtan可以催化SAH生成AI-2。由于RA不产生AI-2,而SAH在胞内蓄积对细菌是有毒性的,推测在RA中,存在类似于布鲁氏菌和铜绿假单胞菌的甲硫氨酸代谢通路,即RA中的SAH是在SahH作用下生成HCY,HCY重新生成甲硫氨酸,相关研究仍有待深入。本研究为进一步研究pfs对RA的调控作用提供参考。
| [1] | Bao H. The regulation of quorum sensing of LuxS/AI-2 in avian pathogenic Escherichia coli[D]. Hefei: Master's Thesis of Anhui Agricultural University, 2013 (in Chinese) 白灏. LuxS/AI-2型密度感应系统对禽致病性大肠杆菌的调控研究[D]. 合肥: 安徽农业大学硕士学位论文, 2013 |
| [2] | Thomas K, Cameron SA, Almo SC, et al. Active site and remote contributions to catalysis in methylthioadenosine nucleosidases[J]. Biochemistry, 2015, 54(15) : 2520–2529. DOI:10.1021/bi501487w |
| [3] | Fan GB. Function of the pfs gene in Riemerella anatipestifer[D]. Beijing: Master's Thesis of Chinese Academy of Agricultural Sciences, 2015 (in Chinese) 范国博. 鸭疫里默氏杆菌pfs基因的功能研究[D]. 北京: 中国农业科学院硕士学位论文, 2015 |
| [4] | Pereira CS, McAuley JR, Taga ME, et al. Sinorhizobium meliloti, a bacterium lacking the autoinducer-2 (AI-2) synthase, responds to AI-2 supplied by other bacteria[J]. Molecular Microbiology, 2008, 70(5) : 1223–1235. DOI:10.1111/mmi.2008.70.issue-5 |
| [5] | Fan GB, Han XG, Zhang YX, et al. Preparation of monoclonal antibodies to pfs of Riemerella anatipestifer[J]. Chinese Journal of Animal Infectious Diseases, 2015, 23(5) : 41–45. (in Chinese) 范国博, 韩先干, 张宇曦, 等. 鸭疫里默氏杆菌pfs基因的克隆表达及单克隆抗体制备[J]. 中国动物传染病学报, 2015, 23(5) : 41–45. |
| [6] | Hu QH, Han XG, Zhou XJ, et al. Characterization of biofilm formation by Riemerella anatipestifer[J]. Veterinary Microbiology, 2010, 144(3/4) : 429–436. |
| [7] | Sperandio V, Mellies JL, Nguyen W, et al. Quorum sensing controls expression of the type Ⅲ secretion gene transcription and protein secretion in enterohemorrhagic and enteropathogenic Escherichia coli[J]. Proceedings of the National Academy of Sciences of the United States of America, 1999, 96(26) : 15196–15201. DOI:10.1073/pnas.96.26.15196 |
| [8] | Kim Y, Lew CM, Gralla JD. Escherichia coli pfs transcription: regulation and proposed roles in autoinducer-2 synthesis and purine excretion[J]. Journal of Bacteriology, 2006, 188(21) : 7457–7463. DOI:10.1128/JB.00868-06 |
| [9] | Redanz S, Standar K, Podbielski A, et al. Heterologous expression of sahH reveals that biofilm formation is autoinducer-2-independent in Streptococcus sanguinis but is associated with an intact activated methionine cycle[J]. The Journal of Biological Chemistry, 2012, 287(43) : 36111–36122. DOI:10.1074/jbc.M112.379230 |
| [10] | Sun JB, Daniel R, Wagner-D bler I, et al. Is autoinducer-2 a universal signal for interspecies communication: a comparative genomic and phylogenetic analysis of the synthesis and signal transduction pathways[J]. BMC Evolutionary Biology, 2004, 4(1) : 36. DOI:10.1186/1471-2148-4-36 |
| [11] | Halliday NM, Hardie KR, Williams P, et al. Quantitative liquid chromatography-tandem mass spectrometry profiling of activated methyl cycle metabolites involved in LuxS-dependent quorum sensing in Escherichia coli[J]. Analytical Biochemistry, 2010, 403(1/2) : 20–29. |
| [12] | Liu L. Regulation of AI-2 on biological functions of Riemerella anatipestifer[D]. Beijing: Master's Thesis of Chinese Academy of Agricultural Sciences, 2013 (in Chinese) 刘蕾. AI-2对鸭疫里默氏杆菌生物学功能调控的研究[D]. 北京: 中国农业科学院硕士学位论文, 2013 |
| [13] | Bao Y. Functional research of pfs and target treatment of infection of Staphylococcus aureus[D]. Hefei: Doctoral Dissertation of University of Science and Technology of China, 2012 (in Chinese) 鲍燕. 金黄色葡萄球菌pfs的功能性研究及金葡萄感染的靶向性治疗[D]. 合肥: 中国科学技术大学博士学位论文, 2012 |
| [14] | Parveen N, Cornell KA. Methylthioadenosine/ S-adenosylhomocysteine nucleosidase, a critical enzyme for bacterial metabolism[J]. Molecular Microbiology, 2011, 79(1) : 7–20. DOI:10.1111/j.1365-2958.2010.07455.x |
 2017, Vol. 44
2017, Vol. 44