扩展功能
文章信息
- 孙广正, 姚拓, 侯栋, 陈龙, 岳宏忠
- SUN Guang-Zheng, YAO Tuo, HOU Dong, CHEN Long, YUE Hong-zhong
- 西葫芦根腐病菌拮抗细菌的防病促生作用
- Biocontrol potential of antagonistic bacteria strains against Fusarium oxysporum and their growth-promoting effects on zucchini
- 微生物学通报, 2017, 44(5): 1121-1130
- Microbiology China, 2017, 44(5): 1121-1130
- DOI: 10.13344/j.microbiol.china.160543
-
文章历史
- 收稿日期: 2016-07-27
- 接受日期: 2016-10-17
- 优先数字出版日期(www.cnki.net): 2016-11-03
2. 甘肃省农业科学院蔬菜研究所 甘肃 兰州 730070
2. Vegetable Research Institute, Gansu Academy of Agricultural Sciences, Lanzhou, Gansu 730070, China
西葫芦Cuxurbita pepo L.是一种营养丰富、栽培面积广、经济效益仅次于黄瓜的主要商品蔬菜。因西葫芦有诸多优点,其种植面积日益增大,成为我国西北和山西省北部等地主要的保护地栽培蔬菜。冬春茬西葫芦栽培生育期长,在定植前需要施有机肥,通常用过磷酸钙、硫酸钾、磷酸二铵或者三元复合肥[1]。然而,随着化肥的大量施用,不仅污染环境,而且影响人的身体健康。同时,由于连年重茬种植、管理不当、防治不力等原因,已造成西葫芦根腐病、病毒病、白粉病、叶枯病和灰霉病愈发严重。其中,西葫芦根腐病尤为严重。尖孢镰刀菌Fusarium oxysporum是引起该病害的病原之一[2-3],可使发病率达到6.2%-18.3%,严重地块的发病率高达70%-90%,成为影响和制约西葫芦种植与发展的重要病害[4]。长期以来,西葫芦根腐病的防治主要依赖化学药剂,但是化学药剂的使用易使病原菌产生抗药性,这样既不能达到防治目的,又容易造成环境污染。
植物根际促生菌(Plant growth promoting rhizobacteria,PGPR)是一类定殖于植物根际,通过提高养分的有效性和促进植物对养分的吸收等方式达到促生目的,还具有防病潜力与应用价值的一类生防菌,因而成为许多学者研究的对象。杨娜等[5]发现菌株a4对尖孢镰刀菌菊专化型的抑制率达到71%;在盆栽试验中,对照植株根际土壤的尖孢镰刀菌数量为施用a4菌剂处理的6.5倍。梁银等[6]发现放线菌CT205菌剂对黄瓜枯萎病F. oxysporum f. sp. cucumerinum防治效果达51.85%,对黄瓜也有促生作用;放线菌CT205菌液和有机肥配施防治效果达81.85%。
目前,PGPR制剂在西葫芦上的应用鲜有报道。鉴于此,本研究利用前期研究得到的19种PGPR菌株,分别测定其对尖孢镰刀菌菌丝生长的影响;用优良拮抗菌株制成微生物菌剂,通过温室盆栽研究其对西葫芦根腐病的防治作用;在田间利用微生物菌剂代替部分化肥,研究其对西葫芦生物量、根系形态和产量的影响,得到较好的肥料配比;旨在为西葫芦根腐病防治以及作物生长提供优良菌种资源和基础资料。
1 材料与方法 1.1 试验地概况试验地位于甘肃省农业科学研究院,东经103°41′,北纬36°5′,海拔为1 600 m,属中温带大陆性气候。南北群山环抱,气候干燥,日照充足,年温差和日温差均较大。春季转瞬即逝,冷暖变化大;夏季短促,气温较高,但无酷暑;秋季短促,降温快;冬季漫长且较寒冷,雨雪少。年平均降水量360 mm左右,年平均气温10左右,全年日照时数平均2 446 h,无霜期180 d以上。
1.2 材料供试PGPR菌:JM170、JM92、LX191、G、JX59、LX22、LX81、LHS11、LM4-3、4N4、P2-1、PGRS-3、XX1、XX2、XX5、XX6、FX1、FX2和F1-4,分离自小麦、玉米、苜蓿和三叶草等多种植物根际,具有良好的固氮、溶磷及分泌植物激素特性[7](表 1),由甘肃农业大学草业学院草地微生物实验室提供。
| 菌株代号 Strain No. | 宿主植物 Host plant | 固氮酶活性 Nitrogenase activity (C2H4 nmol/(mL·h)) | 溶磷量 P solubilization capacity (mg/L) | 分泌生长素 IAA secreting ability (mg/L) |
| Pseudomonas sp. JM92 | 苜蓿Medicago sativa | 75.34 | 132.60 | 47.25 |
| Azotobacter sp. LX191 | 小麦Triticum aestivum | - | 200.02 | 54.36 |
| Azospirillum brasilense G | 小麦T. aestivum | 180.90 | - | - |
| Bacillus sp. JX59 | 小麦T. aestivum | - | 109.30 | - |
| Bacillus sp. LX81 | 小麦T. aestivum | 102.34 | 105.60 | - |
| 4N4* | 玉米Zea mays | 178.94 | 178.25 | 17.80 |
| P2-1* | 玉米Z. mays | 95.10 | 193.67 | 16.84 |
| JM170* | 苜蓿M. sativa | 43.80 | 123.20 | 4.34 |
| B. pumilus LX22 | 小麦T. aestivum | - | 152.69 | - |
| B. subtilis LHS11 | 红三叶Trifolium pratense | 220.36 | 204.74 | 29.56 |
| B. pumilus LM4-3 | 苜蓿M. sativa | 246.46 | - | 13.91 |
| PGRS-3* | 高原早熟禾Poa alpigena | - | - | 39.25 |
| B. cereus XX1 | 苜蓿M. sativa | 44.28 | 35.70 | - |
| XX2* | 苜蓿M. sativa | 12.21 | 11.80 | - |
| Pseudomonas fluorescens XX5 | 苜蓿M. sativa | - | - | 10.01 |
| B. simplex XX6 | 苜蓿M. sativa | 34.33 | - | - |
| FX1* | 苜蓿M. sativa | 7.14 | - | - |
| B. subtilis FX2 | 苜蓿M. sativa | 110.45 | 75.22 | 15.30 |
| B. pumilus F1-4 | 苜蓿M. sativa | 10.06 | 3.79 | - |
| 注:*:待鉴定;-:促生特性微弱;下同. Note: *: Not identified; -: weak growth promoting properties; the same below. | ||||
供试病原真菌:尖孢镰刀菌F. oxysporum由甘肃农业大学草业学院草地微生物实验室提供。
培养基:LB (Luria bertani)固体培养基用于分离和保存根际细菌,LB液体培养基用于发酵根际细菌[8]。PDA (Potato dextrose agar)培养基用于真菌培养和平板对峙培养[8]。
植物材料:西葫芦种子(陇葫一号)由甘肃省农业科学院蔬菜研究所提供,发芽率100%。
药剂:25%多菌灵(Carbendazim)购自甘肃省农科院植保所新农药开发中心。
主要仪器:NanoDrop ND-1000分光光度计,Thermo Scientific公司;LA2400 Scanner,Epson Expression 1000XL,Epson (China)公司。
1.3 PGPR菌株对尖孢镰刀菌的抑制作用按荣良燕等[8]的方法,采用平板对峙法测定供试菌株与病原真菌的拮抗作用。将保存在PDA斜面上的病原真菌接种到PDA平板上,25培养5-7 d。细菌接种在LB液体培养基中,25、150 r/min培养24 h,细菌菌液浓度达到106CFU/mL备用。再将真菌与细菌同时接种在PDA平板上,平板中心接种真菌,菌饼直径为6 mm,距中心1.7 cm处等距离接种4种相同的细菌(用加液枪将菌液垂直滴在培养基上);以只接菌饼的平板为空白对照。每种组合3个重复,试验重复3次。25培养,根据真菌的生长情况,在适宜天数测量真菌距细菌近端的半径。
抑制率=[(对照菌落直径-处理菌落直径)/对照菌落直径]×100%。
1.4 微生物菌剂温室盆栽防治效果测定 1.4.1 微生物菌剂制作: 将泥炭、木炭和花土干燥粉碎,过筛(0.15 mm),按一定比例混合(正在申报专利),调pH值至6.5-7.0,将其在1×105 Pa连续灭菌1-2 h后分装成500 g小袋,分别接种各处理菌株悬浮液50 mL (108 CFU/mL),将菌液与载体充分混匀后置于28培养7-10 d,然后常温保存备用。 1.4.2 试验设计: 按照梁凤臣等[9]的方法处理西葫芦种子。共设计5种处理,将尖孢镰刀菌接种于PDA液体培养基中,25、150 r/min振荡培养6 d,然后按照每0.015 m3土接种250 mL液体病原菌(孢子浓度为106 CFU/mL,菌丝干重为1.2 g)的比例混匀。将接菌的土放入大小一致的花盆中(高15.3 cm,上口直径26 cm,底面直径12 cm),浇水之后,在上面覆盖0.5 cm潮湿的灭菌土。接入病原菌3 d后,在每个花盆中种入5颗拌有微生物菌剂的种子(提前用微生物菌剂拌种,种子表面被微生物菌剂均匀包裹),再放1.5 cm厚灭菌土,浇水。试验设置5个处理:A:单一菌剂LHS11;B:单一菌剂FX2;C:复合菌剂LHS11+FX2;D:25%多菌灵(阳性对照);E:LB无菌液体培养基(阴性对照)。每处理3个重复。 1.4.3 微生物菌剂对西葫芦根腐病的防效测定: 植株生长5周后,观察记载西葫芦根腐病的病情指数和发病株数,再计算发病率及防治效果。病情指数分级标准:0级,根部无病斑,或施药后病斑愈合;1级,根部变色,病斑面积占根部茎秆周长的1%-25%,或中午正常光照不萎蔫;3级,根部变色,病斑面积占根部茎秆周长的26%-50%,或中午正常光照叶片只有顶部4-5片叶萎蔫;5级,根部变色,病斑面积占根部茎秆周长的51%-75%,或中午正常光照只有下部4-5片老叶不萎蔫;7级,根部变色,病斑面积占根部茎秆周长的75%以上,或中午正常光照叶片全部萎蔫,但早晚叶片仍能恢复[4]。发病率=病株数/调查总株数×100%;
防治效果=[(对照病情指数-处理病情指数)/对照病情指数]×100%。
1.5 微生物菌剂对西葫芦生长影响测定 1.5.1 微生物菌剂制作: 将6株PGPR菌株G、LHS11、FX2、LM4-3、JM170和PGRS-3分别接种于LB液体培养基中,28、150 r/min培养72 h。待菌株充分生长后,利用分光光度计测定各菌株悬浮液A660值,用无菌水调其A660≥0.5 (即菌株悬浮液108 CFU/mL),并将调好的各菌株悬浮液按特定体积比(正在申报专利)混合后备用;称取载体250 g,1×105 Pa、25 min连续灭菌两次。将灭菌后的载体置于无菌操作台上冷却后,倒入食品专用袋中;在无菌条件下,将无菌水与载体材料充分混匀,使载体材料湿润、松散而不粘结,混合均匀后补加上述备用的混合菌液约80-100 mL,继续混合搅拌均匀,用自动封口机封口。将制作好的复合菌剂置于28培养7-10 d,备用。 1.5.2 小区设计: 播种前将种子用复合菌剂拌种,置于阴凉、避光处0.5 h (使促生菌充分粘附在种子表面)后即可播种。复合菌剂用量为1.5 g/m2。试验设置9个处理:A:100%化肥;B:85%化肥+复合菌剂;C:85%化肥;D:70%化肥+复合菌剂;E:70%化肥;F:55%化肥+复合菌剂;G:55%化肥;H:复合菌剂;I:无肥对照。每个处理3个重复,共计27个小区,采用随机区组的方法进行小区设计,每个小区长4.7 m,宽1.3 m (0.7 m垄和0.6 m沟)。化肥施用量:全量化肥磷酸二胺使用量为0.03 kg/m2,其余各处理分别按比例减少化肥施用量以复合菌剂代之。 1.5.3 测定指标及方法: 在西葫芦盛花期和成熟期分别测定西葫芦地上鲜重和地下鲜重,在80放置24 h后,分别称量其地上干重和地下干重;在成熟期持续测产1个月;利用根系扫描仪(LA2400 Scanner,Epson Expression 1000XL)测定根表面积、根体积及根直径。 1.6 数据分析采用SPSS 16.0软件中的Duncan氏新复极差法对所有数据进行单因素分析。
2 结果与分析 2.1 优良拮抗细菌筛选培养4 d后,14株菌表现出抑菌活性。其中,LHS11和FX2的抑菌活性较好,与其他拮抗菌相比,抑菌能力显著(P < 0.05),但两者之间差异不显著(P > 0.05)。随着培养时间的增加,9株拮抗菌对病原菌的抑制率提高,其余菌株失去抑菌活性。培养9 d后,各拮抗菌对尖孢镰刀菌的抑制率均达到60%以上(表 2)。其中,FX2抑制效果较明显,受抑制的尖孢镰刀菌菌丝分布范围较小,抑制率达到66.80%。培养11 d后,对照菌落菌丝在半径为45 mm的平板上长满。
| 菌株代号 Strain No. | 4 d | 9 d | |||||
| 处理菌落半径 Treatment colony radius (mm) | 对照菌落半径 Control colony radius (mm) | 抑制率 Inhibition rate (%) | 处理菌落半径 Treatment colony radius (mm) | 对照菌落半径 Control colony radius (mm) | 抑制率 Inhibition rate (%) | ||
| JM170 | 14.17±0.06b | 18.27±3.47d | - | - | |||
| JM92 | - | - | - | - | |||
| LX191 | - | - | - | - | |||
| G | - | - | - | - | |||
| JX59 | 15.17±0.02a | 12.50±0.96e | - | - | |||
| LX22 | 15.17±0.02a | 12.50±0.96e | - | - | |||
| LX81 | 15.50±0.03a | 10.58±1.67e | - | - | |||
| LHS11 | 10.67±0.17d | 38.46±0.96a | 13.83±0.17cd | 65.98±0.41ab | |||
| LM4-3 | 12.67±0.17c | 26.92±0.96c | 14.67±0.44b | 63.93±1.08c | |||
| 4N4 | - | 17.33±0.33 | - | - | 40.67±0.33 | - | |
| P2-1 | 15.00±0.03a | 13.46±1.66e | - | - | |||
| PGRS-3 | - | - | - | - | |||
| XX1 | 12.17±0.44c | 29.81±2.54bc | 13.67±0.17d | 66.39±0.41a | |||
| XX2 | 12.00±0.29c | 30.77±1.67bc | 15.67±0.17a | 61.47±0.41d | |||
| XX5 | 13.83±0.02b | 20.19±0.96d | 14.50±0.03bc | 64.34±0.71bc | |||
| XX6 | 12.67±0.03c | 26.92±1.92c | 14.83±0.07b | 63.53±1.64c | |||
| FX1 | 12.50±0.29c | 27.88±1.67bc | 14.67±0.17b | 63.93±0.41c | |||
| FX2 | 10.67±0.33d | 38.46±1.92a | 13.50±0.58d | 66.80±1.42a | |||
| F1-4 | 11.83±0.17c | 31.73±0.96b | 15.17±0.33ab | 62.70±0.82cd | |||
| 注:表中数据为平均值±标准差;同列不同小写字母表示处理间差异显著(Duncan’s test,P < 0.05);-:抑制率小于10%;下同. Note: Values in the table are x+s; Different lowercase letters within the same column indicate significant difference at P < 0.05 level by Duncan’s test; -: Inhibition less than 10%; The same below. | |||||||
5种处理发病的先后顺序为:E (阴性对照) > B (单一菌剂FX2) > A (单一菌剂LHS11) > D (25%多菌灵) > C (复合菌剂LHS11+FX2)。种植40 d后,处理E的发病率达到93.33%,处理C的发病率降到40.00%,明显低于处理E;不同处理的防治效果为:C (复合菌剂LHS11+FX2) > D (25%多菌灵) > A (单一菌剂LHS11) > B (单一菌剂FX2),其中处理C的防治效果较好,达到57.14% (表 3)。
| 处理 Treatment | 发病率 Incidence (%) | 防治效果 Control efficiency (%) |
| A | 60.00±0.00b | 35.71±0.00b |
| B | 66.67±6.67b | 28.57±7.14b |
| C | 40.00±0.00c | 57.14±0.00a |
| D | 53.33±6.67bc | 42.86±7.14b |
| E | 93.33±6.67a | - |
| 处理 Treatment | 盛花期 Full-blossom period | 成熟期 Mature period | |||
| 鲜重 Fresh weight (g) | 干重 Dry weight (g) | 鲜重 Fresh weight (g) | 干重 Dry weight (g) | ||
| A | 1 883.67±128.00a | 134.33±8.76a | 2 478.33±79.55a | 210.67±18.05ab | |
| B | 1 890.67±214.00a | 135.00±18.73a | 2 297.33±63.56a | 237.67±25.83a | |
| C | 1 275.00±274.00ab | 106.00±17.47ab | 2 136.67±195.31a | 187.00±3.21abc | |
| D | 1 332.00±175.00ab | 105.33±11.26ab | 2 214.67±168.83a | 162.67±16.29bc | |
| E | 911.33±191.43b | 100.67±19.92ab | 1 882.00±198.84a | 138.00±9.29bc | |
| F | 1 339.67±125.00ab | 104.67±8.25ab | 2 054.67±114.17a | 155.00±32.53bc | |
| G | 1 025.33±99.00b | 89.00±17.90ab | 2 082.67±344.14a | 163.67±36.92bc | |
| H | 1 065.00±182.00b | 88.00±12.01ab | 2 251.00±492.00a | 166.67±17.40bc | |
| I | 943.67±269.00b | 76.00±23.64b | 1 898.00±144.03a | 135.67±12.17c | |
| 处理 Treatment | 盛花期 Full-blossom period | 成熟期 Mature period | |||
| 鲜重 Fresh weight (g) | 干重 Dry weight (g) | 鲜重 Fresh weight (g) | 干重 Dry weight (g) | ||
| A | 16.94±0.66abc | 2.15±0.11abc | 28.37±0.17a | 3.20±0.16ab | |
| B | 21.10±1.44a | 2.83±0.05a | 29.70±0.34a | 3.60±0.18a | |
| C | 15.12±1.34bc | 1.95±0.15bc | 24.84±2.81ab | 2.82±0.08ab | |
| D | 17.47±3.13abc | 2.22±0.54abc | 26.71±0.94ab | 3.36±0.30ab | |
| E | 13.72±1.35c | 1.76±0.12c | 25.46±2.26ab | 3.12±0.36ab | |
| F | 19.71±1.52ab | 2.65±0.15ab | 24.69±4.51ab | 2.89±0.57ab | |
| G | 13.75±2.42c | 1.75±0.35c | 20.56±4.69ab | 2.59±0.50ab | |
| H | 16.04±1.73abc | 2.18±0.25abc | 21.58±0.81ab | 2.24±0.42b | |
| I | 12.40±0.54c | 1.61±0.08c | 18.31±3.53b | 2.39±0.27b | |
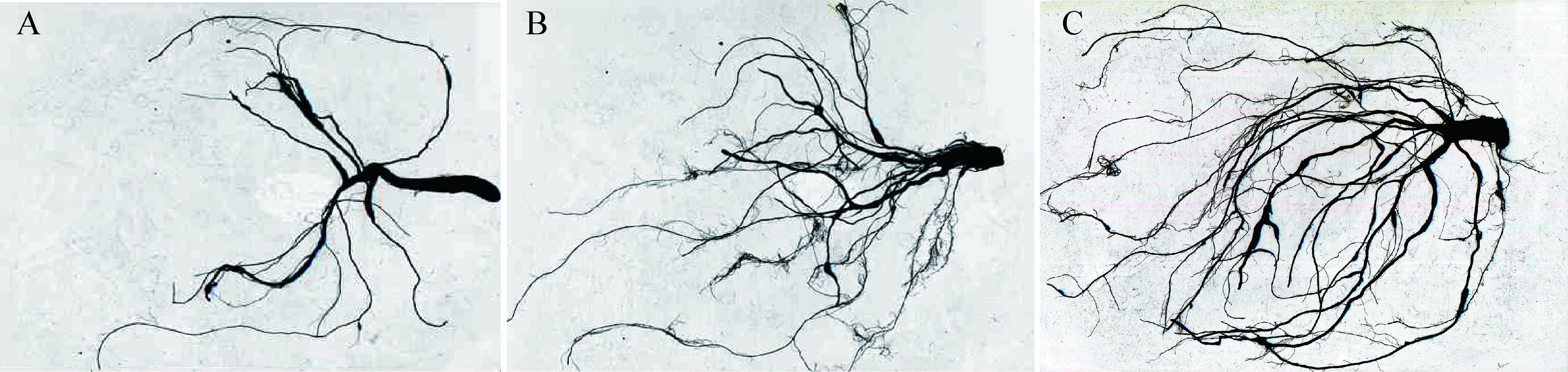
|
| 图 1 不同施肥处理对西葫芦根系外观形态影响(部分) Figure 1 Effects of different fertilization treatments to root morphology on zucchini (part) 注:A:100%化肥;B:85%化肥+微生物接种剂;C:对照. Note: A: 100% Chemical fertilizer; B: 85% Chemical fertilizer + Microbial inoculant; C: Control. |
|
|
| 处理Treatment | 盛花期Full-blossom period | 成熟期Mature period | |||||||
| 总根长Root length (cm) | 根表面积Root surface area (cm2) | 根直径Root diameter (mm) | 根体积Volume (cm3) | 总根长Root length (cm) | 根表面积Root surface area (cm2) | 根直径Root diameter (mm) | 根体积Volume (cm3) | ||
| A | 1 037.31±24.20ab | 28.25±0.93ab | 1.01±0.08ab | 6.66±0.35a | 942.65±31.72bc | 27.48±0.16abc | 1.21±0.09ab | 7.49±0.55ab | |
| B | 1 149.52±62.89a | 29.66±0.66a | 1.21±0.10a | 7.49±0.21a | 1 302.66±144.65a | 28.50±0.66a | 1.34±0.16a | 8.40±0.24a | |
| C | 978.67±31.87bcd | 22.45±1.29ab | 0.94±0.04ab | 3.84±0.30b | 878.75±61.39bc | 26.61±0.35bcd | 1.05±0.13abc | 5.72±0.92bc | |
| D | 1 030.40±21.54ab | 27.69±0.21abc | 0.77±0.12b | 5.13±0.42b | 964.89±54.59b | 28.00±0.26ab | 0.94±0.15abc | 5.63±0.46bc | |
| E | 1 031.77±19.51ab | 28.24±0.60abc | 0.70±0.14b | 4.33±0.82b | 927.61±84.29bc | 27.46±0.58abc | 0.83±0.19bc | 5.80±0.94bc | |
| F | 1 001.21±66.49abc | 27.29±0.63abc | 0.99±0.13ab | 6.62±0.25a | 948.92±66.73bc | 27.49±0.26abc | 0.98±0.13abc | 6.39±1.22abc | |
| G | 912.58±58.52bcd | 26.61±1.16bc | 1.00±0.17ab | 4.44±0.54b | 785.34±77.69bc | 26.02±0.48cd | 1.04±0.14abc | 5.69±0.69bc | |
| H | 840.93±16.21d | 25.24±0.32c | 0.66±0.05b | 4.81±0.12b | 817.00±101.43bc | 27.53±0.38abc | 0.74±0.09c | 6.50±0.27abc | |
| I | 858.89±66.73cd | 27.45±0.88d | 0.70±0.05b | 4.20±0.21b | 686.97±44.43c | 25.62±0.86d | 0.70±0.10c | 4.27±0.55c | |
| 处理 Treatment | 瓜条数(个) The number of zucchini | 总产量 Total yield (kg) | 单瓜质量 Single fruit quality (kg) | 产量增加率 Output growth rate (%) |
| A | 94.67±4.48ab | 57.77±1.65ab | 0.61±0.00a | 22.08±2.72ab |
| B | 102.00±4.04a | 60.08±0.60a | 0.59±0.02a | 27.13±3.90a |
| C | 94.00±7.94ab | 54.90±5.54abc | 0.58±0.01a | 15.51±8.90abc |
| D | 92.00±4.93ab | 56.33±1.42ab | 0.61±0.02a | 19.09±2.95abc |
| E | 87.00±3.79ab | 53.87±1.28abc | 0.62±0.02a | 13.88±2.88abcd |
| F | 83.67±1.33b | 51.68±1.78abc | 0.62±0.01a | 9.23±3.37bcd |
| G | 81.33±1.20b | 52.33±1.64abc | 0.64±0.03a | 10.69±4.40bcd |
| H | 85.00±3.79b | 49.80±3.69bc | 0.59±0.02a | 5.08±6.62cd |
| I | 81.67±7.22b | 47.37±1.75c | 0.59±0.03a | - |
Kloepper等[10]认为,PGPR对植物生长的促进作用主要是通过抑制植物病原菌,尤其是一类靠代谢作用而非寄生来影响植物的根围微生物,与生长刺激物质(如激素和生长因子)产生及对营养的促进吸收等因素似乎关系不大。使用微生物制剂可有效防治植物病害。分离筛选高效拮抗菌是开发生防制剂的关键,而充分发挥拮抗菌株抑菌或杀菌效果,首先需在相应的微生态环境中成为优势种群。陈潺等[11]研究发现侧孢短芽孢杆菌Brevibacillus laterosporus菌株AMCC100017对尖孢镰刀菌的抑制率达到34.32%。本研究中9株PGPR对尖孢镰刀菌的拮抗作用较好,其中,FX2抑制效果较明显,受抑制的尖孢镰刀菌菌丝分布范围较小,抑制率达到66.80%。9种供试拮抗菌发酵液对尖孢镰刀菌的抑制作用较弱。但是,菌株LHS11、XX1和XX2使病原菌菌丝扭曲、肿胀,随着时间的延长,菌丝细胞壁溶解出现断裂;菌株FX2和FX1使菌丝扭曲缠绕,局部变形。说明这些菌株是通过营养竞争和空间位点竞争、诱导系统抗性等其他方式抑制病原菌菌丝的生长,具体的拮抗机理有待进一步研究。
3.2 微生物菌剂对西葫芦根腐病的防治作用国内外利用PGPR制剂防治西葫芦根腐病鲜有报道。但是有关尖孢镰刀菌引起其他农作物病害的防治较多,王小慧等[12]利用对西瓜专化型尖孢镰刀菌拮抗效果较好的菌株Cy5和CR38与已腐熟的有机肥制成生物肥BIO5和BIO38,其对西瓜枯萎病的防治率分别达到75%和25%。朱森林等[13]发现解淀粉芽孢杆菌B. amyloliquefaciens菌株BEB33菌剂使香蕉枯萎病的发病率与病情指数分别降至40%和14.76,其防效为73.51%。本研究观察西葫芦的发病情况,发现健康土接种病原菌菌液使西葫芦根腐病的发病率达到93.33%,使用微生物菌剂(LHS11+FX2) 使西葫芦根腐病的发病率降到40%,表明微生物菌剂对西葫芦根腐病起到一定的防治作用。结果与Roberti等[14]的研究相似(防治率59.5%)。利用生防菌与有机肥复配制成生物有机肥,既可以提高土壤肥力,又可以调节土壤微生物区系,减少病原菌数量[6]。因此,有待在大田试验中进一步验证筛选到的优良生防菌与有机肥混合使用的防治效果。
3.3 复合肥对西葫芦的促生作用有机肥与化肥配施不但可以提高作物产量、改善农作物品质,而且是保证作物稳产和推动农业可持续发展的重要方式[15]。本研究利用具有促生特性和生防效果的PGPR菌株制成复合菌剂,在选取的6株菌中,菌株G和FX2有固氮作用,PGRS-3能够分泌生长素,LHS11、JM170和LX22具有溶磷作用,并且菌株LHS11、FX2、JM170和LX22对尖孢镰刀菌、油菜菌核病菌、立枯丝核菌、番茄早疫病菌、黄瓜枯萎病菌和麦根腐平脐蠕孢具有较好的抑菌活性[7, 16],所以在这些菌株之间无拮抗的前提下,制成的复合菌剂既可以促使植物根系吸收可利用的营养元素,也可以对病虫害起到防治作用[17]。韩华雯等[18]研究发现用3株溶磷菌和1株根瘤菌制成的微生物菌剂+半量磷肥对苜蓿的促生效果较好,苜蓿株高、叶绿素含量、叶茎比、干鲜比及产量较对照显著增加。本研究发现在盛花期和成熟期中,85%化肥+复合菌剂处理的地上干重、地下鲜重和干重均较大。由此可见,利用85%化肥+复合菌剂代替全量化肥既可以减少化肥的使用量,还可以利用微生物菌剂提高植株对营养物质的吸收。
不同氮素水平对植株根系的形态及生理特性影响显著,并且随着施氮水平的增加而升高,根长、根质量、根体积、侧根数、根系活力等均增加,根系各项指标与籽粒产量之间呈正相关[19]。向秀媛等[20]研究发现有机、无机肥配施较单施化肥可有效提高水稻的株高、有效穗数,结实率和千粒质量,从而提高水稻的子粒产量。本研究测定不同施肥处理对西葫芦根系形态的影响,85%化肥+复合菌剂处理的总根长、根表面积、根直径和根体积在所有处理中均较大。与无肥对照相比,85%化肥+复合菌剂处理的瓜条数差异显著且较大,并且总产量较大,增产27.13%。结果同王琴等[21]研究相似,60%化肥氮钾+40%紫云英氮钾处理后水稻产量提高28.7%。但是,微生物菌剂的作用较化肥滞后却具有长效性,通常在植物生长后期的促生效果比较明显,作用更优于全量化肥处理。张久东等[22]发现第一年随着绿肥量的增加小麦产量下降,但是土壤肥力增加,第二年小麦产量明显增加。因此有待在该试验地持续开展微生物菌剂代替部分化肥的研究,以证实微生物菌剂作用的持久性。
| [1] | Li BH, Zheng SH, Qu GH, et al. Efficient cultivation of zucchini of Zibo area in winter and spring the sunlight greenhouse[J]. China Vegetables, 2008(5) : 50–51. (in Chinese) 李炳华, 郑淑华, 曲国华, 等. 淄博地区日光温室冬春茬西葫芦高效栽培[J]. 中国蔬菜, 2008(5) : 50–51. |
| [2] | Jamiołkowska A, Sawicki K. Biodiversity of fungi colonising aboveground parts of zucchini (Cucurbita pepo L. var. giromontina)[J]. Folia Horticulturae, 2011, 23(1) : 29–35. |
| [3] | Guo S, Zhang ZG, Wang JM, et al. Identification of root rot pathogen in summer squash[J]. China Cucurbits and Vegetables, 2007(6) : 7–10. (in Chinese) 郭尚, 张作刚, 王建明, 等. 西葫芦根腐病病原的鉴定[J]. 中国瓜菜, 2007(6) : 7–10. |
| [4] | Guo S, Zhang ZG. Occurrence regularity of root rot disease in summer squash[J]. Journal of Shanxi Agricultural Sciences, 2007, 35(6) : 90–93. (in Chinese) 郭尚, 张作刚. 大棚温室西葫芦根腐病发生规律研究[J]. 山西农业科学, 2007, 35(6) : 90–93. |
| [5] | Yang N, Shen QR, Xu YC. Isolation and biological control of an antagonistic bacteria against medicinal chrysanthemum fusarium wilt[J]. Plant Nutrition and Fertilizer Science, 2011, 17(3) : 731–736. (in Chinese) 杨娜, 沈其荣, 徐阳春. 一株抗药用白菊枯萎病生防菌的分离与生防效应研究[J]. 植物营养与肥料学报, 2011, 17(3) : 731–736. DOI:10.11674/zwyf.2011.0436 |
| [6] | Liang Y, Zhang GY, Wang C, et al. Identification and biocontrol effect of a strain of actinomycete antagonistic to wilt disease of cucumber[J]. Acta Pedologica Sinica, 2013, 50(4) : 174–181. (in Chinese) 梁银, 张谷月, 王辰, 等. 一株拮抗放线菌的鉴定及其对黄瓜枯萎病的生防效应研究[J]. 土壤学报, 2013, 50(4) : 174–181. |
| [7] | Sun GZ, Yao T, Zhao GQ, et al. An assessment of the level of control of two fungal pathogens by various plant growth promoting rhizobacteria[J]. Acta Prataculturae Sinica, 2016, 25(8) : 154–163. (in Chinese) 孙广正, 姚拓, 赵桂琴, 等. 植物根际促生菌对两种真菌病害病原的抑制作用及其鉴定[J]. 草业学报, 2016, 25(8) : 154–163. DOI:10.11686/cyxb2015353 |
| [8] | Rong LY, Yao T, Zhao GQ, et al. Screening of siderophore-producing PGPR bacteria and their antagonism against the pathogens[J]. Plant Protection, 2011, 37(1) : 59–64. (in Chinese) 荣良燕, 姚拓, 赵桂琴, 等. 产铁载体PGPR菌筛选及其对病原菌的拮抗作用[J]. 植物保护, 2011, 37(1) : 59–64. |
| [9] | Liang FC, Zhang LL, Li Y, et al. Effect of wood vinegar on seed viability and seedling growth of summer squash[J]. Chinese Agricultural Science Bulletin, 2016, 32(16) : 51–55. (in Chinese) 梁凤臣, 张丽丽, 李艳, 等. 木醋液浸种对西葫芦种子萌发和幼苗生长的影响[J]. 中国农学通报, 2016, 32(16) : 51–55. DOI:10.11924/j.issn.1000-6850.casb16020035 |
| [10] | Kloepper JW, Leong J, Teintze M, et al. Enhanced plant growth by siderophores produced by plant growth-promoting rhizobacteria[J]. Nature, 1980, 286(5776) : 885–886. DOI:10.1038/286885a0 |
| [11] | Chen C, Chen SF, Wang JY, et al. Isolation, identification and the biocontrol potential of a strain of Brevibacillus laterosporus[J]. Microbiology China, 2014, 41(11) : 2275–2282. (in Chinese) 陈潺, 陈升富, 王建宇, 等. 侧孢短芽孢杆菌AMCC 100017的分离鉴定及其生防潜力[J]. 微生物学通报, 2014, 41(11) : 2275–2282. |
| [12] | Wang XH, Zhang GY, Li R, et al. Control of watermelon fusarium wilt by using antagonist-enhanced biological organic fertilizers[J]. Plant Nutrition and Fertilizer Science, 2013, 19(1) : 223–231. (in Chinese) 王小慧, 张国漪, 李蕊, 等. 拮抗菌强化的生物有机肥对西瓜枯萎病的防治作用[J]. 植物营养与肥料学报, 2013, 19(1) : 223–231. |
| [13] | Zhu SL, Liu XB, Cai JM, et al. Isolation of endophytic bacterial BEB33 and its bio-control evaluation against banana Fusarium Wilt[J]. Chinese Journal of Tropical Crops, 2014, 35(6) : 1177–1182. (in Chinese) 朱森林, 刘先宝, 蔡吉苗, 等. 内生细菌BEB33的分离, 鉴定及对香蕉枯萎病的生防作用评价[J]. 热带作物学报, 2014, 35(6) : 1177–1182. |
| [14] | Roberti R, Veronesi A, Flamigni F. Evaluation of microbial products for the control of zucchini foot and root rot caused by Fusarium solani f. sp. cucurbitae race 1[J]. Phytopathologia Mediterranea, 2012, 51(2) : 317–331. |
| [15] | Si DX, Lü FT, Dai BG, et al. Effect of eco-organic fertilizer application on yield, quality and economic return of pumpkin (Cucurbita pepo L.) in solar greenhouse[J]. Northern Horticulture, 2016(1) : 147–152. (in Chinese) 司东霞, 吕福堂, 戴保国, 等. 生态有机肥对日光温室西葫芦产量、品质及经济效益的影响[J]. 北方园艺, 2016(1) : 147–152. |
| [16] | Sun GZ, Yao T, Liu T, et al. Antagonism of plant growth promoting rhizobacteria on three soil-borne fungous pathogen[J]. Microbiology China, 2014, 41(11) : 2293–2300. (in Chinese) 孙广正, 姚拓, 刘婷, 等. 植物根际促生菌对3种土传真菌病害病原的抑制作用[J]. 微生物学通报, 2014, 41(11) : 2293–2300. |
| [17] | García-Gutiérrez L, Romero D, Zeriouh H, et al. Isolation and selection of plant growth-promoting rhizobacteria as inducers of systemic resistance in melon[J]. Plant and Soil, 2012, 358(1/2) : 201–212. |
| [18] | Han HW, Sun LN, Yao T, et al. Effects of bio-fertilizers with different PGPR strain combinations on yield and quality of alfalfa[J]. Acta Prataculturae Sinica, 2013, 22(5) : 104–112. (in Chinese) 韩华雯, 孙丽娜, 姚拓, 等. 不同促生菌株组合对紫花苜蓿产量和品质的影响[J]. 草业学报, 2013, 22(5) : 104–112. DOI:10.11686/cyxb20130512 |
| [19] | Yang M, Chen LR, Wang JY, et al. Effect of nitrogen on root growth and yield formation of rape[J]. Acta Agriculturae Boreali-occidentalis Sinica, 2010, 19(4) : 66–69. (in Chinese) 杨明, 陈历儒, 王继玥, 等. 氮素对油菜根系生长和产量形成的影响[J]. 西北农业学报, 2010, 19(4) : 66–69. |
| [20] | Xiang XY, Liu Q, Rong XM, et al. Effects of different combined application of organic manures and inorganic fertilizer on yield and N use efficiency of double-rice[J]. Journal of Hunan Agricultural University (Natural Sciences), 2014, 40(1) : 72–77. (in Chinese) 向秀媛, 刘强, 荣湘民, 等. 有机肥和无机肥配施对双季稻产量及氮肥利用率的影响[J]. 湖南农业大学学报:自然科学版, 2014, 40(1) : 72–77. |
| [21] | Wang Q, Zhang LX, Lü YH, et al. Effects of application of Chinese milk vetch and fertilizer on rice yield and soil nutrient content[J]. Pratacultural Science, 2012, 29(1) : 92–96. (in Chinese) 王琴, 张丽霞, 吕玉虎, 等. 紫云英与化肥配施对水稻产量和土壤养分含量的影响[J]. 草业科学, 2012, 29(1) : 92–96. |
| [22] | Zhang JD, Bao XG, Hu ZQ, et al. Effect of combined application of green manure and chemical fertilizer on wheat yield and soil fertility[J]. Agricultural Research in the Arid Areas, 2012, 29(6) : 125–129. (in Chinese) 张久东, 包兴国, 胡志桥, 等. 绿肥与化肥配施对小麦产量和土壤肥力的影响[J]. 干旱地区农业研究, 2012, 29(6) : 125–129. |
 2017, Vol. 44
2017, Vol. 44