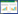扩展功能
文章信息
- 张梦君, 黎继烈, 申爱荣, 谭石勇, 严准, 薛召东, 谈泰猛, 曾粮斌
- ZHANG Meng-jun, LI Ji-lie, SHEN Ai-rong, TAN Shi-yong, YAN Zhun, XUE Zhao-dong, TAN Tai-meng, ZENG Liang-bin
- 亚麻立枯病拮抗菌的筛选、生防效果及发酵条件优化
- Screening, biocontrol effect and optimization of fermentation conditions of an antagonistic bacteria against Flax Rhizoctonia solani
- 微生物学通报, 2017, 44(5): 1099-1107
- Microbiology China, 2017, 44(5): 1099-1107
- DOI: 10.13344/j.microbiol.china.160479
-
文章历史
- 收稿日期: 2016-06-27
- 接受日期: 2016-09-20
- 优先数字出版日期(www.cnki.net): 2016-09-28
2. 中国农业科学院麻类研究所 湖南 长沙 410205;
3. 农业部植物营养与生物肥料重点实验室 湖南 长沙 410205
2. Institute of Bast Fiber Crops, Chinese Academy of Agricultural Sciences, Changsha, Hunan 410205, China;
3. Key Laboratory of Plant Nutrition and Biological Fertilizer, Ministry of Agriculture, Changsha, Hunan 410205, China
亚麻(Linum usitatissimum L.)是一种重要的经济作物,其亚麻纤维被广泛地应用于纺织、造纸产业,亚麻种子可以生产亚麻籽油,营养丰富[1-2]。亚麻立枯病是由立枯丝核菌(Rhizoctonia solani)引起的一种毁灭性的土传病害,主要危害幼苗茎基部或地下根部,导致幼苗大面积猝倒、死苗,造成巨大的经济损失[3-4]。亚麻立枯病的防治目前主要是采用轮作、土壤消毒以及使用化学药剂,但由于立枯丝核菌可在土壤中存活很多年,且长期使用化学药剂会提高病菌抗药性,所以并不能有效地防治亚麻立枯病[5-6]。更为严重的是,长期地使用化学药剂会威胁人类健康,造成环境污染等问题[4]。因此,发展一种有效、绿色、安全地防治亚麻立枯病的新方法是迫切重要的。
利用有益微生物生物防治土传病害具有对人畜安全无毒、无残留、不污染环境以及不会使病原菌产生抗药性等特点,越来越受到人们的重视[7-9]。许多生防菌已经被研究表明能够有效地抑制立枯丝核菌的生长,包括芽孢杆菌(Bacillus spp.)、木霉菌(Trichoderma sp.)、放线菌(Actinomycetes sp.)、青霉菌(Penicillium sp.)、假单胞菌(Pseudomonas spp.)、沙雷氏菌(Serratia spp.)和类芽孢杆菌(Paenibacillus spp.)[10-16]。
本研究从湖南沅江市亚麻立枯发病区健康亚麻植株的根际土壤中,分离出一株对亚麻立枯病菌具有显著拮抗作用的细菌,对其进行形态学、生理生化特征、分子鉴定及抗菌谱测定,并进一步优化了其产生抑菌活性物质的发酵条件,以期为利用拮抗菌进行亚麻立枯病的生物防治奠定基础。
1 材料与方法 1.1 材料 1.1.1 供试病原真菌: 亚麻立枯病菌(R. solani),用于筛选亚麻立枯病原拮抗菌;辣椒疫病病菌(Phytophthora capsici)、亚麻炭疽病菌(Colletotrichum lini)、油茶炭疽病菌(Colletotrichum gloeosporioides)、马铃薯立枯病菌(Rhizoctonia solani)、黄瓜枯萎病菌(Fusarium oxysporum sp. cucumebrium Owen)、油菜菌核病菌(Sclerotinia sclerotiorum)、水稻纹枯病菌(Rhizoctonia solani),用于测定拮抗菌的抑菌谱,均为本实验室分离、鉴定并保存。 1.1.2 培养基: NA培养基[17]用于细菌的分离、培养以及发酵种子液的制备;PDA培养基[17]用于拮抗菌的筛选以及打孔法测定无菌发酵液的抑菌活性;发酵基础培养基(g/L):葡萄糖20.0,牛肉膏10.0,蛋白胨10.0,NaCl 5.0,pH 7.0,用于拮抗菌后续胞外抗菌物质的发酵优化。 1.1.3 主要试剂和仪器: 细菌DNA提取试剂盒、DNA marker、dNTPs、DNA聚合酶等购自宝生物工程(大连)有限公司;其余均为国产分析纯。电泳仪购自北京六一仪器厂;PCR仪购自美国ABI公司;恒温摇床购自天津欧诺仪器仪表有限公司;紫外可见分光光度计购自上海光谱仪器有限公司。 1.2 拮抗菌的分离及筛选从湖南沅江市亚麻立枯发病区收集健康亚麻植株根际土壤样品,取土样5 g置于45 mL的无菌水中,涡旋振荡至悬浮均匀。悬浮液分别稀释成10-5、10-6、10-7系列浓度梯度,然后分别吸取100µL悬浮液涂布至NA平板上,每个浓度重复3次。将平板置于28 ℃下培养36 h,挑选形态各异的菌落进行划线纯化,编号并保存于4℃。
采用对峙培养法[18],将直径为5 mm的亚麻立枯病菌菌块接种于
以候选拮抗菌为研究对象,方法同1.2。靶标菌为辣椒疫病病菌、亚麻炭疽病原菌、油茶炭疽病原菌、马铃薯立枯病原菌、黄瓜枯萎病原菌、油菜菌核病原菌、水稻纹枯病原菌,以不接种细菌的平板为对照,每个处理重复3次。待对照组菌落长满全皿时,测量每个病原菌的抑菌圈直径,获得拮抗菌抑菌谱。
1.4 候选拮抗菌株的菌种鉴定 1.4.1 形态学观察: 将供试菌株划线接种至NA平板上,30℃培养24 h,观察菌落生长形态并进行常规的革兰氏及芽孢染色。 1.4.2 生理生化鉴定: 参照《伯杰细菌鉴定手册》(第9版)对菌株进行生理生化鉴定。 1.4.3 16S rRNA基因序列分析: 采用细菌DNA提取试剂盒提取供试菌株DNA;利用通用引物B27F (5′-AGAGTTTGATCCTGGCTCAG-3′)和U1492R (5′-GGTTACCTTGTTACGACTT-3′)扩增细菌16S rRNA基因;PCR反应体系(50 μL)为:10×PCR buffer 5 μL,DNA模板1 μL,dNTPs(2.5 mmol/L) 4 μL,MgCl2 (25 mmol/L) 3 μL,引物(1 mmol/L)各1 μL,Taq DNA聚合酶0.5 μL,ddH2O 34.5 μL;反应条件为:94 ℃ 5 min;94 ℃ 30 s,53 ℃ 30 s,72 ℃ 1 min,30个循环;4 ℃保存。扩增产物由生工生物工程(上海)股份有限公司测序,将测定的序列在GenBank中进行BLAST相似性比对(available at: http://blast.ncbi.nlm.nih.gov/Blast.cgi),最后用MEGA 6.0的Neighbor-Joining构建系统发育树,确定该菌株的系统发育学地位。 1.5 拮抗菌温室抗病实验供试亚麻种子为中亚2号,为本实验室前期保存及备用。对种子进行表面消毒、恒温暗光催芽处理。基质为市售营养土,使用前先进行两次灭菌处理,然后拌入亚麻立枯病原菌菌液,使得病原菌菌液浓度达105CFU/g。实验共设3个处理,分别为施加HXP-5菌株菌液,浓度达108CFU/g (T),施加等量无菌培养液(CK2) 以及施加等量无菌水(CK1)。每个处理设置3钵,每钵接种50粒出芽亚麻种子。培养条件:温度为22±1 ℃,光照强度为12 000 lx,光周期L׃D=14׃10,RH=90%±10%。每隔2 d每钵施加10 mL营养液,以保证基质较为湿润,亚麻正常生长。待CK1处理组发病率达60%以上时,实验结束并进行抗病效果统计调查。
发病率(%)=发病株数/调查总株数×100;
防治效果(%)=(1-处理组发病株率/对照组发病株率)×100。
1.6 拮抗菌的发酵优化 1.6.1 发酵优化结果评价: 以亚麻立枯病原菌为靶标菌,采用打孔法检测供试菌无菌发酵液的抑菌活性以及利用分光光度计测定发酵液在波长600 nm下的吸光度值,每个处理重复3次。 1.6.2 单因素筛选最优碳源、氮源: 对发酵培养基碳源、氮源进行单因素实验,碳源种类选择葡萄糖、蔗糖、果糖、乳糖、甘油和可溶性淀粉,浓度为2%;氮源种类选择胰蛋白胨、牛肉粉、酵母浸出粉、蛋白胨+牛肉粉(3:1)、蛋白胨+酵母浸出粉(3:1)、黄豆粉、硝酸铵,浓度为1%。接种量为2%,将种子液接入装有50 mL相应培养基的250 mL摇瓶中,28 ℃、180 r/min培养48 h,每处理重复3次。 1.6.3 均匀设计实验: 选择最优碳源、氮源、NaCl、时间、温度、转速、装液量和接种量作为自变量,无菌发酵液抑菌圈直径作为因变量利用DPS实验设计与数据处理软件设计8因素5水平均匀设计表。保持培养条件不变的情况下,按照均匀设计表进行实验,并用该软件处理分析数据,得出最佳组合。最后对上述实验得出的结果进行验证实验,检测模型及结果的准确性。 2 结果与分析 2.1 拮抗菌的分离和筛选从湖南沅江市亚麻立枯发病区健康亚麻植株的根际土壤中共分离筛选到13株对亚麻立枯病原菌有拮抗效果的细菌。其中,菌株HXP-5对病菌的拮抗能力最强,抑菌圈直径达到21.6 mm (图 1)。因此,选择菌株HXP-5用于进一步的研究。
|
| 图 1 菌株HXP-5对亚麻立枯病原菌的拮抗作用 Figure 1 Antagonistic effect of HXP-5 against Rhizoctonia solani |
|
|
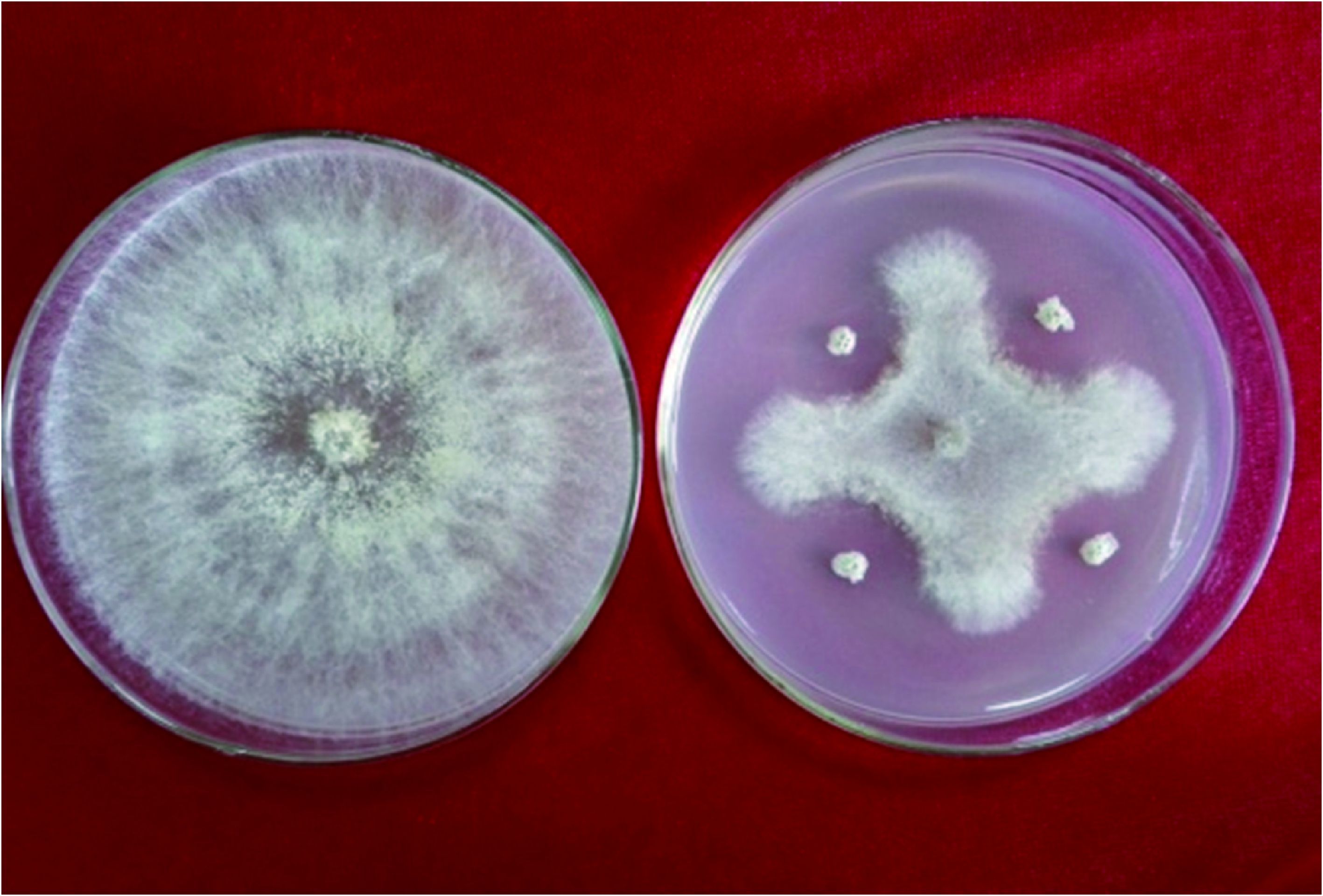
从表 1可以看出,菌株HXP-5对几种供试病原真菌均显示出较强的抑制作用。其中,对辣椒疫病病菌抑制作用最强,抑菌圈直径为23.4 mm;对黄瓜枯萎病原菌抑制作用最弱,但抑菌圈直径也达到了14.4 mm。抑菌效果见图 2,说明菌株HXP-5可高效广谱地拮抗病原真菌。
| 病原真菌 Phytopathogens | 抑菌圈直径 Diameter of inhibition zone (mm) |
| Rhizoctonia solani Kuhn (Linum usitatissimum L.) | 21.6±0.31 b |
| Colletotrichum lini | 17.5±0.33 c |
| Fusarium oxysporum sp. cucumebrium Owen | 14.4±0.18 d |
| Rhizoctonia solani Kuhn (Solanum tuberosum L.) | 20.0±0.82 b |
| Rhizoctonia solani Kuhn (Oryza sativa L.) | 14.8±0.37 d |
| Phytophthora capsici | 23.4±0.32 a |
| Colletotrichum gloeosporioides | 22.3±0.41 a |
| Sclerotinia sclerotiorum | 20.3±0.80 b |
| 注:不同小写字母表示菌株HXP-5对病原真菌之间拮抗作用差异显著(P < 0.05). Note: Values with different letters show significant differences between antagonistic effects of HXP-5 against the phytopathogens at 0.05 level. | |
|
| 图 2 菌株HXP-5对植物病原真菌的拮抗作用 Figure 2 Antagonistic effect of HXP-5 against the phytopathogens 注:A:亚麻立枯病原菌;B:亚麻炭疽病原菌;C:黄瓜枯萎病原菌;D:马铃薯立枯病原菌;E:水稻纹枯病原菌;F:辣椒疫病病原菌;G:油茶炭疽病原菌;H:油菜菌核病原菌. Note: A: Rhizoctonia solani Kuhn (Linum usitatissimum L.); B: Colletotrichum lini; C: Fusarium oxysporum sp. cucumebrium Owen; D: Rhizoctonia solani Kuhn (Solanum tuberosum L.); E: Rhizoctonia solani Kuhn (Oryza sativa L.); F: Phytophthora capsici; G: Colletotrichum gloeosporioides; H: Sclerotinia sclerotiorum. |
|
|
|
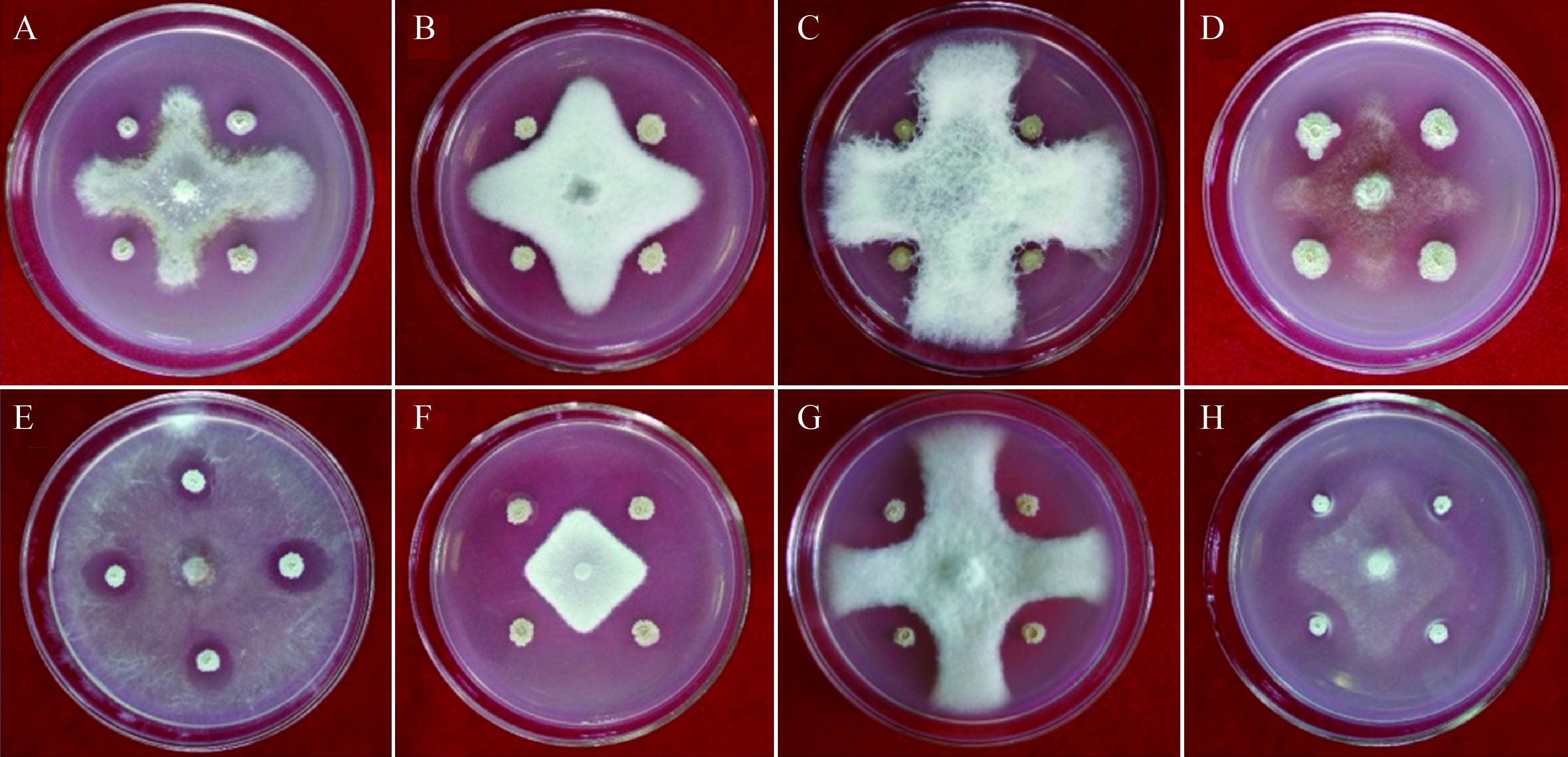
| 图 3 菌株HXP-5的形态学特征 Figure 3 Morphological characteristics of strain HXP-5 注:A:HXP-5菌落形态图;B:HXP-5革兰氏染色图;C:HXP-5芽孢染色图. Note: A: Colony morphology of strain HXP-5; B: Gram-staining of strain HXP-5; C: spore staining of strain HXP-5. |
|
|
| 鉴定试验 Tests | 实验结果 Results |
| Catalyst | + |
| Oxidase | + |
| Hydrolysis of starch | + |
| MR | - |
| VP | + |
| Gelatin liquefaction | + |
| Nitrate reduction | + |
| Glucose fermentation | + |
| H2S production | + |
| Citrate utilization | - |
| Lecithin enzyme activity | + |
| Malonate utilization | + |
| Cellulose decomposition | + |
| Galactose utilization | + |
| Arabinose utilization | + |
| Mannose utilization | + |
| D-fructose utilization | + |
| D-xylose utilization | + |
| Note: +: positive reaction; -: negative reaction. | |
|
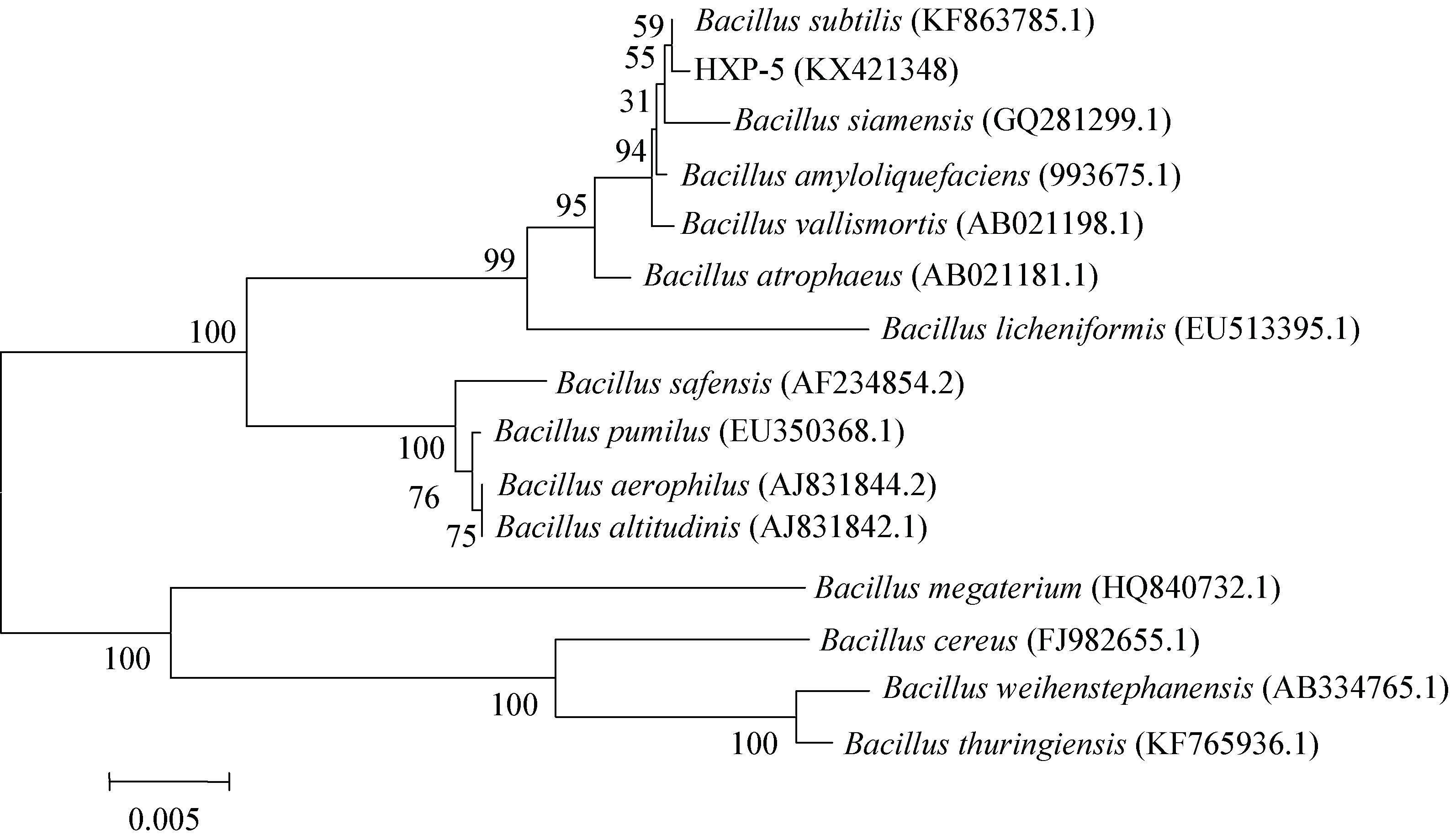
| 图 4 基于16S rRNA基因序列相似性构建的菌株HXP-5的系统发育树 Figure 4 Phylogenetic tree of strain HXP-5 and its related bacteria based on 16S rRNA gene sequences 注:参与比对序列的GenBank登录号列于括号中,分支处标注有自展值,标尺所示长度为0.005核苷酸置换率. Note: The GenBank accession numbers of aligned sequences are shown in the brackets. The bootstrap values are shown at the node. Bar 0.005 means the nucleotide substitution rate of 0.005. |
|
|
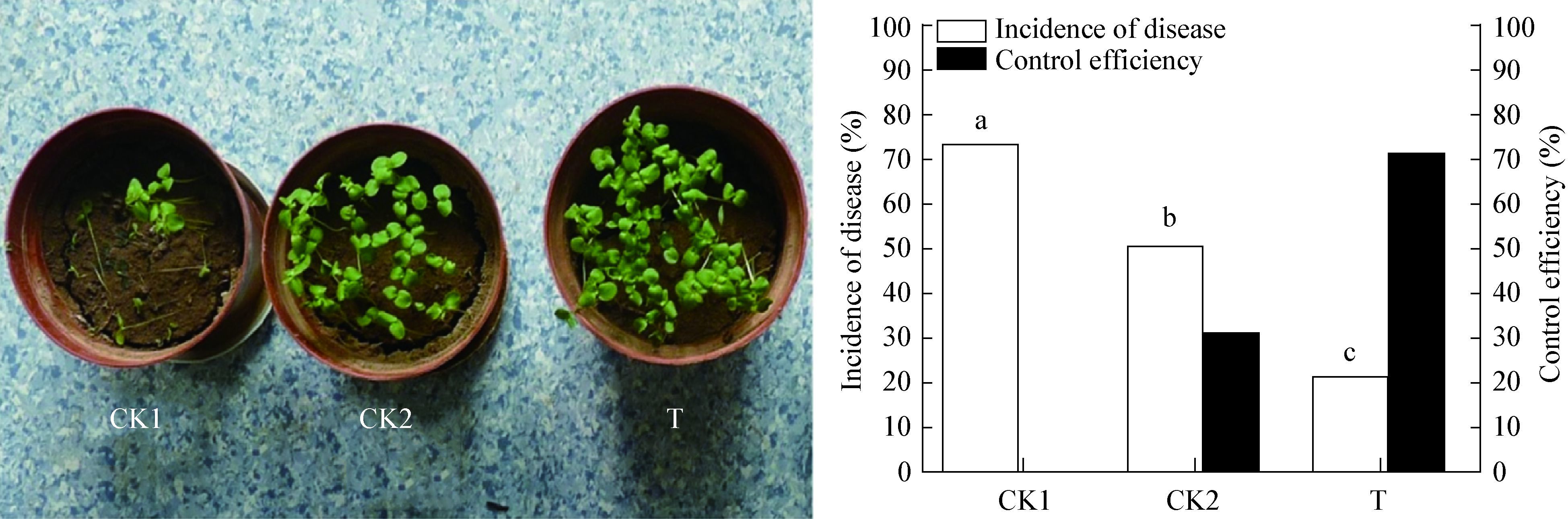
温室抗病实验结果表明枯草芽孢杆菌HXP-5在温室条件下能有效地防治亚麻立枯病的发生。如图 5所示,温室培养15 d后,对照组CK1和CK2均出现大面积的幼苗猝倒、死苗症状,CK1的发病率达到73.56%,CK2也达到了50.73%,而施加了HXP-5菌液处理组的发病率仅为21.17%,远低于对照组。以CK1作为对照,CK2和T处理组的防治效果分别达到31.04%和71.22%,进一步表明了拮抗菌HXP-5具有较强的生防潜力。
|
| 图 5 拮抗菌HXP-5对亚麻立枯病的生防效果 Figure 5 Biocontrol effect of antagonistic bacteria HXP-5 against Flax Rhizoctonia solani |
|
|
|
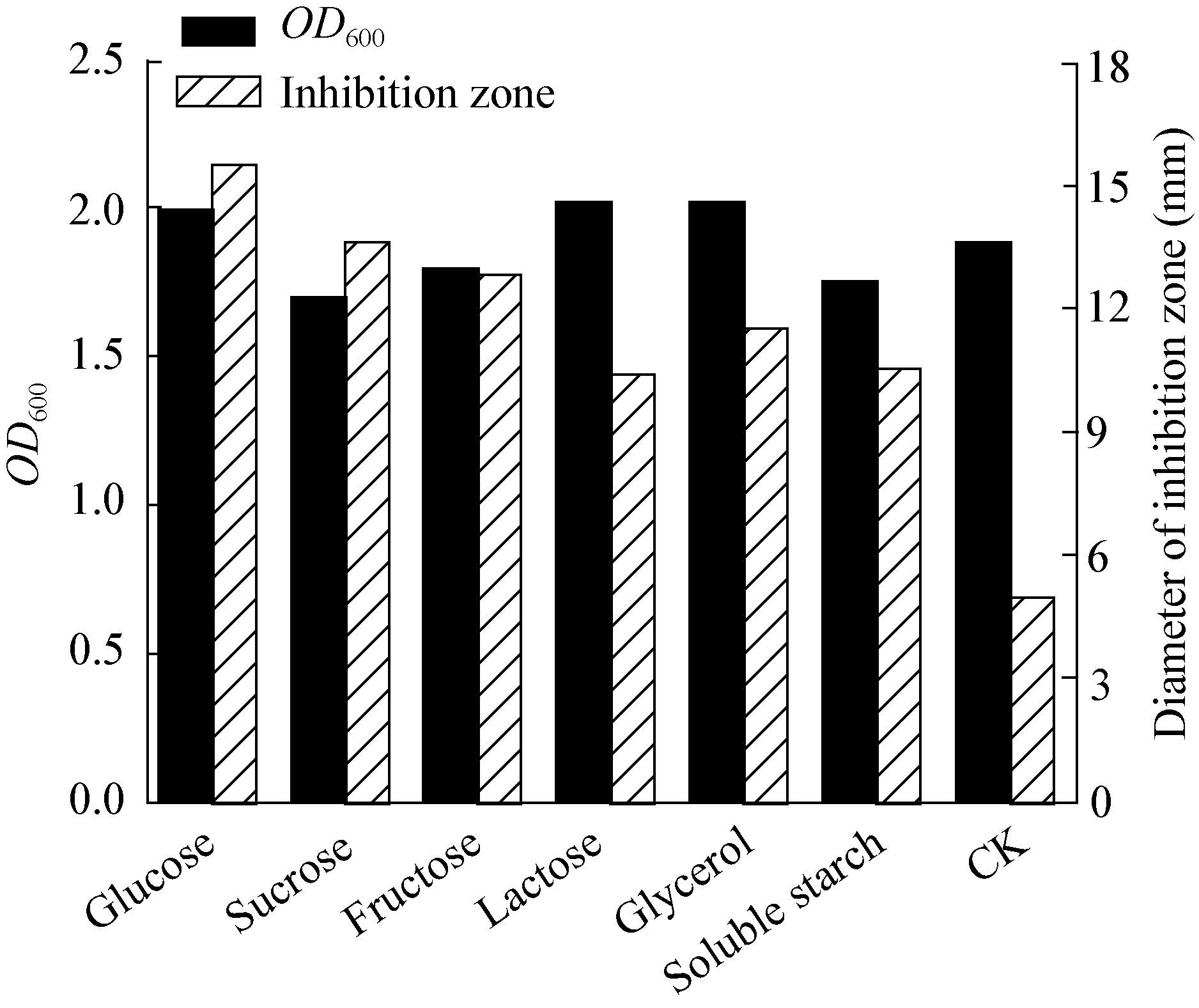
| 图 6 碳源对菌株生长量和抑菌活性物质产生的影响 Figure 6 Effect of carbon source on growth and antagonistic material |
|
|

|
| 图 7 氮源对菌株生长量和抑菌活性物质产生的影响 Figure 7 Effect nitrogen source on growth and antagonistic material |
|
|
| Test number | X1 | X2 | X3 | X4 | X5 | X6 | X7 | X8 | Y |
| N1 | 2.5 | 0.50 | 0.250 | 36 | 32 | 210 | 40 | 4.0 | 11.6 |
| N2 | 2.0 | 1.00 | 0.750 | 72 | 25 | 120 | 100 | 6.0 | 15.5 |
| N3 | 1.0 | 0.25 | 0.125 | 48 | 28 | 90 | 80 | 1.0 | 14.8 |
| N4 | 0.5 | 1.50 | 0.500 | 24 | 22 | 150 | 20 | 2.0 | 5.0 |
| N5 | 1.5 | 2.00 | 1.000 | 60 | 37 | 180 | 60 | 0.5 | 9.9 |
| 注:X1:碳源(%);X2:氮源(%);X3:NaCl (%);X4:时间(h);X5:温度(℃);X6:转速(r/min);X7:装液量(mL);X8:接种量(%);Y:抑菌圈直径(mm). Note: X1: Carbon source (%); X2: Nitrogen source (%); X3: NaCl (%); X4: Time (h); X5: Temperature (℃); X6: Rotational speed (r/min); X7: Liquid volume (mL); X8: Inoculation amount (%); Y: Diameter of inhibition zone (mm). | |||||||||
|
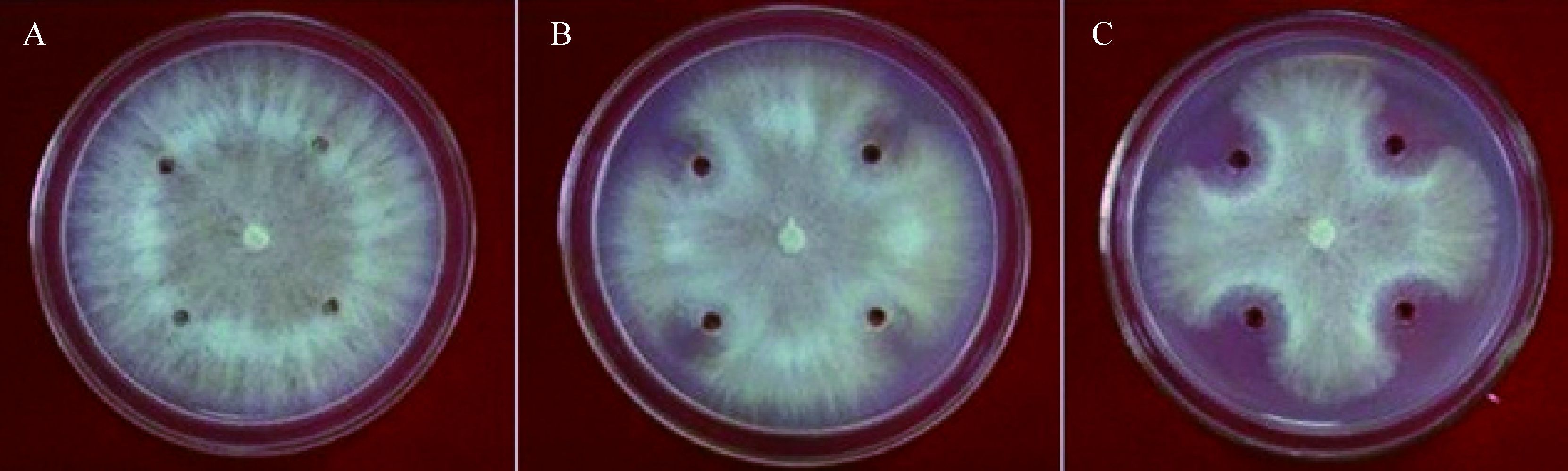
| 图 8 无菌发酵液对亚麻立枯病原菌的抑制作用 Figure 8 Antagonistic effect of cell-free fermentation broth against Rhizoctonia solani 注:A:无菌培养液;B:优化前无菌发酵液;C:优化后无菌发酵液. Note: A: cell-free culture fluid; B: cell-free fermentation broth before optimization; C: cell-free fermentation broth after optimization. |
|
|
枯草芽孢杆菌(Bacillus subtilis)是一种嗜温性的好氧产芽孢的革兰氏阳性杆状细菌,对人畜无毒无害,对环境无污染,具有显著的抗菌活性和极强的抗逆能力,是一种理想的生防微生物[19-20]。国内外已有许多研究报道生防枯草芽孢杆菌能有效地防治多种植物病害。Ma等[21]研究表明枯草芽孢杆菌B99-2制成的微型胶囊生防产品可有效地防治番茄立枯病。Park等[22]研究也发现,枯草芽孢杆菌BS07能有效地降低辣椒炭疽病和辣椒软腐病的发病率。喻国辉等[23]进行田间防治实验发现枯草芽孢杆菌TR21对巴西蕉枯萎病的防治连续两年分别达到63.23%和73.90%。
本研究从湖南沅江市亚麻立枯发病区健康亚麻植株的根际土壤中,分离出13株对亚麻立枯病原菌有拮抗效果的细菌。其中,菌株HXP-5对病菌的拮抗能力最强,抑菌圈直径达到21.6 mm。综合HXP-5菌株形态学特征、生理生化特性以及基于16S rRNA基因的系统发育分析结果,将HXP-5菌株鉴定为枯草芽孢杆菌。为了确定菌株HXP-5的生防潜力,本研究检测了其对几种植物真菌病原菌的拮抗效果,实验结果表明菌株HXP-5均能有效地抑制几种植物真菌病原菌的生长,具有高效广谱的拮抗能力。温室防病实验结果也进一步表明菌株HXP-5能有效地防治亚麻立枯病的发生,其防治效果达到71.22%,说明枯草芽孢杆菌HXP-5具有较好的应用前景。
生防菌发挥生物防治作用的重要物质基础是抑菌活性代谢产物,其产量的高低直接影响菌株的生防效果,而微生物代谢产物的类型和产量与其培养条件密切相关。本研究采用单因素实验和均匀设计实验进行发酵条件的优化,确定了菌株HXP-5的发酵条件为葡萄糖2.3%,胰蛋白胨+酵母粉(3:1) 0.25%,NaCl 0.18%,发酵时间72 h,发酵温度27 ℃,转速210 r/min,250 mL摇瓶装液100 mL,接种量1.7%,其抑菌圈直径可达19.94 mm,为其工业化生产和大面积推广应用提供理论依据。
综上所述,亚麻立枯病拮抗菌HXP-5被鉴定为枯草芽孢杆菌,且具有高效广谱的拮抗能力,在温室条件下能有效地防治亚麻立枯病的发生,通过发酵条件优化,显著地提高了拮抗菌HXP-5无菌发酵液的抑菌能力。后续工作将在此优化基础上,进一步地研究其拮抗作用机制以及分析鉴定其抗菌物质的有效成分。同时,也将进行大田实验,确定其田间防治效果并进行相应生物防治产品的开发及应用。
| [1] | Belkadhi A, de Haro A, Obregon S, et al. Exogenous salicylic acid protects phospholipids against cadmium stress in flax (Linum usitatissimum L.)[J]. Ecotoxicology and Environmental Safety, 2015, 120 : 102–109. DOI:10.1016/j.ecoenv.2015.05.028 |
| [2] | Kreitschitz A, Kovalev A, Gorb SN. Slipping vs sticking: Water-dependent adhesive and frictional properties of Linum usitatissimum L. seed mucilaginous envelope and its biological significance[J]. Acta Biomaterialia, 2015, 17 : 152–159. DOI:10.1016/j.actbio.2015.01.042 |
| [3] | Zhu X, Yang GA, Wang XM, et al. Control efficacy of several agrochemicals to flax Rhizoctonia solani in field[J]. Plant Fiber Sciences in China, 2010, 32(6) : 323–326. (in Chinese) 朱炫, 羊国安, 王学明, 等. 几种药剂对冬季亚麻立枯病的防治效果[J]. 中国麻业科学, 2010, 32(6) : 323–326. |
| [4] | Goudjal Y, Toumatia O, Yekkour A, et al. Biocontrol of Rhizoctonia solani damping-off and promotion of tomato plant growth by endophytic actinomycetes isolated from native plants of Algerian Sahara[J]. Microbiological Research, 2014, 169(1) : 59–65. DOI:10.1016/j.micres.2013.06.014 |
| [5] | Postma J, Schilder MT. Enhancement of soil suppressiveness against Rhizoctonia solani in sugar beet by organic amendments[J]. Applied Soil Ecology, 2015, 94 : 72–79. DOI:10.1016/j.apsoil.2015.05.002 |
| [6] | Huang XQ, Zhang N, Yong XY, et al. Biocontrol of Rhizoctonia solani damping-off disease in cucumber with Bacillus pumilus SQR-N43[J]. Microbiological Research, 2011, 167(3) : 135–143. |
| [7] | Liu YX, Shi JX, Feng YG, et al. Tobacco bacterial wilt can be biologically controlled by the application of antagonistic strains in combination with organic fertilizer[J]. Biology and Fertility of Soils, 2013, 49(4) : 447–464. DOI:10.1007/s00374-012-0740-z |
| [8] | Li SB, Fang M, Zhou RC, et al. Characterization and evaluation of the endophyte Bacillus B014 as a potential biocontrol agent for the control of Xanthomon asaxonopodis pv. Dieffenbachiae induced blight of Anthurium[J]. Biological Control, 2012, 63(1) : 9–16. DOI:10.1016/j.biocontrol.2012.06.002 |
| [9] | Lang JJ, Hu J, Ran W, et al. Control of cotton Verticillium wilt and fungal diversity of rhizosphere soils by bio-organic fertilizer[J]. Biology and Fertility of Soils, 2012, 48(2) : 191–203. DOI:10.1007/s00374-011-0617-6 |
| [10] | Khedher SB, Kilani-Feki O, Dammak M, et al. Efficacy of Bacillus subtilis V26 as a biological control agent against Rhizoctonia solani on potato[J]. Comptes Rendus Biologies, 2015, 338(12) : 784–792. DOI:10.1016/j.crvi.2015.09.005 |
| [11] | Daryaei A, Jones EE, Glare TR, et al. pH and water activity in culture media affect biological control activity of Trichoderma atroviride against Rhizoctonia solani[J]. Biological Control, 2016, 92 : 24–30. DOI:10.1016/j.biocontrol.2015.09.001 |
| [12] | Ascencion LC, Liang WJ, Yen TB. Control of Rhizoctonia solani damping-off disease after soil amendment with dry tissues of Brassica results from increase in Actinomycetes population[J]. Biological Control, 2015, 82 : 21–30. DOI:10.1016/j.biocontrol.2014.11.010 |
| [13] | Brewer MT, Larkin RP. Efficacy of several potential biocontrol organisms against Rhizoctonia solani on potato[J]. Crop Protection, 2005, 24(11) : 939–950. DOI:10.1016/j.cropro.2005.01.012 |
| [14] | Bautista G, Mendoza H, Uribe D. Biocontrol of Rhizoctonia solani in native potato (Solanum phureja) plants using native Pseudomonas fluorescens[J]. Acta Biológica Colombiana, 2007, 20(1) : 19–32. |
| [15] | Youssef SA, Tartoura KA, Abdelraouf GA. Evaluation of Trichoderma harzianum and Serratia proteamaculans effect on disease suppression, stimulation of ROS-scavenging enzymes and improving tomato growth infected by Rhizoctonia solani[J]. Biological Control, 2016, 100 : 79–86. DOI:10.1016/j.biocontrol.2016.06.001 |
| [16] | Peng ZH. Screening of biocontrol agent against to potato black scurf and its antibacterial mechanism[D]. Hohhot: Master's Thesis of Inner Mongolia Agricultural University, 2012 (in Chinese) 彭振红. 马铃薯黑痣病生防菌的筛选及抑菌机理的初步研究[D]. 呼和浩特: 内蒙古农业大学硕士学位论文, 2012 |
| [17] | Yang G. Microbiology Experiment Course[M]. Beijing: Science Press, 2004: 143 -150. (in Chinese) 杨革. 微生物学实验教程[M]. 北京: 科学出版社, 2004: 143 -150. |
| [18] | Ren XL, Zhang N, Gao MH, et al. Biological control of tobacco black shank and colonization of tobacco roots by a Paenibacillus polymyxa strain C5[J]. Biology and Fertility of Soils, 2012, 48(6) : 613–620. DOI:10.1007/s00374-011-0651-4 |
| [19] | Abriouel H, Franz CMAP, Omar NB, et al. Diversity and applications of Bacillus bacteriocins[J]. FEMS Microbiology Reviews, 2011, 35(1) : 201–232. DOI:10.1111/j.1574-6976.2010.00244.x |
| [20] | Askari N, Jouzani GH, Mousivand M, et al. Evaluation of anti-phytoplasma properties of surfactin and tetracycline towards lime witches' broom disease using real-time PCR[J]. Journal of Microbiology and Biotechnology, 2011, 21(1) : 81–88. DOI:10.4014/jmb |
| [21] | Ma X, Wang XB, Cheng J, et al. Microencapsulation of Bacillus subtilis B99-2 and its biocontrol efficiency against Rhizoctonia solani in tomato[J]. Biological Control, 2015, 90 : 34–41. DOI:10.1016/j.biocontrol.2015.05.013 |
| [22] | Park JW, Balaraju K, Kim JW, et al. Systemic resistance and growth promotion of chili pepper induced by an antibiotic producing Bacillus vallismortis strain BS07[J]. Biological Control, 2013, 65(2) : 246–257. DOI:10.1016/j.biocontrol.2013.02.002 |
| [23] | Yu GH, Cheng P, Wang YL, et al. Control effect of Bacillus subtilis strain TR21 on panama disease of banana Brazil (Musa spp.) in fields[J]. Chinese Journal of Biological Control, 2010, 26(4) : 497–500. (in Chinese) 喻国辉, 程萍, 王燕鹂, 等. 枯草芽孢杆菌TR21田间防治巴西蕉枯萎病的效果[J]. 中国生物防治, 2010, 26(4) : 497–500. |
 2017, Vol. 44
2017, Vol. 44