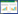扩展功能
文章信息
- 韩文杰, 苏航, Md AbuSaleh, 张培玉, 李福利, 吕明
- HAN Wen-Jie, SU Hang, Md Abu Saleh, ZHANG Pei-Yu, LI Fu-Li, LU Ming
- 热解纤维素菌属F32中乙酰木聚糖酯酶Axe7的表征
- Characterization of an acetyl xylan esterase Axe7 from Caldicellulosiruptor sp. F32
- 微生物学通报, 2017, 44(5): 1056-1064
- Microbiology China, 2017, 44(5): 1056-1064
- DOI: 10.13344/j.microbiol.china.160514
-
文章历史
- 收稿日期: 2016-07-15
- 接受日期: 2016-10-19
- 优先数字出版日期(www.cnki.net): 2016-11-03
2. 中国科学院青岛生物能源与过程研究所 山东 青岛 266101
2. Qingdao Institute of Bioenergy and Bioprocess Technology, CAS, Qingdao, Shandong 266101, China
农林业废弃物木质纤维素主要由纤维素、半纤维素、木质素三种高分子化合物组成。半纤维素是除纤维素以外含量最丰富的碳水化合物。在组成成分上,半纤维素主要是由半乳糖、葡萄糖、果糖、葡萄糖醛酸、木糖、阿拉伯糖等几种单糖构成。这些单糖以不同的组合形式构成了不同类型的结构(如木聚糖、木葡聚糖、葡糖醛酸木聚糖、阿拉伯糖基木聚糖、葡糖醛酸阿拉伯糖基木聚糖等),从而导致了植物结构的多样性(如硬木、软木、牧草等)。木聚糖作为大部分半纤维素的主干部分(Backbone),是含量最丰富的一种,木聚糖的结构强度较低,易在稀酸、稀碱等环境下水解,但由于木聚糖侧链上含有不同基团的取代基,如阿拉伯糖、O-乙酰基、阿魏酸和4-O-甲基葡萄糖醛酸等[1],对其完全降解需要多种酶的协同作用。目前,已报道的可降解半纤维素酶制剂主要有木聚糖酶、β-1, 4-木糖苷酶、乙酰木聚糖酯酶、阿拉伯呋喃糖苷酶和阿魏酸酯酶等[2]。
乙酰木聚糖酯酶(Acetyl xylan esterase,Axe,EC3.1.1.6) 能够水解乙酰化木聚糖中木糖残基C-2和C-3位的O-乙酰修饰基团[3]。硬木、谷物等植物中的木聚糖乙酰化程度较高,通常能达到总木聚糖的15%-25%[4],而在软木中较为少见。对于乙酰化程度较高的木聚糖底物,由于空间位阻效应,木聚糖酶的催化区域难以接近底物[5]。当添加乙酰木聚糖酯酶时,木聚糖或木寡糖上的乙酰基团可先被乙酰木聚糖酯酶水解,使木聚糖酶能够接近暴露的木聚糖或木寡糖,从而导致底物降解的速率明显提高[6]。因此,大多数乙酰木聚糖酯酶可与木聚糖酶进行协同作用,促进乙酰基木聚糖的水解[7]。在工业上,乙酰木聚糖酯酶对造纸业的生物漂白、饲料业的原料预处理、生物能源工业的生物质降解等方面有重要作用和广泛用途,因此不同来源的乙酰木聚糖酯酶逐渐被发现和表征。
酶制剂的工业化应用通常需要酶本身具有较好的稳定性(热稳定性和对化学试剂的稳定性),常温微生物来源的酶制剂往往热稳定性较差,因而工业化的潜力有限。本课题组在2013年首次报道了一株在高温生物堆肥中分离出的具有嗜高温厌氧特性的热解纤维素菌属细菌Caldicellulosiruptor sp. F32,该细菌在75-80 ℃下有较强的降解未经预处理的小麦、玉米等秸秆的能力[8]。通过对其基因组序列分析,发现有4个CE-4家族、1个CE-7家族、1个CE-9家族和1个CE-12家族的脂酶。根据CAZy网站(www.cazy.org)的功能性预测,CE-9家族和CE-12家族主要是以N-乙酰基葡萄糖胺-6磷酸盐和鼠李半乳糖醛酸聚糖为底物的脱乙酰脂酶,CE-4家族的作用底物通常以乙酰化壳聚糖为主。然而CE-7家族作用于乙酰化木聚糖,且对乙酰基存在位置没有特殊要求,工业化应用前景较广,因此在本研究课题中选择CE-7家族的乙酰木聚糖酯酶(Axe7) 作为研究对象。
1 材料与方法 1.1 菌株、载体、试剂、培养基及主要仪器热解纤维素菌属F32菌株由中国科学院青岛生物能源与过程研究所从生物堆肥中分离所得。大肠杆菌Trans1-T1和BL21(DE3)、表达载体pEASY-blunt-E2、DNA聚合酶2×EASYPfu SuperMix等试剂材料均购于北京全式金生物技术有限公司。4-甲基乙酸伞形酯(4-Methylumbelliferyl-acetate,4-MUA)购于Alfa Aesar公司;PCR引物合成与测序由青岛擎科梓熙生物技术有限公司完成。
LB培养基(g/L):胰蛋白胨10.0,酵母提取物5.0,NaCl 10.0。用1 mol/L的NaOH调节pH至7.0,定容至1 L,然后1×105Pa高压灭菌30 min。
主要仪器:Mastercycler梯度PCR仪,德国Eppendorf公司;Bio-Rad凝胶电泳仪及凝胶成像系统,美国伯乐公司;台式离心机1-14,德国Sigma公司;Ultrospec 2100 pro分光光度仪,美国通用电器公司;生化培养箱ZSD-1160,上海智城分析仪器制造有限公司。
1.2 目标基因的生物信息学分析利用RAST (Rapid annotation using subsystem technology)系统(http://rast.nmpdr.org/)对热解纤维素菌属F32的基因组序列进行注释分析[9],而氨基酸序列同源进化树则采用MEGA 5.0软件进行分析[10]。蛋白质结构预测则采用I-TASSER (http://zhanglab.ccmb.med.umich.edu/I-TASSER/)在线系统进行预测[11]。
1.3 表达载体的构建及转化子的表型鉴定根据热解纤维素菌属F32基因组中Axe7的序列合成表 1中引物。
| Primers | Sequences (5′→3′) |
| P1 (Axe7) | ATGGTATTTGATATGCCGCTTG |
| P2 (Axe7) | TCATTCTAACATCTCCATAAGATAC |
以热解纤维素菌属F32基因组为模板PCR扩增目的基因,50μL PCR扩增体系为:1μL 15 ng/μL基因组DNA,25μL 2×EASYPfu SuperMix,1 μL 10μmol/L正、反引物及22 μL灭菌超纯水。
PCR反应条件为:95 ℃ 5 min;94℃ 30 s,55℃ 30 s,72℃ 2 min,30个循环;72℃ 5 min。PCR产物与载体pEASY-blunt-E2连接,连接产物直接转化到大肠杆菌Trans1-T1进行质粒扩增。通过质粒的DNA测序确认构建正确的质粒,转化大肠杆菌BL21(DE3) 进行原核表达。
1.4 乙酰木聚糖脂酶Axe7的重组表达及提纯挑取阳性克隆接种至含100 mg/l Amp的LB培养基,培养至OD600值为0.6-0.8。加入IPTG (终浓度0.3 mmol/L)后,诱导表达5-6 h,离心收集菌体。诱导后的产物经过超声破碎和离心处理,得到含有目标蛋白的上清溶液。经过0.45 µm滤膜过滤后,利用镍离子亲和吸附层析柱(Ni-NTA)进行纯化,纯化后的蛋白经过SDS-PAGE以检验目标蛋白的纯度与分子量。
1.5 乙酰木聚糖酯酶活性测定乙酰木聚糖酶活性测定参照Shao等的方法[12],并稍作修改,以4-甲基乙酸伞形酯(4-MUA)为底物测定酶活力。以每分钟水解底物释放产生1 μmol 4-甲基伞形酮(4-Methylumbelliferyl,4-MU)的乙酰酯酶的量为1个酶活力单位。测定方法:在800 μL 50 mmol/L磷酸缓冲液(pH 7.0) 加入95 μL超纯水和100 μL 10 mmol/L 4-甲基乙酸伞形酯(溶于DMSO),放入分光光度计,在特定温度下的金属浴中预热5 min,加入5 μL酶液并迅速混匀,在354 nm光波长下连续测其开始反应30 s内的吸收值。
1.6 乙酰木聚糖酯酶酶学性质 1.6.1 最适pH与最适温度: 70℃条件下,分别以磷酸缓冲液和Tris盐酸缓冲液测定Axe7在不同pH条件下对底物4-甲基乙酸伞形酯的酶活,分析Axe7的最适pH。然后在最适pH条件下,分别测定60-100 ℃时乙酰木聚糖酯酶对底物4-甲基乙酸伞形酯的酶活,分析Axe7的最适温度。 1.6.2 热稳定性分析: 以4-甲基乙酸伞形酯(4-MUA)作为底物,在最适pH条件下的磷酸缓冲液中,利用不同温度对Axe7进行温育,测定不同温育时长Axe7的残余酶活。 1.6.3 K m和k cat等催化常数和酶动力学曲线: Axe7的米氏常数Km值和催化常数kcat值的测定采用GraphPad Prism软件计算。在最适条件下用等量的酯酶与不同浓度的底物反应20 s内生成的产物量计算出Km与Vmax,当底物浓度远大于酶浓度([E])后,根据公式kcat=Vmax/[E],计算得出kcat值。 1.7 催化位点的鉴定、突变体的制备实验利用I-TASSER在线分析软件和同源蛋白序列比对,找到Axe7中的催化活性位点。利用点突变技术设计引物(表 2),将目标氨基酸(第183位的丝氨酸、第227位的谷氨酸和第302位的组氨酸)分别替换为丙氨酸,并测定相关活性。
| Primers | Sequences (5′→3′) |
| P1 (S183A) | GCCGCAATGGGATTTGCACAAGGTGGTGGCTTG |
| P2 (S183A) | CAAGCCACCACCTTGTGCAAATCCCATTGCGGC |
| P1 (E227A) | CAAAGGATGCGTATGAAGCAATTAGAACATATTTCAG |
| P2 (E227A) | CTGAAATATGTTCTAATTGCTTCATACGCATCCTTTG |
| P1 (H302A) | TATCCTGACTTTGGAGCTGAACAGATTTTCTACTT |
| P2 (H302A) | AAGTAGAAAATCTGTTCAGCTCCAAAGTCAGGATA |
根据CAZy数据库(www.cazy.org)统计,截止目前共有671个CE-7家族脂酶的基因被发现,其中666个归类于细菌中,另有5个来自未被培养的微生物。针对Axe7进行氨基酸序列分析发现:理论分子量为36.58 kD,pI为5.03。利用基因组注释系统RAST筛选发现,Axe7与其它已注释基因(例如梭状芽胞杆菌属的Clostridium cellulolytic和芽孢杆菌属的Bacillus halodurans)存在于不同的基因簇中(图 1A)。采用GenBank上Blast程序进行搜索发现,Axe7与同属菌株的氨基酸同源相似性也不超过89%,而与其它种属来源CE7的相似性则普遍低于64% (数据未显示)。此外,运用MEGA 5.0软件进行蛋白多序列比对与一致性分析并构建系统进化树发现,Axe7与其它已被表征的乙酰木聚糖脂酶聚类于不同的分支(图 1B),因此揭示该酶可能具有独特的生物学和酶学意义。
|
| 图 1 Axe7脂酶的基本信息分析 Figure 1 Bioinformation of Axe7 注:A:基于RAST (Rapid annotation using subsystem technology)的基因组注释分析;B:利用MEGA 5.0进行的同源进化树分析;C:利用I-TASSER系统进行的结构预测. Note: A: RAST-based genome annotation analysis; B: Phylogenetic tree of Axe7 and other homologous by MEGA 5.0; C: Predicted structure of Axe7 by on-line tool 'I-TASSER'. |
|
|
以同源建模系统I-TASSER Serve对Axe7进行同源建模(图 1C),发现其与来自嗜热厌氧菌属JW/SL YS485 (Thermoanaerobacterium sp. JW/SL YS485) 的乙酰木聚糖酯酶序列相似性高达62.34%,因此,以其晶体结构(PDB ID号3FCY)为主要模板同源建模。如图 1C所示,该模型显示其结构带有12个α-螺旋环绕于9个β-折叠组成。
2.2 Axe7的质粒制备和蛋白表达纯化Axe7基因以热解纤维素菌F32基因组为模板,通过设计引物(表 1)进行目标基因扩增(图 2A)。随后,将目标基因连接到表达载体pEAZY-blunt-E2上,得到重组质粒pEAZY-Axe7。将测序正确的重组质粒转化大肠杆菌BL21(DE3),并利用镍柱进行纯化得到与预测蛋白分子量一致的目标蛋白(图 2B)。

|
| 图 2 Axe7脂酶目标基因的扩增和构建的表达质粒(A)及纯化后的重组蛋白(B) Figure 2 Target gene and constructed plasmid (A), and purified recombinant Axe7 in SDS-PAGE (B) |
|
|
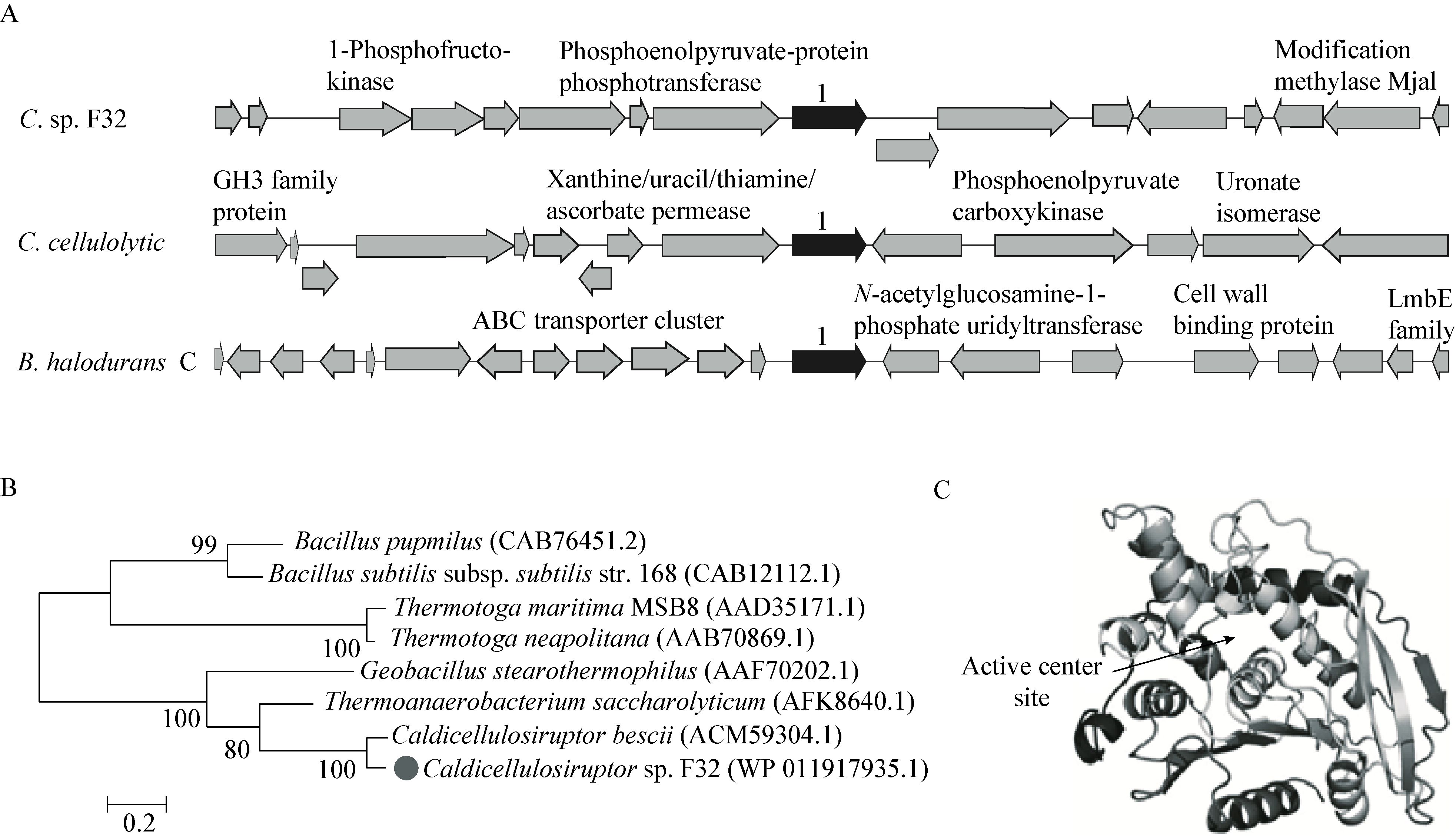
首先,对获得的Axe7蛋白进行最适pH和最适温度的测定。在70 ℃下,该酶的最适pH在6.5-7.0之间,而当pH小于6.0或者大于7.5时,Axe7的活性低于最高酶活(81.0±1.7 u/mg)的40% (图 3A)。随后,在最适pH 7.0的条件下测定Axe7的最适温度。结果显示,该酶的最适温度为85 ℃ (图 3B)。60 ℃时,Axe7的酶活依然为最适温度下的45%以上。
|
| 图 3 Axe7酶学表征 Figure 3 Enzymological characterization of Axe7 注:A:Axe7的最适pH;B:最适温度;C:热稳定性;D:动力学拟合曲线. Note: A: Optimum pH; B: Optimum temperature; C: Thermostability; D: Kinetic curve of Axe7. |
|
|
该酶的热稳定性实验结果如图 3C所示,Axe7在最适温度85 ℃下的酶活半衰期(Half-life)大于4 h,而温度在75 ℃时,其酶活半衰期则超过70 h,因此说明Axe7是高温下相当稳定的脂酶。此外,通过实验测定了该酶的酶动力学参数(图 3D),以4-甲基乙酸伞形酯为反应底物时,Axe7的Km和kcat值分别为0.39 mmol/L和66.95 s-1。通过比较来自不同细菌的同属CE7家族的酯酶,如表 3所示,Axe7对底物的亲和性较好,并且比酶活力较高。
| 菌名 Bacteria species |
最适pH optimum pH |
最适温度 optimum temperature (℃) |
Km (mmol/L) | kcat (s-1) | Specific activity (U/mg) |
| Bacillus pumilus PS213[13] | 8.0 | 55 | 1.54 (α-Naphthyl acetate) | - | 34.00±2.00 (4-MUA) |
| Bacillus subtilis subsp. subtilis str. 168[14] | - | - | - | - | 4.7 (pNP-acetate) |
| Thermotogamaritima MSB8[15] | 6.5 | 90 | 0.12±0.08 | 69.9 | 89.0 (pNP-acetate) |
| Caldicellulosiruptor sp. F32 | 6.5-7.0 | 85 | 0.39 | 66.9 | 81.0±1.7 (4-MUA) |
在反应体系中分别加入金属离子(Co2+、Fe3+、Mg2+、Ni2+、Mn2+、Zn2+、Ca2+,终浓度为1.5 mmol/L)、金属螯合剂EDTA以及变性剂(十二烷基磺酸钠,SDS,终浓度5 mmol/L),分别测定这些化学试剂对Axe7酶活的影响,结果如图 4所示,除镁离子(95.7±2.3)%和金属离子螯合剂EDTA (98.4±1.2)%对其酶活影响较小外,多数金属离子(1.5 mmol/L)对Axe7的酶活有一定的抑制作用,在(66.2±4.6)%-(77.2±4.8)%之间,而变性剂SDS则能显著抑制该酯酶活性( < 10%)。

|
| 图 4 不同金属阳离子、金属螯合剂EDTA及变性剂SDS对Axe7酶活力的影响 Figure 4 Effect of different metal ions, metal chelating agent (EDTA), and denaturant SDS on Axe7 activity |
|
|
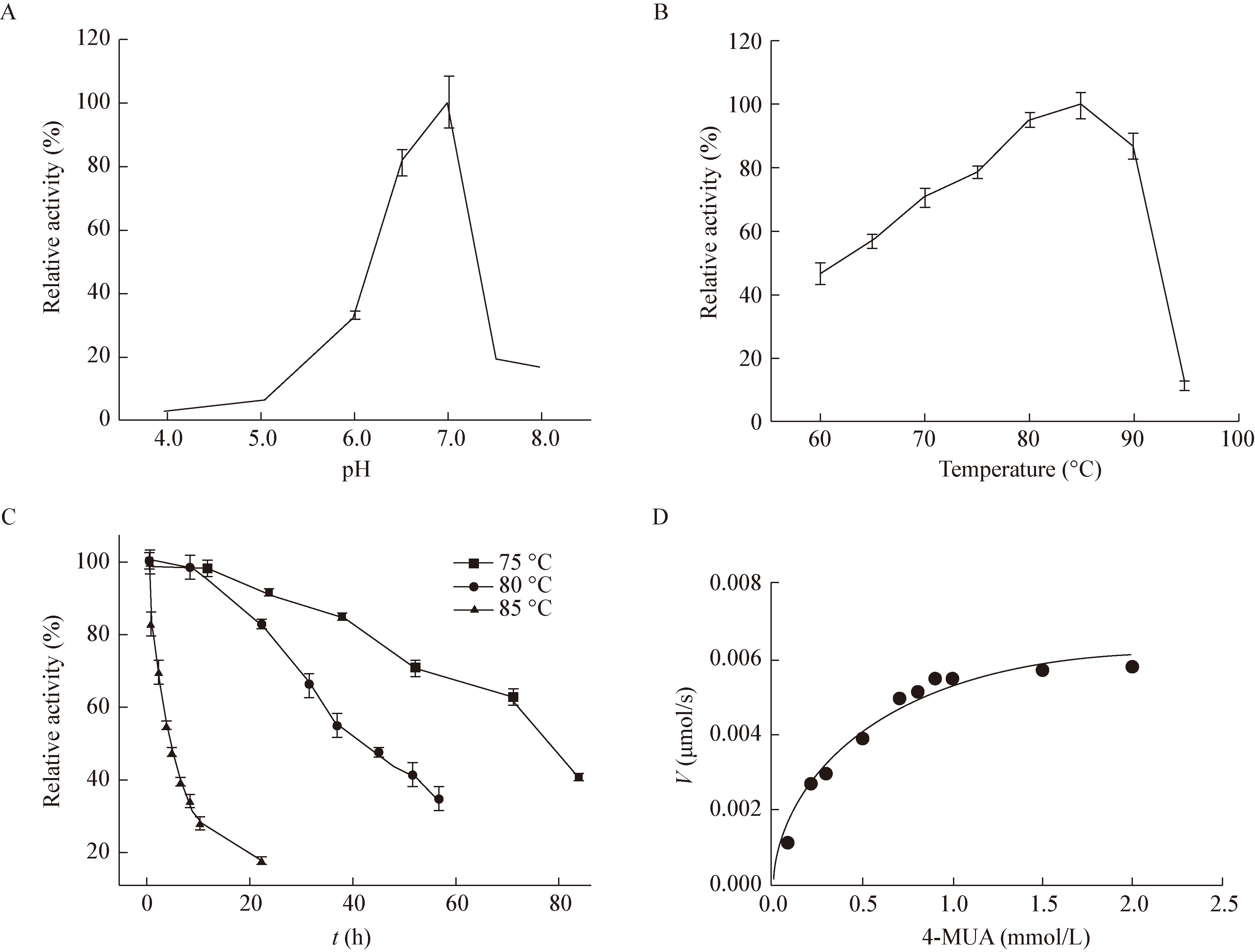
通过结构预测和分子对接软件分析发现(图 5A),Axe7酯酶中的保守氨基酸残基Ser183、Glu227、His302可以组成一个Ser/Glu/His的催化三联体(Catalytic triad),与之前报道的CE-7家族脂酶一致,其中Ser183作为亲核基团是该酶的活性催化位点。通过对上述3个位点进行点突变,将其分别突变为丙氨酸并测定突变体的活性,结果如图 5B所示,突变体均失去了对4-MUA的水解活性,进而证明预测结果的正确性。
|
| 图 5 Axe7活性位点的预测与鉴定 Figure 5 Identification of the active sites on Axe7 注:A:I-TASSER预测的活性位点;B:活性位点突变后酶活性对比. Note: A: Predicated catalytic sites of Axe7 by I-TASSER; B: Specific activities of Axe7 after mutation. |
|
|
植物细胞壁中木质纤维素的降解不仅取决于纤维素酶、半纤维素酶的作用,也取决于乙酰木聚糖酯酶(Axe)、呋喃型阿拉伯糖苷酶等其它侧链降解酶的协同效应。木质纤维素降解酶系中,乙酰木聚糖酯酶的发现虽然较晚,但其潜在的应用价值正日益受到研究者的重视。乙酰木聚糖酯酶可水解天然木聚糖中木糖单元上的2和/或3号位的乙酰基酯键,从而使β-1, 4-木聚糖酶能够深入地靠近木聚糖主链,提高木聚糖的水解效率[16-17],因此揭示了该酶在木聚糖降解过程中的必要性。乙酰木聚糖酯酶往往发现于半纤维素降解酶系的基因簇中,调控该基因的启动元件往往也是其他一些木质纤维素降解酶系的调控基因,这些证据都表明乙酰木聚糖酯酶在自然界生物降解过程中的重要作用。在本研究中,目标乙酰木聚糖酯酶基因虽然未被注释出位于木聚糖降解(或代谢)酶系(图 1A),但该菌株属于较少研究的嗜热厌氧微生物,可能存在较多未知的木聚糖降解(或代谢)酶;同时,通过同源进化树分析发现,该酶与其它7家族酯酶的序列有较大差异(图 1B)。因此,针对该酯酶的研究具有一定的科学意义。
本研究的目的是从嗜热厌氧微生物热解纤维素菌F32中发现和鉴定出高效水解半纤维素侧链的辅助性酶。通过对Axe7进行基因克隆、蛋白纯化(图 2)、酶学表征等一系列实验后发现,Axe7在高温下,对4-甲基乙酸伞形酯有很好的活性和热稳定性(图 3);对另外一种底物对硝基苯酚乙酸酯(pNP-acetate)在较低温度下( < 40 ℃)也具有较强活性(因为对硝基苯酚乙酸酯在高于50 ℃条件下极易分解,因此难以测定高温下活性[15],数据未展示)。在最适条件下Axe7的各项酶学指标(表 3),如比酶活力(81.0±1.7 U/mg)、kcat、Km等,均与目前报道的最高指标——来源于海栖热袍菌MSB8 (Thermotoga maritime MSB8) 的酯酶相当。此外,通过多种金属离子、金属螯合剂和变性剂试验表明(图 4),金属离子使Axe7的活性保持在最适酶活的(66.3±4.6)%-(95.7±2.3)%之间,说明金属离子对其酶活有一定的影响。此外金属螯合剂EDTA没有明显影响该酯酶的活性,说明Axe7参与底物反应的过程中,不以金属离子为辅助因子。利用I-TASSER在线分析软件和氨基酸序列比对,找到了Axe7中高度保守的催化位点,利用点突变的技术手段进一步验证了该催化位点与已报道的CE7家族的一致。因此,通过上述的一系列研究基本阐明了Axe7的酶学特征。
热稳定性是酶制剂在工业利用过程中的重要参数之一。当前报道的大多数乙酰木聚糖酯酶的最适反应温度多在45-60 ℃之间,并且热稳定性参差不齐[18-21]。一些嗜热细菌和真菌来源的乙酰木聚糖酯酶有较高的最适反应温度,如嗜热裂孢菌NTU22中的5家族乙酰木聚糖脂酶在60 ℃下3 h可保持70%的活性[22],而Caldanaerobacter subterraneus菌属[19]中分离出的4家族乙酰木聚糖脂酶在70 ℃下的酶活半衰期仅为40 min。然而从热解纤维素菌属F32中提纯得到的乙酰木聚糖酯酶最适反应温度更是高达85 ℃,在75 ℃下的酶活半衰期长达70 h以上,在80 ℃下的酶活半衰期长达40 h以上。因此,较高的最适反应温度和优良的耐热性使该脂酶有良好的工业化利用价值。
为了完全降解木质纤维素、提高酶降解效率,国内外正逐步开展关于乙酰木聚糖酯酶的研究,主要聚焦于乙酰木聚糖酯酶理论及应用的研究[23-26]。此外,乙酰木聚糖酯酶对打破饲料中抗营养屏障、提高禽畜对饲料的吸收率有重要作用,热稳定良好的乙酰木聚糖酯酶也对饲料酶制剂的工业化生产有重要意义,在生物漂白等方面也显示出良好效果。综上所述,乙酰木聚糖酯酶的市场应用潜力广阔,且符合环境友好的要求。通过本研究发现,Axe7是具有最适温度高、热稳定性好、酶催化效率高等诸多优点的、具有一定商业化潜力的乙酰木聚糖脂酶,为该类型酯酶的工业化应用提供了一种选择。
| [1] | Collins T, Gerday C, Feller G. Xylanases, xylanase families and extremophilic xylanases[J]. FEMS Microbiology Reviews, 2005, 29(1) : 3–23. DOI:10.1016/j.femsre.2004.06.005 |
| [2] | Krastanova I, Guarnaccia C, Zahariev S, et al. Heterologous expression, purification, crystallization, X-ray analysis and phasing of the acetyl xylan esterase from Bacillus pumilus[J]. Biochimica et BiophysicaActa (BBA)-Proteins and Proteomics, 2005, 1748(2) : 222–230. DOI:10.1016/j.bbapap.2005.01.003 |
| [3] | Till M, Goldstone DC, Attwood GT, et al. Structure and function of an acetyl xylan esterase (Est2A) from the rumen bacterium Butyrivibrio proteoclasticus[J]. Proteins: Structure, Function, and Bioinformatics, 2013, 81(5) : 911–917. DOI:10.1002/prot.v81.5 |
| [4] | Koutaniemi S, van Gool MP, Juvonen M, et al. Distinct roles of carbohydrate esterase family CE16 acetyl esterases and polymer-acting acetyl xylanesterases in xylan deacetylation[J]. Journal of Biotechnology, 2013, 168(4) : 684–692. DOI:10.1016/j.jbiotec.2013.10.009 |
| [5] | Bouveng HO, Garegg PJ, Lindberg B. Position of the o-acetyl groups in birch xylan[J]. Acta Chemical Scandinavica, 1960, 14 : 742–748. DOI:10.3891/acta.chem.scand.14-0742 |
| [6] | Zhang JH, Siika-Aho M, Tenkanen M, et al. The role of acetyl xylan esterase in the solubilization of xylan and enzymatic hydrolysis of wheat straw and giant reed[J]. Biotechnology for Biofuels, 2011, 4(1) : 60. DOI:10.1186/1754-6834-4-60 |
| [7] | Huy ND, Thiyagarajan S, Kim DH, et al. Cloning and characterization of a novel bifunctional acetyl xylan esterase with carbohydrate binding module from Phanerochaete chrysosporium[J]. Journal of Bioscience and Bioengineering, 2013, 115(5) : 507–513. DOI:10.1016/j.jbiosc.2012.11.018 |
| [8] | Ying Y, Meng DD, Chen XH, et al. An extremely thermophilic anaerobic bacterium Caldicellulosiruptor sp. F32 exhibits distinctive properties in growth and xylanases during xylan hydrolysis[J]. Enzyme and Microbial Technology, 2013, 53(3) : 194–199. DOI:10.1016/j.enzmictec.2013.04.004 |
| [9] | Overbeek R, Olson R, Pusch GD, et al. The SEED and the Rapid Annotation of microbial genomes using Subsystems Technology (RAST)[J]. Nucleic Acids Research, 2014, 42(D1) : D206–D214. DOI:10.1093/nar/gkt1226 |
| [10] | Tamura K, Peterson D, Peterson N, et al. MEGA5: Molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods[J]. Molecular Biology and Evolution, 2011, 28(10) : 2731–2739. DOI:10.1093/molbev/msr121 |
| [11] | Yang JY, Yan RX, Roy A, et al. The I-TASSER Suite: protein structure and function prediction[J]. Nature Methods, 2015, 12(1) : 7–8. |
| [12] | Shao WL, Wiegel J. Purification and characterization of two thermostable acetyl xylanesterases from Thermoanaerobacterium sp. strain JW/SL-YS485[J]. Applied and Environmental Microbiology, 1995, 61(2) : 729–733. |
| [13] | Degrassi G, Okeke BC, Bruschi CV, et al. Purification and characterization of an acetyl xylan esterase from Bacillus pumilus[J]. Applied and Environmental Microbiology, 1998, 64(2) : 789–792. |
| [14] | Tian QQ, Song P, Chen C, et al. Identification of acetyl xylan esterase from Bacillus subtilis and effects of inducers on its production[J]. Chinese Journal of Bioprocess Engineering, 2013, 11(1) : 60–64. (in Chinese) 田倩倩, 宋萍, 陈晨, 等. 枯草芽胞杆菌乙酰木聚糖酯酶的鉴定及诱导剂对酯酶活力的影响[J]. 生物加工过程, 2013, 11(1) : 60–64. |
| [15] | Drzewiecki K, Angelov A, Ballschmiter M, et al. Hyperthermostable acetyl xylan esterase[J]. Microbial Biotechnology, 2010, 3(1) : 84–92. DOI:10.1111/mbt.2010.3.issue-1 |
| [16] | Wu HL, Xue Y, Liu J, et al. Research progress of acetyl xylan esterase[J]. China Biotechnology, 2016, 36(3) : 102–110. (in Chinese) 吴红丽, 薛勇, 刘健, 等. 乙酰木聚糖酯酶研究进展[J]. 中国生物工程杂志, 2016, 36(3) : 102–110. |
| [17] | Biely P. Microbial xylanolytic systems[J]. Trends in Biotechnology, 1985, 3(11) : 286–290. DOI:10.1016/0167-7799(85)90004-6 |
| [18] | Chung HJ, Park SM, Kim HR, et al. Cloning the gene encoding acetyl xylan esterase from Aspergillus ficuum and its expression in Pichia pastoris[J]. Enzyme and Microbial Technology, 2002, 31(4) : 384–391. DOI:10.1016/S0141-0229(02)00122-9 |
| [19] | Moriyoshi K, Koma D, Yamanaka H, et al. Expression and characterization of a thermostable acetylxylan esterase from Caldanaerobacter subterraneus subsp. Tengcongensis involved in the degradation of insoluble cellulose acetate[J]. Bioscience, Biotechnology, and Biochemistry, 2013, 77(12) : 2495–2498. DOI:10.1271/bbb.130568 |
| [20] | McDermid KP, MacKenzie CR, Forsberg CW. Esterase activities of Fibrobacter succinogenes subsp. succinogenes S85[J]. Applied and Environmental Microbiolog, 1990, 56(1) : 127–132. |
| [21] | Egana L, Gutierrez R, Caputo V, et al. Purification and characterization of two acetyl xylanesterases from Penicillium purpurogenum[J]. Biotechnology and Applied Biochemistry, 1996, 24(1) : 33–40. |
| [22] | Huang YC, Chen GH, Chen YF, et al. Heterologous expression of thermostable acetylxylan esterase gene from Thermobifida fusca and its synergistic action with xylanase for the production of xylooligosaccharides[J]. Biochemical and Biophysical Research Communications, 2010, 400(4) : 718–723. DOI:10.1016/j.bbrc.2010.08.136 |
| [23] | Aguilar-Pontes MV, Zhou MM, van der Horst S, et al. Sexual crossing of thermophilic fungus Myceliophthora heterothallica improved enzymatic degradation of sugar beet pulp[J]. Biotechnology for Biofuels, 2016, 9(1) : 41. DOI:10.1186/s13068-016-0460-y |
| [24] | Peng XW, Qiao WB, Mi SF, et al. Characterization of hemicellulase and cellulase from the extremely thermophilic bacterium Caldicellulosiruptor owensensis and their potential application for bioconversion of lignocellulosic biomass without pretreatment[J]. Biotechnology for Biofuels, 2015, 8 : 131. DOI:10.1186/s13068-015-0313-0 |
| [25] | Mai-Gisondi G, Turunen O, Pastinen O, et al. Enhancement of acetyl xylan esterase activity on cellulose acetate through fusion to a family 3 cellulose binding module[J]. Enzyme and Microbial Technology, 2015, 79/80 : 27–33. DOI:10.1016/j.enzmictec.2015.07.001 |
| [26] | Pawar PMA, Derba-Maceluch M, Chong SL, et al. Expression of fungal acetyl xylan esterase in Arabidopsis thaliana improves saccharification of stem lignocellulose[J]. Plant Biotechnology Journal, 2016, 14(1) : 387–397. DOI:10.1111/pbi.12393 |
 2017, Vol. 44
2017, Vol. 44